聚苯乙烯降解菌的筛选鉴定及降解特性研究
2024-02-23庞哲宇赵晶晶万天丽李佳俊杨凌森周思宇苏婷婷
庞哲宇,赵晶晶,万天丽,李佳俊,杨凌森,周思宇,苏婷婷
聚苯乙烯降解菌的筛选鉴定及降解特性研究
庞哲宇,赵晶晶,万天丽,李佳俊,杨凌森,周思宇,苏婷婷
(辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001)
石油基废弃塑料造成的环境污染已成为人类难以解决的问题,而现有的处理方式既耗能又容易造成二次污染。研究发现,大蜡螟幼虫肠道内存在降解塑料的细菌,可有效加快塑料的降解,分离纯化其肠道内菌株具有极高的研究价值。因此,使用生活中常见的聚苯乙烯(PS)包装盒作为唯一食物来源喂食大蜡螟幼虫,富集大蜡螟幼虫肠道内的PS降解菌;经解剖、培养、分离,最终获得4株菌株(PD⁃1、PD⁃2、PD⁃3和PD⁃4)。将各菌株接种至以PS薄膜为唯一碳源的基础盐培养基(MSM培养基)并测定了其降解率。结果表明,PD⁃1对PS薄膜降解率最高,为1.8%。对PD⁃1进行菌株形态观察、生理生化测定及系统发育树构建,鉴定PD⁃1为肠杆菌科克雷伯氏菌属()。同时,采用紫外或硝酸对PS薄膜进行了预处理,以期提高菌株降解率。结果表明,PD⁃1降解硝酸预处理的PS薄膜的降解率为2.5%,而对紫外预处理的PS薄膜的降解率为0.8%,PS薄膜经硝酸预处理后更易被PD⁃1降解。
大蜡螟; 聚苯乙烯降解菌; 鉴定; 降解率
塑料作为造福人类的石油化工合成物,在现代却成为人类难以克服的污染物[1]。随着塑料生产在全球范围内的大幅扩张,所产生的塑料垃圾量也在持续增加,由于塑料具有高相对分子质量、高疏水性及高化学键能等特点,废弃塑料制品进入自然环境中极难被降解[2]。进入环境中的废弃塑料,经磨损、物理撞击、光降解等作用,最终破碎产生大量微塑料,对生物体造成严重危害,甚至威胁人类健康[3⁃4]。
目前,虽然可采用一些可降解高分子材料代替传统塑料制品,但是这类材料成本较高,且难以大规模生产,进而阻碍其发展[5⁃6]。人类对传统塑料的依赖程度仍然较高,因此寻求环保的塑料降解方式迫在眉睫。利用昆虫代谢长链碳氢化合物的潜力已经得到了广泛证实,发现多种昆虫,包括黄粉虫、大麦虫、大蜡螟幼虫等肠道微生物都具有降解塑料的能力,虽然其体内微生物的长链烃降解酶和降解机制尚不清晰,但为开展传统塑料生物降解研究提供了新思路[7⁃9]。
大蜡螟是鳞翅目、螟蛾科、蜡螟亚科昆虫,其幼虫会取食蜜蜂巢脾、蛀坏蜂具,危害养蜂业。根据相关研究发现,大蜡螟幼虫肠道内含有分解聚乙烯(PE)、聚苯乙烯(PS)的菌群[10],且产地不同的昆虫其肠道内菌群具有不同的降解能力[11];采用紫外与硝酸预处理PS薄膜,可促使其表面的官能团发生变化,从而改变薄膜的化学性质,使细菌更易降解PS薄膜[11]。因此,本文通过常见的PS包装盒喂养大蜡螟幼虫,诱导其肠道降解菌富集生长,然后提取其肠道内的可降解PS菌群,对其进行分离纯化鉴定,并通过材料预处理的方式提高其降解率,以期分离纯化出PS高效降解菌株,寻找适合菌株降解PS的预处理条件,达到低成本、高效率、无污染地降解塑料制品的目的。
1 实验部分
1.1 实验材料
大蜡螟幼虫采购于天津惠裕德生物科技有限公司,幼虫生长状况良好,体长18~30 mm;PS泡沫为常见PS包装盒。
1.2 试剂和仪器
试剂:KH2PO4、Na2HPO4·12H2O、NH4Cl、MgSO4、CaCl2、FeSO4、MnSO4、ZnSO4、二氯甲烷、NaCl、蛋白胨、酵母提取物、乙醇(体积分数为75%)、硝酸(体积分数为65%),分析纯,上海阿拉丁生化科技股份有限公司。
仪器:DFZ⁃6020烘箱、TSQ⁃280恒温培养箱,上海精宏实验设备有限公司;WFH⁃203B紫外分析仪,上海高致精密仪器有限公司;AR124CN精确电子分析天平,上海奥豪斯仪器有限公司;HY⁃2涡旋震荡仪,上海仪电科学仪器股份有限公司;LDZX⁃50KB高压灭菌锅,上海申安医疗器械厂;ZKC摇床,苏州培英实验设备有限公司;HDL超净工作台,北京东联哈尔仪器制造有限公司;DSA100接触角测试仪,德国Kruss公司;SU010扫描电子显微镜(SEM),日立高新技术公司。
1.3 培养基的制备
基础盐培养基(MSM培养基):取KH2PO41.362 g、Na2HPO4·12H2O 3.582 g、NH4Cl 0.330 g、MgSO40.150 g、CaCl21.500 mg、FeSO40.600 mg、MnSO40.330 mg、ZnSO40.600 mg,用无菌水定容至300 mL,调节pH至7.2~7.3。
Luria⁃Bertani培养基(LB培养基):取蛋白胨10.000 g、酵母提取物5.000 g、NaCl 5.000 g,用无菌水定容至1 000 mL。
固体培养基均在上述液体培养基中加入质量浓度为20.0 g/L的琼脂制得。
1.4 PS薄膜的制备
将灭菌PS包装盒粉碎,称取20 g PS泡沫,在通风橱中用二氯甲烷将其溶解1 h;振荡混匀后移至平板并覆盖锡纸,用皮筋固定锡纸;取灭菌大头针在锡纸表面扎孔,室温下静置于通风橱24 h,直至薄膜固化成型;取出薄膜,并裁剪为1 cm×3 cm的长条;放入烘箱烘干后称重,并用紫外灯灭菌45 min备用。
1.5 大蜡螟幼虫的饲养
在室温条件下,对大蜡螟幼虫提前进行饥饿处理1 d,消耗其体内有机质,然后选取生理状态良好的幼虫投喂PS泡沫,培养12 d。在培养过程中,反复观察幼虫的进食状况并挑出蛹化与死亡个体,避免幼虫之间发生啃食现象影响实验。
1.6 大蜡螟幼虫肠道微生物的分离、纯化及降解率测定
在超净工作台,将大蜡螟幼虫浸泡在乙醇溶液中1~2 min灭菌,用无菌棉球把幼虫表面酒精擦拭干净,然后用解剖工具将其肠道取出,放入1.5 mL离心管中,加入少量无菌水。利用涡旋震荡仪震荡离心管内物质,使肠道内容物充分溶解,静置15 min后,取3.0 mL菌液接种于MSM培养基,并加入5片PS薄膜作为唯一碳源,然后在温度为30 ℃、转速为150 r/min的条件下恒温培养60 d。待MSM培养基长出菌落,分别挑取新鲜的菌群接种于LB固体培养基,经多次划线培养,分离纯化出单菌落。
取上述分离纯化出的单菌落,再次接种于以PS为唯一碳源的MSM培养基,在温度为30 ℃、转速为150 r/min的条件下,震荡培养60 d,计算其降解率,同时设置一组对照组(以PS为唯一碳源的MSM培养基),用相同体积的灭菌水代替菌液(实验重复3次)。
1.7 菌株的鉴定
菌株形态学鉴定:取分离纯化后的降解菌株并置于LB固体培养基划线培养48 h,观察菌落形态特征。
生理生化反应特征鉴定:根据《常见细菌系统鉴定手册》和《伯杰氏细菌鉴定手册》中的鉴定方法,接种降解菌株于培养基培养,鉴定菌株生理生化特征,确定菌株分类。
分子生物学鉴定:通过试剂盒提取降解菌株基因,采用16S rRNA常用上游引物27F(5´⁃CAGAGTTTGATCCTGGCT⁃3´)和下游引物1492R(5´⁃AGGAGGTGATCCAGCCGCA⁃3´)进行基因扩增,扩增结果送至上海生工生物工程公司测序,测序结果与NCBI数据库同源序列(BLAST)进行比对,选取相似度较高菌株进一步做同源分析。用MAGE 7.0对纯化菌株与数据库下载菌株基因序列构建系统发育树。根据系统发育树基因相似度比较,结合降解菌株形态学鉴定和生理生化特征鉴定结果,确定降解菌株的种属关系。
1.8 降解性能验证及降解条件优化
选取降解率较高的降解菌,接种1.0 mL菌液于以PS为唯一碳源的MSM培养基,在温度为30 ℃、转速为150 r/min的条件下培养30 d,同时设置一组对照组。培养30 d后取出PS薄膜,通过SEM观察降解菌形态、生物膜及实验组和对照组处理后的薄膜表面状态;通过接触角测试仪,对PS薄膜进行水接触角测定;取1.0 mL菌液均匀涂布于MSM固体培养基表面,然后盖PS薄膜于培养基上,观察降解菌生长情况;使用与SEM连接的模块X光微区分析(EDS)评估实验组和对照组中PS膜表面碳和氧元素含量的差异。
采用硝酸浸泡处理PS薄膜7 d后,用无菌水清洗薄膜并烘干。紫外预处理PS薄膜60 d,清洗并烘干后使用。分别将0.3 g硝酸预处理薄膜和紫外预处理薄膜置于100 mL单菌株和混合菌株的MSM培养基中,在温度为30 ℃、转速为150 r/min的条件下培养30 d,计算其降解率,筛选降解的优化条件。其中,单菌株为筛选出的降解率较高的菌株,混合菌株为筛选出的所有菌株按等浓度比例混合的菌株,对照组以相同体积的灭菌水代替菌液,其他条件与实验组一致(实验重复3次)。
降解率计算公式见式(1)。

式中:r为降解率,%;为PS的初始质量,g;为PS降解后的质量,g。
2 结果与讨论
2.1 降解菌的PS薄膜降解率
经平板初筛后最终筛选出4株菌株,分别命名为PD⁃1、PD⁃2、PD⁃3和PD⁃4。对4株降解菌的PS薄膜降解率进行计算,结果见图1。从图1可以看出,PD⁃1降解率最高,达到1.8%,其余3株降解菌的PS薄膜降解率均较低,因此选取PD⁃1进行后续实验。

图1 4株菌株的PS薄膜降解率
2.2 大蜡螟幼虫肠道降解菌的鉴定
2.2.1 生理生化反应特征鉴定
对PD⁃1进行多项生理生化反应特征鉴定,结果见表1。参照《常见细菌系统鉴定手册》与《伯杰氏细菌鉴定手册》,初步判断PD⁃1为肠杆菌科,依托进一步实验鉴定PD⁃1菌种,确定其种属。

表1 生理生化反应特征鉴定结果
注:“+”为阳性,“-”为阴性。
2.2.2 菌株形态学鉴定
图2为PD⁃1的菌落形态与电镜照片。
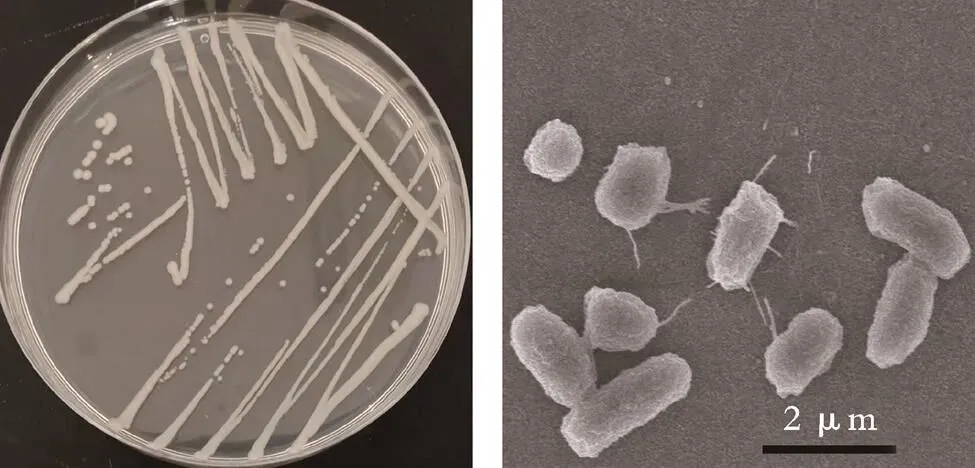
(a)菌落形态 (b)电镜照片
图2 PD⁃1的菌落形态与电镜照片
Fig.2 Colony morphology and electron microscopy of strain PD⁃1
从图2(a)可以看出,菌株生长得到白色菌落,表面无光泽,质软,有黏性,菌落边缘光滑完整不透明。从图2(b)可以看出,电镜下菌体呈短杆状,两端钝圆,无芽孢,符合肠杆菌科细菌形态特征,与生理生化鉴定结果相一致。
2.2.3 分子生物学鉴定
基于生理生化反应结果和菌株形态学鉴定,结合PD⁃1的16S rRNA检测结果进一步明确菌株种属。将PD⁃1基因序列在NCBI网站进行BLAST同源比对分析,下载相似度高的基因序列,采用N⁃J法,通过MAGA7.0软件构建系统发育树,结果见图3。
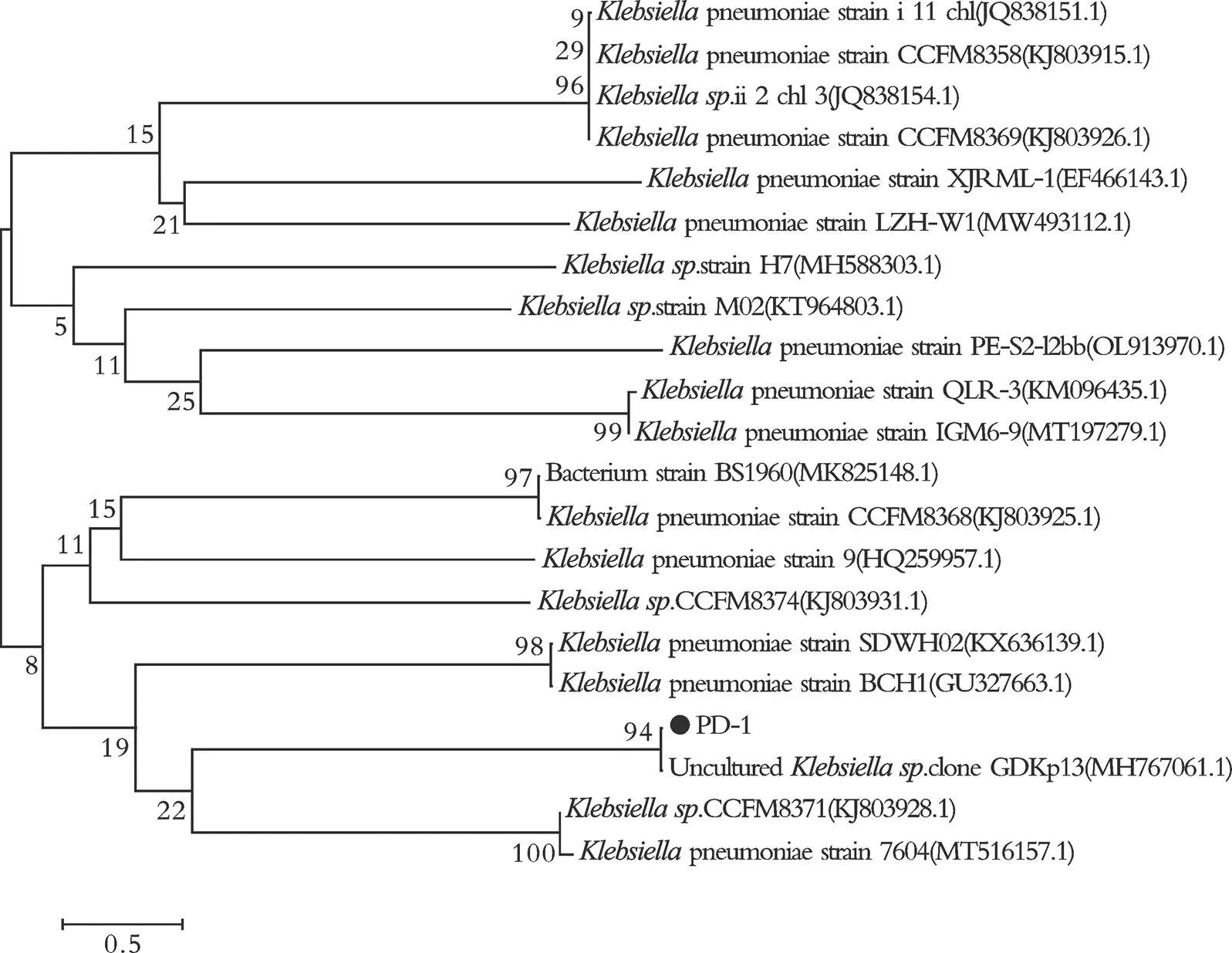
图3 基于16S rRNA 序列的PD⁃1与相关菌种的系统发育进化树
从图3可以看出,PD⁃1与. clone GDKp13菌株的步长高达94%,说明其亲缘关系非常接近。结合上述鉴定结果可知,分离获得的菌种PD⁃1即为肠杆菌科克雷伯氏菌属()。
2.3 降解性能验证
以PS薄膜为唯一碳源的MSM培养基培养30 d后,取出PS薄膜,利用扫描电子显微镜观察菌体特征及薄膜表面,结果见图4。从图4可以看出,经过PD⁃1降解后,在PS薄膜表面出现生物膜(见图4(a)),将膜上的菌落(见图4(b))冲洗后,发现薄膜表面(见图4(c))与对照组(见图4(d))相比明显变得粗糙,产生很多孔洞。由此可知,经过30 d的培养,PD⁃1对PS薄膜表面产生了降解作用。
取PD⁃1降解前后的薄膜,并对其进行水接触角测定,结果见图5(a)。从图5(a)可以看出,降解后PS薄膜的水接触角为85.5°±1.6°,而对照组的水接触角为93.2°±0.5°,由此可知,PD⁃1处理后PS膜的疏水性下降。图5(b)为盖膜实验结果。从图5(b)可以看出,在以PS薄膜为唯一碳源的MSM培养基上,PD⁃1在薄膜四周有明显生长,而在其他地方未见明显变化,说明PD⁃1可利用PS薄膜生长。
通过与扫描电子显微镜连接的模块EDS,分析了PD⁃1处理前后PS薄膜表面的C、O组成情况,结果见图6。从图6可以看出,对照组与实验组的C原子数目无明显差异,但在实验组中检测到的O原子数目明显增多,说明PD⁃1处理后的PS薄膜表面发生了氧化反应,形成了含氧官能团,这一现象可能是由于PD⁃1分泌的某种胞外酶催化降解所引起[12]。这一结果也解释了经PD⁃1处理后的PS薄膜水接触角减小的原因,可能是由于其表面发生了氧化反应,导致其表面张力降低,表现为疏水性降低。

(a)菌体固定 (b)菌体形态 (c)降解后薄膜 (d)空白对照

对照组 实验组(a)水接触角分析结果 对照组 实验组(b)盖膜实验结果

(a)对照组(O) (b)实验组(O) (c)对照组(C) (d)实验组(C)
2.4 降解条件的筛选
文献[13-14]的研究结果表明,硝酸预处理影响塑料薄膜中C=O和C-H的数量,从而改变塑料特性,紫外预处理塑料薄膜同样影响塑料薄膜中C=O和C-H的数量,同时紫外预处理对塑料晶型有一定影响,使塑料薄膜表面产生裂纹,更易被细菌侵占分解。因此,本文采用紫外光和硝酸预处理PS薄膜,使其更易被微生物降解,然后分别接种PD⁃1单菌株和混合菌,以期筛选出最佳的PS薄膜降解条件,结果见表2。由表2可知,在紫外光预处理条件下,混合菌组的PS薄膜降解率为1.9%,大于对照组与PD⁃1单菌株组,说明混合菌组更易降解经紫外光预处理的PS薄膜,而PD⁃1单菌株组对紫外光预处理后PS薄膜的降解率为0.8%,小于其对PS薄膜处理前的降解率1.8%,说明PD⁃1不易降解紫外光预处理后的PS薄膜;PD⁃1单菌株组对硝酸预处理PS薄膜的降解率为2.5%,高于另外两组,同时也高于紫外光预处理下PD⁃1单菌株组的降解率(0.8%)。因此,PD⁃1单菌株组更易降解硝酸预处理后的PS薄膜,混合菌组更易降解紫外光预处理后的PS薄膜。

表2 紫外光和硝酸预处理后PS薄膜的降解率
3 结 论
1)从大蜡螟幼虫肠道中分离纯化出4株PS降解菌(PD⁃1、PD⁃2、PD⁃3、PD⁃4),其中PD⁃1对PS薄膜的降解率最大,为1.8%,经鉴定明确其属于肠杆菌科克雷伯氏菌属()。
2)通过电镜和水接触角分别观察PD⁃1对PS薄膜降解前后表面变化情况,进一步明确了PD⁃1具有一定的PS薄膜降解特性,可使其表面形成生物膜,并发生氧化反应,降低其疏水性。
3)硝酸预处理后的PS薄膜经PD⁃1降解,PS薄膜的降解率达到2.5%,但经紫外光预处理后PS薄膜的降解率为0.8%,说明紫外光和硝酸预处理后PS薄膜会影响降解菌的降解作用,且经硝酸预处理后的薄膜更易被PD⁃1降解。
[1] DHANRAJ N D, HATHA A A M, JISHA M S. Biodegradation of petroleum based and bio⁃based plastics: approaches to increase the rate of biodegradation[J]. Archives of Microbiology, 2022, 204(5): 258.
[2] 许楹,殷超凡,岳纹龙,等. 石油基塑料的微生物降解[J]. 生物工程学报, 2019, 35(11): 2092⁃2103.
XU Y, YIN C F, YUE W L, et al. Microbial degradation of petroleum⁃based plastics[J]. Chinese Journal of Biotechnology, 2019, 35(11): 2092⁃2103.
[3] 王佳佳,赵娜娜,李金惠. 中国海洋微塑料污染现状与防治建议[J]. 中国环境科学, 2019, 39(7): 3056⁃3063.
WANG J J, ZHAO N N, LI J H. Current situation of marine microplastics pollution and prevention proposals in China[J]. China Environmental Science, 2019, 39(7): 3056⁃3063.
[4] WU P F, HUANG J S, ZHENG Y L, et al. Environmental occurrences, fate, and impacts of microplastics[J]. Ecotoxicology and Environmental Safety, 2019, 184: 109612.
[5] 王学军,孙大为,冯建立,等. 可降解塑料评价标准现状与展望[J]. 塑料工业, 2021, 49(6): 1⁃5.
WANG X J, SUN D W, FENG J L, et al. Status and prospect of evaluation standards on degradable plastics[J]. China Plastics Industry, 2021, 49(6): 1⁃5.
[6] 王蒙,曹长海,高慧鹏,等. 绿色塑料(PHAs)的生物法制备及应用[J]. 当代化工, 2022, 51(7): 1679⁃1682.
WANG M, CAO C H, GAO H P, et al. Preparation and application of "green plastics" (PHAs) by biological method[J]. Contemporary Chemical Industry, 2022, 51(7): 1679⁃1682.
[7] TAN K M, FAUZI N M, KASSIM A S M, et al. Isolation and identification of polystyrene degrading bacteria from zophobas morio's gut[J]. Walailak Journal of Science and Technology, 2021, 18(8): 9118.
[8] JIANG S, SU T T, ZHAO J J, et al. Isolation, identification, and characterization of polystyrene⁃degrading bacteria from the gut of Galleria mellonella (lepidoptera: pyralidae) larvae[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9: 736062.
[9] BRANDON A M, GARCIA A M, KHLYSTOV N A, et al. Enhanced bioavailability and microbial biodegradation of polystyrene in an enrichment derived from the gut microbiome of Tenebrio molitor (mealworm larvae)[J]. Environmental Science & Technology, 2021, 55(3): 2027⁃2036.
[10] LOU Y, EKATERINA P, YANG S S, et al. Biodegradation of polyethylene and polystyrene by greater wax moth larvae (Galleria mellonella L.) and the effect of co⁃diet supplementation on the core gut microbiome[J]. Environmental Science & Technology, 2020, 54(5): 2821⁃2831.
[11] YANG S S, BRANDON A M, ANDREW FLANAGAN J C, et al. Biodegradation of polystyrene wastes in yellow mealworms (larvae of Tenebrio molitor Linnaeus): Factors affecting biodegradation rates and the ability of polystyrene⁃fed larvae to complete their life cycle[J]. Chemosphere, 2018, 191: 979⁃989.
[12] WANG Z Y, WANG Y, GUO Z Q, et al. Purification and characterization of poly(L⁃lactic acid) depolymerase from Pseudomonas sp. strain DS04⁃T[J]. Polymer Engineering & Science, 2011, 51(3): 454⁃459.
[13] 刘强. 物化预处理耦合生物处理降解塑料[D]. 哈尔滨:哈尔滨工业大学, 2021.
[14] 王志航,许金余,刘高杰,等. 紫外老化对聚合物基复合材料剪切性能及孔隙结构的影响[J]. 材料导报, 2022, 36(2): 210⁃215.
WANG Z H, XU J Y, LIU G J, et al. Effect of UV aging on shear properties and pore structure of polymer⁃based composites[J]. Materials Reports, 2022, 36(2): 210⁃215.
Screening, Identification and Degradation Characteristic of Polystyrene Degrading Bacteria
PANG Zheyu, ZHAO Jingjing, WAN Tianli, LI Jiajun, YANG Lingsen, ZHOU Siyu, SU Tingting
(School of Petrochemical Engineering, Liaoning Petrochemical University, Fushun Liaoning 113001, China)
Pollution caused by petroleum⁃based plastic products has become a problem that is difficult for human beings to solve, and the existing treatment methods are both energy⁃consuming and easy to cause secondary pollution. The study found that the bacteria that degrade plastic in the intestines of(Lepidoptera: Pyralidae) larvae can effectively accelerate the degradation of plastics. This experiment uses polystyrene (PS) packaging boxes, which are common in life, as the only food source to feed the larvae of the large wax borer, enriching the PS⁃degrading bacteria in the intestines of thelarvae. After dissection, culture, and isolation, four strains were obtained: PD⁃1, PD⁃2, PD⁃3 and PD⁃4. The degradation capacity of MSM culture medium with PS film as the only carbon source was inoculated with each strain, and the degradation rate of PD⁃1 on PS film was the highest, which was 1.8%. PD⁃1 was observed by strain morphology, physiological biochemical determination and phylogenetic tree construction, and it was identified as Enterobacter colebella (). Meanwhile, the method of UV and nitric acid pretreatment of PS film were used to improve the degradation rate of the strain, and the results showed that the weight loss rate of PD⁃1 degradation of nitric acid⁃treated PS film was improved, which was 2.5%, while the UV group was 0.8%, indicating that PS film was more easily degraded by PD⁃1 after nitric acid treatment.
; Polystyrene degrading bacteria; Identification; Degradation rate
TQ319
A
10.12422/j.issn.1672⁃6952.2024.01.003
2023⁃07⁃29
2023⁃09⁃19
辽宁省博士科研启动基金计划项目(2020⁃BS⁃229);辽宁省大学生创新创业训练计划项目(202110148032)。
庞哲宇(2000⁃),男,本科生,生物工程专业,从事高分子材料生物降解研究;E⁃mail: 1004637526@qq.com。
赵晶晶(1987⁃),女,博士,讲师,从事高分子材料生物降解研究;E⁃mail: jingjing6180@126.com。
庞哲宇,赵晶晶,万天丽,等.聚苯乙烯降解菌的筛选鉴定及降解特性研究[J].辽宁石油化工大学学报,2024,44(1):15-20.
PANG Zheyu,ZHAO Jingjing,WAN Tianli,et al.Screening, Identification and Degradation Characteristic of Polystyrene Degrading Bacteria[J].Journal of Liaoning Petrochemical University,2024,44(1):15-20.
(编辑 宋官龙)
