桑叶水提物对高糖环境下前成骨细胞成骨分化的作用研究
2024-02-23张文杰吴泽钰夏雨凝
张文杰 吴泽钰 夏雨凝 赵 今
糖尿病是全球增长最快的疾病之一,预计到2045 年将影响6.93 亿成年人,目前已成为全球广泛关注的慢性代谢疾病之一[1]。牙周病(periodontal diseases,PD)是由多种复杂因素(遗传、环境和细菌感染等)共同作用导致的感染性疾病,能够造成牙周组织的破坏,最终导致牙齿脱落[2]。流行病学研究证实牙周炎是糖尿病的第六大并发症,且糖尿病患者患牙周炎的风险是非糖尿病患者的三倍[3]糖尿病患者伴发牙周炎在国际上已经被公认为是一种特殊类型的牙周疾病,称为糖尿病牙周炎[4],目前临床上常采用全身给药的方式治疗糖尿病,其不仅毒副作用较强,且无法同时改善罹患牙周炎患者的牙周状况。近年来,中医药用于辅助治疗牙周炎获得了很好的疗效,并且很多中药在抗炎的同时还具有降血糖的作用,国内外已有较多学者将传统中药用于DP进行了相关研究。研究证实,桑叶富含多种活性成分,如多糖、黄酮类和维生素等,具有抗炎、降糖和促进骨组织形成的潜在作用[5]。然而,对于桑叶水提物在高糖环境下对成骨分化的影响,目前的了解还十分有限。因此,本研究旨在评估桑叶水提物在高糖环境下对MC3T3-E1 细胞成骨分化的影响,可以进一步为桑叶水提物用于治疗DP 提供一定的理论依据。
材料和方法
1.材料
(1)细胞株小鼠成骨前体细胞株(MC3T3-E1)(货号:CL-0387),购自武汉普诺赛生物生命科技有限公司。
(2)药物桑叶水提物粉末,购自中国上海源叶,货号:S28490 纯度:≥98%。
(3)主要试剂α-MEM 培养基(Gibco,美国);0.25%胰蛋白酶、地塞米松、胎牛血清、1%青-链霉素双抗(BI,印度);细胞增殖毒性检测试剂盒CCK-8(Dojindo,日本);成骨细胞矿化结节染色试剂盒(货号:C0148)、BCIP/NBT 碱性磷酸酶染色试剂盒(货号:C3206)、碱性磷酸酶检测试剂盒(货号:P0321)购于碧云天生物科技有限公司(中国);4%多聚甲醛(Biosharp 生物,中国);Trizol(invitrogen,美国);,酶联免疫吸附ELISA 试剂盒(睿信生物,中国),碧云天凋亡试剂盒(货号:c1062L),碧云天ROS 检测试剂盒(货号:S033M);TB Green Premix ExTaqTMII、PrimeScriptTM RTreagent Kit with gDNA Eraser(Perfect Real Time)购买于Takara 生物技术有限公司(Takara Biomedical Technology Co,Ltd,日本)。
(4)主要实验仪器超净工作台(苏净安泰,中国)、细胞培养箱(Thermo,美国)、荧光倒置显微镜(Leica,德国)、全波长酶标仪(Thermo,美国)、实时荧光定量PCR 仪(Applied Biosystems 7500 Fast,美国)。
2.方法
(1)细胞培养:将课题组冻存的MC3T3-E1 细胞放入37℃恒温水浴箱复苏,加入含血清的培养基于培养瓶中培养,当细胞密度大于80%时,可按1:3 的比例传代培养,隔天换液,将其传代培养至P4 时开始用于后续各实验。
(2)药物的配置:①不同浓度高糖培养基的配置:称取4.504 g 葡萄糖,充分溶解于50 mL 的α-MEM 完全培养基中,于超净台中用0.22 nm 的滤器过滤,得到500 mM 的母液,将其分装于15 mL 离心管中置于4℃冰箱保存备用。实验过程中将其稀释为:10 mM、20 mM、30 mM、40 mM、50 mM、60 mM、70 mM、100 mM 的工作液。②不同浓度桑叶水提物的配置:将10 mg 桑叶提取物粉末溶于1 mL 的含50 mM葡萄糖的α-MEM 培养基中充分混匀,在超净台中用0.22 nm 的滤器过滤,得到10 mg/mL 的桑叶水提物母液,将其分装于1.5 mL 的无菌EP 管中,-20℃冰箱储存。实验过程中将药物分别稀释为:10 mg/mL、1 mg/mL、100 μg/mL、10 μg/mL、1 μg/mL、100 ng/mL、10 ng/mL的工作液。
(3)CCK-8 检测高糖浓度及桑叶水提物浓度对MC3T3-E1 细胞的增殖影响:①CCK-8 筛选适宜高糖浓度:将长至80%~90%的P4 代MC3T3-E1 细胞用胰酶消化后将细胞调整为2×104个/mL 的密度接种于96 孔板,每孔100 μL。待细胞贴壁后,弃原培养基,分别加入含5 mM、10 mM、20 mM、30 mM、40 mM、50 mM、60 mM、70 mM、100 mM 葡萄糖的完全培养基中,培养1 d、3 d、5d、7 d 后弃原培养基,加入100 μLα-MEM 培养基及10 μL CCK8 溶液,放入37 ℃培养箱中避光孵育2 h 。用酶标仪在450 nm波长时测定吸光度。②筛选出适宜药物浓度:步骤同上,不同之处在于细胞贴壁后分别加入含10 mg/mL、1 mg/mL、100 μg/mL、10 μg/mL、1 μg/mL、100 ng/mL、10 ng/mL桑叶水提取物的培养基。
(4)实验分组:不含葡萄糖的对照组(control组);含50 mM 葡萄糖的高糖组(HG 组);50 mM 葡萄糖+含不同浓度桑叶水提取物(1 μg/mL、10 μg/mL、100 μg/mL)的实验组(HSY组)。
(5)细胞凋亡:取对数期生长的MC3T3-E1 细胞以4.0×105个细胞/皿的密度接种到6 cm 培养皿中,每孔4 mL,贴壁后按分组干预72 h,按说明书操作,加入5 μL Annexin V-FITC,轻轻混匀,避光,室温孵育10 min;再加入5 μL PI 染料,混匀避光,室温孵育5 min。补加200 μL的1×Binding Buffer,用流式细胞仪进行检测。
(6)MC3T3-E1 的ROS 检测:按上述方法进行铺板及干预,于72 h 后将ROS 荧光探针按1:1000 的比例加入基础培养基中,避光保存。取出培养皿,胰酶消化后转移至离心管中离心(1000 rpm,5 min)。弃原培养基加入无酚红的α-MEM 培养基重悬后继续离心。弃培养基后加入1 mL ROS 荧光探针溶液,放置于37℃恒温箱中避光孵育30 min,弃液,使用不含酚红的α-MEM 重复上述清洗步骤3遍,过筛后转移至流式管中,短时间内使用流式细胞仪进行检测。
(7)不同浓度桑叶水提物在高糖环境下对细胞炎症因子表达的影响:将细胞接种于12 孔板,待细胞贴壁后按分组加入药物进行干预72 h,取1 mL 培养液离心(4000 rpm,20 min),取上清转移至新的EP管中,-20℃保存。按相关说明书操作。
(8)碱性磷酸酶染色:细胞传代培养至P4 代后调整细胞浓度为3×104个/孔的密度接种于12 孔板,待细胞长至80%左右,更换为含不同浓度的桑叶水提取物的高糖培养基,2 天/次进行换液,诱导7 d、14 d 后弃原培养基加入PBS 清洗3 遍,加入1 mL 组织细胞固定液固定30 min,弃液后,PBS清洗3次,加入800 μL 现配的碱性磷酸酶孵育液放入37℃烘箱中避光孵育15 min,弃液后PBS 清洗,倒置显微镜下观察并拍照。
(9)碱性磷酸酶活性:步骤同上,弃液后加入预冷的PBS 清洗,每孔加入60 μL 无抑制剂细胞裂解液,裂解至1.5 mL 的无菌EP 管中,5 min/次涡旋,12000 r/min,4℃条件下离心15 min,取上清于新的EP 管中作为待测样本保存于-80℃备用。BCA 法测得待测样本蛋白浓度;按照碱性磷酸酶试剂盒说明书于96 孔板中操作:设置空白孔、标准孔、待测孔,依次加入标准液、缓冲液、基质液,充分混匀,37 ℃水浴15 min 后加入显色剂终止反应,用酶标仪在520 nm 波长处测定各孔吸光度OD 值。计算金氏单位(U/mg)用以反映ALP 活性。细胞中ALP活力=测OD 值-空白OD 值/标准OD 值-空白OD 值×标准品浓度(0.1 mg/mL)÷待测样本蛋白浓度。
(10)茜素红染色:将P4 代细胞以3×104个/孔的密度接种于3.5 cm的小皿中,待细胞长至80%左右,弃原培养基,加入含不同浓度的桑叶水提物的高糖成骨培养基,隔天换液,分别于14 d、21 d 时终止培养。PBS 清洗小皿,组织细胞固定液室温下固定30 min后弃固定液,纯水清洗小皿,弃液后加1 mL茜素红染液室温下染色30 min,弃染液用纯水清洗小皿,清亮为止。显微镜下观察矿化结节并拍照记录。
(11)茜素红定量:配置氯化十六烷基吡啶溶液(每克加入10 mL 水至其完全溶解),上述小皿拍照完成后弃纯水,每皿加入1 mL 氯化十六烷基吡啶溶液放置于水平摇床溶解30 min,吹打混匀,将其转移至96 孔板中每孔100 μL,于562 nm 的波长下检测其OD值。
(12)RT-PCR 检测基因表达:将传代培养至P4代的细胞在含药的成骨诱导液中培养3 d、7 d,每组设3 个平行孔。利用Trizol 法提取总RNA,定量后进行反转录。RT-PCR 反应条件:①预变性95 ℃2 min;②变性95 ℃5 s;③退火58 ℃30 s,共40个循环;④延伸72 ℃,5 min。检测相关mRNA 的表达,以GAPDH为内参。采用2-ΔΔCT法进行相对定量分析。
3.统计学方法
用SPSS26.0 及Graphpad 统计软件处理实验数据,计量资料以均数±标准差表示,对各组数据进行正态及方差齐性检测,若数据满足正态分布及方差齐性,则采用单因素方差分析进行数据分析,组间比较采取Dunnett-t检验,若方差不齐则采用秩和检验。以P<0.05,α=0.05表示差异有统计学意义。
结果
1.CCK-8筛选出高糖浓度及桑叶水提物浓度
如图1 所示,低浓度葡萄糖对细胞的增殖影响不大,甚至还能促进细胞的增殖;但随着葡萄糖浓度的升高,细胞的增殖开始下降。经统计学分析,当葡萄糖浓度在0~30 mM 时,短时间内其细胞增殖甚至大于control 组(P<0.05),当糖浓度在50~100 mM 时细胞增殖能力受到抑制(P<0.05),结果与欧等[6]结果一致,故选用50 mM的葡萄糖浓度用于后续实验。
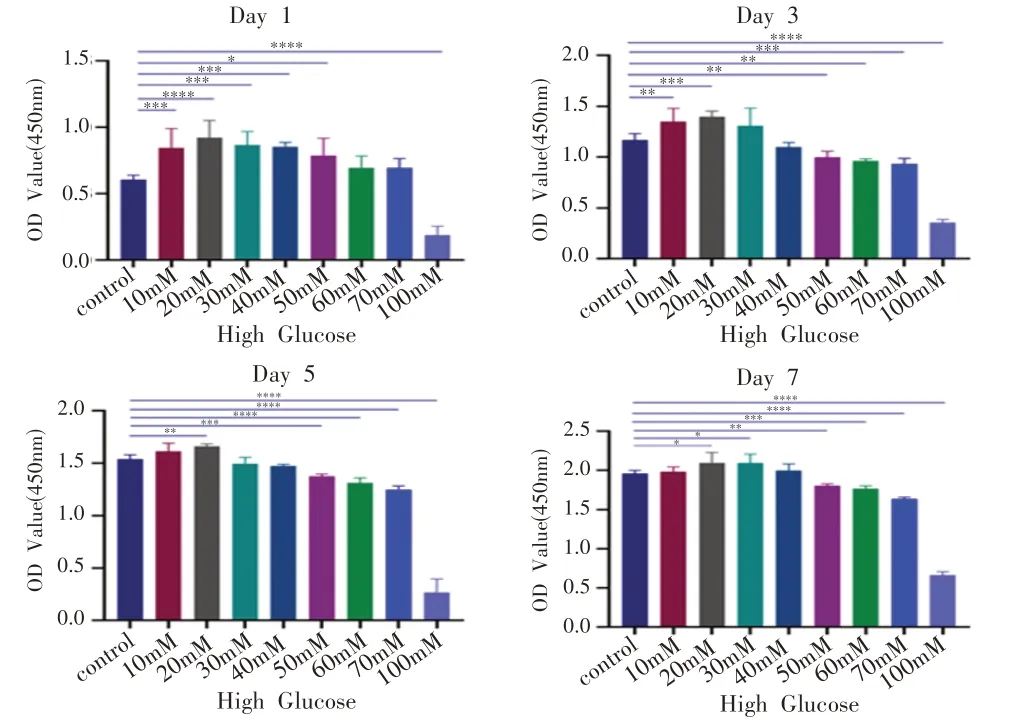
图1 不同浓度的葡萄糖对MC3T3-E1细胞增殖能力的影响
如图2 所示,将含有50 mM 葡萄糖的α-MEM 培养基培养MC3T3 细胞,并加入不同浓度的桑叶水提物分别干预1 d、3 d、5 d、7 d。随着干预时间的延长,细胞的OD值与对照组相比在10 mg/mL~1 μg/mL范围内不断升高,差异具有统计学意义(P<0.05),当桑叶水提物在1~100 μg/mL 时,与对照组相比其细胞增殖活性促进更明显且稳定,故选用1~100 μg/mL作为有效药物浓度用于后续实验。

图2 不同浓度桑叶水提物在高糖环境下对MC3T3-E1细胞增殖能力的影响
2.桑叶水提物在高糖环境下对MC3T3-E1 细胞凋亡的影响
流式细胞术显示桑叶水提物在高糖刺激下的MC3T3-E1 细胞的细胞凋亡具有影响(图3)。第一象限是由晚期凋亡细胞组成。第二象限是指PI 阴性的细胞,第三象限是指未被染色的正常活细胞。第四象限是指早期凋亡细胞。对照组和高糖组的早期凋亡率分别为(15.00±0.94)%和(30.90 ±0.19)%。桑叶水提物组分别为(14.15±1.96)%、(16.65±1.53)%和(19.35±1.96)%.高糖组于对照组相比显著促进了细胞的凋亡(P<0.05),在高糖环境下加入桑叶水提取物后均可在一定程度上降低细胞的凋亡率(P<0.05),尤其是高浓度的桑叶水提取物。可以得出结论,桑叶水提取物可显著保护细胞免受高糖刺激引起的凋亡。
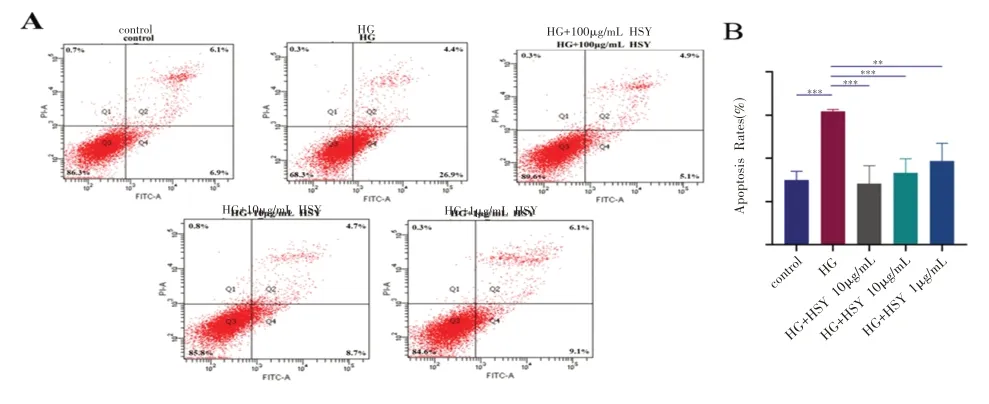
图3 不同浓度桑叶水提物在高糖环境下对MC3T3-E1细胞凋亡的影响
3.不同浓度的桑叶水提物对高糖环境下的MC3T3-E1细胞内ROS的表达
如图4 所示,对照组和高糖组的细胞内活性氧水平分别为(50.75±0.02)%和(81.55±0.78)%.桑叶水提物分别为(20.15±5.07)%、(33.9±10.65)%和(40.15±11.24)%。流式结果表明与正常组相比在高糖状态下的MC3T3-E1 细胞会产生更多的ROS(P<0.05)。实验组与高糖组相比,均可以在一定程度上缓解因高糖刺激引起的细胞内ROS 水平升高,尤其是100 μg/mL 的桑叶水提物浓度。且其ROS水平较正常组更低,完全逆转了因高糖刺激引起的氧化应激损伤。
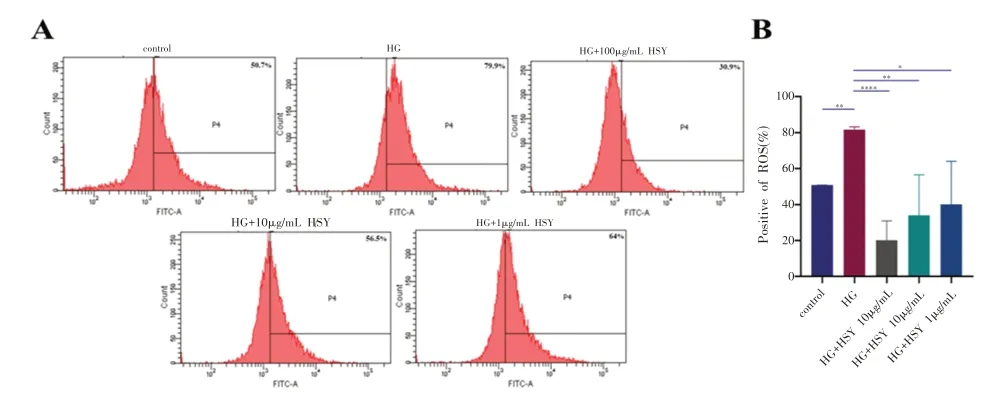
图4 不同浓度桑叶水提物在高糖环境下对MC3T3-E1细胞内ROS的表达
4.不同浓度的桑叶水提物对高糖环境下的MC3T3-E1细胞炎症因子表达的影响
通过ELISA 检测上清液中相关炎症因子的表达水平(见图5),与对照组(control)相比,高糖组(HG)上清液中晚期糖基化终末产物(advanced glycation end products,AGEs)、白细胞介素-1(interleukin 1,IL-1β)、白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α, TNF-α)的表达量明显升高。加入不同浓度的桑叶水提物干预后,与HG组相比,均能在一定程度上抑制相关因子的表达(P<0.05),尤其是高浓度的桑叶水提物(P<0.01)。

图5 不同浓度桑叶水提物在高糖环境下对MC3T3-E1细胞内炎症因子的表达
5.桑叶水提物对MC3T3-E1 细胞ALP 活性的影响
ALP 是成骨分化的早期标志物之一,与对照组相比如图6 所示,桑叶水提物的ALP 活性在用药物干预培养7 d、14 d 后,高糖组ALP 活性与对照组相比显著降低。与高糖组相比1 μg/mL、10 μg/mL、100 μg/mL 桑叶水提取物干预的实验组ALP 表达能力随着剂量的升高逐渐升高(P<0.05),药物组均可以缓解高糖刺激引起的ALP 活性降低,且存在以剂量依赖的方式增加ALP活性的表达能力。
6.桑叶水提物对MC3T3-E1 细胞矿化结节的影响
成骨细胞在细胞增殖分化过程中会产生细胞外钙化物沉积,将MC3T3-E1细胞成骨诱导14 d、21 d,如图7 所示,在与14 d、21 d 茜素红染色的结果图中均可看出与对照组相比HG 组的钙化能力显著下降,药物组可有效促进高糖环境下成骨细胞的分化且存在剂量依赖。尤其在100 μg/mL 时可以逆转高糖对成骨细胞分化的影响。

图7 不同浓度的桑叶水提物在高糖环境下对MC3T3-E1细胞A细胞矿化能力的表达
7.桑叶水提物对成骨细胞凋亡调节因子(apoptosis regulator Bcl-2,Bcl-2)、凋亡调节因子Bax(apoptosis regulator Bax,Bax)mRNA表达的影响
与对照组相比,HG 组Bax 表达明显降低(P<0.05),且Bcl-2 表达明显增多(P<0.05)。加入桑叶水提取物后,与HG 组相比,随着桑叶水提物浓度增高,Bax 的表达呈递减趋势,且Bcl-2 蛋白表达明显增多,差异具有统计学意义,3 d与7 d的结果基本一致(图8)。
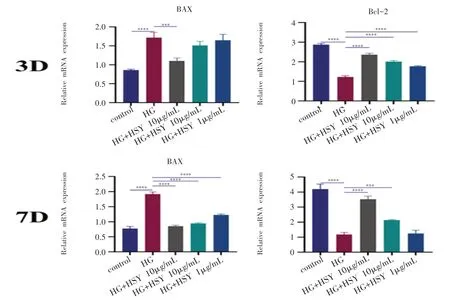
图8 不同浓度桑叶水提物在高糖环境下对MC3T3-E1细胞凋亡相关基因mRNA的表达
8.桑叶水提物对成骨细胞IL-1β、IL-6、TNFαmRNA表达的影响
与ELISA 结果基本一致,与对照组相比,HG 组炎症相关的mRNA表达明显降低。加入桑叶水提取物后,与HG 组相比,随着桑叶水提物浓度增高,mRNA的表达呈递减趋势(图9)。
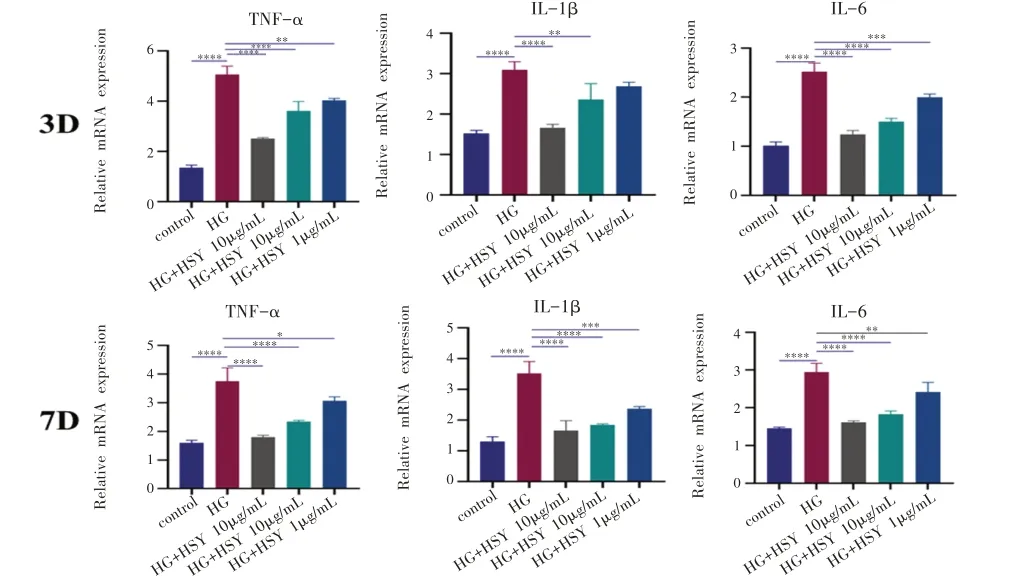
图9 不同浓度桑叶水提物在高糖环境下对MC3T3-E1细胞内炎症相关基因
9.桑叶水提物对成骨细胞成骨相关mRNA 表达的影响
在高糖环境下MC3T3-E1 细胞的runt 相关基因2(runt-related transcription factor2, Runx2)、碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalcin,OCN)、成骨细胞特异性转录因子(osterix,OSX)、Ⅰ型胶原蛋白(Collagen Type,Col-1)、胰岛素样生长因子1(insulin-like growth factor,IGF-1)的mRNA 的表达显著降低,且差异具有统计学意义(P<0.05)。与高糖组相比,药物干预后的细胞中mRNA 的表达呈剂量依赖性增加(图10、11)。
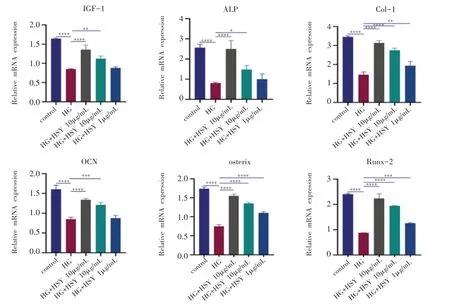
图10 不同浓度桑叶水提物在高糖环境下对MC3T3-E1细胞内成骨相关基因mRNA的表达(3天)

图11 不同浓度桑叶水提物在高糖环境下对MC3T3-E1细胞内成骨相关基因mRNA的表达(7天)
讨论
长期的高血糖是导致患骨类疾病风险显著增加的主要原因之一[6]。因此,本研究通过CCK8 法检测MC3T3-E1 在高糖环境下第1、3、5、7 天的增殖情况,与刘等[7]的研究结果相似,从第3 天开始,50 mM的高糖环境均能够显著抑制MC3TC-E1的增殖。造成这个现象的原因可能是由于短时间内升高低浓度的葡萄糖为细胞提供了更加充足的养分反而促进了其增殖,而较高的糖浓度短时间内就对细胞产生了损伤。故本实验采用50 mM的葡萄糖模拟体内高糖环境。
通过对天然药物的研究发现,天然药物可缓解因高糖刺激引起的成骨细胞分化能力减弱和氧化应激。而桑叶作为我国传统中药材,含有酚类、生物碱类、多糖类、氨基酸类等多种活性成分,具有抗氧化、降血糖、降血脂、抗炎和抗肿瘤等药理作用[8]。本课题组前期研究发现,桑叶水提物可以在正常及炎症环境中促进成骨细胞的增殖和分化。然而,目前关于桑叶水提物对高糖环境下前成骨细胞增殖和分化的研究较少。本研究通过CCK-8 法检测高糖环境下MC3T3-E1 加入桑叶水提物后的增殖情况,最终选取了1~100 μg/mL 的桑叶水提物用于接下来的实验,并观察桑叶水提物在高糖环境下对前成骨细胞成骨分化的作用研究。
成骨细胞的增殖是骨形成的重要阶段之一。目前关于桑叶水提物对高糖环境下前成骨细胞凋亡的研究较少。本研究发现,与对照组相比,高糖刺激可以引起前成骨细胞的凋亡率增加,加入桑叶水提物在一定浓度范围内能缓解因高糖刺激而引起的细胞凋亡。100 μg/mL 的桑叶水提物在抑制因高糖刺激引起的凋亡最为明显。Bax 是一种促凋亡蛋白基因,Bcl-2 是一种抗凋亡蛋白基因,在成骨细胞的凋亡过程中发挥着至关重要的作用[9]。本研究发现,在高糖环境下加入一定浓度的桑叶水提物后抗凋亡蛋白Bcl-2 表达增高,凋亡蛋白Bax 表达降低,Bcl-2/Bax 比值升高,且与桑叶水提物的浓度有一定的关系。因此,推测桑叶水提物在一定浓度范围内可能通过调控Bax/Bcl-2来抑制前成骨细胞凋亡。
氧化应激是由高血糖状态下介导胰岛β 细胞损害的重要病因,被认为是糖尿病合并骨质疏松、牙周病、冠心病、动脉粥样硬化等的共同发病机制[10,11]。氧化应激会造成ROS 大量产生,当体内ROS 超出了机体清除率时会导致细胞的有氧损伤,从而加剧体内的氧化应激反应[7,11],清除ROS能够有效促进细胞的成骨能力,高糖状态产生过量ROS 会导致细胞内谷胱甘肽的水平下降,将抑制细胞的成骨分化[12,13]。糖尿病及牙周炎均会造成氧化应激升高,当牙周处于炎症状态时,机体内抗氧化水平的降低会进一步加剧糖尿病状态下的氧化失衡状态[14]。糖尿病伴随牙周炎会加重局部和全身的氧化损伤,氧化应激的增加又会损害牙周组织[15]。而且ROS的过度产生与糖尿病的AGEs 密切相关,AGES 大量产生会导致IL-1β、TNF-α 和IL-6 等炎症介质的分泌增多,会导致牙槽骨的快速丧失,继而影响相关成骨指标的表达[16]。因此,氧化应激被认为可能是糖尿病牙周炎致病中的关键。本研究发现,与对照组相比高糖环境明显促进了ROS 的产生和相关炎性因子的表达。加入桑叶水提物后,可在一定程度上能抑制ROS 的产生和相关炎症因子的表达,表明桑叶水提物能够缓解因高糖刺激引起的细胞氧化应激损伤。
高糖环境会产生大量ROS,进而导致牙槽骨的吸收和破坏,而牙槽骨主要通过成骨和破骨细胞的共同作用改建,包括骨生成和骨吸收[18]。因此本研究检测了与骨形成和矿化相关成骨指标的表达情况。IGF-1 是细胞及组织代谢过程中的中间产物,参与葡萄糖稳态[19,20],当其作用于成骨细胞,可诱导成骨细胞增殖、分化以及促进成骨矿化相关基因的表达[21,22]。ALP、Runx2、OCN、COL-1、Osterix 作为骨细胞的标志性转录因子,对骨的分化及改建方面有着至关重要的作用[23~25]。本研究通过碱性磷酸酶染色及活性以及检测成骨相关基因的表达情况来探究高糖状态下成骨细胞的成骨分化能力。结果发现与对照组相比,高糖组碱性磷酸酶活性及成骨相关mRNA 表达情况明显降低,说明高糖环境可以抑制成骨细胞的分化能力,加入桑叶水提物后可能通过抵抗ROS 的产生从而逆转高糖环境下成骨基因表达低的情况。
综上,桑叶水提物能够对高糖环境下MC3T3-E1 细胞发挥良好的抗炎及抗氧化能力,缓解甚至逆转高糖环境引发的炎症反应和细胞氧化应激进而促进高糖环境中细胞的增殖活性、成骨分化功能及基质矿化能力。该研究虽然阐述了桑叶水提物对高糖状态下成骨细胞分化的影响,但体外高糖环境并不能完全模拟糖尿病在体内对骨损伤的致病机理,后期还需进一步完善相关体内实验,为桑叶水提物用于糖尿病牙周炎的防治提供更多的参考依据。
