禽星状病毒检测技术研究进展
2024-02-23尚佳静封莹洁张富友邓春冉于晓慧蒋文明刘华雷刘冠慧
罗 娟,尚佳静,封莹洁,孟 鸽,张富友,邓春冉,于晓慧,蒋文明,刘华雷,刘冠慧,李 阳
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.河北工程大学生命科学与食品工程学院,河北邯郸 056038)
星状病毒(astroviruses,AstVs)于1975年首次被发现,因其在电子显微镜下呈现具有明显五角或六角星状外观而被命名为星状病毒。AstVs 最早是在患有腹泻的儿童中被检出,随后在哺乳动物幼崽和雏鸟中被发现[1-2]。基于感染宿主范围不同,AstVs 可分为哺乳动物星状病毒(mammalian astroviruses,MAstV) 和禽星状病毒(avian astroviruses,AAstV)。虽然不同属AstVs 对同一物种可引起相似的临床症状,但对不同物种引起的临床症状存在一定差异:哺乳动物感染AstVs 可表现肠道疾病,或其他一系列症状,如水貂和奶牛可表现脑炎和脑膜炎症状,犊牛出现呼吸道疾病等[3-5];禽类感染后,火鸡主要表现肠炎[6],鸡表现肾炎[4],鸭、鹅则出现肝炎、痛风等不同病症[7-8],还可出现孵化率降低、死亡率增加等[9-10]。研究发现AAstV 可能存在跨宿主感染:Meyer等[11]在冈比亚、肯尼亚人类粪便中分离到2 株新型AAstV,比对发现其与禽肾炎病毒1 型、2 型及犬星状病毒具有高度相似性;Chen 等[12]从患病小鸭中成功分离到鹅星状病毒2型(goose astrovirus 2,GoAstV-2)毒株,对其进行雏鸭动物回归试验发现,该毒株在雏鹅和雏鸭之间可能存在跨宿主感染。
AAstV 分型较多,至今尚未有有效疫苗和药物对该病进行防治,因此病原检测在AAstV 感染监测和鉴别诊断中起重要作用。目前国内外已建立多种AAstV 检测方法,包括电镜法以及病毒分离与鉴定、免疫学检测、分子生物学检测等技术。本文主要针对现阶段的AAstV 检测技术的应用和发展进行综述,期望能够为AAstV 检测方法研究提供参考。
1 病毒分类及生物学特性
1.1 病毒分类
1995年以来,国际病毒分类委员会(The International Committee for Taxonomy of Viruses,ICTV)对不同来源禽类和哺乳动物物种的AstVs分类进行了多次修改[13-14]。目前ICTV 报道的AAstV 包 括3 个 型——AAstV-1、AAstV-2 和AAstV-3,其中AAstV-1 包含火鸡星状病毒1 型(turkey astrovirus 1,TAstV-1),AAstV-2 包含禽肾炎病毒1 型(avian nephritis virus 1,ANV-1)和2 型(ANV-2),AAstV-3 包含TAstV-2 和鸭星状病毒1 型(duck astrovirus 1,DAstV-1)[15]。近年来还有一些AAstV 没有被明确分类,如鸡星状 病毒(chicken astrovirus,CAstV)、GoAstV、TAstV-3、DAstV-2 等[16]。AAstV 分类图见图1。
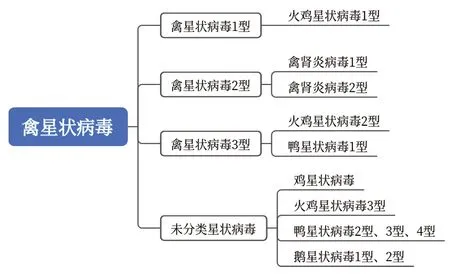
图1 AAstV 分类
1.2 分子生物学特征
AAstV 是一种无囊膜的单股正链RNA 病毒,基因组全长一般为6.8~7.9 kb,由5' 非翻译区(5' UTR)、3'非翻译区(3' UTR)、1 个多聚核苷酸尾巴(poly A)及3 个开放阅读框(ORF1a、ORF1b、ORF2)组成[17]。ORF1a 和ORF1b 区域编码非结构蛋白(NSP),包括跨膜结构域(TM)、丝氨酸蛋白酶基序、锌指蛋白模型、核定位序列和RNA 依赖性RNA 聚合酶[18]。ORF1b 与ORF1a之间存在一段重叠区域,且不同物种AstVs 的重叠区域稍有不同,MAstV 重叠区长为10~148 nt,AAstV 重叠区长一般为12~45 nt。两者重叠区域中还包含1 个核糖体移码信号,其对RNA 聚合酶翻译起重要作用。ORF1b 是病毒种属和血清型之间差异最小的区域[19];ORF2 编码衣壳蛋白、刺突蛋白和结构蛋白(衣壳蛋白前体),是病毒高度变异区间,能够与病毒的特异性抗体发生特异性反应,同时也是划分AAstV 的种间依据[20-22]。
1.3 理化特征
AAstV 适应外界环境能力较强且比较稳定,在4 ℃及室温环境中可稳定存活几个月,对高温、高浓度酸不敏感;可抵抗多种消毒剂,如氯仿、各种去垢剂、酚类、酸类、醇类、季铵盐和脂质溶剂等[23]。但有研究[24]表明,90%甲醇或含有硫酸盐的消毒剂也可以达到灭活AAstV 的目的。
2 检测技术
2.1 电镜法
电镜法是指借助电子显微镜等仪器,对病毒粒子的显微结构进行观察,对病毒种类进行分类的一种检测方法。1975年,研究者利用电子显微镜在患有胃肠炎婴儿的粪便中观察到28~30 nm 的星状病毒粒子。有研究[25]将GoAstV-2 接种鸡肝癌细胞(LMH cell,LMH),3 次传代后收集病毒感染的LMH,用2.5%戊二醛固定后使用透射电子显微镜观察到大量病毒颗粒,颗粒直径约为30 nm。电子显微镜的敏感程度和样品浓度相关,因此在检测时具有一定的局限性,当病毒含量低时结果难以被准确观察。由于只有少数病毒粒子能够表现出完整的星状结构,易与一些小RNA 病毒混合,所以此方法准确性低。因此,电镜法不适于大批量临床样品检测,少数条件下适用于实验室研究。
2.2 病毒分离与培养
AAstV 常用禽胚或细胞进行分离培养。有研究[26]利用无特定病原(specific pathogen free,SPF)鸡胚代替鸭胚或鹅胚进行DAstV 和GoAstV分离鉴定,发现有些毒株无法适应SPF 鸡胚,但在SPF 鸡胚中被成功分离的病毒,对鸡胚致死率达到100%。Zhang 等[27]将GoAstV-2 组织样品处理后接种到鹅胚发现,随着传代次数的增加,到第5 天胚胎死亡率达到60%~100%,死亡胚胎出现浮肿、肝脏坏死和出血,绒毛尿囊膜增厚。Liu等[28]经绒毛尿囊膜接种鸭胚对DAstV-3 毒株进行分离鉴定,发现从第4 代开始出现鸭胚死亡,死亡率达到20%~33.3%,第7~16 代,死亡率高达62.5%~100%,并且感染胚胎表现出不同程度的发育迟缓、皮肤出血和头部水肿等症状。Wang等[29]为实现GoAstV-1 的分离,将病毒匀浆液分别接种于SPF 鸡胚、SPF 鸭胚和鹅胚,发现接种3 代后,鹅胚在10 d 后出现死亡,死亡率可达40%~100%,死亡胚胎出现严重的皮下出血,但利用鸡胚、鸭胚进行分离,未成功分离出病毒。由于缺乏SPF 鹅胚,在每次进行GoAstV 分离时,都要从鹅胚中排除其他病原体污染,导致GoAstV 分离较为困难。
鸡肝癌细胞(LMH)、鹅胚胎肾细胞(GEK)、鹅胚胎肝细胞(GEH)、鹅胚胎成纤维细胞(GEF)、鸭胚成纤维细胞(DEF)也可用于AAstV 分离[30]。Zhu 等[25]和Zhao 等[31]分别将患病鹅和鸡的内脏组织匀浆液接种LMH,发现能够通过LMH分离到GoAstV-2 和CAstV。Zhang 等[32]也发现GoAstV 虽然能够在LMH 中繁殖,但未导致明显细胞病变。Zhang 等[33]研究发现DAstV-1 的亲本毒株和获救毒株均可以在DEF 细胞中培养。由此可见,部分毒株也可适应细胞,在细胞上进行繁殖。但原代细胞生长潜力有限,需要自己制备。综上可见,用禽胚和原代细胞分离鉴定操作过程繁琐,周期长,且在分离过程中存在一定的局限性。
2.3 免疫学检测技术
2.3.1 免疫荧光技术 免疫荧光技术是根据抗原抗体反应的基本原理,将抗原或抗体以共价键形式牢固结合,荧光抗体或抗原与特异性抗原或抗体反应,在紫外线下可观察到荧光的技术[34]。该技术可分为直接免疫荧光技术(direct fluorescent antibody,DFA)和间接免疫荧光技术(indirect fluorescent antibody,IFA)。DFA 灵敏度低且用于直接标记的抗原来源较少,操作复杂,未得到广泛使用;IFA 主要使用未标记的一抗与抗原结合,利用不同来源的二抗与一抗结合,在荧光显微镜下观察,即可检测出相应的抗原定性和定位。刘莉等[35]以原核表达载体pET-30a(+)表达了GoAstV-1 结构蛋白编码基因ORF2,制备了兔源多克隆抗体血清,经IFA 鉴定,证实所制备的多克隆抗体血清能够与GoAstV-1 特异性结合。而Li等[36]则使用大肠杆菌表达系统表达ORF2 衣壳基因片段制备了小鼠多克隆抗体,并以此作为IFA 一抗,可用于测定病毒滴度。但IFA 的一抗需自己制备,制备过程繁琐耗时。
2.3.2 酶联免疫吸附试验 酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)是将吸附在固相载体表面的已知抗原或抗体与酶标记的待检抗体或抗原进行孵育,利用洗涤液将在固相载体上形成的抗原抗体复合物与其他物质分离,滴加显色剂进行显色,通过酶标仪对待测物浓度进行检测的一种方法。Wang 等[37]表达了DAstV 衣壳蛋白C 端,建立了DAstV ELISA 抗体检测方法;Ren 等[38]针对ORF2 的单克隆抗体(mAbs),开发了用于检测抗GoAstV-1 抗体的夹心ELISA 检测方法,可用于GoAstV-1 的血清学检测。此类方法对实验室安全级别要求不高,不会造成过多的污染,在流行病学调查中应用较多,但该方法的稳定性还有待提高[39]。
2.4 分子生物学诊断技术
2.4.1 聚合酶链式反应 20世纪80年代Mullis 发明了聚合酶链式反应(ploymerase chain reaction,PCR),因其能够检测难以培养的微生物,操作简单,目前已成为实验室应用较多的方法之一,也是AAstV 的主要检测方法之一。扩增程序主要包括变性、退火和延伸[40],扩增产物可通过琼脂糖凝胶电泳分析、直接测序或克隆到单个质粒载体后测序分析,对单个克隆进行测序[41-42]。该方法已被应用于AAstV 分型和大批量临床样本的流行病学调查。Liu 等[28]建立了一种检测DAstV-3 的PCR 方法,其特异性较好,与其他3 种DAstV 无交叉反应,最低检测限可达5.5×102copies/µL,为开展DAstV-3 流行病学和致病性调查提供了诊断工具。肖亦辰等[43]针对GoAstV-2 的ORF2 基因序列设计特异性引物建立了RT-PCR 方法,其最低检测限可达4.54×102copies/µL,对实现该病的临床检测及有效防控具有重要意义。总体上,PCR 方法操作简单,成本低,已成为临床上检测AAstV的主要手段,被用于大批量临床样本AAstV 筛查,但其耗时长,产物残留或PCR 抑制易导致假阳性结果[44]。随着技术的发展,在单一PCR 扩增的基础上又兴起了多重PCR 技术,即在同一体系中加入两对或多对扩增不同目标的引物,操作与单一PCR 相同,但在设计引物时要注意区分不同病毒目的片段的大小,以免混淆。Dai 等[45]以鹅细小病毒(GPV)和番鸭细小病毒(MDPV)Rep1基因为靶基因,设计了通用PCR 引物,同时根据鸭肠炎病毒(DEV)UL54基因、GoAstV 的ORF1b基因设计特异性检测引物,建立了多重PCR 检测方法,可在一次反应中同时检测GPV、MDPV、DEV、GoAstV,研究发现此方法特异性较好,其中DEV、GoAstV 灵敏度分别为2.136×102和7.481× 10−1copies/µL,GPV 和MDPV 的灵敏度一致,均为2.375×103copies/µL。Jindal 等[46]针对禽轮状病毒的NSP4基因以及TAstV-2 和禽呼肠孤病毒的S4基因保守序列设计特异性引物,所建立的PCR 检测方法能够实现对这3 种病毒的同时检测与鉴别。为实现GoAstV-1 和GoAstV-2 的鉴别检测,王宏宇等[47]针对GoAstV-1 和GoAstV-2 的RdRp区域设计特异性引物,建立了双重RT-PCR检测方法,此方法特异性较好,检测限分别可达103和102copies/µL,为GoAstV 感染的早期流行病学调查和临床诊断提供了可靠手段。
2.4.2 实时荧光定量PCR 实时荧光定量PCR 是将PCR 与荧光报告化学及电信号分析相结合,监测模板扩增的一种检测方法,分为相对定量和绝对定量两种,可用于基因表达,微生物、拷贝数的绝对定量或相对基因表达研究。相对定量法是将一个样品的基因表达与另一个样品进行比较,而绝对定量法是使用一系列标准品构建的标准曲线进行定量计算。相较于RT-PCR 方法,实时荧光定量PCR的灵敏度和特异性更好,其操作简单,反应产物无需开盖检测,检测限(能够检到核酸或者细胞的最低浓度)和定量限(被定量的最低浓度)较高[48-49],目前已被广泛用于AAstV 实验室快速检测。Smyth 等[50]建立了分别检测ANV 和CAstV的实时荧光定量PCR 检测方法,并通过试验证明该方法可对感染鸡的病毒复制能力进行监测。为实现DAstV-3 的快速检测,掌握其在鸭群中的流行动态,傅秋玲等[51]针对nsp1a基因设计了特异性引物和探针,建立了检测DAstV-3 的荧光定量PCR 方法,其最低检测限可达21.3 copies/µL,灵敏度较常规RT-PCR 高11.60%。邓昕竹等[52]针对GoAstV 的ORF1b 基因保守序列设计特异性引物和探针,分别建立了TaqMan 和SYBR Green Ⅰ荧光定量PCR 方法,并利用该方法对临床样本进行检测,发现探针法灵敏度较好,其阳性检出率较染料法高。荧光定量PCR 仪器具有可以同时检测不同荧光通道扩增情况的优势,即在同一反应体系中加入不同荧光基团标记的探针,可实现对多种疾病病原的同时检测。近年来有许多研究者建立了多重荧光定量PCR 技术。如:Wang 等[53]针对GoAstV 的ORF1b 保守基因序列,建立了快速检测GoAstV-1 和GoAstV-2 的双重荧光RT-PCR 方法;Yang 等[54]建立了检测GPV 和GoAstV 的双重实时荧光定量PCR 方法,能够实现对两种病毒混合感染的鉴别检测,为GPV 和GoAstV 感染的流行病学调查提供了有效的筛查手段。
2.4.3 其他检测技术 随着技术的不断发展,一些新兴的检测技术也逐渐被应用到禽病检测中,如环介导等温扩增(loop-mediated isothermal amplification,LAMP)和重组酶介导等温扩增(recombinase aided amplification,RAA) 等。 上述方法操作简单,反应时间较短,恒温条件下即可完成反应,无需昂贵的设备,目前已被用于新型冠状病毒[55]、禽流感病毒[56]等病原体的检测,在AAstV 上也有一定的应用。邓春冉等[57]针对DAstV-3 的RdRp基因保守区域设计特异性引物和探针,建立了RT-RAA 检测方法,其在39 ℃恒温条件下,仅需20 min 就能实现对DAstV-3 的快速检测。Yu 等[58]针对GoAstV ORF2 基因设计了特异性引物从而建立了RT-LAMP 检测方法,并将该方法与巢氏PCR 和普通RT-PCR 方法进行对比,结果发现RT-LAMP 的灵敏度与巢氏PCR 基本一致,但要优于普通RT-PCR,且该方法耗时短,对设备要求不高,仅需恒温水浴锅即可完成反应。除此之外,基于规律成簇的间隔短回文重复序列及其相关蛋白(CRISPR/Cas)核酸的即时检测分子诊断技术由于快速、简单、敏感等优点,也逐渐被用于检测各种病原体,包括寨卡病毒、登革热病毒、非洲猪瘟病毒等[59]。Yang 等[60]将酶促重组等温扩增技术(ERA)与CRISPR-Cas12a 技术相结合,成功建立了用于快速检测GoAstV 的方法,其操作简单,仅需便携式加热器进行反应,特异性较好,灵敏度低至8 copies/µL。上述不同AAstV 分子生物学诊断技术的检测限及优缺点对比结果见表1。
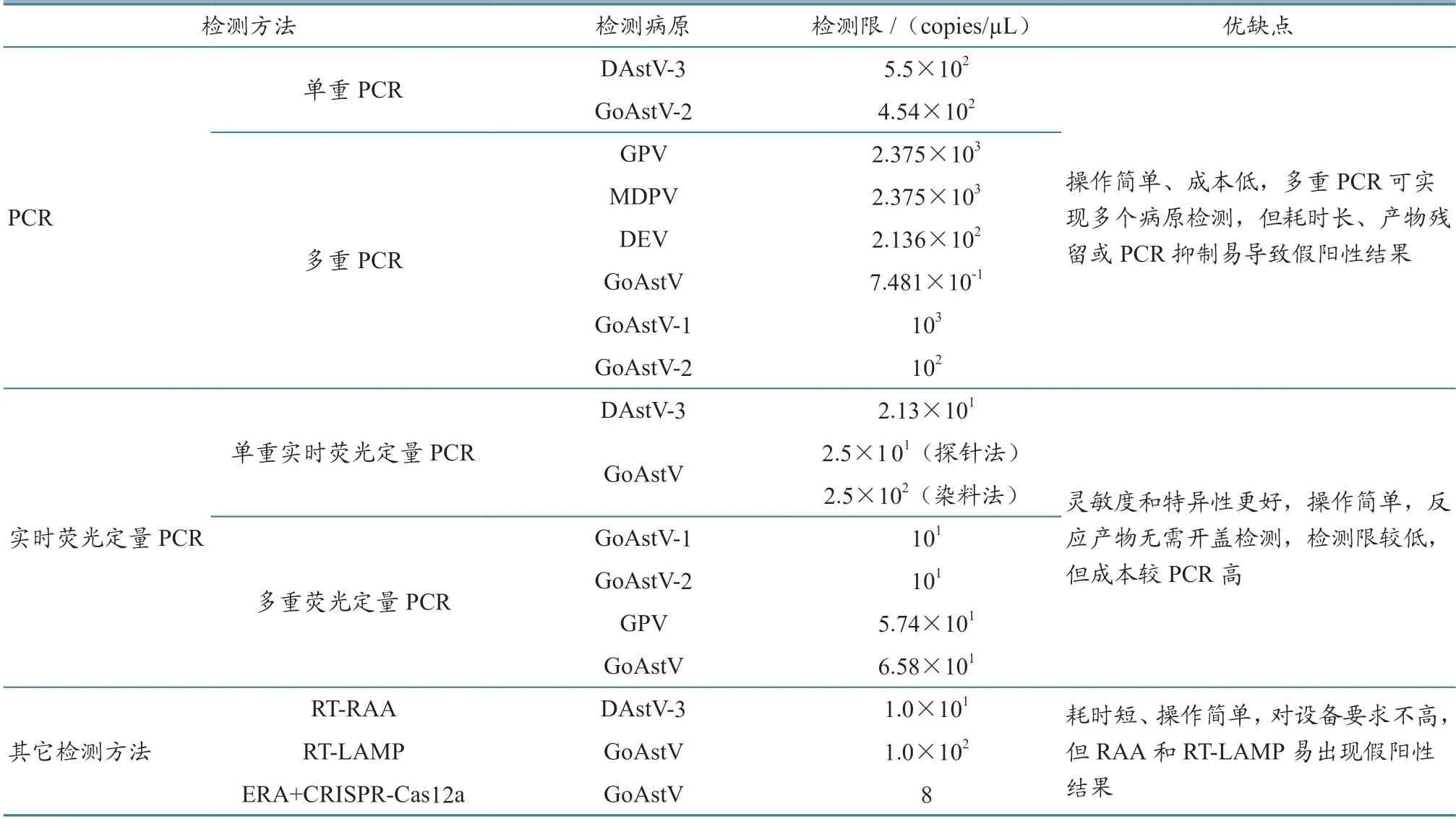
表1 不同AAstV 分子生物学诊断技术检测限及优缺点对比
3 小结
现阶段对于AAstV 的研究大部分都集中在引起以痛风、尿酸盐沉积为主要症状的GoAstV,而对CAstV、TAstV、DAstV 等其他AAstV 的研究相对较少。由于缺少合适的动物模型,在AstVs 致病机制、疫苗和药物研发方面存在一定难度。基于上述研究现状和局限,开发灵敏、快速、准确的检测方法,对于有效控制AAstV 感染的频发和开展分子流行病学调查具有重要意义。随着检测技术的不断进步,AAstV 检测技术得以发展。不同检测方法各有优劣:电镜法在病毒含量低时难以检测,准确性较低;病毒分离鉴定准确可靠,但缺少理想的病毒体外培养体系,且分离培养耗时长;IFA 没有成品化的一抗,需要个人制备;ELISA 操作简单,成本较低,被广泛应用于流行病学调查及抗体水平检测,但目前针对AAstV 的研究相对较少;PCR操作简单,成本低,但耗时长,产物残留或PCR抑制易出现假阳性结果;实时荧光定量PCR 的灵敏度和特异性更好,操作简单,但成本较PCR 高,荧光引物探针设计复杂;RT-RAA、RT-LAMP、CRISPR-Cas 等检测技术耗时更短,设备要求不高,灵敏性和特异性更好,但同样易出现假阳性结果。在生产实践及研究中,可以根据不同场合及需求选择合适的方法,以提高工作效率。随着对AAstV研究的不断深入,以及不同技术的结合与优化,该病原的检测方法将会得到更多的开拓,更灵敏、更简便的新型检测技术的建立也将为该病诊断及防控提供更有力的技术支持。
