基于TCGA数据分析TRIM45基因在乳腺癌中的表达特征及生物学功能
2024-02-22武永霞姜良乾朱峰
武永霞 姜良乾 朱峰
(1临沂市人民医院产科,临沂 276000;2临沂市人民医院检验科,临沂 276000;3济宁医学院生物科学学院,日照 276826)
乳腺癌是严重威胁女性生命健康的一种疾病,2021年美国女性癌症发病首位为乳腺癌,年发病人数约为28.15万,占女性癌症新发病例的30%;女性癌症死因乳腺癌排第二位,年死亡人数约为4.36万,占女性癌症死亡病例的15%[1]。因此,寻找能够诊断乳腺癌的肿瘤标志物迫在眉睫。目前,三模体家族45(Tripartite Motif Family 45,TRIM45)在乳腺癌中研究较少,通过GDC TCGA Breast Cancer (BRCA)数据库筛选发现TRIM45表达显著上调。TRIM45,一种具有RING-finger 结构域的E3泛素连接酶,是TRIM家族的一员,在细胞增殖、分化、凋亡和肿瘤发生发展等多种细胞功能中发挥重要作用[2-6]。TRIM45可通过抑制AP-1和ELK-1转录活性从而负调控MAPK信号传导途径[2];同时,TRIM45是一种新型的RACK1相互作用蛋白,能够抑制RACK1/PKC复合物的形成而下调MAPK信号转导[3];此外,TRIM45可以负调节NF-κB通路并抑制癌细胞增殖[4];并且TRIM45与p53相互作用,通过促进p53的K63连接的多聚泛素化,能够稳定p53,从而抑制了p53的泛素化降解[5]。研究表明TRIM45是一种重要的抗肿瘤分子。因此,本研究主要以单基因TRIM45为研究对象,通过GDC TCGA Breast Cancer(BRCA)数据挖掘,利用生物信息学方法分析TRIM45在乳腺癌中的表达、临床病理相关性及生存预后分析,使用GSEA(Gene Set Enrichment Analysis)基因富集分析TRIM45参与乳腺癌调控的信号通路,揭示其调控乳腺癌发生发展的可能分子机制。
1 材料与方法
1.1 乳腺癌基因芯片表达数据及临床数据的收集和处理
乳腺癌患者的临床资料和RNA-Seq数据来自GDC TCGA Breast Cancer(BRCA)(https://xenabrowser.net)。其中,下载1104例乳腺癌组织样本和113例癌旁样本及配对样本(乳腺癌临床样本113例、癌旁样本113例)的临床信息和RNA-Seq数据,所有样本的RNA-Seq数据均已在R软件(V.3.6.0)中使用BioConductor包进行处理和归一化。
1.2 TRIM45在乳腺癌中的表达差异及其与临床病理特征的关系
采用R软件(V.3.6.0)对GDC TCGA Breast Cancer(BRCA)数据进行处理,使用edgeR包对RNA-Seq数据作差异分析,计算TRIM45在乳腺癌组织(1104例)和癌旁组织(113例)、乳腺癌组织和与其相匹配的癌旁组织(113例)的差异表达。使用UALCAN (http://ualcan.path.uab.edu)[7]分析TRIM45在乳腺癌中的表达及其与临床病理类型的关系。
1.3 乳腺癌组织TRIM45表达水平与乳腺癌预后的关系
按TRIM45在乳腺癌临床样本中的表达均值(FPKM平均值为2.0341)进行分组,低于均值为低表达组,高于均值为高表达组。分析TRIM45表达水平与Overall Survival的关系。
1.4 基因集富集分析
使用KEGG基因集[c2.cp.kegg.v7.5.1.symbols.gmt]进行GSEA富集分析,评估TRIM45可能参与乳腺癌调控的信号通路。按TRIM45在乳腺癌临床样本中的表达中位数(FPKM中位数为1.9665),将乳腺癌临床样本分为高、低两组。在分析过程中,TRIM45的表达被认为是高、低两组表型,根据NES(标准化富集分数)、NOM p-val(标准化显著性水平)和FDR q-val(矫正多重假设检验)对每种表型的富集途径进行分类,NES绝对值>1.0,NOM p-val<0.01,FDR q-val<0.05确认为有意义的基因集合。
1.5 统计学方法
所有统计分析均使用R(V.3.6.0)软件。两组独立样本数据的比较使用Student′st-test检验,多组数据间的比较使用秩和检验。采用卡方检验分析TRIM45表达与临床病理特征的关系,使用Kaplan-Meier法作生存分析。以P<0.05为差异有统计学意义。两基因间相关性分析使用Spearman相关性分析,P<0.05并且r绝对值>0.3为差异有统计学意义。
2 结果
2.1 乳腺癌和正常乳腺组织TRIM45差异表达
基于TCGA数据分析,在非配对乳腺癌样本与癌旁样本中的差异表达分析显示,TRIM45在乳腺癌中的表达高于癌旁组织(P<0.001)(图1A)。在配对乳腺癌样本与癌旁样本中的差异表达分析显示,TRIM45在乳腺癌中的表达高于癌旁组织(P<0.001)(图1B)。
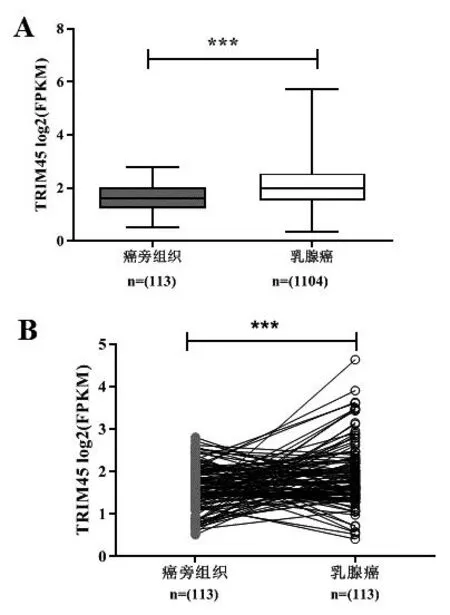
注:A.TRIM45在乳腺癌组织与癌旁组织中的表达分析;B.TRIM45在乳腺癌组织及其匹配的癌旁组织中的表达分析。***P<0.001。
2.2 TRIM45与乳腺癌患者总生存期的关联性
TRIM45高表达的患者总生存期优于TRIM45低表达的患者(P=0.0021)。见图2。

图2 TRIM45在乳腺癌中的总生存期分析
2.3 乳腺癌组织TRIM45表达及其临床病理关联性
通过对1104例乳腺癌临床数据进行筛选,保留TCGA数据集中包含临床参数和生存资料的病例,最后得到含有完整临床病理参数和生存资料的病例825例,其中TRIM45低表达422例,TRIM45高表达403例。
TRIM45 mRNA表达水平与乳腺癌患者分子分型、T分期、TNM分期以及病理类型存在显著关联(P<0.05)。见表1。
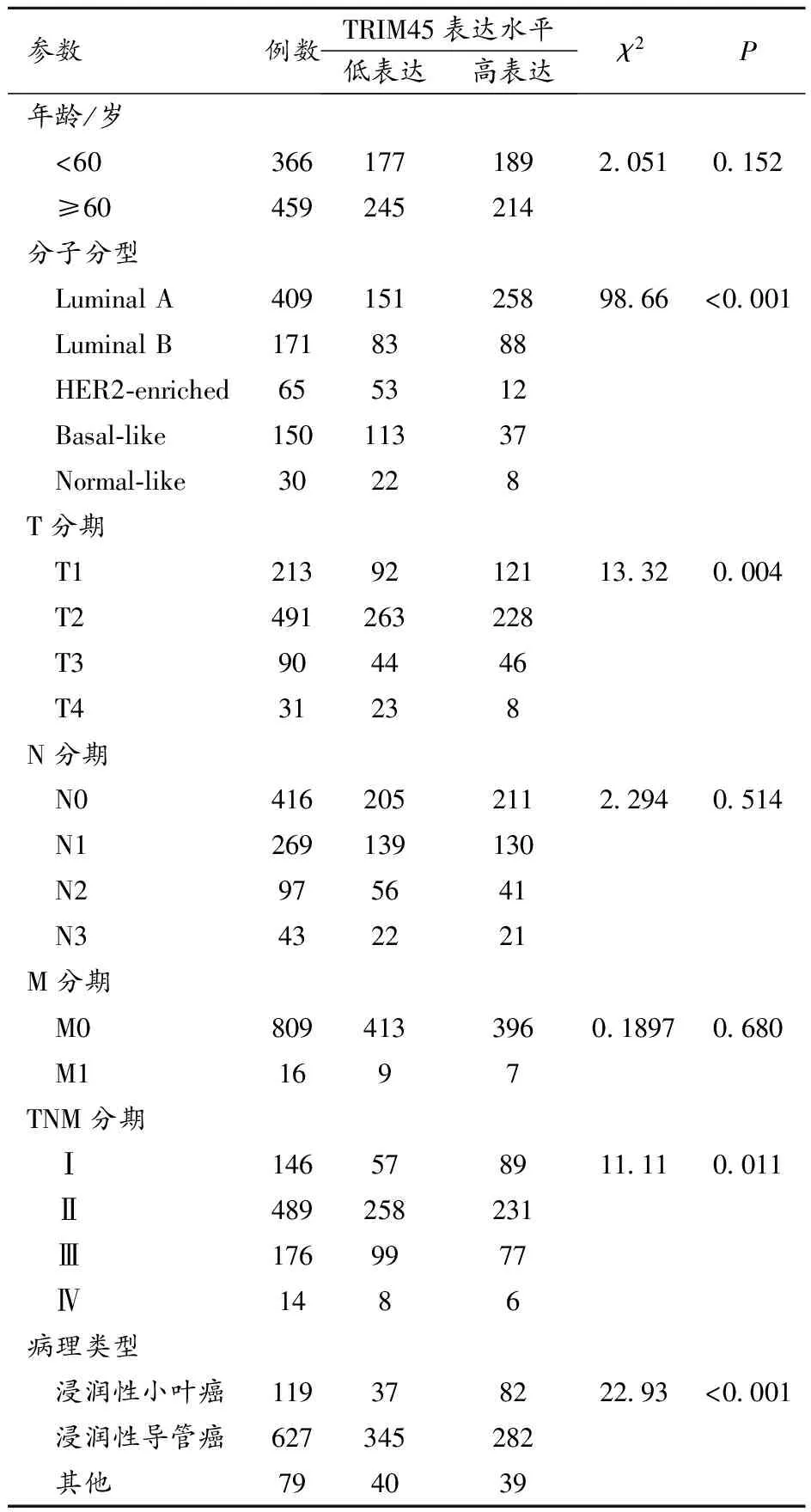
表1 TRIM45表达与乳腺癌临床病理关联性分析
2.4 TRIM45功能基因富集分析
GSEA富集分析发现TRIM45在KEGG_PATHWAYS_IN_CANCER信号通路中发挥重要作用(NES=-1.81,NOM p-val=0.002,FDR q-val=0.023),同时KEGG_PATHWAYS_IN_CANCER信号通路在乳腺癌中发挥重要作用。见图3。
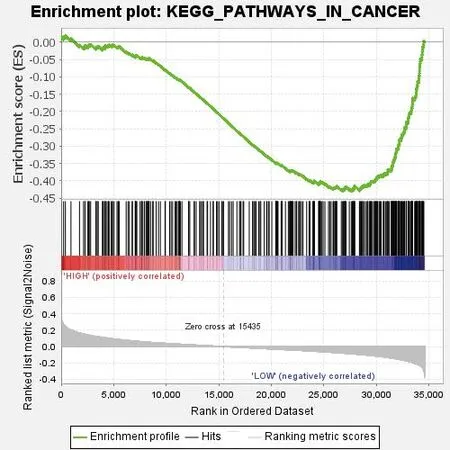
图3 GSEA信号通路富集分析
2.5 TRIM45在KEGG_PATHWAYS_IN_CANCER信号通路中共表达基因筛选
通过相关性分析可以发现TRIM45与KEGG_PATHWAYS_IN_CANCER信号通路中多种基因存在相关关系,其中STK36、IKBKB、GLI3与TRIM45具有正相关关系(图4A~4C),HIF1A与TRIM45具有负相关关系(图4D)。
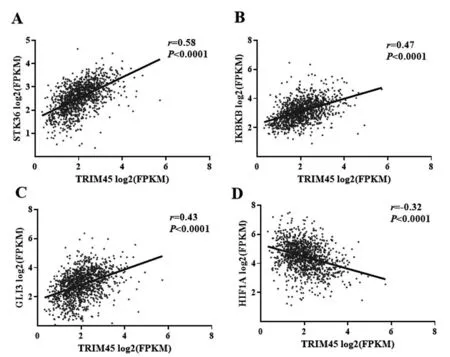
注:A.TRIM45与STK36的相关性分析;B.TRIM45与IKBKB的相关性分析;C.TRIM45与GLI3的相关性分析;D.TRIM45与HIF1A的相关性分析
3 讨论
TRIM45是一种具有RING-finger结构域的E3泛素连接酶,在细胞增殖、分化、凋亡和肿瘤发生发展等中发挥重要作用[2-6]。本研究通过挖掘TCGA数据明确TRIM45在乳腺癌中表达上调。通过乳腺癌临床病理相关性分析,发现TRIM45在乳腺癌中的表达与T分期、TNM分期、分子分型及病理类型相关。通过生存分析显示,TRIM45高表达乳腺癌患者的总生存期高于TRIM45低表达者,以上生物信息学数据分析结果显示TRIM45有望成为乳腺癌抑癌基因,且TRIM45高表达能显著提高乳腺癌患者的生存率。
为进一步研究TRIM45在乳腺癌中的功能及调控机制,基于TCGA数据利用GSEA软件进行KEGG基因集富集分析。GSEA富集分析发现TRIM45在KEGG_PATHWAYS_IN_CANCER信号通路中发挥重要作用。通过相关性分析可以发现TRIM45与KEGG_PATHWAYS_IN_CANCER信号通路中STK36、IKBKB、GLI3具有正相关关系,与HIF1A具有负相关关系。
STK36是丝氨酸/苏氨酸激酶家族的成员,是GLI锌指转录因子的正调节因子,在Hedgehog信号通路中起关键作用[8-9]。GLI3编码的蛋白质属于GLI家族成员,是一种DNA结合转录因子,并且是Sonic Hedgehog(Shh) 信号传导的介质[8]。Hedgehog信号通路在调控细胞的增殖、分化、干细胞调控、肿瘤的发生中起着关键性的作用[10]。IKBKB编码的蛋白能够磷酸化NF-κB复合物中的抑制剂,导致抑制剂解离并激活NF-κB,进一步活化NF-κB信号通路[11-12]。HIF1A编码缺氧诱导因子-1(HIF-1)的α亚基,而HIF-1是由α和β亚基组成的异二聚体[13-14]。HIF-1作为细胞和系统对缺氧的稳态反应的主要调节因子,参与调控能量代谢、血管生成、细胞凋亡等基因转录[13-15]。
综上所述,通过挖掘TCGA数据库,应用生物信息学技术推测TRIM45可能作为潜在的诊断乳腺癌和预测其预后的肿瘤标记物,其内在的调控机制可能是通过调控STK36、IKBKB、GLI3和HIF1A影响乳腺癌细胞的增殖、侵袭和转移,尚需要进行一系列的实验来验证本文的预测结果,为乳腺癌的早期诊断和疗效评估提供新的靶点。
利益冲突:所有作者均申明不存在利益冲突。
