2009—2021年夏季长江口海域浮游生物群落结构时空分布特征及其影响因素研究
2024-02-21李立群卢士强何柄震程全国
李立群,王 艳,王 彪,卢士强,雷 坤,何柄震,程全国
1. 沈阳大学环境学院,辽宁 沈阳 110044
2. 中国环境科学研究院流域水环境污染综合治理研究中心,北京 100012
3. 上海市环境科学研究院,上海 200233
浮游生物作为近海生态系统的基础,在近岸海域物质循环和能量流动中起重要作用[1]. 浮游植物是主要初级生产者之一,其物种组成、群落结构不仅影响水体的物质循环、能量流动和水体净化效率,而且能够调节生态系统平衡[2-3]. 浮游动物在海洋生态系统中起着重要的调控作用,其动态变化控制着初级生产力的节律、规模和归宿,浮游动物的变化可直接反映生态系统的健康状况[4].
长江口是我国最大的河口,地处陆海交汇区域,生态环境复杂多变,生态系统敏感脆弱[5-6]. 长期以来,长江口海域生态环境问题凸显[7]. 一方面,长江口及邻近海域富营养化严重,营养盐结构失衡,水环境质量较差[8-9]. DO浓度虽然近20年有所升高,但是仍监测到低氧区的存在[10];另一方面,海洋工程[11]和人类活动[12]破坏海洋生物栖息地,导致生物群落结构不稳定,生态系统长期处于亚健康状态.
关于长江口海域浮游生物群落结构特征及其影响因素,前人做了大量研究,但大多基于特定航次或部分年份的监测数据[13-19],分析浮游植物或浮游动物的变化趋势及其与环境因子之间的关系,缺乏利用长时间序列同时分析长江口海域浮游植物与浮游动物的时空分布特征. 长江口同时受陆源污染排放以及潮汐和盐水入侵影响,不同水域受到的环境压力不同.因此,本文参照文献资料[20-24],选择盐度5‰和25‰等值线作为口门区(盐度<5‰)、河口区(盐度5‰~25‰)和海水区(盐度>25‰)分界线,基于2009-2021年长序列监测数据,分区探讨长江口海域浮游生物群落结构分布特征及其影响因素,以期为长江口海域生态环境管理提供基础.
1 研究区域与研究方法
1.1 研究区域
研究区域为长江口海域,位于30°30'N~31°50'N、121°05'E~123°15'E之间,其范围如图1所示. 长江口受多流系混合作用影响,河口东南部有高温、高盐、低营养盐的台湾暖流北上,北部有南下的苏北沿岸流,复杂的海流与充沛的冲淡水混合[25],上游下泄的泥沙与下游上溯的泥沙在此集聚,伴随咸淡水混合絮凝并下沉,在口门处形成了最大浑浊带[26],该区域营养盐含量丰富,富营养化较为严重[27].

图1 研究区范围及监测站位示意Fig.1 Schematic of the study area and monitoring stations
1.2 数据来源
本文收集了2009-2021年每年夏季(7-8月)长江口海域生态环境监测数据,主要包括磷酸盐(PO4-P)、硅酸盐(SiO3-Si)、溶解性无机氮(DIN)浓度以及浮游植物、浮游动物数据,监测站位如图1所示.
采样及监测方法参考GB/T 17378-2007《海洋监测规范》[28]. 水质采样要求:水深<10 m时,采表层样;水深≥10 m时,采表层、底层样. 浮游植物采用浅水Ⅲ型浮游生物网垂直拖网,浮游动物采用浅水Ⅰ型和Ⅱ型浮游生物网,种类组成(包括优势种和常见种等)结合浅水Ⅰ型和Ⅱ型浮游生物网样品分析;生物密度、生物量采用浅水Ⅰ型浮游生物网采集的样品数据. 浮游植物和浮游动物数据采用垂直拖网数据,不区分表底层,水质数据采用表层数据进行分析.
1.3 研究方法
1.3.1 排序分析方法
排序分析方法使用Canoco 5软件对浮游生物与环境因子进行分析,由于各指标间数据差异较大,在进行排序分析前,将响应变量和解释变量数据进行lg(X+1)转化(除pH外),使数据趋于正态分布(p<0.05).首先进行去趋势对应分析(DCA),若DCA长度梯度的最大值小于3,则采用冗余分析(RDA);若DCA长度梯度的最大值大于4,则采用典范对应分析(CCA);若DCA长度梯度的最大值在3和4之间,则采用冗余分析(RDA)或典范对应分析(CCA)皆可. 该研究对不同区域浮游生物类群丰度进行DCA分析,其最大长度梯度值均小于3,因而选用RDA分析法探究浮游生物特征变化影响因素.
1.3.2 生物多样性指数
运用优势度指数(Y)、Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)和Margalef丰富度指数(d)来计算浮游生物群落特征,其中,优势度可以反映区域内群落的优势种,且优势度指数Y≥0.02的物种叫做浮游生物优势种,Shannon-Wiener多样性指数可以反映物种多样性,Pielou均匀度指数可直观反映各群落个体数目分配的均匀程度,Margalef丰富度指数可以反映物种丰富情况,其计算公式[29-32]如下:
式中,ni为第i个物种的个体数,fi为第i个物种的出现频率,N为所有物种的总个体数,Pi为第i个物种的个体数占该监测站位总个体数的比例,S为总种数.
1.3.3 数据处理
统计分析图采用Origin软件进行绘制,空间分布图采用ArcGIS 10.2软件进行绘制,插值方法采用反距离加权算法.
2 浮游生物群落结构时空变化特征
2.1 浮游植物群落结构时空分布特征
2.1.1 浮游植物种类组成
2009-2021年夏季长江口海域共鉴定出浮游植物34~177种,平均119种,2010年最低,2021年最高(见图2),平均种类数比20世纪90年代有所增加[33].从时间变化来看,浮游植物物种数量呈波动增加的趋势,在2012年、2017年和2020年均达到了极大值.空间分布上,浮游植物物种数量呈现出由口门区至海水区逐渐递增的趋势,与盐度的空间分布规律较为一致(见图2).

图2 2009—2021年夏季长江口海域浮游植物物种数量的时空分布Fig.2 Spatial and temporal distribution of phytoplankton species abundance in the Yangtze River Estuary during the summer of 2009-2021
2016-2021年夏季长江口海域浮游植物的群落组成如图3所示,其中硅藻在各年份浮游植物种类组成上占绝对优势,占总种类数的53.9%~68.1%;甲藻次之,占总种类数的13.4%~26%. 从年际变化来看,甲藻占比略有上升,硅藻占比略有下降.

图3 2016—2021年夏季长江口海域浮游植物的群落组成Fig.3 Community composition of phytoplankton in the Yangtze River Estuary during the summer of 2016-2021
2.1.2 浮游植物细胞数量
2009-2021年夏季长江口海域浮游植物细胞数量的时空分布如图4所示,其年均细胞数量范围为0.52×105~276.94×105个/m3,平均值为40.05×105个/m3,2014年最低,2011年最高. 年际变化上,浮游植物的细胞数量总体呈上升趋势,空间分布上,浮游植物细胞数量的高值区主要集中在河口区.

图4 2009—2021年夏季长江口海域浮游植物细胞数量的时空分布Fig.4 Spatial and temporal distribution of phytoplankton cell counts in the Yangtze River Estuary during the summer of 2009-2021
2.1.3 浮游植物生物多样性
2009-2021年夏季长江口海域浮游植物生物多样性指数的时空分布特征如图5所示. Shannon-Wiener多样性指数范围为0.43~1.08,2021年最低,2020年最高;Pielou均匀度指数范围为0.14~0.57,2021年最低,2015年最高;Margalef丰富度指数范围为0.47~1.49,2010年最低,2020年最高.
从时间变化来看,浮游植物的Shannon-Wiener多样性指数和Margalef丰富度指数变化波动较大,Pielou均匀度指数变化较小. 2021年Margalef丰富度指数较2009年有明显升高,这与浮游植物物种数量呈上升趋势相符合,从2015年开始,浮游植物细胞数量持续波动,导致Pielou均匀度指数自2015年开始呈现出缓慢下降的趋势,Shannon-Wiener多样性指数无明显变化.
在空间分布上,浮游植物的Margalef丰富度指数分布与其物种数量的空间分布相符合,高值区集中在海水区,Shannon-Wiener多样性指数和Pielou均匀度指数的高值区则集中在口门区和海水区. 河口区内,浮游植物聚集,细胞数量高,因此Pielou均匀度指数较低;海水区内,Margalef丰富度指数和Pielou均匀度指数均为高值区,因此Shannon-Wiener多样性指数也较高;口门区内,Margalef丰富度指数较低而Pielou均匀度指数较高,因此Shannon-Wiener多样性指数存在小范围的高值区.
2.1.4 浮游植物优势种
2009-2021年夏季长江口海域浮游植物优势种的变化情况如表1所示. 由表1可以看出,2009-2021年夏季长江口海域共出现了10种优势种,其中硅藻门9种,甲藻门1种(梭角藻),2014年优势种种类数最多. 中肋骨条藻占绝对优势,出现频率达到84.61%,除2010年和2013年外,一直是优势种且是第一优势种. 2010年第一优势种为颗粒直链藻,2013年第一优势种为虹彩圆筛藻. 各优势种的优势度指数变化差异较大,最低值为0.023,最高值为0.621,这表明长江口海域浮游植物群落处于不稳定的状态,且结构趋于简单.
2.2 浮游动物群落结构时空分布特征
2.2.1 浮游动物种类组成
2009-2021年夏季长江口海域共鉴定出浮游动物37~255种,平均种类数为122种,2010年最低,2009年最高(见图6). 从时间变化来看,浮游动物物种数量2010年出现谷值后呈先上升再微幅下降的趋势.在空间分布上,与浮游植物类似,浮游动物物种数量也呈现出由口门区至海水区逐渐递增的趋势(见图6).
2016-2021年夏季长江口海域浮游动物的种类组成较为丰富(见图7),以桡足类为主,占比为22.8%~34%,腔肠动物次之,占比为12.2%~21.6%. 桡足类动物占比有下降的趋势,而腔肠动物有升高的趋势,二者处于动态平衡的互补状态.

图7 2016—2021年夏季长江口海域浮游动物的群落组成Fig.7 Community composition of zooplankton in the Yangtze River Estuary during the summer of 2016-2021
2.2.2 浮游动物密度和生物量
2009-2021年夏季长江口海域浮游动物密度和生物量的时空变化如图8和图9所示. 由图8和图9可见,浮游动物密度范围为9.19~372.18个/m3,2020年最低,2017年最高;生物量范围为132.8~815.49 mg/m3,2020年最低,2016年最高. 浮游动物的密度和生物量在2016年、2017年异常升高,2018-2020年大幅回落,此后呈上升趋势. 空间分布上,浮游动物的密度与生物量分布大体一致,高值区集中在河口区内. 在口门区,浮游动物的密度也存在小范围的高值区.

图9 2009—2021年夏季长江口海域浮游动物密度和生物量的空间分布Fig.9 Spatial distribution of zooplankton density and biomass in the Yangtze River Estuary during the summer of 2009-2021
2.2.3 浮游动物生物多样性
2009-2021年夏季长江口海域浮游动物多样性的时空分布如图10所示. Shannon-Wiener多样性指数范围为1.15~1.92,2016年最低,2009年最高;Pielou均匀度指数范围为0.52~0.75,2016年最低,2021年最高;Margalef丰富度指数范围为1.77~3.73,2010年最低,2021年最高.
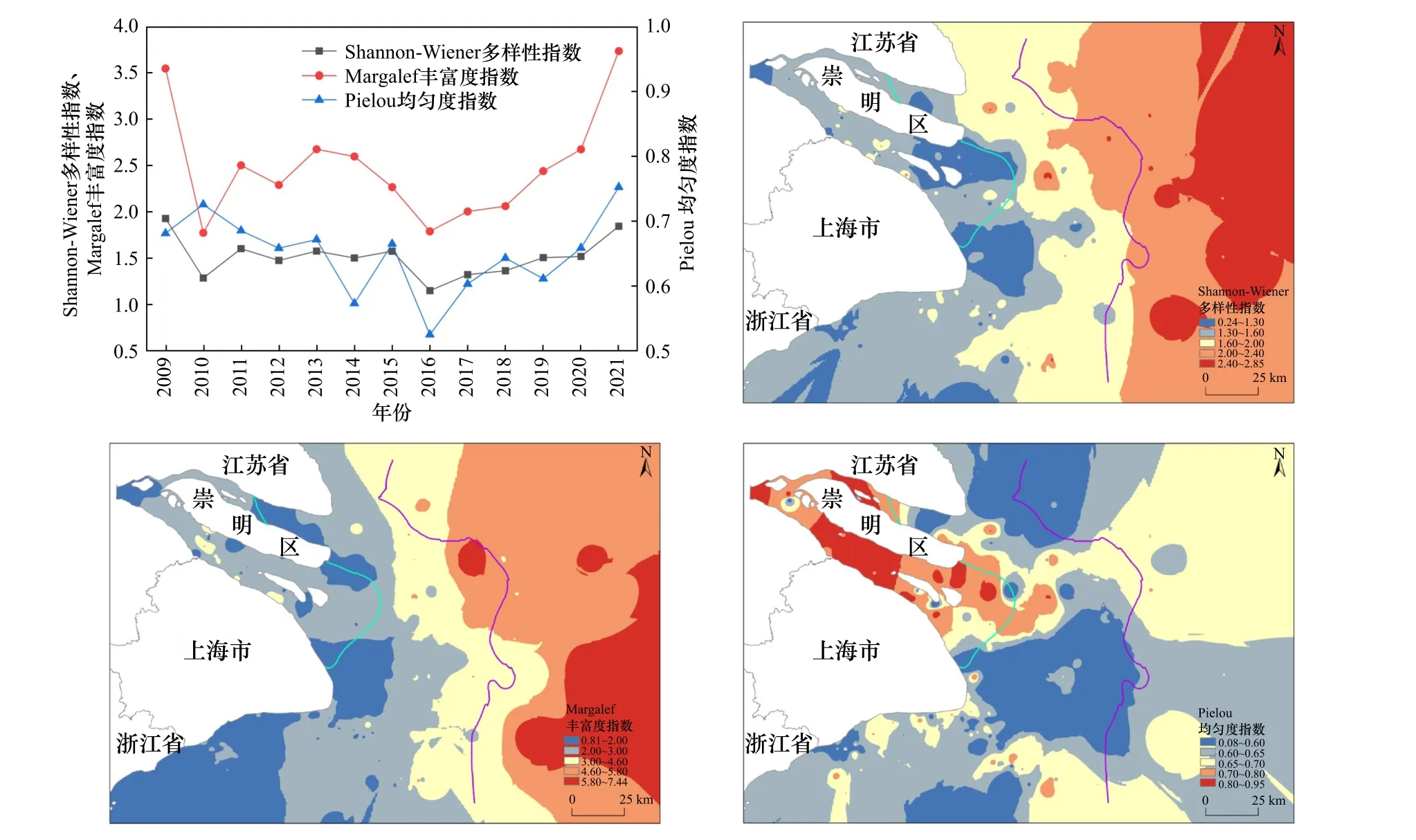
图10 2009—2021年夏季长江口海域浮游动物生物多样性的时空分布Fig.10 Spatial and temporal distribution of zooplankton biodiversity in the Yangtze River Estuary during the summer of 2009-2021
从年际变化来看,浮游动物Shannon-Wiener多样性指数、Pielou均匀度指数和Margalef丰富度指数均有上升的趋势. 2010年由于物种数量较少,所以导致Margalef丰富度指数和Shannon-Wiener多样性指数也达到了极小值.
在空间分布上,浮游动物Shannon-Wiener多样性指数和Margalef丰富度指数均呈现出由口门区向海水区逐渐增大的趋势,与浮游动物物种数量的分布趋势较为一致;Pielou均匀度指数则相反,在口门区形成了高值区.
2.2.4 浮游动物优势种
2009-2021年夏季长江口海域浮游动物优势种的变化情况如表2所示. 从表2可以看出,2009-2021年夏季长江口海域共出现了14种优势种,其中桡足类动物10种,浮游幼体3种,腔肠动物1种,2015年优势种种类数最多. 太平洋纺锤水蚤出现频率高达100%,分别在2010年、2012-2014年、2016年、2018-2019年成为第一优势种. 2009年第一优势种为短尾类溞状幼虾,2011年第一优势种为真刺唇角水蚤,2015年第一优势种为针刺拟哲水蚤,2017年第一优势种为溞属,2020-2021年第一优势种为虫肢歪水蚤. 相较于浮游植物,浮游动物的优势种更为丰富,且各优势种的优势度指数变化较小,最低值为0.045,最高值为0.148,这表明浮游动物的群落结构相对比较稳定.

表2 2009—2021年夏季长江口海域浮游动物优势种的变化情况Table 2 Changes in dominant zooplankton species in the Yangtze River Estuary during the summer of 2009-2021
2.3 浮游生物群落结构变化特征历史比较
根据历史调查资料,20世纪50年代,夏季长江口海域浮游植物细胞数量约为19×107个/m3,浮游动物细胞数量约为1 000 mg/m3. 到了20世纪80年代,浮游植物种类数量总体呈上升趋势[34-35],浮游动物生物量逐渐开始升高,21世纪初,长江口赤潮发生频率开始增加,长江口海域浮游植物和浮游动物均受到了影响,浮游生物变化波动幅度均比较大[36-37]. 经过一系列的措施控制,近年来长江口海域赤潮发生频率已经大幅下降,但是由于营养盐结构比例失衡,有毒赤潮的比例增大,这对浮游植物硅藻和甲藻的演替产生了重要影响. 学者们发现长江口海域近50年来浮游植物群落中的硅藻比例下降,甲藻比例上升[38-40],这与该文的研究结果一致.
也有学者对丰枯水期长江口海域浮游植物群落结构特征进行研究,发现丰水期浮游植物物种丰富,细胞数量高,在近岸水域形成高值区,枯水期物种数量较少,细胞数量低,在离岸水域形成高值区[41]. 长江口海域为赤潮高发区[42],每年5-8月为赤潮高发时段,监测期间部分站位正在发生中肋骨条藻赤潮,异于正常时期水体状态,细胞数量观测值会出现偏高的情况[12]. 浮游植物密集区与浮游动物高生物量区常同时出现于近岸低盐水与外海高盐水的交汇区,也就是最大浑浊带范围内,浑浊带内咸淡水混合,泥沙沉积,营养盐含量丰富[43],有利于浮游植物和浮游动物的生长,与其细胞数量的空间分布特征大体一致[44]. 根据历史资料,2017年7月的长江径流量显著高于2018年,是近10年中较大的一年,势力强、范围广的冲淡水带来了大量的低盐类群生物,导致浮游动物的细胞数量在2017年大幅增加,2018年又大幅降低[45]. 夏季长江口海域黑潮势力强盛,外海水团携带的高温高盐物种逐渐向近岸扩展,所以在近岸也会形成小范围的密度高值区.
生物多样性的历史研究表明,长江口海域浮游生物的生物多样性呈下降趋势[46],但该研究结果显示浮游动物多样性水平自2016年开始呈上升趋势,这意味着长江口海域浮游生态系统进入了新的发展阶段. 就生物多样性的空间分布而言,口门区及部分河口区,陆源输入带来了丰富的氮、磷营养盐,加之河口区咸淡水混合,促进了浮游植物和浮游动物的生长,Pielou均匀度指数高值区则集中在此,与浮游植物的细胞数量和浮游动物的密度、生物量的空间分布一致. 海水区受黑潮影响,盐度高,营养盐含量丰富,黑潮携带大量浮游植物暖水种进入东海[47],Margalef丰富度指数和Shannon-Wiener多样性指数均为高值区,与浮游植物物种数量的空间分布趋于一致.
3 浮游生物群落结构特征变化的影响因素
根据2.1~2.2节中浮游生物的空间分布,盐度是影响浮游植物和浮游动物分布的最主要因素.长江口海域环境复杂,浮游生物的生长受到多种因素的综合影响. 为了探究影响浮游生物特征变化的主要因素,该文分别选择浮游植物和浮游动物占比较大的两个类群,浮游植物选择了硅藻和甲藻,浮游动物选择了桡足类动物和腔肠动物,结合同步监测的水质数据PO4-P、SiO3-Si、DIN、DO、SS(悬浮物)、COD、Chla浓度以及DIN/P(物质的量比,下同)、Si/P(物质的量比,下同)、Si/DIN(物质的量比,下同)、盐度(Salinity)、水温(Temp)、pH等13个环境因子进行排序分析. 由于长江口海域不同的水域受到的主导因素不同,因此按照口门区(盐度<5‰)、河口区(盐度为5‰~25‰)、海水区(盐度>25‰)分水域进行分析.
浮游植物细胞数量与环境因子的RDA排序图如图11所示. 口门区,前两个轴可以解释80.1%的变量,根据蒙特卡洛检验结果,筛选出Chla浓度(p=0.008)、PO4-P浓度(p=0.012)以及Salinity(p=0.018)3个具有显著解释性的环境因子. 硅藻细胞数量与SS、Chla、COD浓度及Salinity均呈显著相关;甲藻细胞数量与DO、PO4-P浓度均呈显著相关. 河口区,前两个轴可以解释87.5%的变量,根据蒙特卡洛检验结果,筛选出Chla浓度(p=0.008)、COD浓度(p=0.04)及Salinity(p=0.01)3个具有显著解释性的环境因子. 硅藻细胞数量与SS、Chla浓度及DIN/P、Si/P均呈显著相关,甲藻细胞数量与Chla浓度呈显著相关. 海水区,前两个轴可以解释77.7%的变量,根据蒙特卡洛检验结果,筛选出DIN浓度(p=0.01)、DO浓度(p=0.01)、Si/DIN(p=0.03)3个具有显著解释性的环境因子. 硅藻细胞数量和甲藻细胞数量均与SS、Chla、COD浓度以及DIN/P、Temp呈显著相关.
浮游动物密度与环境因子的RDA排序图如图12所示. 口门区,前两个轴可以解释100%的变量,根据蒙特卡洛检验结果,筛选出PO4-P浓度(p=0.05)1个具有显著解释性的环境因子. 桡足类动物密度与DO、PO4-P浓度以及Temp、pH均呈显著相关,腔肠动物密度与DIN、Chla浓度均呈显著相关. 河口区,前两个轴可以解释30.2%的变量,根据蒙特卡洛检验结果,筛选出Salinity(p=0.006)、Temp(p=0.002)2个具有显著解释性的环境因子. 桡足类动物密度与Temp、SS浓度均呈显著相关,腔肠动物密度与DIN/P呈显著相关. 海水区,前两个轴可以解释63.1%的变量,根据蒙特卡洛检验结果,筛选出DO浓度(p=0.05)一个具有显著解释性的环境因子. 桡足类动物密度与Chla、SS、COD浓度以及Temp、DIN/P均呈显著相关,腔肠动物密度与DIN浓度呈显著相关.
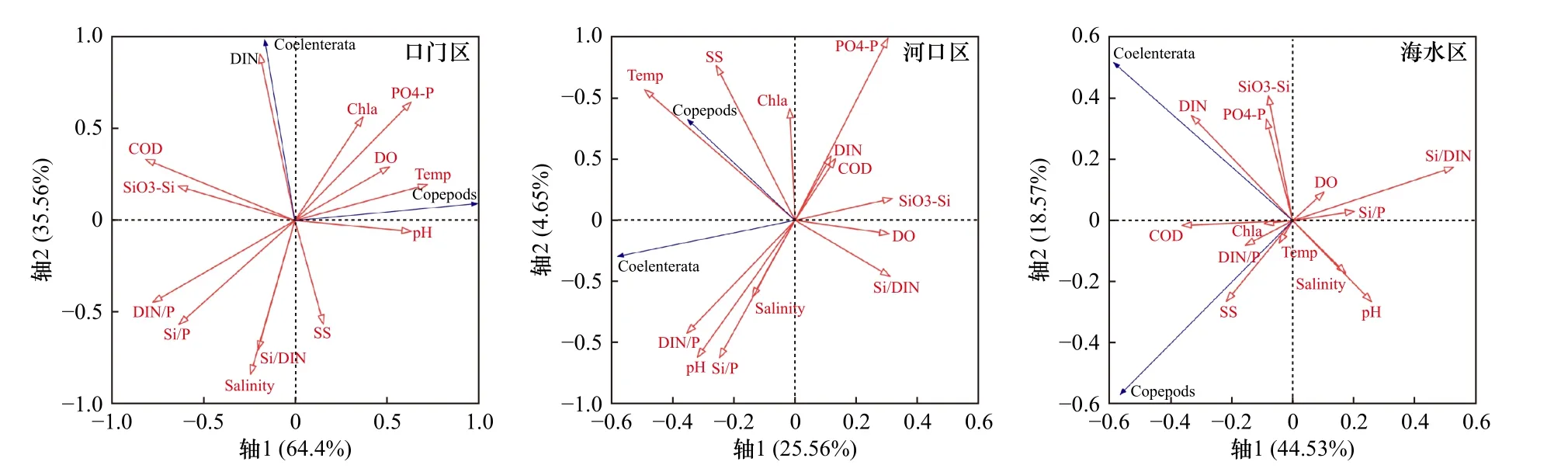
图12 浮游动物密度与环境因子的RDA排序图Fig.12 RDA ordination plot of zooplankton density versus environmental factors
综上,口门区,SS、Chla、COD、DO、PO4-P、DIN浓度以及Temp、pH、Salinity是浮游植物和浮游动物群落结构的主要影响因子;河口区,SS、Chla浓度以及DIN/P、Si/P、Temp是浮游植物和浮游动物群落结构的主要影响因子;海水区,SS、Chla、COD、DIN浓度以及DIN/P、Temp是浮游植物和浮游动物群落结构的主要影响因子. 其中共同的环境因子主要是SS、Chla浓度以及Temp、Salinity、DIN/P,概括来说是水温、盐度、光照和营养盐4个主要环境因素,与已有研究结果[48-51]相符. 水温对浮游植物的生长有着直接的关系,影响着浮游生物细胞新陈代谢的速率,对酶的活性、营养盐吸收效率和细胞分裂周期等会造成影响[52-53]. 盐度主要受陆源输入和外海洋流共同作用,在口门区,强大的长江冲淡水携带了大量氮磷营养盐入海,加之黑潮影响的海水区有高温高盐海水输入,不仅会带来丰富的物种,同时也为浮游生物的生存和繁殖提供了有利的条件[54-55]. 光照是浮游生物的能量来源基础,在河口区内,悬浮物含量高,导致光照条件差,极大地影响了浮游植物的光合作用,降低了Chla浓度[56-58].
除了环境因素对浮游生物的影响以外,生物之间的竞争与捕食作用也是调节浮游生物群落结构的主要动力. 浮游动物的捕食作用可分为浮游动物对浮游植物的捕食、肉食性浮游动物对其他浮游动物的捕食[59],以及鱼类对浮游动物的捕食[60]. 在浮游动物中,枝角类和轮虫的食物生态位几乎完全重叠,竞争激烈,而桡足类和枝角类的食物生态位重叠度相对较低,竞争作用不大[61]. 在浮游动物与浮游植物中,低浓度藻类环境下,常见桡足类的摄食能有效控制目标藻种的生长,而在高浓度藻类环境下,其摄食作用对目标藻种生长的抑制效果不明显[62]. Geiger等[63]则认为:浮游动物组成与鱼类捕食强度有关,捕食强度小,小型浮游动物数量下降,大型浮游动物如桡足类占优势;捕食强度大,则桡足类等数量大大下降,小型浮游动物占优势.
4 结论
a) 时间上,2009-2021年夏季长江口海域浮游植物物种数量和细胞数量呈上升趋势,群落结构以硅藻为主,甲藻占比近年来有所升高. 浮游动物物种数量、密度和生物量整体呈下降趋势,群落组成以桡足类动物为主. 空间上,浮游植物和浮游动物物种数量呈现出由口门区向海水区递增的趋势,与盐度分布较为一致.
b) 浮游动物多样性水平整体优于浮游植物,二者生物多样性的空间分布较为一致. 其中,海水区(盐度>25‰)浮游生物多样性和丰富度均较高,结构复杂;口门区(盐度<5‰)浮游生物种类少,但均匀度较高;河口区(盐度为5‰~25‰)浮游生物种类较多但分布不均匀.
c) RDA分析结果表明,水温、盐度、光照、营养盐是影响浮游生物生长的主要因素. 除环境要素外,生物间的捕食作用对群落特征变化也具有重要影响.
