线粒体靶向抗氧化剂SKQ1对糖尿病小鼠肾损伤的治疗作用与机制
2024-02-21巩永凤王明霞
高 治 巩永凤 王明霞
滨州医学院基础医学院生理学教研室 山东 烟台 264003
糖尿病肾病(diabetic nephropathy ,DN)是糖尿病(diabetes mellitus,DM)的一种严重并发症。随着DM发病率的增加,DN已成为慢性肾脏疾病发展的重要致病因素[1]。全球约30%~40%的终末期肾病患者是DM患者[2]。DN症状包括蛋白尿、足细胞损伤和肾纤维化[3-4]。足细胞作为高度分化的细胞,构成肾小球滤过屏障的最外层。由于足细胞的再生能力有限,足细胞的损伤和丢失可能导致肾小球滤过膜的破坏[5]。因此,足细胞损伤与蛋白尿的发展密切相关[6]。临床上评估DN的进展和严重程度时,通常使用足细胞损伤和肾纤维化的程度作为指标[7]。因此,保护足细胞和减轻肾纤维化的治疗被认为对DN具有重要意义。
SKQ1是质体醌的衍生物,是一种靶向线粒体的抗氧化剂,对比其他线粒体靶向抗氧化剂(Mitoquinone,MitoQ),SKQ1的促氧化活性低于MitoQ,其“抗氧化”活性范围大于MitoQ,这为SKQ1的临床应用提供了潜在的优势[8]。已证实SKQ1在治疗疾病过程中发挥着关键作用,包括干眼病、阿尔茨海默病、伤后愈合和衰老过程[9-10]。同时研究发现,SKQ1不仅可以预防缺血再灌注损伤、顺铂或叶酸等导致的急性肾损伤[11],还可以延长肾缺血再灌注损伤后的寿命[12]。鉴于此,SKQ1对DN是否具有防治作用,是否可以通过抑制足细胞损伤和肾纤维化进而减轻DN的肾损伤,引起我们的浓厚兴趣。本研究应用SKQ1干预1型DM模型小鼠,探讨SKQ1对DM模型肾脏足细胞损伤和肾纤维化的影响,进一步阐明SKQ1对 DN疾病进展过程中的作用和机制。
1 材料与方法
1.1 实验动物 C57BL/6野生型小鼠购自济南朋悦实验动物繁育有限公司,选取7周龄的雄性小鼠进行实验,体质量为22 g左右,每组小鼠10只。所有动物实验均遵守实验动物伦理学规范,饲养于SPF级动物房,每笼不超过5只小鼠,饲养环境温度、湿度适宜,自由饮食摄水,维持昼夜交替,每2~3天更换一次垫料,保证环境整洁。饮用水和鼠笼及其他物品均经过高压蒸汽灭菌后使用,限制人员进出饲养间频率,以减少动物产生应激反应。
1.2 主要试剂与药品 SKQ1(MCE);链脲佐菌素(Streptozocin,STZ)(sigma);肌酐、尿素氮等试剂盒(南京建成科技有限公司);ELISA 试剂盒(美国Bethyl公司);DAPI(北京索莱宝科技有限公司);足突蛋白(NPHS2)抗体(R&D SYSTEMS)、肾母细胞瘤基因1(Wilms tumor gene 1,WT1)抗体(Abcam)、结蛋白(desmin)抗体(Abcam)、α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)抗体(Abcam)、HRP标记的二抗(Cell Signaling Technology,美国CST公司)。
1.3 单侧肾切除术 为加速小鼠糖尿病肾脏损伤,本研究采用单侧肾切除手术联合STZ注射诱导1型糖尿病模型。
1.3.1 手术方法 腹腔注射4%水合氯醛(100 μL/10 g)麻醉小鼠,在右侧背部做切口,暴露出小鼠右侧肾脏,微血管夹夹闭肾门血管和输尿管,在近心端用缝合线进行结扎,在远心端剪断血管及输尿管,缝合伤口,39℃水浴锅上保持小鼠体温,手术结束后补充500 μL生理盐水。
1.3.2 诱导1型DM模型 单侧肾切除术恢复一周后,用STZ进行腹腔注射(50 mg/kg),连续注射5 d。注射前需禁食,第一天禁食12 h,后四天禁食6 h,造模后1周后测血糖,随机血糖≥16.65 mmol/L为糖尿病小鼠。对照组注射等量的生理盐水。
1.4 治疗方法 SKQ1组小鼠每天自由饮用SKQ1(250 nmol·kg-1·d-1))水溶液[9,13],对照组和DM组正常自由饮水。3组持续处理28周。
1.5 尿液取材 代谢笼接取12 h尿液,将尿液12 000 rpm、离心4 min后转移至新的离心管中,冻于-80 ℃保存。根据ELISA 试剂盒中的说明书方法进行检测。
1.6 肾脏取材 腹部解剖小鼠,摘取小鼠肾脏,去除被膜,小鼠肾脏沿纵轴切开,一半肾脏加到1.2 mL Trizol中、提取RNA,一半肾脏加入4% PFA固定,待做组织学染色,或一半肾脏OCT包埋后冻存于-80℃待做免疫荧光。
1.7 RNA提取以及qRT-PCR实验 按照Trizol试剂盒说明书的步骤提取肾组织总RNA,使用反转录试剂盒进行反转录得到cDNA,用于qRT-PCR。 qRT-PCR结果采用QuantStudioTM设计与分析SE软件v1.5.0获得。表1包含本研究中使用的引物序列。与β-actin归一化后,计算各mRNA的表达水平。

表1 qRT-PCR引物序列
1.8 免疫荧光染色 将OCT包埋的肾组织取出,-20℃环境下切5 μm的切片,使用甲醇-20℃固定20 min;10% 胎牛血清(0.2 % Tween 20)室温封闭90 min;一抗均以1∶200稀释,4℃孵育过夜,PBS洗3遍;二抗以1∶200稀释,室温避光孵育90 min,PBS洗3遍;加DAPI室温避光孵育5 min,PBS洗3遍后Mowiol封片,使用Zeiss LSM880激光共聚焦显微镜(德国蔡司)观察拍照。
1.9 组织学染色 取出固定好的肾组织,梯度脱水后用石蜡包埋,切4 μm石蜡切片,进行HE和PAS染色,使用光学显微镜观察各组肾脏组织病理结构变化的情况。
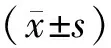
2 结果
2.1 SKQ1减轻DM小鼠尿微量白蛋白水平 血糖结果(图1A)显示,DM组和SKQ1组DM诱导成功,两组血糖均高于对照组。ELISA结果(图1B)显示,与对照组相比,DM组小鼠后期尿微量白蛋白均显著升高 (P<0.01) ;而与DM组小鼠相比,SKQ1组小鼠后期尿微量白蛋白显著降低(P<0.05) 。
A.小鼠空腹血糖;B.小鼠蛋白尿/肌酐的相对值。与对照组相比,**P<0.01,***P<0.001; 与DM组相比,#P<0.05。
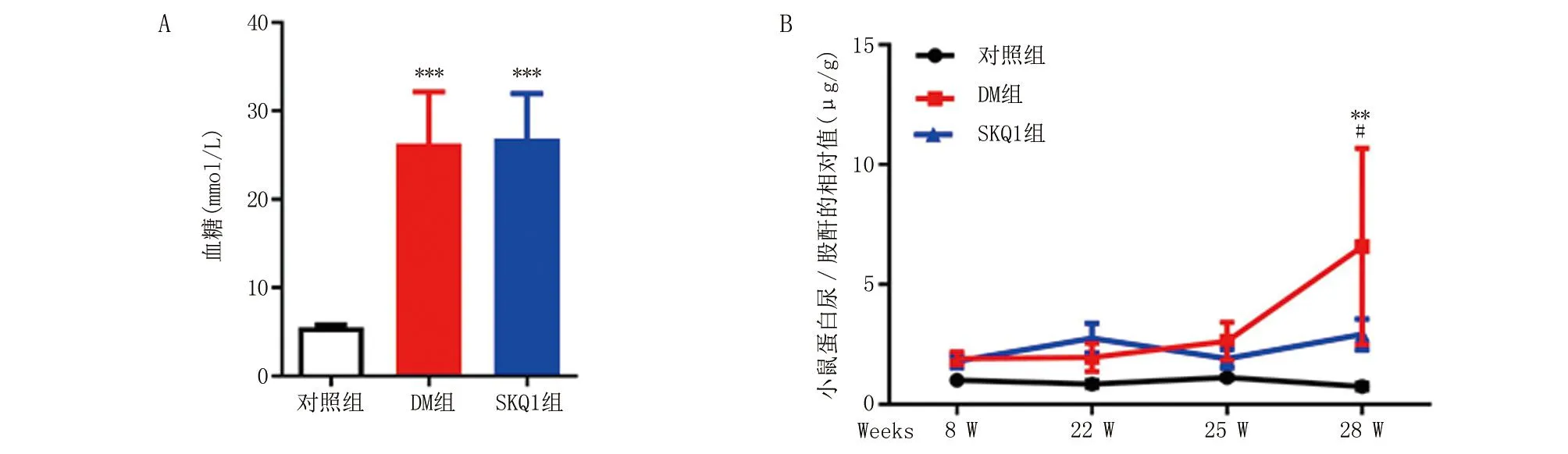
2.2 SKQ1对DM小鼠肾脏病理结构的影响 对不同组别小鼠肾组织进行HE染色,观察肾脏病理结构改变。HE染色结果(图2)显示,与对照组相比,DM组小鼠肾小球系膜细胞增多,细胞外基质增多;与DM组比,SKQ1 组小鼠肾小球系膜细胞数目减少,细胞外基质增生减轻。
HE染色(×400,n=3),上图比例尺100 μm,下图比例尺50 μm。
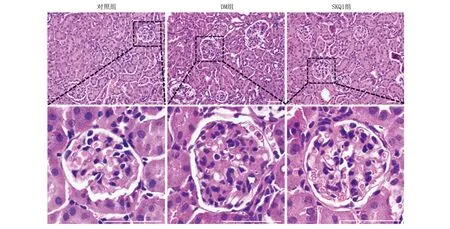
2.3 SKQ1对各组小鼠足细胞相关蛋白表达的影响 qPCR结果(图3)显示,DM组Nphs2、Podxl、Wt1等小鼠肾脏足细胞相关mRNA表达量均较对照组减少(P<0.01) ,desmin的表达量较对照组增多(P<0.01);SKQ1 组小鼠肾脏足细胞相关转录因子Nphs2 、Podxl、WT1表达量均较DM组增多(P<0.01) ,desmin的表达量较DM组减少(P<0.01)。免疫荧光结果(图3)显示,小鼠肾脏足细胞相关蛋白变化与mRNA的结果一致;并统计WT1阳性细胞数代表足细胞数量(图3),结果显示,与正常组比较,DM组小鼠肾小球足细胞数量减少,SKQ1组小鼠肾小球足细胞数量增加。
A-D: Nphs2、Podoxl、Wt1、 desmin mRNA表达水平(实时荧光定量PCR,n=5);E-F,H:NPHS2、Podxl、desmin荧光强度;G:WT1阳性细胞数;I-L:NPHS2、WT1、Podxl、desmin蛋白表达(免疫荧光×400,n=3),比例尺20 μm, DAPI染核;与对照组相比,*P<0.05, **P<0.01 ,***P<0.001;与DM组相比,#P<0.05,##P<0.01,###P<0.001。
2.4 SKQ1改善DM小鼠肾脏纤维化 q-PCR(图4A)和免疫荧光(图4B、C)结果显示,与对照组相比,DM组小鼠α-SMA表达量明显增多(P<0. 001),SKQ1组小鼠α-SMA表达减少(P<0.05)。PAS(图4D)染色结果显示,与对照组相比,DM组小鼠肾小球有明显的胶原纤维沉积,SKQ1组小鼠肾小球胶原纤维沉积明显减轻。
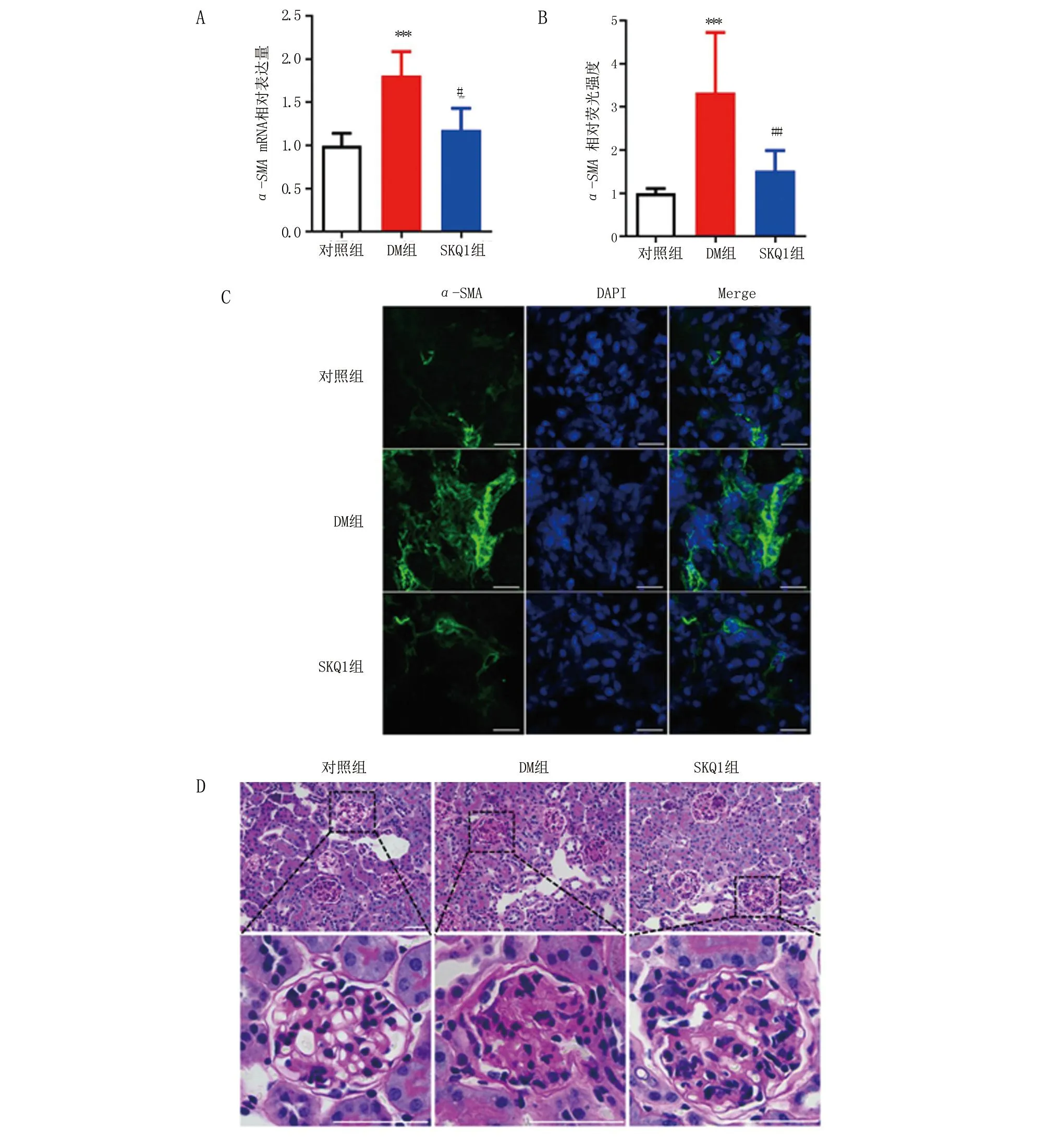
A.α-SMA mRNA表达水平(实时荧光定量PCR,n=5);B-C.α-SMA荧光强度、蛋白表达(免疫荧光×400,n=3),比例尺20 例尺;D.PAS染色(×400,n=3),上图比例尺100 μm,下图比例尺50 μm。与对照组相比,***P<0.001;与DM组相比,#P<0.05,##P<0.01。
3 讨论
随着DM发病率的迅速上升,DN已成为慢性肾脏疾病发展的重要致病因素[14]。本研究旨在阐明线粒体靶向抗氧化剂SKQ1对DM相关肾损伤的保护作用及机制。通过雄性C57BL/6小鼠行右侧肾切除术后,腹腔注射STZ构建DM模型,然后通过饮用SKQ1水溶液进行治疗[9,13],连续饮用28周。结果显示,DM状态下尿微量白蛋白水平明显增加,在饮用SKQ1水溶液后明显降低。Vladimir P. Skulachev在一侧肾切除后进行肾缺血/再灌注,发现SKQ1通过利尿、血[肌酸酐]和Ca2+重吸收部分正常化等方面发挥保护作用[15]。Gaetano Serviddio发现,SKQ1可以降低肾缺血再灌注后血尿素氮和肌酐水平。这些结果均说明SKQ1可以在一定程度上改善蛋白尿及肾功能。
尽管近几十年来进行了大量研究[16],但DN的确切机制尚未完全阐明。关于DN的发展,一种被广泛接受的观点是,DN是高血糖条件下多个肾靶点损伤的综合结果[17]。在这些靶点中,足细胞被公认为是早期损伤部位,且多个肾脏信号通路的破坏在这些病理损伤的进展中至关重要[18]。本研究发现,DM状态下NPHS2、Podoxl、WT1等蛋白的表达量明显下降,足细胞的损伤标志物desmin表达上调;在饮用SKQ1水溶液后,足细胞标志物NPHS2、Podoxl和WT1等蛋白的表达量增加,足细胞的损伤标志物desmin表达下降,这也说明饮用SKQ1水溶液治疗可以保护足细胞免受损伤。NPHS2可以维持裂隙膜的正常滤过功能,Podoxl是CD34家族表面糖基化的唾液酸激酶,其能将足突和狭缝膈膜蛋白正确定位到膜结构域并维持超滤结构的完整性[19],并且也是肾小球疾病中的足细胞损伤特定标志物[20]。WT1也是足细胞的特异标志之一,肾脏组织中 WT1 表达的变化可以反映足细胞损伤程度[20]。Desmin是慢性肾小球病时足细胞损伤的早期标志物之一,当足细胞损伤时desmin表达增强。Vladimir P. Skulachev研究显示,肾脏上皮细胞与SKQ1预孵育可在缺氧24 h再复氧24 h后提高上皮细胞的存活率[15]。这与本研究的结果一致,SKQ1可以保护足细胞,减少足细胞的死亡。E. Y. Plotnikov 和Gaetano Serviddio研究发现SKQ1在肾缺血再灌注模型中发挥了肾脏保护功能[19-21]。同时也有研究发现,SKQ1预处理可以减轻肾缺血再灌注后小鼠的死亡率[12-15]。在本次研究中也发现,DM组死亡率为50%(5只鼠死亡),SKQ1组的死亡率20%(2只鼠死亡),SKQ1干预明显提高DM鼠的存活率,并延长了小鼠的寿命(此数据没有展示)。这些研究发现与本研究的结果一致,在病理状态下,SKQ1具有肾脏保护功能。
肾脏纤维化是DN病进展为终末期肾病(End-stage renal disease,ESRD)的重要原因,是全球医疗保健的主要负担[22]。肾纤维化发生的机制较为复杂,多种细胞信号通路共同参与调节肾纤维化的形成。本研究发现,DN病小鼠足细胞数量减少的同时还伴有肾纤维化。之前就有研究发现,足细胞损伤是局灶性节段性肾小球硬化发生发展的主要因素。肾脏纤维化的主要特征是成纤维细胞和细胞外基质过量累积,同时有肾小球硬化等现象发生[23],这些病理变化最终会发展为ESRD。足细胞受到损伤后,肌成纤维细胞分泌α-SMA,是肾纤维化发生的关键。本实验结果显示,DM组小鼠肾小球可见大量细胞外基质沉积,α-SMA蛋白表达增多,足细胞数量减少,肾组织出现病理损害。经SKQ1治疗后,α-SMA蛋白表达显著减少,肾间质沉积的细胞外基质明显降低,足细胞数量增多,肾组织病理变化也有所改善。本研究结果表明,SKQ1可以改善糖尿病状态下小鼠的肾小球纤维化情况。
综上所述,SKQ1可以减轻足细胞损伤,改善小鼠尿微量白蛋白排泄和肾小球纤维化,进而延缓DN的进展。
