蛋白质也有“寿命”吗
2024-02-21杨冬
杨冬
蛋白质的重要性决定了它的“生”与“死”都是细胞不可或缺的生理过程。
在细胞中,蛋白质是由核糖体根据编码它们的信使RNA序列合成的。组成蛋白质的基本单位是氨基酸,每个氨基酸都由三个碱基组成的密码子来编码。例如,赖氨酸的密码子可以是三个腺嘌呤,用缩写表示就是AAA。不过,蛋白质并不只是氨基酸序列的线性连接,它们还会经历折叠过程,形成具有复杂结构和功能的三维最终产物。人体是一个动态系统,细胞中总有一些蛋白质处于被降解的过程,即“死去”的过程。被降解的蛋白质会变为其基本组成单位—氨基酸,随后,这些氨基酸会被重新使用,再次合成新的蛋白质。
为什么蛋白质一定要经历“生死轮回”呢?合成一个蛋白质后,就让细胞“用一辈子”,不是更好吗?比如,只要细胞活着就一直用这个蛋白质,如果细胞分裂成两个,蛋白质的浓度降低了一半,就合成新的蛋白质来补充这个缺口。显然,这种方法更节约能量,为什么要将合成好的蛋白质又降解掉呢?
蛋白质必须经历“生死轮回”,其实背后有多种原因。首先,蛋白质有一定的“使用寿命”,例如,在细胞中,蛋白质可能会经历氧化或其他化学反应,导致其氨基酸侧链受损。其次,蛋白质虽然经过折叠形成特定的三维结构(即构象),但其构象并非一成不变。然而,构象发生改变的蛋白质可能不具备正常功能,甚至会发生聚集,导致细胞损伤。总之,随着时间的流逝,蛋白质可能会出现问题,因此细胞必须适时降解它们,以便合成新的蛋白质。
细胞要降解蛋白质的另一个原因是,有些蛋白质的功能是暂时的。比如,细胞目前的生长阶段需要合成某种化学物质,所以需要一种酶(一种特殊的蛋白质)来负责这一化学物质的合成;一旦该生长阶段结束,细胞就不再需要这种酶,它就会被降解掉。此外,有些蛋白质被降解还与细胞增殖调控密切相关—机体会通过降解蛋白质防止细胞过度增殖。
因此,细胞通过不断降解蛋白质,同时合成新的蛋白质,一方面能保证蛋白质都处在“保质期”内,另一方面可以时刻维持当前所需的蛋白质种类。尽管这种做法看起来很浪费,但实际上是维持蛋白质动态平衡的有效手段。
那么,细胞如何降解蛋白质呢?
细胞中有一种特殊的蛋白质—泛素(见图1),它是由几十个氨基酸组成的小蛋白质。当细胞要降解某个蛋白质时,该蛋白质就会在一系列酶的作用下与泛素连接在一起。在很多情况下,连接在待降解蛋白质上的泛素还会连上另一个泛素,后者可以再连上新的泛素,最终形成长长的一条泛素链。细胞进行这种“神操作”的目的是为了给细胞中的蛋白质降解机器发送一个信号,告诉它们哪些蛋白质需要被降解。
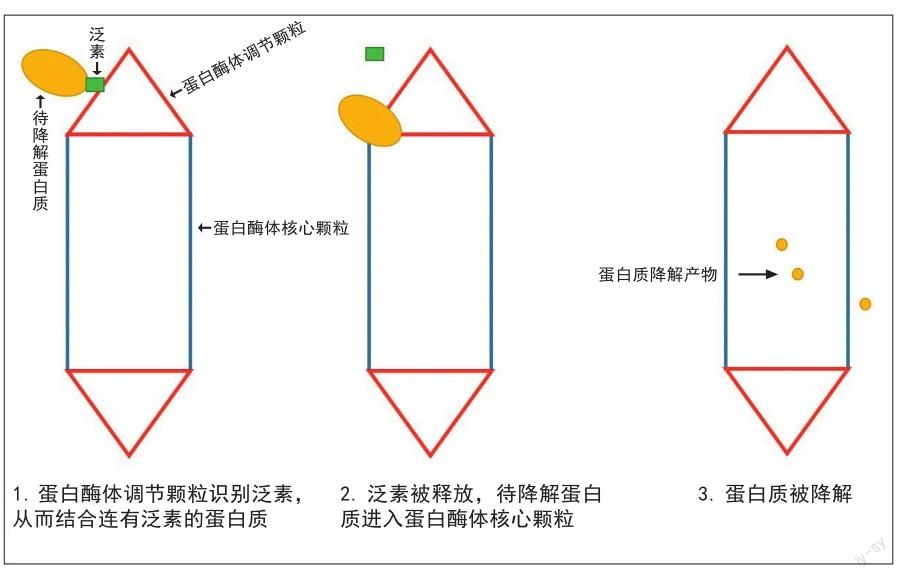
在细胞中,主要的蛋白质降解机器是蛋白酶体。从结构上看,蛋白酶体的主体部分像一个桶,这部分也被称为蛋白酶体核心颗粒(见图2)。蛋白质进入这个桶后就会被降解,为了确保只有待降解的蛋白质才会进入桶内,蛋白酶体必须守住它的“大门”。“大门”是指位于桶两端的“帽状”结构,又名蛋白酶体调节颗粒,它们可以识别蛋白质上被标记的泛素(见图2),只允许正确标记泛素的蛋白质进入桶中。在降解开始前,泛素会与待降解蛋白质分离,从而保全自身,以便重复使用。然而,蛋白酶体只能降解位于细胞质内的蛋白质。除了细胞膜外,细胞中还有许多由膜构成的细胞器,如内质网、高尔基体、核膜等,这些膜结构上存在大量蛋白质,但它们无法进入蛋白酶体进行降解。
那么,细胞如何降解膜上的蛋白质呢?目前,科学家已经确定的一条降解路径是基于胞吞和内吞体的出芽过程,这一途径与生长因子受体(位于细胞膜上的蛋白质)的调节密切相关。细胞通过控制其表面的生长因子受体的数量来限制自身增殖。
要降解膜上的蛋白质,细胞首先会出现一个胞吞过程(见图3)。胞吞是指细胞膜的某一部分向细胞内形成出芽,最终形成一个位于细胞质内的囊泡,将出芽部分的膜与细胞膜分离。胞吞后形成的囊泡可以与细胞内的内吞体进行膜融合。当胞吞发生在包含生长因子受体的区域时,出芽与内吞体融合后,这些受体最终定位于内吞体膜上。脱离细胞膜后,生长因子受体便无法继续与细胞外的生长因子结合,也就无法向细胞内传输细胞增殖信号。通过调节胞吞过程,细胞可以控制其需要接收的增殖信号。然而,到目前为止,这个过程仍然是可逆的,比如,在特殊情况下,细胞可以将内吞体膜上的生长因子受体重新输送至细胞膜上。不过,当细胞决定降解这些受体时,它可以给这些受体连上泛素。此时,内吞体膜就会向内吞体内部出芽,将带有生长因子受体的内吞体膜转变成内吞体内的囊泡(见图3)。最后,这些囊泡及其上的受体,都会被输送到一个名为溶酶体的细胞器中进行降解。
除了上述途径外,细胞还有一种自噬过程,也可以降解蛋白质。顾名思义,自噬就是“自己吃自己”。在自噬过程中,细胞会在需要被降解的物质周围形成一层膜,将其包裹起来,然后把它送入溶酶体进行降解。溶酶体是一个细胞器,内含多种酶,相当于一个垃圾处理厂,能够降解各种生物大分子。细胞自噬的对象很多,既可以是蛋白质聚集物,也可以是整个细胞器,如线粒体。为什么细胞要自噬呢?首先,当细胞处于饥饿状态时,会消化部分自身不需要的物质,从而为自身提供养分;其次,为了降解细胞中已经损坏的物质,包括蛋白质聚集物、破损的膜组织等。因此,蛋白质也可以通过细胞自噬而被降解。
由于蛋白质的“死”对于细胞的“生”非常重要,细胞演化出了多种方法来处理掉它不需要的蛋白质。然而,如果这些途径受阻,细胞的生存就可能受到威胁。例如,错误折叠的蛋白质堆积可能导致蛋白质聚集,进而导致细胞损伤。这类细胞损伤与多种疾病有关,如阿尔茨海默病、帕金森病。此外,如果与调控细胞增殖相关的蛋白质没有根据需要被及时降解,有可能给细胞过多的增殖信号,从而导致癌症。因此,通过药物干预蛋白质降解过程,抑制或诱导细胞降解特定蛋白质,都可以为医学界提供治疗疾病的新思路。

目前,科學家已经利用蛋白质降解过程研发出了新型药物,蛋白酶体抑制剂就是其中之一,它已经成为多发性骨髓瘤的有效治疗药物。多发性骨髓瘤是一种恶性血液肿瘤,这种肿瘤起源于浆细胞。浆细胞是免疫细胞B细胞分化形成的专门合成抗体(免疫球蛋白)的细胞。因此,多发性骨髓瘤细胞保留了浆细胞能合成大量抗体的特性,它合成的抗体中有不少具有折叠错误。通常情况下,这些具有折叠错误的蛋白质会被标记上泛素,并通过蛋白酶体被降解。然而,科学家可以通过蛋白酶体抑制剂阻止蛋白酶体降解这些具有折叠错误的蛋白质,令多发性骨髓瘤细胞中大量具有折叠错误的蛋白质无法被清除,最终导致肿瘤细胞死亡。
同样,科学家还可以利用蛋白质的降解途径除掉某些癌基因的产物,从而治疗癌症。比如,目前一些制药公司正在研究的一个靶点—Ras蛋白,它是细胞内一种控制细胞增殖的蛋白质,通常它本身的功能是受到严格调控的。然而,带有某些基因突变的Ras蛋白就不再听命于调控,会持续向细胞内传输增殖信号。此时,它变成了一个癌基因的产物,成为导致很多恶性肿瘤的关键因子。既然如此,能否开发出一种药物破坏Ras蛋白的功能呢?
科学家研究发现,Ras蛋白的一些结构特征导致了它具有“不可成药”的特点。也就是说,很难找到一个化学分子可以专门结合到Ras蛋白的某个关键位点上,从而抑制它的功能。最近,科学家看到了解决这一问题的曙光,即设法“诱导”蛋白酶体去降解Ras蛋白。蛋白酶体要降解某个蛋白质,首先要使其与泛素连接,但连接泛素的过程非常复杂,其中一个关键因素是E3泛素连接酶。然而,E3泛素连接酶帮助蛋白质连上泛素的过程在细胞内受到严密控制。那么,我们能否“诱导”E3泛素连接酶帮Ras蛋白连上泛素呢?
为此,科学家开发了一种新技术—PROTAC技术。该技术的关键就是设计一个化学分子,它的一端可以结合待降解的蛋白质,比如Ras蛋白,而另一端可以结合一个E3泛素连接酶。如果该化学分子能够进入细胞,就可以将待降解的蛋白质与E3泛素连接酶“拉”到一起,从而帮蛋白质连上泛素,使之可以被蛋白酶体识别并降解。目前,PROTAC技术处于快速发展阶段,除了降解Ras蛋白,科学家还在其他多种与肿瘤形成相关的蛋白质上进行了尝试。可以想象,在不久的未来,基于PROTAC技术的抗癌药物很快会实现临床应用。
对于生命来说,生与死是一种辩证的关系。正如细胞的死,不等于机体的死,在很多情况下,只有细胞适时死去,机体才可以继续生存。同样,在一个细胞中,组成细胞的蛋白质的死,也是整个细胞生存的基础。科学家已经从蛋白质降解的过程受到启发,相信未来会有更多蛋白质相关药物上市,小小的蛋白质将在生死轮回中守护人类健康,协助我们进一步改善生命的质量。
【责任编辑】张小萌
