超高效液相色谱-串联质谱法测定水质中多肽类抗生素
2024-02-20吴庆阳
吴庆阳
(必维申美商品检测有限公司,上海 201108)
引言
多肽类抗生素指具有多肽结构,即三个及以上氨基酸分子脱水缩合结构,一小部分肽类抗生素呈线状的,其余大多是环状化合物。在多肽类抗生素中,不同的抗生素所具有的抗菌作用不同,可分别对抗真菌、病毒、细菌等的感染,可治疗一些炎症和感染。通常使用小剂量来抑菌,使用大剂量来杀菌。使用多肽类抗生素,细菌不易产生耐药性,但是其毒性较大,主要会引起神经毒性和肾毒性,且不易被来自动植物体内的酶所水解。多肽类抗生素主要以原药、代谢产物等形式排出体外,然后通过生活污水、农业粪肥、养殖和制药企业废水等方式进入环境水体。近年来,在国内外的不同环境水体中均检出抗生素,这些残留的抗生素严重危害了生态系统,并可能在环境和生物体中累积或者通过食物链富集,使细菌产生抗生素抗性基因,严重威胁人类健康。进入环境水体的多肽类抗生素多以痕量浓度存在,且种类多、性质差别大,所以检测这些抗生素的难度也比较大,目前几乎没有水质中多肽类抗生素的检测方法。本研究拟采用超高效液相色谱-串联质谱法(UPLC-MS/MS)同时测定水质中11种多肽类抗生素,并利用固相萃取柱对样品进行萃取净化,从而实现对水质中多肽类抗生素的灵敏、快速、准确的检测。
1 实验部分
1.1 主要仪器和试剂
1.1.1 仪器
超高效液相色谱串联质谱仪,UPLC-Xevo TQ-S串联质谱,沃特世公司;涡轮混合器,QT-1,琪特公司;氮吹仪,TM112,联合公司;自动固相萃取仪,Fotector plus 60,含大体积进样装置,睿科公司;电子天平,XS105DU,梅特勒-托利多公司。
去甲万古霉素、万古霉素、粘杆菌素B、粘杆菌素A、杆菌肽B、杆菌肽A、恩拉霉素B、恩拉霉素A、太古霉素、维吉尼亚霉素M1、维吉尼亚霉素S1,Dr.E公司;乙腈、甲醇、甲酸和丙酮(色谱纯),飞世尔公司;盐酸(优级纯),黙克公司;固相萃取柱,Oasis HLB柱(6 mL/500 mg),沃特世公司;Na2EDTA(分析纯),国药公司;0.45 μm、0.22 μm滤膜,沃特世公司。
1.2 标准溶液的制备
1.2.1 标准储备溶液
1 000 mg/L的单标储备液:分别称取11种多肽类抗生素各标准品适量(标准物质的浓度折算后各抗生素的质量为10.0 mg),移入10 mL容量瓶中,用0.1%甲酸甲醇溶液溶解抗生素和定容,配制成单个抗生素的标准储备液。
10 mg/L混合标准溶液:用1 mL移液枪分别准确移取11种多肽类抗生素单标储备液1 mL于同一个100 mL的容量瓶中,用0.1%的甲酸甲醇溶液定容至刻度。
1.2.2 标准曲线的配制
根据实验需要,标准曲线浓度点分别为0、2、5、10、20、50、100、200 μg/L,移取适量的10 mg/L混合标准溶液于容量瓶中,初始流动相定容。
1.3 样品前处理
准确移取经过0.45 μm微孔滤膜过滤后的水样1 000 mL,加入0.5 g的Na2EDTA,用超声振荡使其溶解,再用1 mol/L的盐酸调节pH值为3.0,备用;上样前,依次用10 mL甲醇、5 mL超纯水和5 mL的0.1%甲酸水溶液活化HLB柱;然后以8 mL/min流速抽取水样,经HLB柱收集目标物;用12 mL超纯水淋洗小柱,气推后依次用5 mL的0.1%甲酸甲醇和5 mL的甲醇以1 mL/min速率洗脱。收集的洗脱液在45 ℃下用氮气吹干,加初始比例流动相1 mL复溶,混匀,然后使用0.22 μm的滤膜过滤,并使用UPLC-MS/MS测试滤液。
培训工作需要解决的问题还很多,还有漫长的路要走,在实际工作中要不断拓宽教育培训思路,创新教育培训形式,着力提高农民用水户协会发展质量,使其真正自主管理、自主经营,巩固农田水利基本建设成果,提升农业综合生产能力,确保水利事业持续健康快速发展。
1.4 试验方法
1.4.1 液相色谱条件
色谱柱:AQUITY UPLC BEH C18,规格2.1×100 mm,1.7 μm,流速300 µL/min,柱温:35 ℃,进样量:1 µL,0.1%甲酸水溶液作为水相流动相,0.1%甲酸乙腈作为有机相流动相;梯度洗脱条件如表1所示。

表1 流动相梯度洗脱条件
1.4.2 质谱分析条件
离子源参数:ESI+离子源,电离源温度为150 ℃,脱溶剂温度为500 ℃,脱溶剂气流流速为1 000 L/h,锥孔气流速为150 L/h,毛细管电离电压为2.5 kV,用质谱多反应监测扫描,离子对等质谱参数如表2所示。
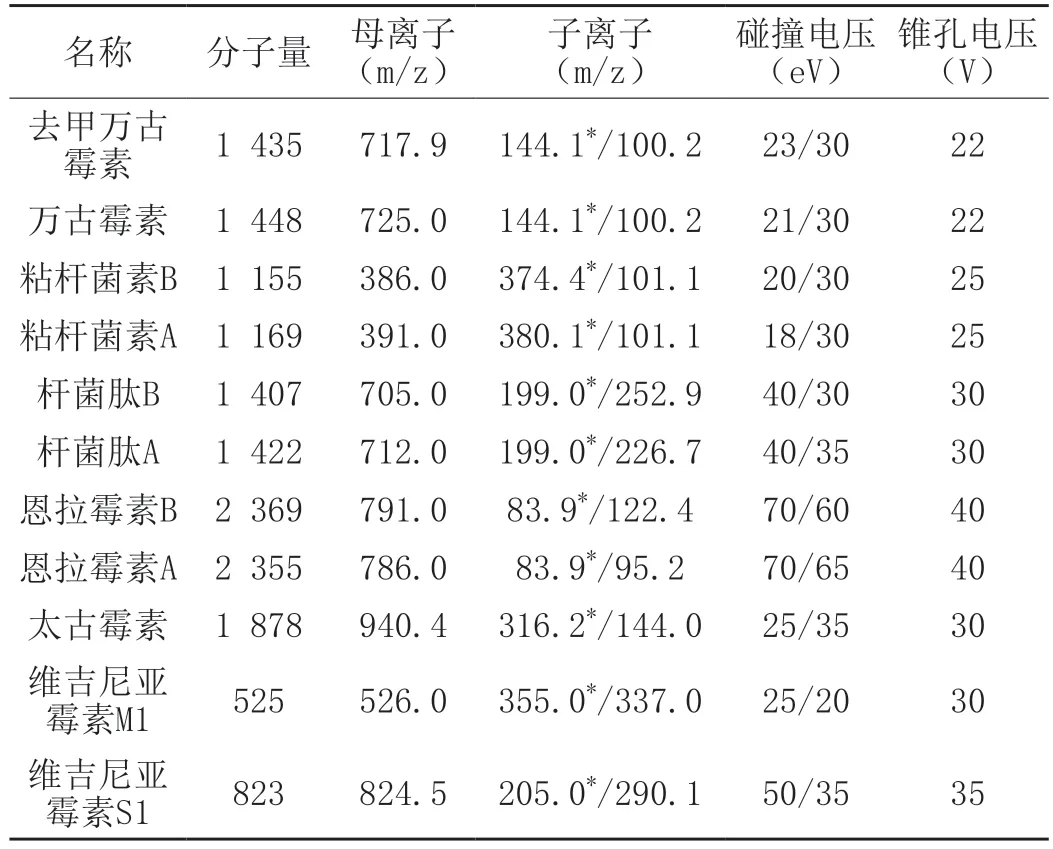
表2 定量定性离子质谱参数
2 结果与讨论
2.1 样品前处理方法的优化
2.1.1 水样pH值的选择
由于多肽类抗生素会与多种金属离子螯合,形成沉淀,所以在水样中加入Na2EDTA后,因为EDTA与金属离子的配位能力更强,可以通过螯合作用释放出多肽类抗生素,消除部分离子的抑制作用,有效降低了杂质的影响[1],提高了测定的回收率,但pH值影响了金属离子与EDTA的配位。另外,大多数多肽类抗生素都含有氨基、羟基和羧基,显弱碱性,在弱酸性条件下比较稳定,需调节水样的pH值。因此,需要通过实验来考察pH值对多肽类抗生素测试的影响。
移取1 000 mL空白水样5份,加入适量多肽类抗生素混合标准溶液,配置抗生素浓度均为100 ng/L的加标试样,用0.1 mol/L盐酸溶液调节5份样品的pH值分别为2、3、4、5、6,其他条件不变,进行UPLC-MS/MS测定。测试结果表明各种多肽类抗生素的提取效率有显著差异。当pH值为6及以上时,多肽类抗生素回收率明显降低。当pH=3时,多肽类抗生素综合回收率为最佳。因此,选择pH=3时的水样进行HLB柱萃取净化。
2.1.2 HLB柱的选择
多肽类抗生素几乎都为极性物质,目前大多数文献中,多肽类抗生素测定都推荐使用HLB固相萃取柱。HLB固相萃取柱采用反相保留机理,吸附剂由亲水性物质和亲脂性物质两种单体按比例聚合而成,通过聚合物上的亚氨基加强对极性物质的保留,同时具有很好的水浸润性,故此类化合物在HLB具有较好的疏水相互作用,可基于反相作用原理得以保留,而且HLB柱的净化效果较之C18、混合型萃取柱有更好的回收和更强的除杂能力[2]。对于大体积样品,采用体积容量较大的6 mL/500 mg型Oasis HLB柱,可避免堵死HLB小柱现象,且能够节约时间。实验结果表明,采用HLB柱萃取净化,多肽类抗生素的回收率较高,且重复性好。
2.1.3 洗脱液的选择
选择甲醇、乙腈和丙酮三种试剂进行洗脱效果比较,结果表明,丙酮及乙腈仅对部分抗生素的洗脱效果好,对其余部分抗生素的洗脱效果不好;而甲醇对多肽类抗生素的洗脱能力较为平均,对多肽类抗生素的综合回收率较高,且基质效应少,故选择甲醇为洗脱溶剂。同时也对甲醇的洗脱体积进行了考察,实验结果表明,当洗脱体积大于10 mL后,多肽类抗生素的回收率无明显提高,同时通过实验发现,使用5 mL、0.1%的甲酸甲醇代替5 mL的甲醇洗脱,多肽类抗生素的回收率更佳,洗脱液选择5 mL、0.1%的甲酸甲醇和5 mL的甲醇。
2.1.4 氮吹温度的选择
HLB柱萃取净化后,通常需对目标化合物的洗脱液进行浓缩,以提高试样的富集倍数和测量的灵敏度。氮吹是常用的方法,该方法所需仪器操作简单,可批量处理样品,在测试中得到广泛运用。然而,氮吹过程中通常需要对溶液进行加热,以缩短浓缩时间,提高分析通量。但若加热温度过高,则可能引起热稳定性差的组分分解。因此,需要通过实验来考察氮吹温度对多肽类抗生素测试的影响。
移取1 000 mL的空白水样4份,加入适量多肽类抗生素混合标准溶液,得到4份多肽类抗生素含量均为100 ng/L的加标试样。经前处理及HLB柱萃取净化后,洗脱液分别于25 ℃、35℃、45 ℃、55 ℃进行氮吹至干,用初始流动相溶解并定容至1 mL,进样1 µL,进行UPLC-MS/MS上机测定。实验结果表明,在4种不同氮吹温度下,多肽类抗生素回收率温度的升高,呈现出先基本稳定后下降的趋势。氮吹温度为45 ℃时,得到的多肽类抗生素的回收率与25 ℃和35 ℃氮吹相近,但是考虑到25 ℃和35 ℃氮吹条件下,氮吹时间过长,影响实验效率;而当温度升高至55℃时,样品中的有些抗生素回收率明显下降,提示可能发生降解。因此,选择45 ℃作为最佳氮吹温度。
2.2 色谱-质谱分析方法的优化
2.2.1 色谱条件的优化
由于各种多肽类抗生素在水、甲醇和乙腈中的溶解度不同,相对而言,甲醇总体上的溶解度特性优于乙腈,能完全溶解更多类型的样品,但甲醇比乙腈更粘稠,会产生更高的柱压,且乙腈比甲醇有更高的洗脱能力,乙腈流动相的峰形更窄,分离度更高。在流动相中添加0.1%的甲酸,以增大多肽类抗生素在质谱中母离子的信号,同时甲酸可以使色谱柱内的硅胶硅醇基质子化,从而减弱了硅醇基与待测物的相互作用,减少了色谱峰拖尾,使得色谱峰的峰形更佳[3]。实验结果表明,相比甲醇,采用乙腈作为有机相时,11种多肽类抗生素的响应均较高。因此,流动相为0.1%的甲酸乙腈和0.1%的甲酸水溶液。
2.2.2 质谱条件的优化
多肽类抗生素是由氨基酸缩合而成的肽类物质,与高等动植物中具有激素功能的多肽和蛋白质不同,分子量比一般蛋白质小得多,几乎都在300~3 000间,平均在1 000左右,在进入一级质谱后易结合H+,从而产生带正电的单电荷离子或多电荷离子,所以适合于使用ESI正模式离子源。在实验过程中,应向仪器中注入100 μg/L的待测物混标在正离子条件下进行全扫描,选择响应值较高的离子作为母离子,并优化锥孔电压,使母离子能够达到最高的响应强度,同理进行二级扫描,以优化碰撞电压。在确定子离子对,其他一些仪器参数采用的是仪器推荐值。
2.3 方法学验证
2.3.1 标准曲线、线性范围和检出限
按1.2.2所述,配制多肽类抗生素曲线,使用UPLC-MSMS进行分析。横坐标为多肽类抗生素各浓度点,纵坐标为色谱峰面积,建立各个抗生素标准工作曲线。多肽类抗生素线性方程和线性相关系数r2见表3。在2~200 μg/L的浓度范围内,11种多肽类抗生素标准曲线线性良好,其线性相关系数r2均大于0.998。移取1 000 mL的空白水样7份,加入多肽类抗生素混合标准溶液适量,得到7份多肽类抗生素含量均为1ng/L的加标试样。按照1.3样品前处理和1.4仪器工作条件进行分析,计算7份加标样品结果的标准偏差,其标准偏差的3.14倍值即为检出限。实验结果表明:11种多肽类抗生素检出限介于0.38~0.89 ng/L之间,均小于1 ng/L,故在标准曲线浓度范围内,多肽类抗生素线性关系良好,检出限都能满足现行测试的需求。

表3 平均加标回收率和RSD、标准曲线回归方程、相关系数r2
2.3.2 方法准确度和精密度
通过对水样中多肽类抗生素低、中、高浓度水平下的加标测试,计算平均回收率,对多肽类抗生素测试方法的准确度进行考察,并计算同浓度水平加标回收率间的相对标准偏差(RSD),对多肽类抗生素测试方法的精密度进行考察。移取1 000 mL空白水样为一份样品,共19份,一份作为基质样品,在其余样品中分别加入不同体积的多肽类抗生素高浓度标准液,配制成加标水平分别为高、中、低浓度的加标样品,6个平行样品一个浓度水平进行实验,按照实验部分的前处理方法对样品进行前处理操作,使用优化好仪器条件的UPLC-MSMS测试样品。11中多肽类抗生素同浓度水平间平均回收率和RSD结果见表3。由表3可见,在加标浓度为2、50、200 ng/L下,平均加标回收率在77.7%~98.1%之间,RSD在1.5%~14.2%之间,表明测试方法的精密度和准确度很好,都能够满足水质中测试11种多肽类抗生素含量的测试要求。
2.4 实际样品测定
为了考察该测试方法的适用性,采集了纺织企业废水、制药企业废水、养殖企业废水、地下水、地表水和生活饮用水共48个样品。按照测试方法的分析步骤测定11种多肽类抗生素含量,同时进行样品加标实验。结果显示,除了一家养殖企业废水中多粘菌素B有检出(为3.12 ng/L)外,其他纺织企业废水、制药企业废水、地表水、地下水和生活饮用水样品中均未检出多肽类抗生素,且48个样品的加标回收率均满足70%~120%之间,符合实际样品测试多肽类抗生素的要求。
3 结论
本方法选择UPLC-MS/MS进行水质中多肽类抗生素的测定,该仪器比常用的HPLC-MS/MS拥有更高的灵敏度和分辨率,以及更短的出峰时间和更高效的采集效率。通过实验优选水样的pH值和固相萃取柱。在流动相的选择中,选用了使多肽类抗生素在质谱中更易于质子化的0.1%甲酸水溶液和0.1%甲酸乙腈溶液作为流动相。对二级质谱的定量离子和定性离子进行了优选,在此基础上,对UPLC-MS/MS的方法学进行验证,结果表明,11种多肽类抗生素标准曲线的线性关系良好,相关系数r2均大于0.998。检出限均小于1 ng/L,加标回收率在77.7%~98.1%之间,RSD在1.5%~14.2%之间。将已建立的方法应用于不同类型的48个水样测试,其中一个样品检出3.12 ng/L加标多粘菌素B,48个样品的加标回收率均在70%~120%间。因此,所建立的水质中多肽类抗生素的固相萃取UPLC-MS/MS测定方法,具有适用基质广泛,前处理方法相对简单,方法灵敏度高,检出限低,准确度高,重复性好等优点,适用于大规模样品的测试。
