“黎平2号”油茶组培快繁技术
2024-02-19田兴军陈明德刘晓宏宋娟田怀

摘 要:以“黎平2号”良种油茶带芽嫩茎作为外植体,分析在不同的消毒方式和植物生长调节剂配比下“黎平2号”油茶的诱芽、增殖、生根情况,构建“黎平2号”油茶的组培快繁技术体系。此次实验中,最适合“黎平2号”油茶的消毒试剂组合为75%乙醇消毒30 s后再用0.1%氯化汞消毒10 min,这一消毒方式下的“黎平2号”外植体的存活率为63%,褐化率为3%,污染率为17%;最适合“黎平2号”油茶不定芽诱芽的植物生长调节剂的配比为MS+1 mg/L 6-BA+0.4 mg/L NAA+0.06 mg/L TDZ,这一配比下的黎平2号外植体的出芽率达到98%,诱导率达到88%;最适合外植体增殖的植物生长调节剂组合为MS+0.5 mg/L
6-BA+0.04 mg/L NAA+0.03 mg/L TDZ+0.2 mg/L IBA,增殖系数为9.2倍,玻璃化率为26%;最适合“黎平2号”外植体生长的调节剂组合为0.5MS+0.6 mg/L NAA+0.5 mg/L IBA,生根率达到86%,平均生根条数达到2.8条,平均根长为2.7 cm。
关键词:“黎平2号”油茶;组培快繁技术;外植体消毒
中图分类号:S794.4 文献标志码:B 文章编号:2095–3305(2024)11–000-03
“黎平2号”良种油茶是由贵州省林业科学院黎平县林业局共同选育的油茶品种,植株主要呈圆形灌木状,树叶呈椭圆状,鲜果出油率达到10%以上,远远超过国家规定的油茶果实出油指标。“黎平2号”良种油茶归类为山茶科山茶属,属于小乔木灌木类。与栽培技术发展较为成熟、栽培面积更加广泛的普通油茶相比,“黎平2号”良种油茶的果皮薄、产油量高、对环境的适应性更强,产量高并且产出稳定,具有较高的经济价值和生产利用价值。
组培快繁技术是一种通过细胞培养和再生植株来大规模繁殖植物的方法,其能通过体外环境控制和植物生长调控,得到质量更高的经济农作物,降低作物培育难度,提高作物生产效率。当前,组培快繁技术在水果培育、兰草花类作物培植、药用植物配置等方面的应用广泛,对植物的栽培和繁育具有重要作用[1]。现阶段“黎平2号”的主要繁殖方式包括种子繁殖、扦插繁殖、嫁接繁殖、压条繁殖、埋根繁殖等,但种子繁殖并不能保留植物的亲本优良性,其他繁殖方式则极大受气候、温度等外部环境的影响,植物的繁殖效率不高,严重影响“黎平2号”油茶种植规模的扩大[2]。对此,通过对外植体消毒、组培育苗培养等相关研究和分析,旨在建立有效的“黎平2号”良种油茶组培繁育技术,为“黎平2号”良种油茶的标准化、规模化种植提供有效的技术支撑。
1 材料与方法
1.1 材料
供试材料选取的是黎平县洪州镇的“黎平2号”良种油茶所引种栽培的品种“黎平2号”,于当年3月下旬至4月中旬选取新萌发油茶树中生长健康、未见病虫害的带芽茎段,密封保鲜带回实验室[3]。
1.2 方法
1.2.1 外植体消毒
第一步,选取长势良好的良种“黎平2号”油茶嫩茎,将茎上枝条去叶后用清水清洗,使用软刷轻轻清理枝条,清理后用纯净水再次清洗;第二步,在超净工作台上将枝条剪切为2.5 cm的小段,用3种方式进行消毒实验,具体消毒方式见表1。在消毒过程中为了充分利用消毒液,可以不断摇晃消毒容器;第三步,在完成灭菌后利用镊子将外植体转移至培养皿中,用滤纸吸收多余水分,再用纯净水冲洗4次,顺着切口再切除约0.3 cm的枝段,保留剩下2.2 cm的枝段备用;第四步,将备用外植体接种至MS诱导培养基中,每个处理50瓶,每瓶接种2个外植体,在培养室进行培养,以5 d为一周期,调查存活率、褐化率、污染率,共调查20 d。
1.2.2 不定芽诱导
以MS作为培养基,将枝段消毒后接种到不同浓度培养基中,培养基中添加的植物生长剂主要由萘乙酸(NAA)、6-苄氨基腺嘌呤(6-BA)、人工合成的苯基脲衍生物(TDZ)组成。
研究不同的植物生长剂添加方式对“黎平2号”不定芽诱导的影响,添加方案分别为:(1)MS+0.8 mg/L
6-BA+0.2 mg/L NAA+0.04 mg/L TDZ;(2)MS+1 mg/L 6-BA+0.4 mg/L NAA+0.06 mg/L TDZ;(3)MS+1.2 mg/L
6-BA+0.6 mg/L NAA+0.08 mg/L TDZ,分别记作B1、B2、B3。每个培养基处理50瓶,每瓶接种2个外植体,在培养室内进行培养,跟踪观察出芽率和诱导率[4-9]。
1.2.3 继代增殖培养
从MS培养基中取出培养效果较好且长势相当的芽苗,将其转移至增殖培养基中继续增殖培养。增值培养基的主要成分包括:NAA、6-BA、TDZ、
6-吲哚丁酸IBAIBA,添加方案分别为:(1)MS+0 mg/L
6-BA+0.02 mg/L NAA+0.01 mg/L TDZ+0 mg/L IBA;(2)MS+0.5 mg/L 6-BA+0.04 mg/L NAA+0.03 mg/L TDZ+0.2 mg/L IBA;(3)MS+1 mg/L 6-BA+0.06 mg/L NAA+0.05 mg/L TDZ+0.4 mg/L IBA,将其记作C1、C2、C3。每个培养基处理50瓶,每瓶接种2个外植体,在培养室内进行培养,跟踪观察培养情况并记录外植体在20 d内的增殖系数和玻璃化率。
1.2.4 生根培养
将继代增殖培养后所获得的单芽剪下2.5 cm,并将剪下的单芽转移至生根培养基中继续诱导生根。诱导生根培养基主要由不同浓度的NAA和IBA组成,
具体的添加方案为:(1)0.5MS+0.4 mg/L NAA+0.3 mg/L
IBA;(2)0.5MS+0.6 mg/L NAA+0.5 mg/L IBA;(3)0.5MS+0.8 mg/L NAA+0.7 mg/L IBA,记作D1、D2、D3。共处理50瓶,每瓶1个嫩梢,跟踪嫩梢的生长情况,并详细统计其生长情况,计算培育过程中植物体的生根率、平均生根条数、平均根长。
生根率=不定根发生的茎段数/接种茎段数×100%
平均生根条数=生根条数/接种茎段
平均根长=总根长/接种茎段
1.3 统计分析方式
用Excel表格统计实验数据,用统计学软件SPSS 23.0对实验数据进行差异性分析。
2 实验结果
2.1 最佳消毒方式分析
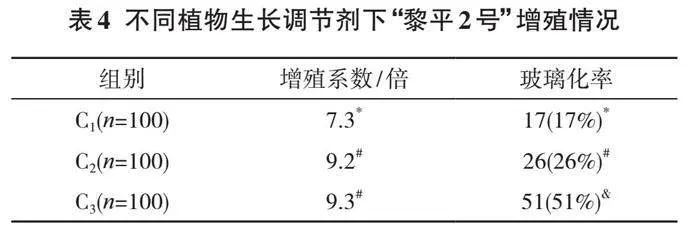
研究不同消毒方式下“黎平2号”外植体的消毒效果,结果见表2。
表2中,A1组、A2组、A3组不同消毒方式下存活率、褐化率、污染率均不同,这说明了“黎平2号”外植体消毒效果的差异性较为显著。当直接用0.1%氯化汞消毒10 min时,外植体的污染率、褐化率明显高于另外两种消毒方式,存活率也仅为28%;利用乙醇和氯化汞两种消毒方式进行组合消毒时,外植体的存活率和污染率指标得到明显好转,但植物的褐化率较高。利用75%乙醇消毒30 s后,再用0.1%氯化汞消毒
10 min时,这一消毒方式对“黎平2号”外植体的褐化率影响最小,存活率最高。随着乙醇消毒时间延长,“黎平2号”外植体的褐化率上升,存活率下降。
综合对比后可以确定,此次实验最佳的消毒方式为用75%乙醇消毒30 s后,再用0.1%氯化汞消毒10 min,
这一消毒方式下,“黎平2号”外植体的存活率可以达到63%,褐化率仅为3%。
2.2 “黎平2号”的腋芽植物生长调节剂选择
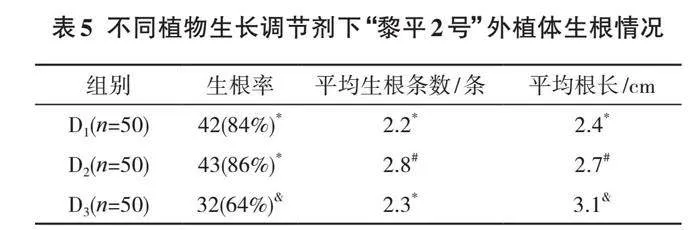
通过实验得出不同的植物生长调节剂下,“黎平2号”的外植体腋芽生长情况见表3。
表3中,不同植物生长调节剂的配比对“黎平2号”腋芽生长的影响具有显著的差异性。其中,处理方式B1和B2的出芽率均能达到90%以上,诱导率也能达到85%以上,说明MS+6-BA+NAA+TDZ的植物生长调节剂组合能有效促进植物分化和出芽成长,但随着植物生长剂中各个生长激素的持续添加,“黎平2号”外植体的诱导率和出芽率都有所下降。这说明过多的植物生长剂激素也会对外植体的诱导和出芽起到反作用。
当植物生长调节剂的配比为MS+1 mg/L 6-BA+
0.4 mg/L NAA+0.06 mg/L TDZ时,“黎平2号”外植体的出芽率达到98%,诱导率达到88%,并且腋芽长势较好。这说明“黎平2号”的腋芽植物生长调节剂最优配比为MS+1 mg/L 6-BA+0.4 mg/L NAA+0.06 mg/L TDZ。
2.3 “黎平2号”的增殖植物生长调节剂选择
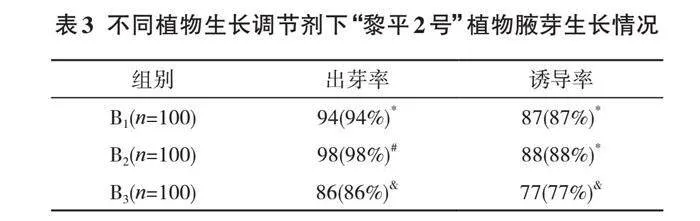
通过实验得出不同的植物生长调节剂下,“黎平2号”的外植体增殖情况见表4。
表4中,在使用植物生长调节剂后,“黎平2号”的植物增殖系数最高可以达到9.3倍,当仅使用NAA和TDZ作为植物生长调节剂时,植物的增殖系数较低,但添加了6-BA和IBA后,植物的增殖系数达到9倍以上;对比C2和C3可知,C3组合的植物生长调节剂下,“黎平2号”外植体的增殖系数稍高,但相应的玻璃化率也较高,甚至超出控制范围,而C2组合的植物生长调节剂组合下的“黎平2号”外植体增殖情况与C3差异并不明显,但玻璃化率明显偏低。
这说明此次实验中,最适合外植体增殖的植物生长调节剂组合为MS+0.5 mg/L 6-BA+0.04 mg/L NAA+0.03 mg/L TDZ+0.2 mg/L IBA,增殖系数为9.2倍,玻璃化率为26%。
2.4 “黎平2号”的生根植物生长调节剂选择
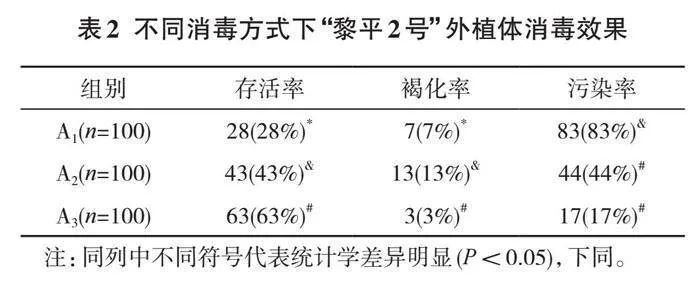
通过实验得出不同的植物生长调节剂下,“黎平2号”的外植体生根情况见表5。
表5中,在使用植物生长调节剂后,“黎平2号”的植物生根率最高可以达到86%,最低为64%,平均生根条数最高可以达到2.8条,最低可以达到2.2条,平均根长最高为3.1 cm,最低为2.4 cm。这说明使用MS+NAA+
IBA作为植物生长调节剂具有良好的使用效果。
对比D1和D2,发现两者的生根率差异性并不显著,但D2的平均生根条数和平均根长较D1组数据更好,说明D2组的外植体长势更加健康;对比D2和D3,发现D3的植物生长调节剂配比下,外植体的平均根长较高,说明D3方案更有利于植物生长,但该方案下外植体的生根率和平均生根条数远低于D2方案,说明尽管D3方案下植物能快速生长,但这一配比方案并不利于植物的生根和发育,因此D2方案相对更具明显的应用优势。
综上,最适合“黎平2号”外植体生长的调节剂组合为0.5 MS+0.6 mg/L NAA+0.5 mg/L IBA,生根率达到86%,平均生根条数达到2.8条,平均根长为2.7 cm。
3 结论
(1)此次实验主要采用氯化汞与乙醇作为实验消毒药剂,分别分析乙醇和氯化汞消毒在规定时间下的消毒效果。最适合“黎平2号”油茶的消毒试剂组合为用75%乙醇消毒30 s后,再用0.1%氯化汞消毒
10 min,这一消毒方式下外植体的存活率为63%,褐化率为3%,污染率为17%,消毒效果良好。同时,在此次实验中,为了保证试剂的利用充分性,在实验中不断摇晃容器,有效降低了外植体的污染率。
(2)植物生长调节剂对外植体腋芽诱导、增殖及生长具有良好的应用效果。此次实验选取的植物生长激素主要有6-BA、NAA、TDZ、IBA等,其中,6-BA能加速植物细胞的分裂及扩大,诱导腋芽生长分化;NAA主要用于提高植株生长高度;TDZ主要用于促进植物细胞伸长,诱导腋芽内的增殖,是调节植物生长组织细胞促使植物平稳生长[10-14];IBA主要用于提高植物的发芽率和成活率,诱导形成外植体的不定芽、愈伤组织及胚状体等。
(3)此次实验中,最适合“黎平2号”油茶的消毒试剂组合为用75%乙醇消毒30 s后,再用0.1%氯化汞消毒10 min;不定芽诱芽的植物生长调节剂的配比为MS+1 mg/L 6-BA+0.4 mg/L NAA+0.06 mg/L TDZ;外植体增殖的植物生长调节剂组合为MS+0.5 mg/L 6-BA+
0.04 mg/L NAA+0.03 mg/L TDZ+0.2 mg/L IBA;外植体生长的调节剂组合为0.5 MS+0.6 mg/L NAA+0.5 mg/L IBA。
参考文献
[1] 徐嘉娟,朱亚艳,王港.贵州小果油茶表型多样性分析及综合评价[J].浙江林业科技,2021,41(3):15-23.
[2] 李振东,陈向东,吴涛,等.黎平县小果油茶良种栽培技术[J].绿色科技,2021,23(3):103-104,114.
[3] 卢永艳,吴运辉,杨承荣,等.小果油茶良种苗木繁育技术[J].林业科技通讯,2020(9):93-95.
[4] 卢永艳,杨恒,吴运辉,等.长林油茶良种栽培及产业化推广应用[J].种子,2019,38(2):131-134.
[5] 杨承荣,姚渊,吴运辉,等.黎平油茶良种选育研究[J].种子,2017,36(12):105-109.
[6] 陈胜群,王港,刘小红,等.‘黎平2号’油茶良种组培快繁技术[J].贵州林业科技,2023,51(3):14-19.
[7] 林颖怡,汪勇,李颖.广东河源特色油茶产业现状与高质量发展对策[J].中国油脂,2024,49(6):6-10,17.
[8] 赖小军.粤北地区油茶良种特性及培育技术要点[J].南方农业,2023,17(15):192-194.
[9] 陈建萍,舒相才,龙德增.红花油茶“腾冲7号”良种无性系选育技术[J].特种经济动植物,2023,26(5):144-147.
[10] 范玉蓉,刘四黑,王蓉,等.铜仁市油茶种质资源现状及产业发展对策分析[J].南方农业,2023,17(3):193-197.
[11] 鲁赛,郭晓春,贾代顺,等.云南油茶产业现状及高质量发展对策[J].林业科技通讯,2023(9):17-21.
[12] 邓可,许俊波,廖德胜,等.贵州省册亨县油茶产业发展现状及对策思考[J].贵州林业科技,2022,50(2):51-55.
[13] 陈锐帆,张恒,奚如春.广东引种‘岑软2号’和‘岑软3号’油茶良种区域试验与评价[J].经济林研究,2022,40 (1):104-111.
[14] 张维,程军勇,邓先珍,等.湖北省油茶产业现状及高质量发展对策[J].湖北林业科技,2021,50(6):62-65.
