椎间盘退变中血管内皮生长因子的作用及相关性研究进展
2024-02-18黄杰蒋强练诗林刘江丁宇
黄杰 蒋强 练诗林 刘江 丁宇
椎间盘退行性病变 (intervertebral disc degeneration,IVDD) 是引起慢性腰痛的常见原因,严重降低患者的生活质量,同时增加了社会经济压力与医疗负担[1-2]。椎间盘是连接相邻椎体无血管、神经的纤维软骨样组织,由内部的髓核、外部的纤维环以及上下软骨终板组成,在维持脊柱平衡、缓冲脊柱机械负荷等方面具有重要作用。IVDD 多由于椎间盘内部合成代谢和分解代谢过程的不平衡而引起,进而导致细胞外基质成分改变、髓核细胞的丧失及过度氧化应激和炎症反应。研究表明,多种细胞因子参与 IVDD 过程,包括白介素-1 (interleukin-1,IL-1)、肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)、神经生长因子 (nerve growth factor,NGF) 以及血管内皮生长因子(vascular endothelial growth factor,VEGF) 等,其中 VEGF以其发挥血管生成、基质降解及突出髓核重吸收等关键作用而备受关注。退变椎间盘内部微环境改变,诱导 VEGF相关微血管形成,同时伴有神经末梢的内向性生长,由此引发腰痛症状[3]。
一、VEGF 的生物学特性
1983 年,研究人员从肿瘤患者腹水中提取到一种分子质量为 34 000~42 000 道尔顿的蛋白质衍生因子,具有迅速增加肿瘤微血管通透性作用,并将其命名为“血管通透因子”(vascular permeability factor,VPF)。1989 年,从牛的垂体滤泡细胞分离出了具有靶向特异性,能够强有力地促进内皮细胞增殖,不同于其它生长因子的内皮细胞特异性有丝分裂原,并将其称之为 VEGF。VEGF 同源蛋白家族包括 VEGF-A (VEGF)、VEGF-B、VEGF-C、VEGF-D、VEGF-E 以及胎盘生长因子 (placental growth factor,PLGF),其 VEGF 受体包括 VEGFR1,VEGFR2 和VEGFR3,并通过其 C 肽的不同与 Neuropilin1 (Npr1) 和Neuropilin 2 (Npr2) 受体特异性结合而发挥生理功能[4]。具有血管生成活性[5-6]、控制血管通透性[7-8]、维持血管功能及性状[9-10]、参与细胞外基质重塑[11]及调节带血管骨与软骨组织[12-13]等生物学特性 (图 1)。
二、VEGF 与椎间盘退变
椎间盘是由内部的髓核、外部的纤维环以及上下软骨终板组成,是人体组织内最大的无血管和神经的器官,除了纤维环的外 1/ 3 有些许血管和神经末梢的浸润。IVDD 包括炎症反应、基质变性和血管生成三个过程,这些过程可以通过增加分解代谢反应和炎症介质的过度表达来介导。
大量的临床证据表明 VEGF 参与 IVDD。Lu 等[14]对156 例腰椎间盘突出症患者术中取出的椎间盘组织进行病理解剖,观察发现 62.8% 的椎间盘出现血管浸润现象;免疫组织化学示 VEGF 表达阳性率为 73.42% (116/ 156),p53 的阳性表达率为 58.97% (92/ 156),并且在 116 例VEGF 阳性的标本中,有 83 例显示 p53 阳性,由此说明退变椎间盘 VEGF 的高表达与 p53 表达密切相关,两者协同促进退变椎间盘新生血管的生长和浸润过程,从而进一步加剧椎间盘的退变。Xin 等[15]通过组织学 HE 染色发现健康的椎间盘具有结构完整的纤维环,当椎间盘发生退变时,纤维环遭受破坏,结构受损,且有血管的出现,这说明结构完整的纤维环能够抑制正常椎间盘内血管的浸润。由 VEGF 表达增加触发的新生血管生成是椎间盘退行性病变的重要特征之一。Chen 等[16]研究报道退变的髓核组织中氨基肽酶及亮氨酸氨基肽酶等蛋白酶的表达明显,VEGF 阳性表达的血管内皮细胞与蛋白酶含量呈正相关,说明蛋白酶介导的基质降解与 VEGF 诱导的血管生成共同参与椎间盘的退变。
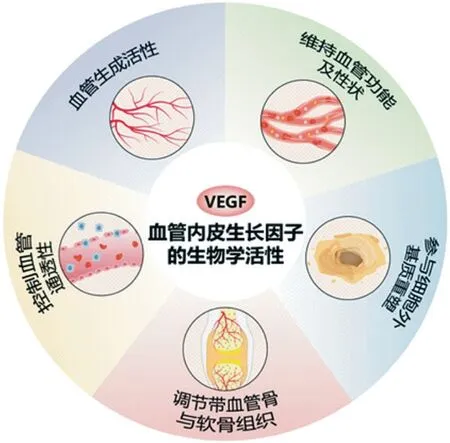
图1 VEGF 的生物学活性Fig.1 Biological activity of vascular endothelial growth factor
构建 IVDD 动物模型是研究 IVDD 机制最常用的手段。Xiao 等[17]将 40 只雌鼠造模 12 周后将其处死并获取L1~6脊柱节段,应用免疫荧光技术检测椎间盘中 VEGF 的表达水平,结果显示:对照组 VEGF 表达不明显,但对照组中重度退变椎间盘内 VEGF 强阳性表达,以无血管的髓核表达更为尤甚,且实验发现 VEGF 表达部位与基质成分异常表达及骨软骨重塑一致,说明 VEGF 通过调节细胞外基质参与 IVDD 过程。李玲慧等[18]为探究补肾活血方对兔 IVDD 模型 VEGF 表达的影响,在针刺造模后给予实验组补肾活血方剂,研究发现低剂量中药组髓核细胞明显减少,纤维环及髓核裂隙也增多,VEGF 免疫组织化学蛋白染色阳性率无明显变化,VEGF 表达量稍下调;中高剂量中药组细胞数量较低剂量组明显增多,纤维环裂隙减少,细胞外基质排列较为均一,VEGF 表达量明显下降,说明退变椎间盘 VEGF 表达量增加,补肾活血方通过抑制 VEGF 的表达延缓 IVDD。郭井泉等[19]通过建立腰椎不稳模型,利用卵巢切除加速 IVDD 进程,制备 IVDD 模型,研究发现椎间盘组织中的 VEGF 的表达增加通过激活 mTOR 细胞通路,上调 Beclin-1 和 LC3 自噬蛋白,下调 Caspase-3 和 Caspase-9 凋亡蛋白,促进椎间盘细胞的自噬,抑制细胞凋亡,进而延缓 IVDD。Zhan 等[20]将 16 只新西兰兔处死后在无菌环境下取出脊椎运动节段,包括完整的椎间盘及上下软骨终板,随机将其分为压力组及对照组,给予压力组持续压力,结果表明持续压力破坏椎间盘的形态完整性,导致软骨终板的血管芽数量减少,并与椎间盘组织中的 VEGF 表达下降呈正相关,这提示 VEGF 参与椎间盘压力性退变,其在 IVDD 过程中可能起着至关重要的作用。张志强等[21]研究报道退变椎间盘 VEGF 上调与丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK) 蛋白表达增加呈正相关,说明在椎间盘发生退变时,伴随着 p38-MAPK 信号通路的激活,VEGF 通过激活该通路诱导新生血管的入侵。Choi 等[22]通过研究发现SM/ J 小鼠 VEGF-A 表达量下降,加速髓核细胞凋亡,促进基质降解,使得椎间盘自发性的发生早期退变,说明VEGF 在椎间盘早期退变过程中具有重要作用。He 等[23]收集椎间盘退行性病变患者和正常个体的椎间盘组织用于分析 P14ARF 表达,同时通过针刺法诱导大鼠尾椎椎间盘发生退变,结果表明正常的椎间盘 P14ARF 和 TIMP3 过度表达,当椎间盘发生退变时,P14ARF 和 TIMP3 表达量明显降低,过度表达的 P14ARF 通过上调 TIMP3 抑制大鼠退变的髓核细胞中炎症因子及 VEGF 的释放,并抑制血管内皮细胞向髓核内生长。
在椎间盘血管化的过程中,椎间盘细胞与相邻的非椎间盘细胞 (包括免疫细胞和内皮细胞) 之间不可避免地发生相互作用。Hwang 等[24]采用微流体共培养设备观察到在 IL-1β 诱导下,内皮细胞向髓核细胞迁移生长,由此说明髓核细胞与人脐静脉内皮细胞间的可以相互作用,该作用是由于椎间盘发生退变时,促炎性因子促使退变的髓核细胞分泌大量的 VEGF 作用于内皮细胞,从而促进血管的内向性生长,引发盘源性腰痛;实验还报道在 IL-1β 的刺激作用下,人类纤维环细胞表达比人髓核细胞更高水平的VEGF-A 和 VEGF-C mRNA,结果表明 IL-1β 主要通过激活核因子 kB (nuclear factor-kB,NF-kB) 信号通路,刺激纤维环细胞产生高水平的 VEGF 促进椎间盘的血管化,诱导细胞外基质降解,加快椎间盘的退变。王金鹏等[25]将髓核细胞与内皮细胞非接触共培养,发现正常的髓核细胞VEGF 低表达,能够抑制血管内皮细胞的生长和迁移,并诱导内皮细胞的凋亡;当椎间盘发生退变时,衰老的髓核细胞内 VEGF 表达明显增加,促进内皮细胞的生长,诱导椎间盘新生血管的生成。Sun 等[26]利用外泌体技术发现退变纤维环来源的外泌体能够产生更多的 VEGF,促进血管内皮细胞的迁移,说明当椎间盘发生退变时,纤维环细胞分泌的 VEGF 增多,促进内皮细胞的生长和迁移,诱导椎间盘新生血管的生成。
IVDD 是众多细胞因子交互作用的结果,VEGF 在IVDD 发生发展中,必不可免地与其它因子相互作用。孙小航等[27]研究发现低月龄组兔椎间盘碱性成纤维细胞生长因子 (basic fibroblast growth factor,bFGF) 及 VEGF强表达,中月龄组 bFGF 及 VEGF 表达量下降,高月龄组 bFGF 及 VEGF 表达量有增加的趋势,结果表明出生时椎间盘的纤维环外层及上下软骨终板有 bFGF 及 VEGF 强表达的血管内皮细胞。随着年龄的增长,bFGF 及 VEGF阳性的血管内皮细胞数量减少,当椎间盘发生退变时,bFGF 及 VEGF 在退变的椎间盘内强表达并伴有新生血管的形成。由此可知,bFGF 及 VEGF 的表达量随着年龄的增长,有着由强到弱再到强的特点,而椎间盘内的血管内皮细胞也有着从多到少再到多的特点,bFGF 及 VEGF 两者在促进血管生成方面具有协同作用。Aydin 等[28]研究报道内皮一氧化氮合酶介导的一氧化氮生成和 VEGF 变异共同参与 IVDD。赵嘉国等[29]研究发现游离型及脱出型腰椎间盘突出症患者基质细胞源性生长因子 1α 与 VEGF 的阳性表达量明显高于突出型患者,且两者的表达量皆随着椎间盘突出程度的加重而增加,基质细胞源性生长因子 1α 与 VEGF 作用相似,能够协同促进退变椎间盘的血管生成。此外,大量的研究表明缺氧可以激活缺氧诱导因子 1α (hypoxia-inducible factor,HIF-1α) 通路诱导 IVDD。Kwon 等[30]研究表明在缺氧环境下,髓核细胞可以诱导内皮细胞 VEGF 表达量增加参与椎间盘的退变,而脊索细胞可以抑制内皮细胞 VEGF 的表达,进而抑制椎间盘的血管化,延缓 IVDD,由此说明,缺氧条件下的脊索细胞具有抗血管生成的能力,在脊索细胞大量存在的时候,即婴幼儿时期,椎间盘内不易生成血管,成年后脊索细胞数量减少甚至消失不见,因而容易发生 IVDD。Hsu 等[31]研究报道在缺氧条件下 HIF-1α 表达增加,椎间盘内的促炎性细胞因子 IL-1β、IL-20 及骨形成蛋白 2 (bone morphogenetic protein 2,BMP-2) 上调,促进 VEGF 的表达,诱导细胞因子趋化,协同调节退变椎间盘内的炎症反应、基质降解及血管生成。付方达[32]通过建立脊柱轴线力学失稳诱导IVDD 小鼠模型,观察发现造模组纤维环 HIF-1α 与 VEGF表达明显上调,提示 HIF-1α 与 VEGF 共同参与椎间盘的退变。
三、VEGF 在 IVDD 治疗中的可行性
VEGF 是椎间盘生长发育过程及退变发生发展过程中的重要细胞因子,正常成年人的椎间盘内缺乏 VEGF 的表达,但当椎间盘发生退变时,VEGF 表达量增加,并随着IVDD 的进展而逐渐增加,但当疾病发展到一定程度时,VEGF 的表达量会有所下降。对于 VEGF 在 IVDD 中发挥的作用,目前尚存争议。
大量研究报道,VEGF 的高表达促进 IVDD 的发生发展,抑制 VEGF 的表达可以有效的延缓 IVDD 的进展。Chen 等[33]研究发现贝伐珠单抗可以通过抑制 VEGF 的表达,下调基质金属蛋白酶 (matrix metalloproteinase,MMP),促进 Ⅱ 型胶原和蛋白聚糖的表达,进而延缓IVDD。Shen 等[34]研究表明褪黑素通过抑制 VEGF 与人脐静脉内皮细胞 (human umbilical vein endothelial cells,HUVEC) 上的受体结合发挥抗血管生成作用,从而达到抑制 IVDD 的作用。Wang 等[35]研究报道在退变的髓核中MicroRNA-101-3p 表达明显上调,MicroRNA-101-3p 通过抑制斯钙素 1 (stanniocalcin-1,STC1)/ VEGF/ MAPK 通路降低 VEGF 介导的血管生成,抑制 STC1 表达,并抑制髓核细胞的凋亡,从而发挥延缓 IVDD 的作用。黄明等[36]利用纤维环穿刺法建立小型巴马猪 IVDD 动物模型,发现椎间盘发生退变时 VEGF 表达量增加,低剂量的激光可以延缓椎间盘的退变,抑制 VEGF 的表达,进而发挥治疗IVDD 的作用。Qiu 等[37]研究发现 VEGFR-1/ Flt-1 基因敲除的椎间盘损伤大鼠痛觉敏感度下降,其椎间盘周围的疼痛相关因子及 VEGFR-1/ Flt-1 水平降低,表明 VEGF 通过 VEGFR-1/ Flt-1 信号通路促进椎间盘退变,说明抑制VEGF 可以有效地延缓 IVDD 的进程。Zhang 等[38]发现艾灸可以通过诱导 IVDD 大鼠 HIF-1α 的表达,下调 VEGF 的表达,来发挥延缓 IVDD 的作用;实验还发现艾灸可以通过 HIF-1α/ VEGF 通路诱导髓核细胞自噬,抑制髓核细胞凋亡,进而抑制 IVDD。
但有学者持相反观点,认为 IVDD 过程中 VEGF 诱导的血管生成可以提供营养供应,代偿性地促进突出髓核吸收,延缓椎间盘退变。张海平等[39]收集了不同类型腰椎间盘突出症患者术中取出的髓核标本,观察到当椎间盘突出时,突出的髓核可以引起免疫反应,激活 T、B 淋巴细胞,并形成新生血管,且随着椎间盘突出程度的加重,免疫反应愈加严重,VEGF 表达量也随之增加;实验还报道病程在 12 个月以上者 VEGF 表达量显著高于病程在 12 个月以内者,结果说明 VEGF 的表达量随着病情的加重而增加,之后随着疾病的发生发展,突出的髓核逐渐被吸收,血管也随之变性,闭塞甚至消失,VEGF 的表达量也逐渐变少;由此可见,当作为机体隐蔽抗原的髓核突出时,会诱发机体的免疫反应,激活免疫细胞,刺激 VEGF 的表达,诱导退变椎间盘新生血管的生成,促进突出髓核的重吸收。李晓春等[40]通过是否刺破椎间盘将造模大鼠分为模拟破裂形突出与模拟非破裂形突出组,结果提示椎间盘刺破组即模拟破裂形突出组 VEGF 表达量明显高于椎间盘未刺破组即模拟非破裂形突出组,且两组的 VEGF 表达量随着时间的进展而不断增加;表明 VEGF 高表达能够促进新生血管的形成,提高血管的通透性,从而有利于纤维环破裂后突入硬膜外隙髓核的重吸收。刘汝银等[41]通过构建并转染腺相关病毒 (adeno-associated virus,AAV)-VEGF和 AAV-TGF-β1 腺病毒载体,报道 AAV-VEGF 和 AAVTGF-β1 可以诱导骨髓间充质干细胞向类髓核细胞分化并发挥髓核细胞的功能,且 AAV-VEGF 和 AAV-TGF-β1 共转染的作用更为明显;AAV-VEGF 和 AAV-TGF-β1 能够促进骨髓间充质干细胞增殖,减少骨髓间充质干细胞凋亡,促进 sry 相关高迁移率蛋白转录因子 (sry-related highmobility-group box transcription factor,Sox-9)、Ⅱ 型胶原和蛋白聚糖的表达,延缓 IVDD。
以上研究结果说明 VEGF 在治疗 IVDD 方面具有争议性,因此,应用 VEGF 生物制剂治疗 IVDD 有待进一步研究,但 VEGF 在 IVDD 中的高表达可提高相关盘源性腰痛的诊断,早期采取治疗手段抑制 VEGF 的表达可有效地延缓 IVDD 进程。
四、总结与展望
IVDD 的机制错综复杂,充分理解 IVDD 的分子生物学机制及生物力学机制对指导临床治疗椎间盘退行性病变至关重要。虽然 VEGF 在 IVDD 过程中发挥调节作用的机制及其和其它细胞因子与 IVDD 之间的关系尚不明确,但VEGF 具有强有力的促血管生成刺激作用,与 IVDD 关系密切,尤其在盘源性腰痛的发生发展过程中发挥至关重要的作用 (图 2)。
临床中因腰痛入院行手术治疗的患者,术前影像学提示腰椎椎间盘高信号区 (high-intensity zone,HIZ),在术中取出的游离髓核组织中,有不少标本可见血管翳,这充分表明 IVDD 过程中伴有血管肉芽组织长入。由此可见,利用 VEGF 较强的刺激血管生成的特性,可以在早期筛检出由于椎间盘组织血管内向性生长引发的盘源性腰痛。随着诊断学技术的不断发展,利用 VEGF 检测早期不明原因的腰痛,尤其是针对早期临床表现与体征不符,且尚无明显影像学改变的腰痛患者具有一定的诊断意义;VEGF 或可作为评估 IVDD 的指标,结合影像学,共同指导患者的预后情况,为临床随访提供一定的参考价值。
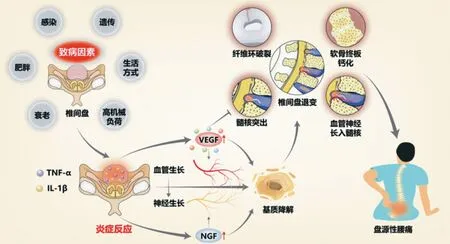
图2 VEGF 调节 IVDD 的机制:各种致病因素促进椎间盘内 IL-1β、TNF-α 等促炎性因子表达增加,从而上调 VEGF 及 NGF 的表达;VEGF 发挥其生物学效应,促进血管长入退变的椎间盘内,促进 NGF 诱导的神经生长,促进突出髓核的吸收,与其它细胞因子协同作用;椎间盘内炎症反应及血管神经生长促进细胞外基质降解,诱导椎间盘发生退变,引起盘源性腰痛Fig.2 Mechanisms of VEGF regulation in IVDD: various pathogenic factors promote the expression of pro-inflammatory factors such as IL-1β and TNF-α within the intervertebral disc,thereby upregulating the expression of VEGF and NGF.VEGF exerts its biological effects by promoting neovascularization and degeneration within the intervertebral disc,facilitating NGF-induced nerve growth,enhancing the resorption of herniated nucleus pulposus,and synergizing with other cytokines.Inflammatory reactions within the intervertebral disc,along with vascular and neural growth promotion,contribute to extracellular matrix degradation,inducing disc degeneration and resulting in discogenic low back pain
VEGF 可促进退变的髓核组织中的基质降解及血管长入。细胞外基质降解是 IVDD 过程的主要病理改变,细胞外基质的不断降解,伴随着椎间盘营养供应逐渐减少,而VEGF 诱导的退变椎间盘血管化能够代偿性地提供营养、运输代谢废物、维持椎间盘细胞的稳态,但新生血管的长入通常伴随着神经纤维的生长,诱发炎症反应,促使痛觉敏化,引起盘源性腰痛。VEGF 往往被认为是椎间盘退变的不利影响因素,抑制 VEGF 的表达可有效地延缓 IVDD的进程;但仍有少数学者认为 VEGF 作为机体的代偿因素,在椎间盘突出后期可促进突出髓核的吸收。由于转基因技术的发展,可以将 P14ARF 与腺病毒共转染制备生物制剂,或将 VEGF 与转化生长因子共同导入腺病毒载体制成生物制剂注入退变的椎间盘,可延缓 IVDD 的进展。虽然 IVDD 的研究广泛,成果颇多,但仍有一些亟待解决的问题,如 VEGF 的双重效应的趋避、动物实验与临床实际间的差异等。
总而言之,由于椎间盘内部生物学环境的复杂性,使得应用 VEGF 生物制剂延缓或治疗 IVDD 较为困难,但无论如何,VEGF 参与 IVDD 的发生发展,早期采取治疗手段抑制 VEGF 的表达可有效地延缓 IVDD 进程,为临床防治 IVDD 及相关盘源性腰痛提供新技术和新方向。
