基于16S rRNA测序分析银屑病小鼠皮肤及肠道微生态菌群
2024-02-16张雨婷赵慧霞赵佳乐何晓园
张雨婷 赵慧霞 孟 欣 赵佳乐 何晓园
1长治医学院,山西长治,046000;2长治医学院附属和济医院皮肤科,山西长治,046000
皮肤和肠道菌群参与机体免疫的建立,是许多促炎疾病的重要驱动因素[1,2]。银屑病和微生态菌群变化之间有着密不可分的联系,菌群紊乱可能是导致银屑病发生的关键因素[3,4]。与正常人群相比,银屑病患者皮肤及肠道菌群多样性改变,进一步支持了肠-免疫-皮肤轴[5,6]的存在。为探讨银屑病皮肤及肠道菌群变化,我们造模银屑病小鼠模型,收集皮肤、粪便样本,采用16S rRNA高通量基因测序方法,检测并分析菌群变化。皮肤及肠道菌群与宿主之间的相互作用将有助于探讨银屑病的发病机制,并为今后银屑病微生态研究提供新的理论基础。
1 材料和方法
1.1 构造银屑病小鼠模型 雄性BALB/c小鼠(SPF级,5周龄,体重16~18 g,北京斯贝福生物技术有限公司)置于隔离环境中饲养。温度23℃,湿度50%。所有动物操作均通过长治医学院伦理委员会批准。
适应环境1周后将小鼠随机分为实验组和对照组,每组纳入6只。使用脱毛膏将全部小鼠背部毛发脱除。实验组小鼠背部皮肤涂抹咪喹莫特乳膏[IMQ,四川明欣药业有限责任公司,3 g/支,(批准文号)国药准字H20030129]62.5 mg/日,连续7天[7];对照组小鼠接受相同体积的凡士林(山东德州利康医药科技有限公司,300 g/盒),连续7天,见图1。在此期间,实验组及对照组在相同条件下饲养,饲料、水、饲养温度、湿度均无明显差异。第8日麻醉后处死小鼠。
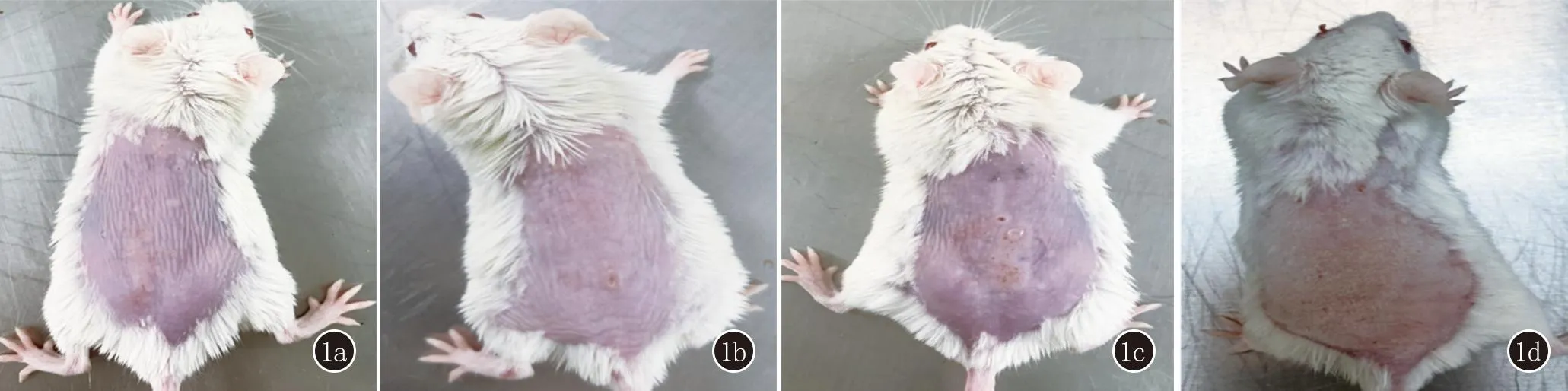
1a、1b:对照组;1c、1d:实验组
1.2 皮肤组织样本采集 造模第8日,使用二氧化碳气体麻醉机(PerkinElmer)将小鼠麻醉后,取背部皮肤组织,大小约1 cm×1 cm×2份,标记为1号样本、2号样本。取样后即刻将1号样本放入无菌福尔马林溶液固定,2号样本放入无菌冻存管,置入-80℃冰箱内冻存备用。所有样本均由同一实验人员采集,严格遵守无菌原则,避免实验标本在采集过程中受其他菌群污染。
1.3 粪便样本采集 造模第8日,采集两组小鼠新鲜粪便,取样后即刻分装2 g粪便样本于无菌冻存管,置入-80℃冰箱内冻存备用。采集过程及要求同前。
1.4 样本处理 1号样本送至长治医学院附属和济医院病理科,经固定、脱水、包埋、切片、染色等步骤,制作成石蜡切片,结果回报后阅片。
2号样本及粪便样本送至上海宝藤生物医药科技股份有限公司进行检测,提取样本中的细菌总DNA,对V3~V4可变区行聚合酶链反应扩增,使用Illumina NovaSeq平台行高通量测序,分类学分析得到代表序列的物种注释结果。选用SILVA138数据库比对,并在门、纲、目、科、属、种分类水平上统计每个样本的群落组成,分析两组小鼠菌群多样性、群落差异、组间物种及功能差异等[8]。
1.5 统计学方法 使用SPSS 25.0轶件进行统计学分析,计量资料以(X±S)表示,正态分布样本采用t检验,非正态分布样本采用Wilcoxon秩和检验,组间差异分析采用χ2检验、Anosim检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠皮肤组织病理 对照组、实验组小鼠局部皮肤组织病理结果见图2。

2a、2b:对照组;2c、2d实验组
实验组病理显示:角化过度,颗粒层变薄或消失,棘层增厚,表皮突规则下延,真皮浅层毛细血管扩张,周围炎细胞浸润。符合银屑病病理改变,造模成功。
2.2 小鼠皮肤组织菌群
2.2.1 α多样性分析 通过计算每个样本的α多样性指数,可以反映样本内微生物群落的丰富度、多样性和均匀度。与对照组相比,实验组Shannon指数(P=0.1)、Simpson指数(P=0.1)、ACE指数(P=0.1)降低,而Chao 1指数(P=0.7)、goods_coverage(P=0.1)升高,如表1所示。各指数均P>0.05,差异无统计学意义,但这些指数的数值表明银屑病小鼠皮肤群落丰度和物种多样性均略低。
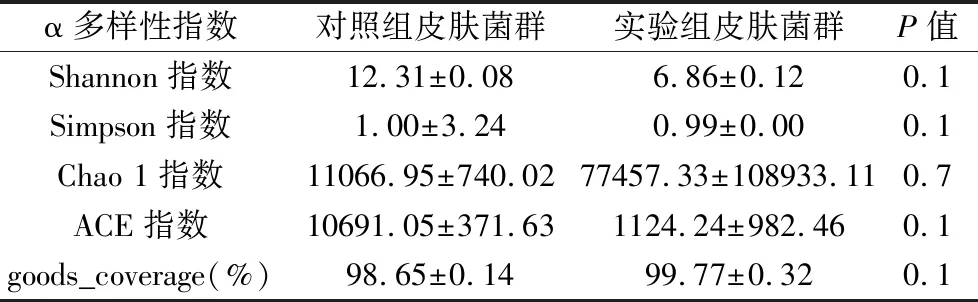
表1 对照组与实验组皮肤微生态菌群α多样性指数分析
2.2.2 β多样性分析 β多样性分析关注样本间的菌群组成差异。结果显示,加权距离Anosim检验结果R=1,P=0.1。R>0,说明组间差异大于组内差异,但P>0.05,差异无统计学意义。我们基于Bray-Curtis距离进行PCoA分析,计算得不同分组因素对样本差异的解释度R=0.5767,分组显著性P=0.1。分析结果,虽然P>0.05,差异无统计学意义,但仍能说明菌群多样性差异较大。
2.2.3 菌群组成分析 实验结果显示,实验组皮肤菌群丰度较对照组变化显著。与对照组相比,实验组中拟杆菌门、弯曲杆菌门、肠杆菌门、红蝽菌纲、脱铁杆菌纲、脱硫弧菌纲、梭状芽孢杆菌目_UCG-014、毛螺菌目、理研菌科、瘤胃球菌科、副杆菌属、丁酸杆菌属、沙门氏菌种、耐久肠球菌种等的相对丰度降低,而厚壁菌门、芽孢杆菌纲、葡萄球菌目、巴斯德氏菌科等的相对丰度升高,乳杆菌目无明显变化。因此,在门、纲、目、科、属、种水平上,实验组与对照组相比,菌群丰度显示有明显差异。两组样本在各分类水平上的物种相对丰度柱状图、两组间属水平物种的聚类热图见图3。

图3 3a:门水平物种相对丰度柱状图;3b:纲水平物种相对丰度柱状图; 3c:目水平物种相对丰度柱状图; 3d:科水平物种相对丰度柱状图; 3e:两组间属水平物种的聚类热图
2.2.4 两组群落差异分析(LefSe) 采用LefSe分析两组的皮肤菌群组成、样本所含菌群种类及各分类群的相对丰度差异,辨别对两组间差异起决定作用的的物种。结果显示小鼠皮肤菌群中,在纲水平,红蝽菌纲、拟杆菌纲、弯曲杆菌纲、脱铁杆菌纲、脱硫弧菌纲、芽孢杆菌纲在两组样本菌群的差异中起主要作用,在目水平,红蝽菌目、拟杆菌目、黄杆菌目、弯曲菌目、脱铁杆菌目、脱硫弧菌目、无胆甾原体目、丹毒丝菌目、乳杆菌目、葡萄球菌目起主要作用。见图4。
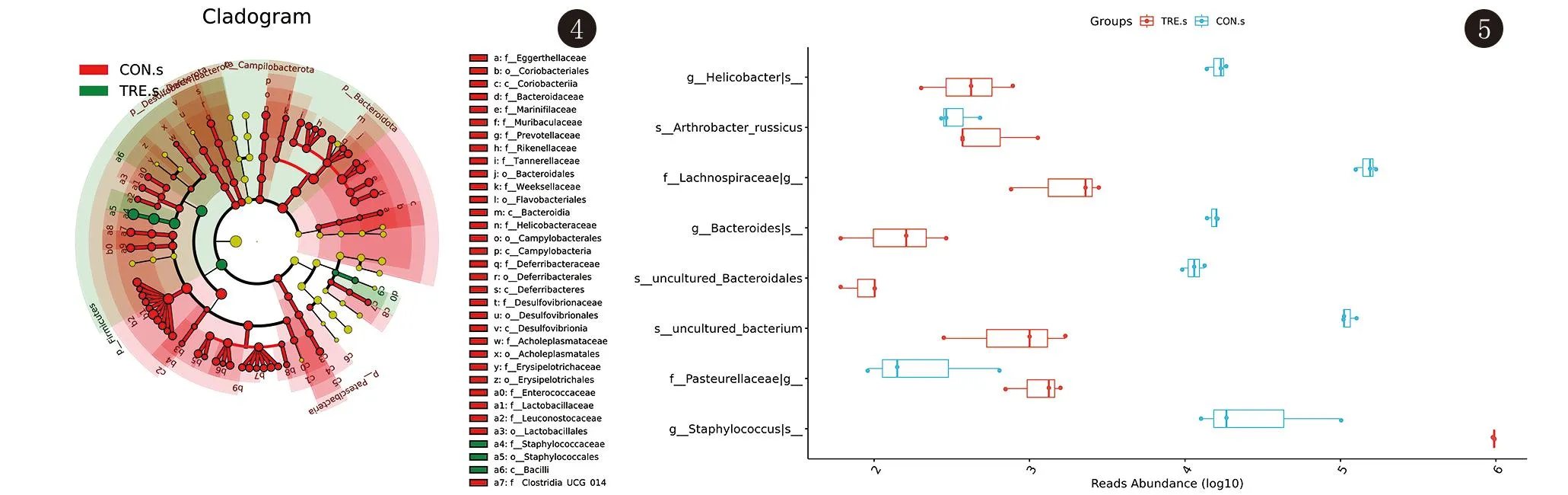
图4 皮肤菌群LefSe进化分支图
2.2.5 组间物种及功能差异分析(MetagenomeSeq) MetagenomeSeq利用线性模型找到对照组与实验组菌群差异所在,结果显示,χ2=16.069,P=0.003,95%CI[0.098,0.393],两组菌群在门、纲、目、科、属、种水平均存在差异,有统计学意义。较为显著的是,小鼠皮肤菌群中,实验组中巴斯德菌科、葡萄球菌属、关节杆菌科占优势,而对照组中螺杆菌属、拟杆菌属、毛螺菌科占优势。见图5。
2.3 小鼠肠道菌群
2.3.1 α多样性分析 实验组肠道菌群Shannon指数(P=0.2)、Chao 1指数(P=0.4)、ACE指数(P=0.3)、goods_coverage(P=0.3)均降低,Simpson指数(P=0.2)无变化,如表2所示。各指数均P>0.05,差异无统计学意义,但结果仍能显示出银屑病小鼠肠道群落丰度略高,而物种多样性均略低。
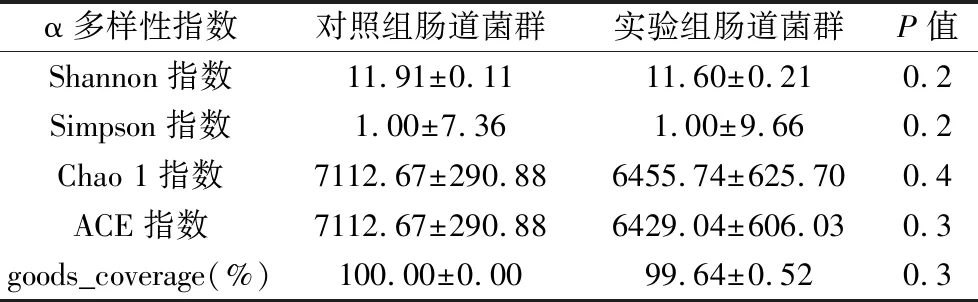
表2 对照组与实验组肠道微生态菌群α多样性指数分析
2.3.2 β多样性分析 实验结果显示,加权距离Anosim检验结果R=0.778,P=0.1。R>0,说明组间差异大于组内差异,但P>0.05,差异无统计学意义。基于Bray-Curtis距离的PCoA分析结果R=0.2712,分组显著性P=0.1。虽然P>0.05,差异无统计学意义,但菌群多样性仍有差异。
2.3.3 菌群组成分析 实验结果显示,实验组肠道菌群丰度较对照组变化显著。一些细菌的相对丰度降低,如拟杆菌门、肠杆菌门、变形菌门、α-变形菌纲、乳杆菌目、理研菌科、紫单胞菌属、瘤胃球菌属等,而其他细菌,如弯曲杆菌门、蓝藻菌门、厚壁菌门、梭状芽孢杆菌纲、毛螺菌目、念珠藻目、消化链球菌目、脱铁杆菌科、脱硫弧菌科、瘤胃球菌科、丁酸杆菌属、沙门氏菌种、埃希氏菌种等的相对丰度增加,而真杆菌科、螺杆菌属等变化存在矛盾。因此,实验组与对照组相比在各水平上菌群丰度均有差异。两组在各分类水平上的物种相对丰度柱状图、两组间属水平物种的聚类热图。见图6。
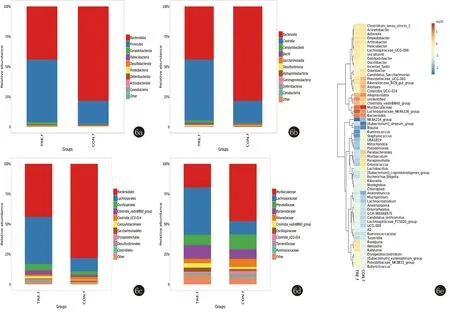
图6 6a:门水平物种相对丰度柱状图; 6b:纲水平物种相对丰度柱状图; 6c:目水平物种相对丰度柱状图; 6d:科水平物种相对丰度柱状图; 6e:两组间属水平物种的聚类热图
2.3.4 两组群落差异分析(LefSe) LefSe分析结果显示,小鼠肠道菌群中,在纲水平,拟杆菌纲、脱铁杆菌纲、脱硫弧菌纲、梭状芽孢杆菌纲、α-变形菌纲在两组样本菌群的差异中起主要作用,在目水平,拟杆菌目、脱铁杆菌目、脱硫弧菌目、乳杆菌目、梭状芽孢杆菌目_vadinBB60群、毛螺菌目、念珠藻目、消化链球菌目、肠杆菌目起主要作用。见图7。
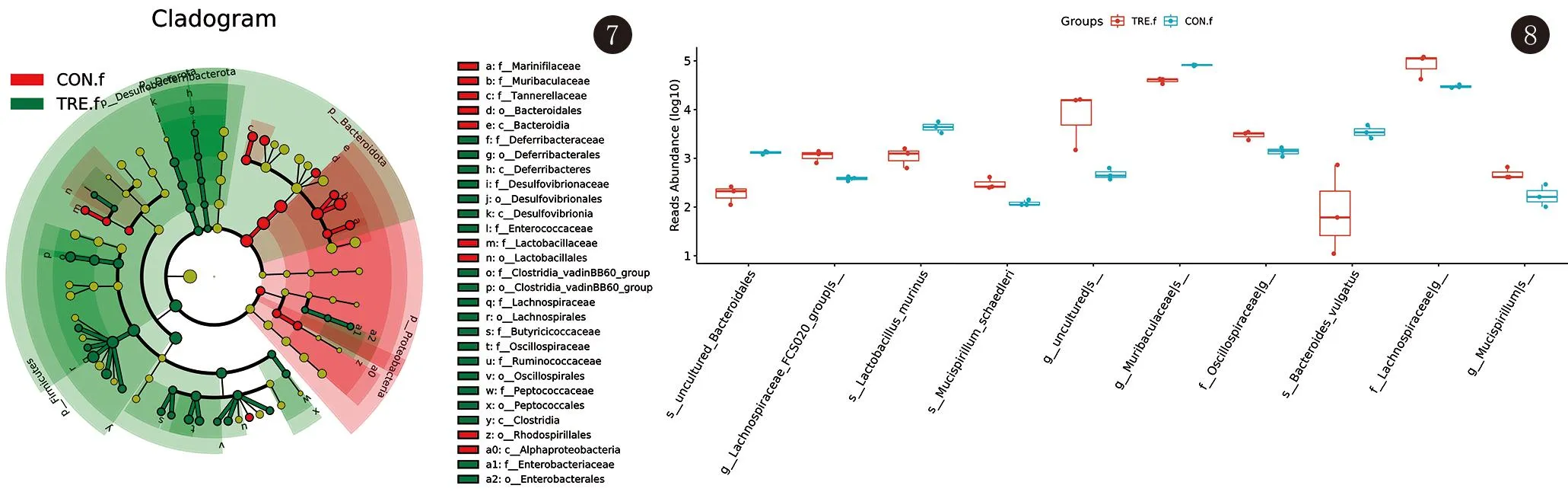
图7 肠道菌群LefSe进化分支图
2.3.5 组间物种及功能差异分析(MetagenomeSeq) MetagenomeSeq结果显示,χ2=16.069,P=0.003,95%CI[0.098,0.393],两组菌群在门、纲、目、科、属、种水平均存在差异,有统计学意义。结果显示小鼠肠道菌群中,实验组中颤螺旋菌科、毛螺菌科、毛螺菌属_FCS020群、黏液螺旋菌属、舍氏小螺菌种占优势,而对照组中拟杆菌属、鼠乳杆菌种占优势。见图8。
3 讨论
综上所述,实验组与对照组相比,皮肤和肠道菌群的相对丰度均存在明显差异,提示银屑病小鼠存在微生态菌群失调。目前学者普遍认为,正常情况下微生态菌群处于动态平衡的状态,具有维持机体稳定、抵御病原微生物入侵、调节免疫应答、调控营养代谢等多种功能。菌群失调会使代谢产物释放入血,引发免疫炎症反应,进而参与银屑病的进程[9-10]。
近年来多项研究报道,银屑病患者存在不同程度的皮肤及肠道微生物群紊乱,提示菌群变化可能在银屑病的发病机制中起关键作用[11-12]。本研究中,实验组与对照组相比,在门、纲、目、科、属、种水平上,皮肤和肠道菌群相对丰度均存在显著差异,有统计学意义。LefSe分析表明,小鼠皮肤菌群中红蝽菌纲、拟杆菌纲、乳杆菌目、葡萄球菌目等起主要作用,肠道菌群中拟杆菌纲、梭状芽孢杆菌纲、肠杆菌目、毛螺菌目等起主要作用。MetagenomeSeq分析结果显示,银屑病小鼠皮肤菌群中巴斯德菌科、葡萄球菌属、关节杆菌科等占优势,而肠道菌群中颤螺旋菌科、毛螺菌科、毛螺菌属_FCS020群、黏液螺旋菌属、舍氏小螺菌种等占优势。我们的实验结果与之前多项关于银屑病菌群研究的结果基本一致。Hidalgo-Cantabrana等[13]的研究显示,银屑病患者肠道中厚壁菌门的比例显著升高,而拟杆菌门、嗜黏蛋白阿克曼菌属、瘤胃球菌属、普拉梭菌种降低,同时,厚壁菌门/拟杆菌门比值与银屑病的严重程度呈正相关[14]。我们的实验中银屑病小鼠肠道厚壁菌门、拟杆菌门、瘤胃球菌属的变化与Hidalgo-Cantabrana等的研究结果相同,但普拉梭菌属在银屑病小鼠肠道中无明显变化。Wang等[15]对27例银屑病样本和54例对侧非皮损皮肤及健康皮肤样本进行了菌群成分的测序和分析,结果显示,银屑病皮肤样本菌群α多样性和β多样性显著低于健康人群,且不动杆菌、假单胞菌、沙门氏菌、芽孢杆菌的丰度较健康人群皮肤明显降低,本实验中也显示出相似的结果,但银屑病小鼠皮肤中不动杆菌的变化不明显。Zhang等[16]的研究结果也相似,且与我们的实验结果一致。这些结果差异可能与银屑病患者容易受到外界环境影响或与饮食结构不同有关,导致部分菌群受干扰,而小鼠在相同环境下饲养,受干扰的因素较少。但总体而言,我们的实验结果和之前的研究基本一致,进一步验证了实验的可信度。
我们通过成功构建咪喹莫特诱导的银屑病小鼠模型,采用16S rRNA高通量测序比较并分析了银屑病小鼠与正常小鼠皮肤及肠道中菌群差异,并与目前已公开发表的关于银屑病患者菌群变化的结果进行联合分析,提示银屑病患者存在明显的皮肤及肠道菌群变化,菌群相对丰度及多样性发生改变。其原因可能与银屑患者皮肤屏障受损有关,动态平衡被破坏,增加了致病菌感染的风险,通过肠道进入机体,进而肠道微生态环境紊乱,影响相关炎症因子释放和免疫应答,导致疾病的发生,但具体发生机制还有待进一步研究证实。
然而,我们的实验也存在不足之处,一是实验样本量较小,二是检测的菌群数量有限。在后续实验中,皮肤及肠道微生态菌群对银屑病的影响仍需更深入剖析。菌群变化对银屑病慢性炎症反应的发生发展具有重要意义,调节皮肤、肠道菌群可能成为银屑病的替代治疗方式。我们将继续进一步探索皮肤、肠道菌群与银屑病的关联,为今后研究银屑病、研发新型治疗药物提供新的策略,皮肤及肠道菌群作为治疗银屑病新的靶点,可能将在银屑病的诊疗中发挥举足轻重的作用。
