发酵菜籽粕对黄颡鱼表观消化率、肝脏及肠道健康的影响
2024-02-15贾冰玉邹峰余徐杰杰柳声赞
贾冰玉 邹峰余 徐杰杰 赵 涛 柳声赞 罗 智
(华中农业大学水产学院,武汉 430070)
菜籽粕是我国第二大蛋白质原料,其营养物质丰富,氨基酸组成全面,富含含硫氨基酸、蛋氨酸和半胱氨酸等氨基酸及硒、镁、铁、钙等矿物质[1]。欧盟、中国、加拿大和印度是全球四大菜籽粕生产国/组织,2020年我国菜籽粕产量达到909万吨,居于世界第二位[2]。随着水产养殖规模的不断增加,水产行业饲料供给不足,而菜籽粕可作为潜在的新型植物蛋白源应用于水产饲料行业。但是菜籽粕含有的高碳水化合物、高粗纤维及大量抗营养因子成为其在水产饲料中的限制因素。抗营养因子过量会导致动物消化功能、抗氧化能力与免疫功能受损,并且会降低摄食量和生产性能[3,4]。有研究已表明,菜籽粕经过发酵可以有效降解硫甙、单宁和植酸等抗营养因子,并通过水解蛋白质为易吸收的小分子多肽等来提高菜籽粕的营养价值[5,6]。因此,发酵菜籽粕可作为一种有潜力的饲用蛋白源应用于水产饲料行业。
发酵菜籽粕在畜禽生产中的研究较广泛,已证明它可以提高动物增重率、生产性能和免疫力,增加动物对饲料的表观消化率,增加矿物质利用率并改善肠道健康[7—9]。然而,发酵菜籽粕在水产饲料行业的应用研究较为缺乏。有研究表明,发酵菜籽粕可以替代南美白对虾(Litopenaeus Vannamei)饲料中64.40 g/kg水平的鱼粉,而未发酵菜籽粕替代鱼粉的水平仅为25 g/kg[10]。与未发酵菜籽粕替代组相比,发酵菜籽粕替代组可以明显增加鲫(Carassius auratus)[11]和真鲷(Pagrus major)[12]的生长性能及饲料利用率,提高鱼体的抗氧化水平。鱼类的健康和免疫与抗氧化防御系统高度相关,当鱼体受到的氧化损伤过重时,甚至会引起鱼体细胞凋亡[13,14]。
黄颡鱼(Tachysurus fulvidraco)广泛分布于亚洲多个国家,是中国最重要的淡水养殖物种之一[15]。因此,本实验以黄颡鱼为养殖对象,先对其生长性能和表观消化率进行分析,初步探讨了发酵菜籽粕对鱼体生长和营养物质消化吸收能力的影响。接着从黄颡鱼肝肠组织、肠道紧密连接相关基因表达水平、炎症反应、氧化应激及细胞凋亡等方面入手,进一步讨论了发酵菜籽粕对鱼体肝脏及肠道健康的影响,为发酵菜籽粕在水产饲料中的开发利用提供理论支持。
1 材料与方法
1.1 饲料配制
饲料配方参考Han等[16]试验方法配制3组实验饲料: 以基础饲料为对照组(Control),未发酵菜籽粕替代30%基础饲料为URSM,发酵菜籽粕替代30%基础饲料为FRSM。具体组成见表1。其中,发酵菜籽粕所用菌种为 枯草芽孢杆菌(Bacillus subtilis)来源于中国典型培养物保藏中心,酿酒酵母(Saccharomyces cerevisiae)和植物乳杆菌(Lactobacillus plantarum)来源于华中农业大学生命科学技术学院发酵与酶工程教研室赵述淼老师的馈赠。饲料原料经粉碎,过60目筛,按饲料配方准确配制,采用逐级放大原则充分混匀。充分揉搓饲料,经水产专用挤条膨化机压成细条,烘干后保存于-20℃条件下。
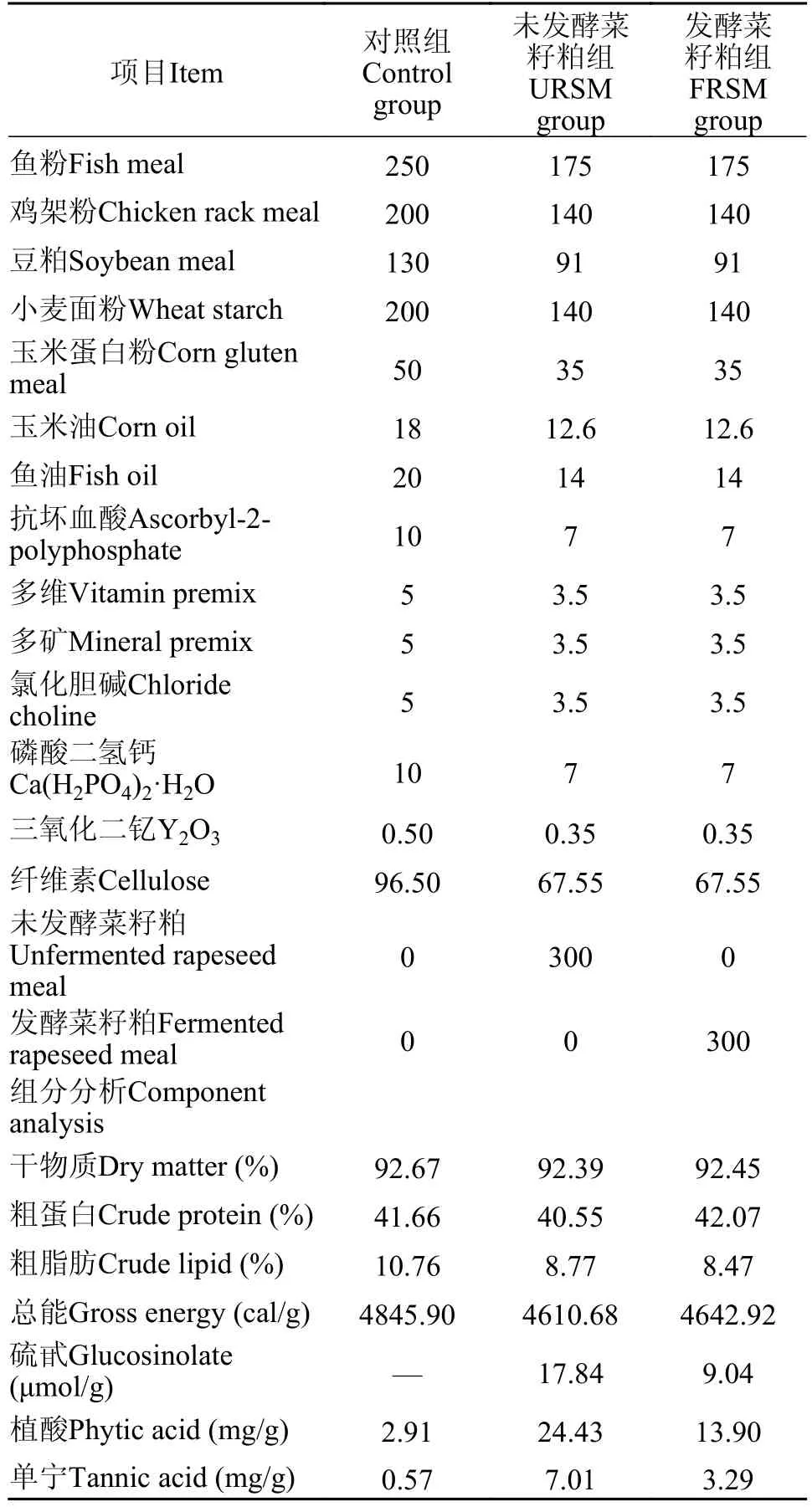
表1 饲料配方和成分分析Tab.1 Feed formulation and proximate analysis of experimental diets
1.2 饲养管理
黄颡鱼购自当地养殖场(武汉,中国)。在养殖实验开始之前,暂养2周黄颡鱼进行驯化。在正式实验前,实验鱼饥饿24h,选取180尾健康无病黄颡鱼[体重: (6.08±0.02) g],随机放入9个养殖缸中,每缸20尾鱼。实验共3个处理,每个处理组3个平行。每天8:00和16:00投喂至表观饱食,每次投喂0.5h后吸除残饵。在投喂1周后,开始收集粪便样品。实验采用静态水养殖系统,养殖期间连续充气保证水体的溶氧充足。在整个实验过程中,为了确保水质,每缸每天换水2次,每周对水体氨氮、pH、溶解氧和温度等水体指标测定2次,试验期间水温为28.7—30.7℃,pH为7.8—8.1,溶解氧和氨氮分别为6.1—6.5 mg/L和0.03—0.07 mg/L。实验共持续7周。
1.3 样品采集
粪便样品的收集采用虹吸法,每次投饵后6h内,每隔2h收集1次粪便。收集新鲜、成型、饱满及包膜完好的粪便颗粒,烘干并存于-20℃冰箱,直到粪便样品够分析用。
取样前将黄颡鱼饥饿24h,用100 mg/L MS-222麻醉后进行计数和称重。抽血后,迅速置于冰上解剖取其内脏、肝脏及肠道进行称重,以计算形体指标。每缸取3条鱼在冰上迅速解剖取其肝脏和肠道,分别在TRIzol溶液中提取RNA,用于测定相关基因表达水平。另取3尾鱼冰上迅速解剖,分离肝脏和肠道组织,置于甲醛固定液中固定,用于后续组织学观察。另随机选取6尾鱼于冰上迅速解剖,将其肝脏组织及肠道组织分别冷冻于液氮中,保存于-80℃冰箱,用于酶活性及氧化应激相关指标的测定。
1.4 样品分析
表观消化率测定在105℃烘箱中烘干至恒重,测得样品干物质含量(GB/T 6435-2006);采取凯氏定氮法测定样品粗蛋白含量(GB/T 5009.5-2003);采取索氏抽提法测定样品粗脂肪含量(GB/T 6433-2006);饲料和粪便的总能采用热量氧弹仪(6200 Isoperibol Calorimeter)测定;采用电感耦合等离子发射光谱仪(ICP-OES;Optima 8000DV,PerkinElmer,USA)测定饲料及粪样中的钇含量。实验原料干物质、粗蛋白、粗脂肪和能量的表观消化率的计算公式参照何明等[17]。
肝脏和肠道HE染色分析参照文献[18]的方法,取肝脏或肠道样品经梯度酒精脱水,接着进行石蜡包埋和切片(厚度6—8 μm),用苏木精和伊红(HE)染色后经中性树脂封片。其中,染色过程为: 二甲苯脱蜡-100%—50%酒精逐级复水-苏木精染色-流水冲洗返蓝-50%—95%酒精逐级脱水-伊红染色-二甲苯透明-中性树脂封片。
肝脏及肠道生化指标测定总超氧化物歧化酶(T-SOD)活性、过氧化氢酶(CAT)活性和总抗氧化能力(T-AOC)采用南京建成生物工程研究所的试剂盒进行测定,丙二醛(MDA)含量、Caspase 3和Caspase 9酶活性均采用碧云天生物技术的商业化试剂盒进行测定,操作过程参照试剂盒说明书。
基因表达水平分析根据文献[18]方法,总RNA的提取方法参照Invitrogen的TRIzol说明书进行。通过琼脂糖凝胶电泳和Nanodrop ND-2000分光光度计(Thermo Fisher Scientific,USA)测定总RNA的浓度和纯度。以提取的总RNA为模板,采用TaKaRa反转录试剂盒合成第一链cDNA,然后在巢式PCR仪上进行反转录反应。反应结束将产物保存于-20℃备用。采用实时荧光定量PCR(qPCR)检测黄颡鱼组织的基因表达,荧光定量引物见表2。本实验选用双内参,用GeNorm标准化,选择8种管家基因(18S rRNA、b2m、ubce、tuba、gapdh、rpl7、tbp和elfa)对它们进行转录水平稳定性检测。采用2-ΔΔCt方法计算相对表达水平。
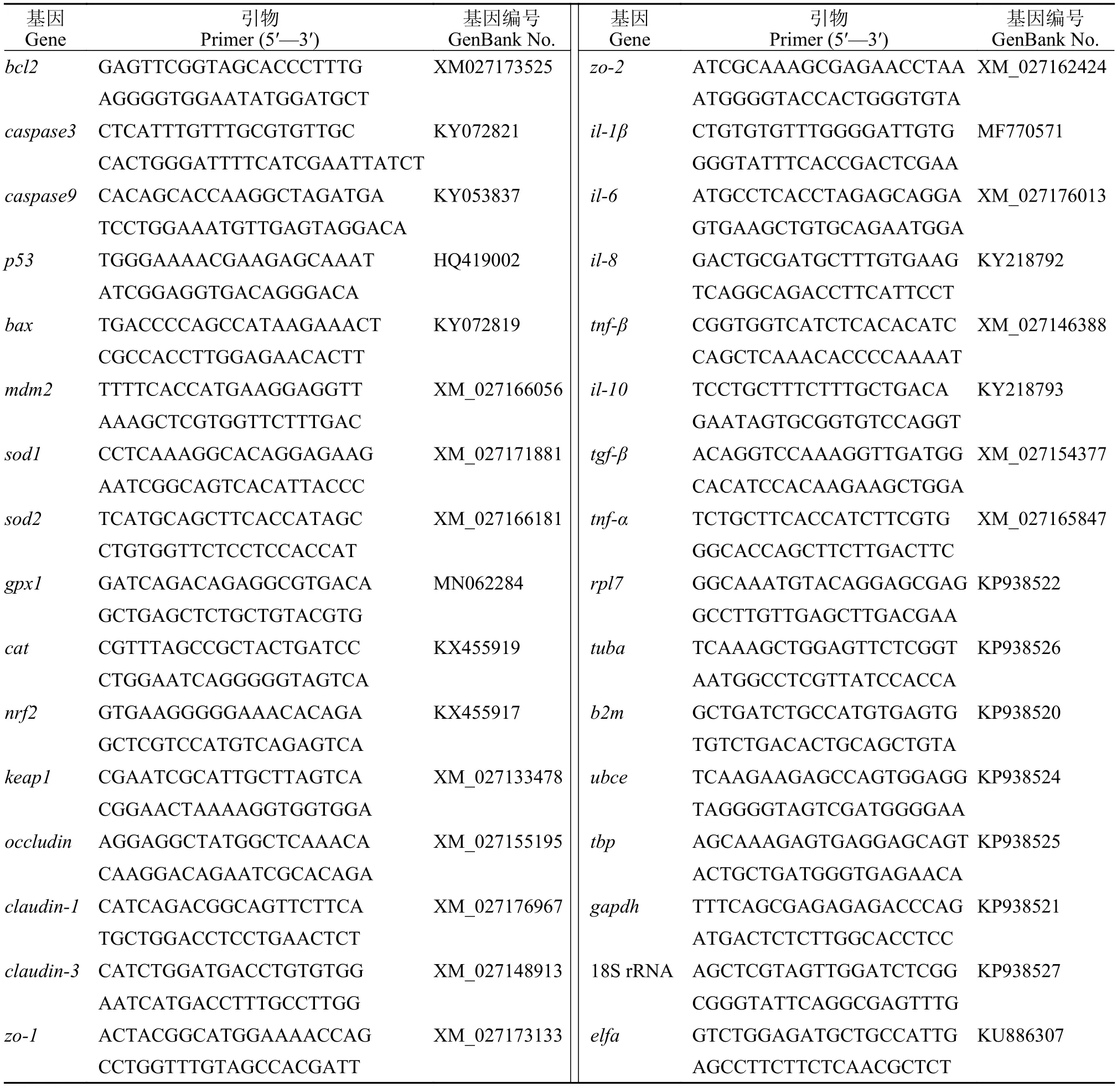
表2 荧光定量PCR基因引物Tab.2 Primers used for quantitative Real-time PCR
1.5 计算公式
增重率(WGR,%)=100×(末体重-初体重)/初体重
摄食率(FI,%)=100×饲料摄入量/[(初体重+末体重)/2×天数]
存活率(SR,%)=100×末鱼数量/初鱼数量
肥满度(CF,g/cm3)=100×鱼体重/(体长,cm)3
脏体比(VSI)=100×内脏团重/鱼体重
肝体比(HSI)=100×肝脏重/鱼体重
比肠重(ISI)=100×肠道重/鱼体重
饲料系数(FCR)=饲料摄入量/(末体重-初体重)
1.6 统计分析
采用SPSS 17.0软件对实验数据进行统计分析,所有数据结果均用平均值±标准误(mean±SE,n=3)表示。使用单因素方差分析(one-way ANOVA)进行不同组间指标差异性统计检验,若不同组间的差异显著,则采用Duncan多重比较来检验不同处理组间的差异显著性,以P<0.05为差异有统计学意义。
2 结果
2.1 生长、饲料利用及形体指标
如表3所示,FRSM组黄颡鱼的末体重(FBW)和增重率(WGR)显著高于URSM组(P<0.05)。与对照组相比,URSM组黄颡鱼的饲料系数(FCR)和肝体比(HSI)显著增加(P<0.05)。而发酵菜籽粕饲料显著降低了菜籽粕导致的饲料系数及肝体比的增加(P<0.05)。
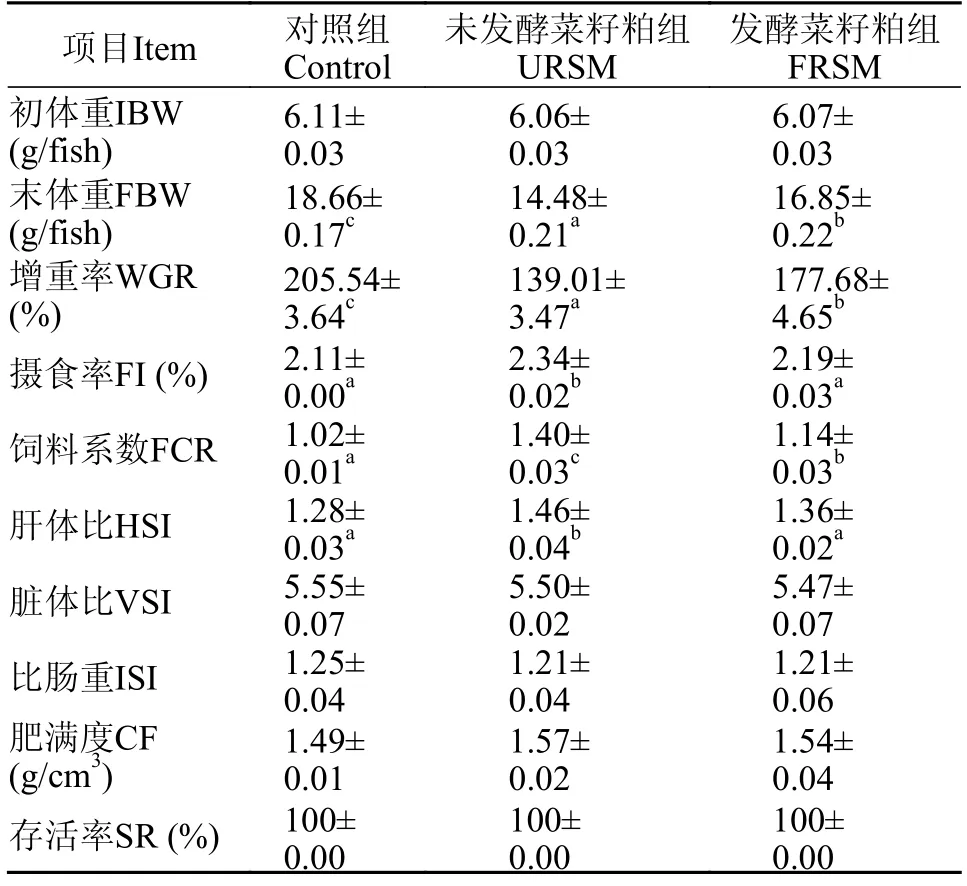
表3 发酵菜籽粕对黄颡鱼生长、饲料利用及形体指标的影响Tab.3 Effects of fermented rapeseed meal on growth,feed utilization and morphological index of yellow catfish
2.2 原料的表观消化率
由表4可知,黄颡鱼对发酵菜籽粕原料的干物质、蛋白质、脂肪和能量的表观消化率平均值分别为71.92%、83.38%、91.08%和79.65%,均高于未发酵菜籽粕原料。另外,黄颡鱼对发酵菜籽粕原料的干物质表观消化率的增加率(3.91%)最低,对脂肪表观消化率的增加率(18.16%)最高。
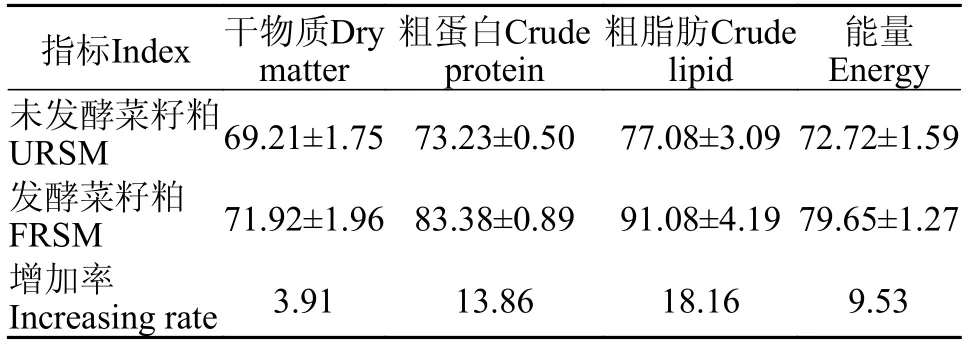
表4 黄颡鱼对未发酵菜籽粕和发酵菜籽粕的表观消化率Tab.4 Apparent digestibility of unfermented rapeseed meal and fermented rapeseed meal in yellow catfish (%)
2.3 肝脏及肠道HE染色
如图1所示,与对照组相比,URSM组黄颡鱼肝脏组织出现明显病变,细胞核偏移至一侧,黄颡鱼肝细胞空泡化现象明显。FRSM组黄颡鱼肝脏组织的病变情况得到明显改善,肝细胞空泡化的相对面积显著低于URSM组(P<0.05)。由图2可知,与对照组相比,URSM组黄颡鱼的肠道绒毛长度显著降低(P<0.05),绒毛宽度无显著差别(P>0.05),而肠道zo-1和zo-2的mRNA表达水平显著下调(P<0.05)。发酵菜籽粕缓解了菜籽粕导致的肠道绒毛长度显著降低及zo-1和zo-2表达的下调。
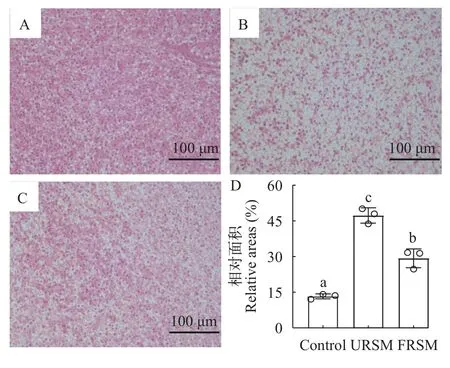
图1 发酵菜籽粕对黄颡鱼肝脏组织的影响(HE染色)Fig.1 Effect of fermented rapeseed meal on liver of yellow catfish (HE staining)
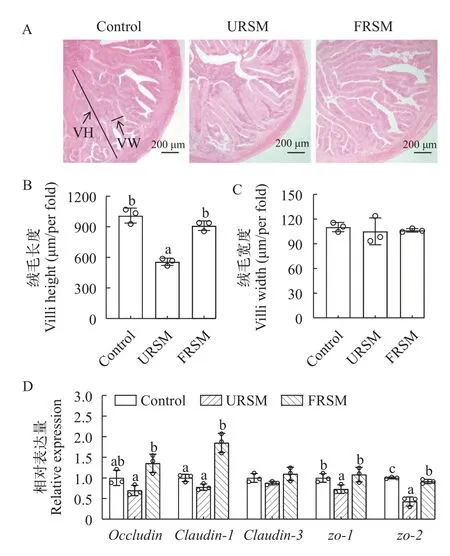
图2 发酵菜籽粕对黄颡鱼肠道结构的影响Fig.2 Effect of fermented rapeseed meal on the intestinal structure of yellow catfish
2.4 炎症因子相关基因表达
如图3A所示,FRSM组饲料饲喂黄颡鱼降低了未发酵菜籽粕诱导的肝脏促炎因子相关基因(tnfα、tnf-β、il-1β和il-6)mRNA表达的上调,并提高了肝脏抗炎因子il-10mRNA表达水平的下调。而在黄颡鱼肠道中(图3B),FRSM组也降低了未发酵菜籽粕诱导的tnf-α和il-6的mRNA表达水平的上调,且抗炎因子相关基因(tgf-β和il-10)mRNA表达水平显著高于URSM组(P<0.05)。
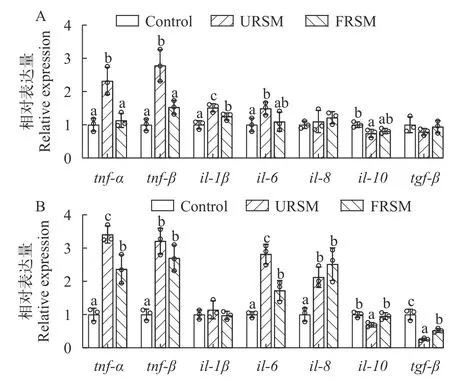
图3 发酵菜籽粕对黄颡鱼肝脏(A)和肠道(B)炎症因子相关基因表达的影响Fig.3 Effect of fermented rapeseed meal on gene expressions of inflammatory cytokines in the liver (A) and intestine (B) of yellow catfish
2.5 抗氧化系统相关基因表达及酶活性
由图4可知,与对照组相比,URSM组黄颡鱼的肝脏cat、sod1、gpx1和keap1的mRNA表达水平及T-AOC、CAT和T-SOD酶活性显著下调(P<0.05),而nrf2的mRNA表达水平和MDA含量显著增加(P<0.05)。而FRSM缓解了抗氧化系统相关基因表达和酶活的变化。由图5可知,FRSM对肠道抗氧化系统与肝脏有相似的变化,FRSM同样缓解了未发酵菜籽粕饲料导致的黄颡鱼肠道氧化应激相关基因和酶活的变化。
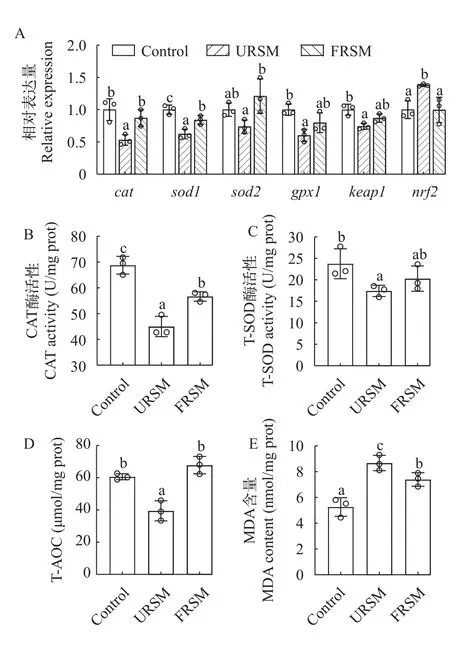
图4 发酵菜籽粕对黄颡鱼肝脏抗氧化系统的影响Fig.4 Effect of fermented rapeseed meal on antioxidant system in the liver of yellow catfish
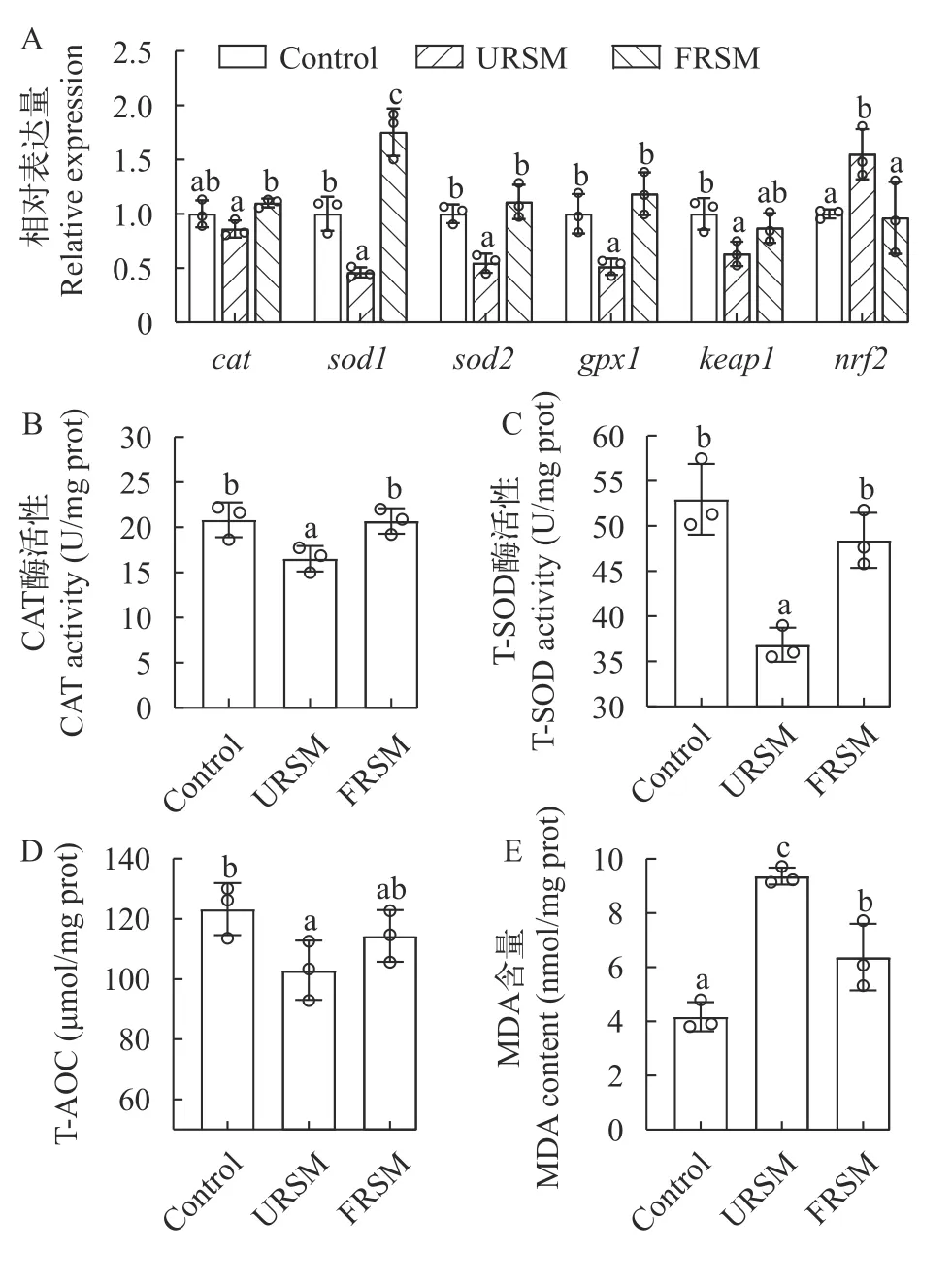
图5 发酵菜籽粕对黄颡鱼肠道抗氧化系统的影响Fig.5 Effect of fermented rapeseed meal on antioxidant system in the intestine of yellow catfish
2.6 肝脏和肠道细胞凋亡相关基因表达
由图6A可知,与对照组相比,URSM组饲料饲喂的黄颡鱼肝脏促凋亡基因(bax、caspase3、caspase9和mdm2)的表达水平显著上调(P<0.05),而bcl2的mRNA表达水平显著下调(P<0.05)。发酵菜籽粕饲料缓解了未发酵菜籽粕诱导的黄颡鱼肝脏细胞凋亡相关基因的变化。由图6B可知,FRSM组饲料同样缓解了菜籽粕诱导的黄颡鱼肠道bax、p53、caspase3、caspase9和mdm2表达水平的上调及bcl2表达的下调。
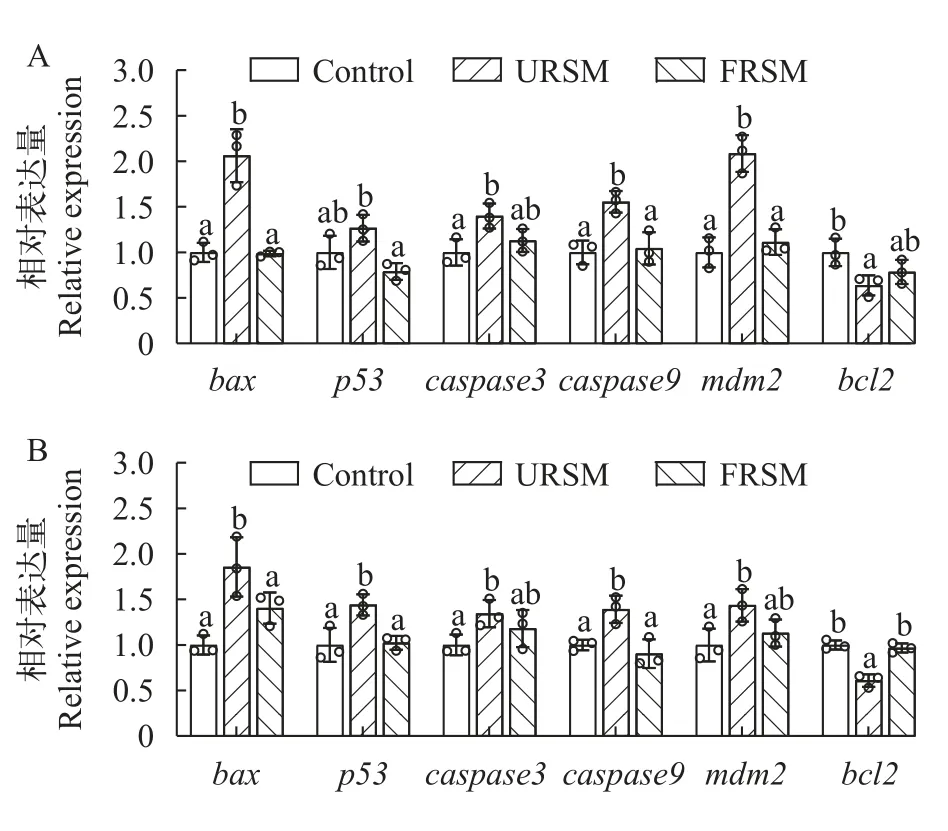
图6 发酵菜籽粕对黄颡鱼肝脏(A)和肠道(B)细胞凋亡相关基因表达的影响Fig.6 Effect of fermented rapeseed meal on gene expressions of apoptosis in the liver (A) and intestine (B) of yellow catfish
3 讨论
3.1 发酵菜籽粕对动物生长及表观消化率的影响
通过为期7周的养殖实验,可以看到FRSM组饲料促进了黄颡鱼的生长,提高了饲料利用率。在肉鸡饲养实验中,也观察到喂食FRSM的肉鸡的增重率及饲料系数明显高于未发酵菜籽粕组[9]。菜籽粕中含有大量硫甙、植酸和单宁等抗营养因子,这些有毒物质会影响动物生长性能及对营养物质的吸收利用[19,20]。有研究表明,饲料中过量硫甙会导致严重的生长抑制[3]。与未发酵菜籽粕组相比,发酵菜籽粕组的硫甙、植酸及单宁的抗营养因子含量得到明显降解。因此,发酵菜籽粕促进黄颡鱼的生长及饲料的利用可能和菜籽粕中有毒物质的降解有关。
养殖鱼类饲料的营养价值取决于单个饲料原料的营养成分及动物消化和吸收营养物质的能力[21]。在本研究中,黄颡鱼对发酵菜籽粕原料的干物质、蛋白质、脂肪及总能的表观消化率均高于URSM组。这与Chiang等[7]的研究结果一致,该研究发现饲喂发酵菜籽粕的肉鸡对能量和干物质的表观消化率高于未发酵菜籽粕。将发酵菜籽粕与未发酵菜籽粕作为试验原料添加至泥鳅(Misgurnus anguil-licaudatus)饲料中,结果也表明泥鳅对发酵菜籽粕的干物质及蛋白质的表观消化率较高[22]。表观消化率是判断动物饲料营养平衡的依据,能够在为目标鱼类设计的饲料中更准确地进行成分替代[23]。所以表观消化率测定是评价发酵菜籽粕在饲料中的使用价值的重要的第一步。豆粕经发酵后添加至饲料中,大口黑鲈(Micropterus salmoides)对饲料的干物质和蛋白质的表观消化率得到了显著增加,并且未对大口黑鲈的增重造成影响[17]。由此说明微生物发酵能促进鱼类对植物性蛋白源的表观消化率的增加,这可能是FRSM组黄颡鱼体重增加及饲料系数减少的另一个重要因素。
3.2 发酵菜籽粕对动物肝脏及肠道结构的影响
鱼类肝脏在几项重要功能的基础代谢中起着重要作用[24]。有研究表明,饲料中高含量的菜籽粕会抑制草鱼(Ctenopharyngodon idella)的生长,并对肝脏等内脏结构造成损害[25]。本研究同样发现FRSM组黄颡鱼肝脏组织出现明显病变,肝细胞空泡化现象严重。据报道,菜籽粕中的硫甙分解形成的腈类化合物会损害肝肾功能[26],这可能是未发酵菜籽粕对黄颡鱼肝脏造成损伤的原因之一。在本研究中,URSM组黄颡鱼的肝体比明显高于其他两组,这也进一步证实了肝脏组织学观察结果。在本研究中,FRSM组黄颡鱼肝脏组织的病变情况得到明显改善,空泡化的相对面积减少。通过对患脂肪肝的小鼠喂食发酵乳,8周后发现小鼠肝脏空泡化数量明显减少[27]。这说明菜籽粕可能通过微生物发酵降低菜籽粕中的抗营养因子含量,从而改善菜籽粕对黄颡鱼肝脏造成的损伤。
肠绒毛对营养的消化利用具有重要的功能,有利于增加酶活性和养分吸收[4]。在本实验中,URSM组降低了黄颡鱼肠绒毛高度,饲料中添加发酵菜籽粕缓解了这一变化。有研究发现,饲料中添加不超过10%的发酵菜籽粕时,肉鸡十二指肠和空肠黏膜的绒毛高度增加[8]。肠绒毛的高度和宽度是反映肠黏膜形态结构和功能完整性的最直接指标[14]。有研究表明,菜籽粕中的芥酸引起鱼类肠道充血和肠绒毛增生,破坏了草鱼肠道结构完整性[28]。由此可知,发酵菜籽粕可能通过降解抗营养因子缓解菜籽粕对黄颡鱼肠道结构的损伤,从而改善鱼体肠道健康。
紧密连接蛋白在鱼类肠道屏障中发挥着重要的作用[29]。在本研究中,发酵菜籽粕添加缓解了菜籽粕引起的zo-1和zo-2的mRNA表达下调。Occludin和Claudin-1是跨膜蛋白,Zo-1和Zo-2属于闭合小环蛋白,它们构成紧密连接复合体,选择性地阻止腔内物质自由进出[30]。有研究报道了菜籽粕中的抗营养因子会下调紧密连接相关基因的表达[28]。occludin、claudin-1、claudin-3和zo-2等紧密连接的下调会损害动物的肠道屏障[31]。这说明未发酵菜籽粕中过量的抗营养因子使黄颡鱼的肠道屏障功能受损。Laukoetter等[32]报道上调zo-1和occludin基因表达水平有利于小鼠肠屏障功能的恢复。由此说明,发酵菜籽粕可以通过增强黄颡鱼肠道细胞间的紧密连接,从而维持肠道屏障的完整性。
3.3 发酵菜籽粕对动物肝脏和肠道炎症及抗氧化能力的影响
研究表明屏障功能与炎症因子相关[14]。在本研究中,发酵菜籽粕缓解了菜籽粕诱导的黄颡鱼肝脏和肠道炎症因子相关基因的变化。同样,发酵饲料喂养断奶仔猪,空肠il-10、tgf-β表达水平显著上调[33]。tnf-α、tnf-β、il-1β和il-6是重要的促炎基因,而il-10和tgf-β作为抗炎基因在炎症控制中也发挥重要作用[34]。因此,本研究结果表明,未发酵菜籽粕具有促进肝脏和肠道炎症的特性,发酵菜籽粕激活了黄颡鱼的免疫反应基因。同样,Wang等[35]通过研究也发现发酵菜籽粕添加可以提高肉鸡免疫力。
鱼类的健康和免疫与抗氧化防御系统高度相关,屏障完整性受损可导致炎症因子泄漏到血液循环系统,从而引发应激反应或加重全身炎症反应[14]。在正常情况下,Nrf2与抑制蛋白Keap1结合形成Keap1-Nrf2复合物,应激时,Nrf2从Keap1释放并进入细胞核与抗氧化反应元件(ARE)结合,促进抗氧化相关基因的转录[36]。菜籽粕中的芥酸会诱导鱼肠道中Nrf2通路相关的氧化损伤[28]。在本实验中,添加未发酵菜籽粕黄颡鱼肝脏和肠道keap1mRNA表达水平下调和nrf2的mRNA表达水平上调,这说明未发酵菜籽粕导致黄颡鱼产生氧化应激。T-AOC代表生物体抵御ROS损伤的能力[37]。SOD是对抗氧自由基的主要防御系统之一[38]。在本研究中,未发酵菜籽粕饲喂的黄颡鱼的MDA水平升高,抗氧化防御标志物(CAT、T-SOD和T-AOC)水平下降,饲料中添加发酵菜籽粕显著缓解了菜籽粕导致的氧化应激反应。丙二醛是过氧化过程的最终产物[39]。使用菜籽粕与棉籽粕复合替代鱼粉的饲料饲喂黄颡鱼,结果发现替代水平达到20%后可明显增加黄颡鱼肌肉的MDA水平[40]。有研究表明发酵菜籽粕降低了MDA含量,并提高了T-AOC和T-SOD活性,因此发酵菜籽粕可以降低氧化损伤的风险[41]。另外,通过银鲑(Oncorhynchus kisutch)养殖实验发现,发酵豆粕替代10%鱼粉蛋白促进了肝脏抗氧化能力[42]。因此,本研究表明微生物发酵可以缓解菜籽粕导致的肝脏和肠道组织的氧化应激,从而促进黄颡鱼的生长。
3.4 发酵菜籽粕对动物肝脏及肠道凋亡相关基因表达的影响
氧化应激是促进细胞凋亡的重要因素,当氧化应激产生的ROS过量时,会诱导细胞发生凋亡[13]。在本研究中,URSM组黄颡鱼的促凋亡相关基因上调及bcl2基因下调。Bcl-2家族在细胞凋亡信号转导过程中起着重要作用,其表达和调控是影响细胞凋亡的关键因素[43]。其中,bcl2/bax比值是启动细胞凋亡的“分子开关”,下调bcl2或上调bax表达可促进细胞凋亡[44]。此外,bax和bcl2可以形成调节线粒体膜通透性的聚合物,引起细胞色素C释放,使Caspase活化,最终引起细胞凋亡[45]。p53蛋白激活可引起细胞周期阻滞、DNA修复和细胞凋亡,其活性主要受MDM2的抑制[46]。有研究表明菜籽粕中的芥酸会诱导草鱼细胞凋亡[28]。这说明未发酵菜籽粕中过量的抗营养因子可能会导致黄颡鱼产生过多ROS,从而诱导肝脏和肠道细胞凋亡。在本研究中,FRSM组饲料饲喂黄颡鱼缓解了细胞凋亡现象。有研究表明,发酵菜籽粕提取物能大大降低ROS的水平,从而可能减轻细胞凋亡[47]。来自酵母细胞壁的多糖具有高抗氧化活性[48]。因此,菜籽粕可能通过发酵降低其中的抗营养因子含量并提高相关多糖含量,从而缓解黄颡鱼肝脏和肠道细胞凋亡。
4 结论
综上所述,使用发酵菜籽粕替代未发酵菜籽粕添加至饲料中饲喂黄颡鱼,增加了黄颡鱼的生长性能和饲料利用率,提高了黄颡鱼对原料的干物质、蛋白质、脂肪和能量表观消化率,并且改善了菜籽粕引起的肝脏及肠道结构损伤、炎症反应、氧化损伤和细胞凋亡。由此可见,菜籽粕经发酵处理可减少其对黄颡鱼肝脏和肠道健康的不利影响,本实验不仅能够为黄颡鱼的养殖提供理论指导,而且有助于发酵菜籽粕在鱼类实际生产中的开发应用。
