金丝桃甙对百草枯诱导的大鼠急性肺损伤的保护作用
2024-02-13王卿语古春昱陈新军陕西省人民医院医学装备部陕西西安70068陕西省人民医院急诊内科陕西西安70068
武 卓,陈 乐,王卿语,古春昱,陈新军 (. 陕西省人民医院医学装备部,陕西 西安 70068;. 陕西省人民医院急诊内科,陕西 西安 70068)
百草枯(paraquat,PQ)是世界上最常用的除草剂之一,然而,全球每年都有大量民众死于百草枯中毒,肺是百草枯的主要损伤目标[1-2]。百草枯诱导的肺毒性与炎症、氧化应激、细胞凋亡和纤维化相关的各种机制途径有关[3],其中核因子红细胞2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)途径[4]、核因子-κB(nuclear factor-κB,NF-κB)途径[5]和转化生长因子-β(transforming growth factor-β1,TGF-β1)/Smad2/3途径[6]分别在百草枯诱导的氧化应激、炎症和纤维化中发挥调控作用。金丝桃甙(hyperoside,HYP)是一种存在于金丝桃属植物中的天然黄酮醇甙,分子量为464.38,分子式为C21H20O12,具有广谱的生物活性,包括抗炎、抗氧化、抗菌、抗病毒、器官保护等作用[7],还具有良好的抗心[8]、肝[9]、肾[10]纤维化作用。此外,金丝桃甙可减轻博来霉素诱导的小鼠肺纤维化[11]。推测金丝桃甙可能是一种防治百草枯诱导的肺损伤的天然药物。因此,本研究探讨金丝桃甙对百草枯致大鼠急性肺损伤的保护作用以及其可能的分子机制,现报道如下。
1 材料与方法
1.1 实验材料
20%百草枯溶液购自美国Syngenta 公司。金丝桃甙(纯度99.56%,批号:HY-N0452-62235)购自美国MedChemExpress 公司。苏木精-伊红(HE)染液(批号:20181107)购自南京建成生物工程研究所。Masson三色染色液(批号:20200418)购自北京索莱宝科技有限公司。白细胞介素(interleukin,IL)-1β ELISA 试剂盒(批号:20191016)购自北京普利莱基因技术有限公司。IL-6 ELISA 试剂盒(批号:20210604)购自派普泰克生物科技(苏州)有限公司。巨噬细胞炎性蛋白-2(macrophage inflammatory protin-2,MIP-2)ELISA 试剂盒(批号:20210923)购自上海乔羽生物科技有限公司。丙二醛(malondialdehyde,MDA)试剂盒(批号:0517191107)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(批号:0625201005)购自碧云天生物技术研究所。E-cadherin(批号:20180503)、α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA;批号:20100822)、Vimentin(批号:20200415)、GAPDH(批号:20190607)一抗购自美国Cell Signaling Technology 公司。Nrf2(批号:190416)、NF-κB p65(批号:201209)、p-NF-κB p65(批号:191106)、TGF-β1(批号:180828)、Smad3(批号:210305)、p-Smad3(批号:210417)一抗及HRP 偶联的IgG二抗(批号:180624)购自英国Abcam公司。
1.2 实验动物
SPF 级雄性SD 大鼠,7 周龄,体质量220~250 g,购自陕西师范大学[生产许可证号:SCXK(陕)2021-002]。饲养环境:温度(23±2)℃,湿度(55±5)%,12 h 光暗循环。饲养期间不限制饮食。本研究通过我院医学伦理委员会批准(2021-10-D07)。
1.3 大鼠分组及处理
将大鼠随机分为对照组、PQ 组、低剂量金丝桃甙组(HYP-L 组)、中剂量金丝桃甙组(HYP-M 组)和高剂量金丝桃甙组(HYP-H组),每组12只。对照组大鼠一次性灌胃蒸馏水1 mL,其他组大鼠分别一次性灌胃1 mL 百草枯(终使用剂量为50 mg/kg)。灌胃30 min后,对照组和PQ 组大鼠灌胃2%二甲基亚砜(DMSO)1 mL;参考文献[9,12],HYP-L 组、HYP-M 组和HYP-H组大鼠分别灌胃金丝桃甙100 mg/kg、200 mg/kg 和400 mg/kg,每天1次,共7 d。
1.4 大鼠支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中IL-1、IL-6和MIP-2的测定
治疗7 d 后,大鼠左气管插管,PBS 灌洗肺3 次,收集BALF,于4 ℃下以1500 r/min 离心15 min,取上清。通过ELISA 法测定BALF 中IL-1、IL-6 和MIP-2 的水平。
1.5 大鼠肺组织中SOD和MDA的测定
治疗7 d 后,采用3%戊巴比妥钠麻醉大鼠,开胸取两侧肺,右肺研磨制备匀浆,于4 ℃下以3 000 r/min离心10 min,取上清。按照试剂盒说明书检测肺组织中SOD和MDA的水平。
1.6 大鼠肺组织学染色
用4%多聚甲醛固定大鼠左肺,常规制备4 µm 厚的石蜡切片。通过HE 染色观察肺组织形态,通过Masson 三色染色观察肺纤维化情况,并进行纤维化评分[13]。
1.7 免疫组织化学染色
大鼠肺组织切片脱蜡和再水化后,用3%过氧化氢室温孵育15 min,0.01 mol/L 柠檬酸盐缓冲液(pH 6.0)煮沸15 min,5%BSA 和0.03%Triton X-100室温封闭30 min。将切片在4 °C 下与Nrf2、p-NF-κB p65 和TGF-β1一抗(1∶500)孵育过夜。然后,将切片在37 °C下与HRP 偶联的IgG 二抗(1∶500)孵育30 min。DAB显色,苏木素复染。在Olympus BX51光学显微镜下观察并拍照。使用Image-Pro Plus 6.0 软件检测积分光密度(integral optical density,IOD)值。
1.8 Western blot检测
使用RIPA 裂解液和BCA 试剂盒分离和测定大鼠肺组织总蛋白。各组取等量的蛋白质(60 µg)经10%SDS-PAGE 电泳分离并转移到PVDF 膜。室温下用5%脱脂牛奶封闭1 h 后,将膜在4 ℃下与E-cadherin(1∶2 000)、α-SMA(1∶2 000)、Vimentin(1∶1 000)、Nrf2(1∶1 000)、NF-κB p65(1∶3 000)、p-NF-κB p65(1∶3 000)、TGF-β1(1∶5 000)、Smad3(1∶5 000)、p-Smad3(1∶5 000)和GAPDH(1∶3 000)一抗孵育过夜。随后在室温下将膜与HRP 偶联的IgG 二抗(1∶2 000)孵育1 h。免疫条带用ECL 试剂盒显影。用Image J 软件分析灰度值,GAPDH作为内参蛋白。
1.9 统计学分析
数据使用SPSS 22.0 统计软件分析处理。计量数据以均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 金丝桃甙抑制百草枯诱导的大鼠肺部炎症反应
与对照组比较,PQ 组大鼠BALF 中IL-1β、IL-6 和MIP-2 水平升高(P<0.05);与PQ 组比较,HYP-L 组、HYP-M 组和HYP-H 组大鼠BALF 中IL-1β、IL-6 和MIP-2 水平降低(P<0.05),变化趋势具有金丝桃甙剂量依赖性(P<0.05),见表1。
表1 大鼠BALF中IL-1β、IL-6和MIP-2水平(,n=12,nmol/L)
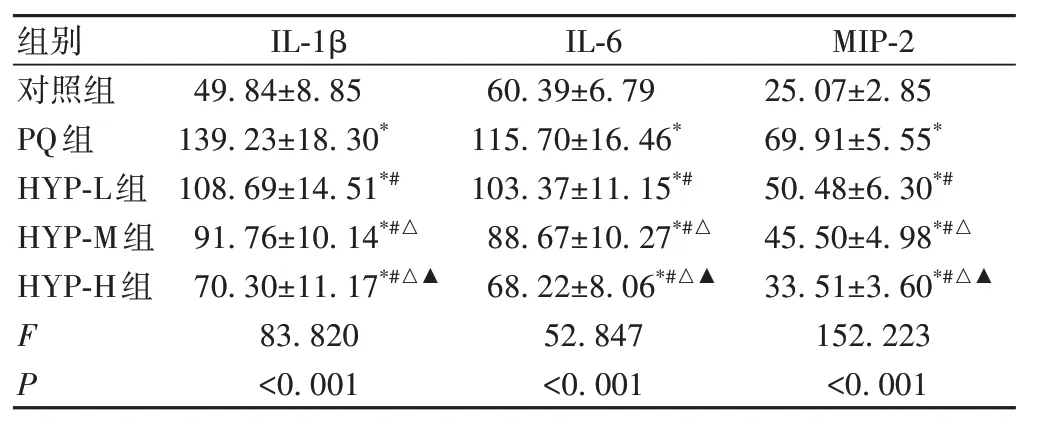
表1 大鼠BALF中IL-1β、IL-6和MIP-2水平(,n=12,nmol/L)
*:与对照组比较,P<0.05;#:与PQ组比较,P<0.05;△:与HYP-L组比较,P<0.05;▲:与HYP-M组比较,P<0.05
?
2.2 金丝桃甙抑制百草枯诱导的大鼠肺部氧化应激反应
与对照组比较,PQ组大鼠肺组织中SOD水平降低(P<0.05),MDA 水平升高(P<0.05);与PQ 组比较,HYP-L 组、HYP-M 组和HYP-H 组大鼠肺组织中SOD水平升高(P<0.05),MDA 水平降低(P<0.05),变化趋势具有金丝桃甙剂量依赖性(P<0.05),见表2。
表2 大鼠肺组织中SOD和MDA水平(,n=12)

表2 大鼠肺组织中SOD和MDA水平(,n=12)
*:与对照组比较,P<0.05;#:与PQ组比较,P<0.05;△:与HYP-L组比较,P<0.05;▲:与HYP-M组比较,P<0.05
?
2.3 金丝桃甙减轻百草枯诱导的大鼠肺损伤和纤维化
HE 染色结果显示,对照组大鼠肺组织形态正常;PQ组大鼠肺组织出现肺泡出血,肺泡壁断裂、增厚、间隔水肿,出现明显炎症细胞浸润等病变;HYP-L 组、HYP-M组和HYP-H组大鼠肺组织损伤程度较PQ组减轻,见图1a。Masson 三色染色结果显示,对照组大鼠肺组织无纤维化;PQ 组大鼠肺组织出现明显纤维化;HYP-L组、HYP-M组和HYP-H组大鼠肝组织纤维化程度较PQ 组减轻,见图1a。各组大鼠肺组织纤维化评分结果显示,与对照组比较,PQ 组大鼠肺组织纤维化评分升高(P<0.05);与PQ 组比较,HYP-L 组、HYP-M组和HYP-H组大鼠肺组织纤维化评分降低(P<0.05),见图1b。

图1 大鼠肺组织HE染色和Masson三色染色
2.4 金丝桃甙抑制百草枯诱导的大鼠肺组织上皮-间质转化(epithelial-mesenchymal transition,EMT)过程
与对照组比较,PQ 组大鼠肺组织中E-cadherin 的表达水平降低(P<0.05),α-SMA 和Vimentin 的表达水平升高(P<0.05);与PQ 组比较,HYP-L 组、HYP-M 组和HYP-H组大鼠肺组织中E-cadherin的表达水平升高(P<0.05),α-SMA 和Vimentin 的表达水平降低(P<0.05),见图2。
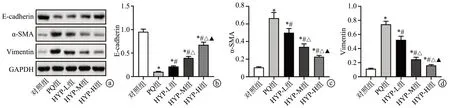
图2 Western blot检测大鼠肺组织中E-cadherin、α-SMA和Vimentin的表达水平
2.5 金丝桃甙激活百草枯诱导的大鼠肺组织Nrf2信号通路并抑制NF-κB和TGF-β1/Smad2/3信号通路
与对照组比较,PQ组大鼠肺组织中Nrf2的蛋白表达水平降低(P<0.05),TGF-β1 的蛋白表达水平以及NF-κB p65 和Smad3 蛋白的磷酸化水平均升高(P<0.05);与PQ组比较,HYP-L组、HYP-M组和HYP-H组大鼠肺组织中Nrf2 的蛋白表达水平升高(P<0.05),TGF-β1 的蛋白表达水平以及NF-κB p65 和Smad3 蛋白的磷酸化水平均降低(P<0.05),见图3。
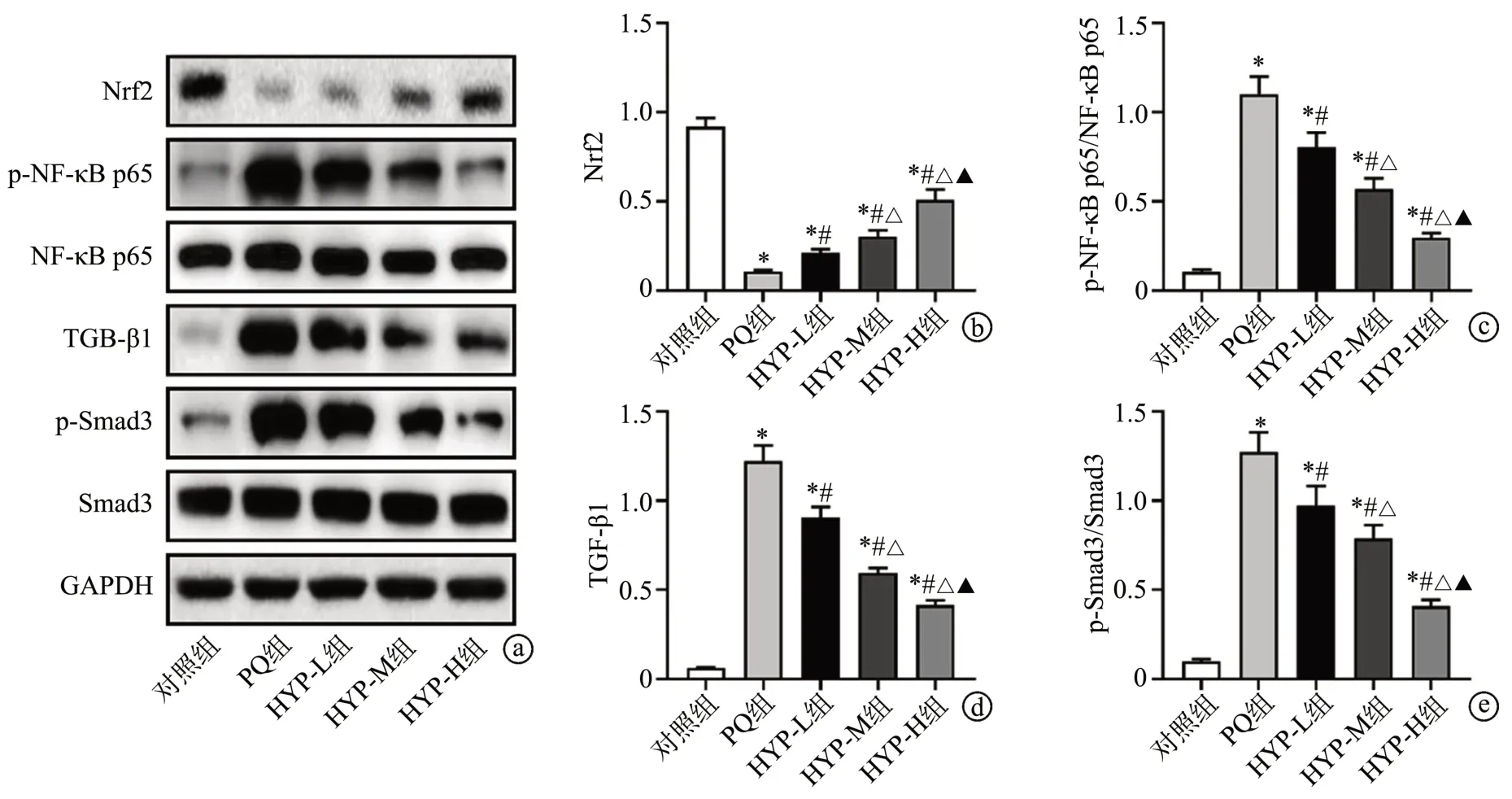
图3 Western blot检测大鼠肺组织中Nrf2、p-NF-κB p65、NF-κB p65、TGF-β1、p-Smad3和Smad3的蛋白表达水平
与对照组比较,PQ 组大鼠肺组织中Nrf2的IOD 值降低(P<0.05),p-NF-κB p65 和TGF-β1 的IOD 值均升高(P<0.05)。与PQ 组比较,HYP-L 组、HYP-M 组和HYP-H 组大鼠肺组织中Nrf2 的IOD 值升高(P<0.05),p-NF-κB p65 和TGF-β1 的IOD 值均降低(P<0.05),见图4。

图4 免疫组化染色检测大鼠肺组织中Nrf2、p-NF-κB p65和TGF-β1的蛋白表达
3 讨论
本研究使用3个剂量(100、200、400 mg/kg)的金丝桃甙治疗百草枯诱导的肺纤维化大鼠模型,结果显示,金丝桃甙呈剂量依赖性地减轻了百草枯诱导的大鼠肺损伤和纤维化,提示金丝桃甙可能是一种治疗百草枯中毒的天然药物。有研究报道,金丝桃甙具有对心肌[8]、肝[9]、肾[10]和肺[11]的抗纤维化作用。结合本研究结果可知,金丝桃甙可能是一种良好的抗纤维化天然药物,具有较高的研究开发价值。
过度的氧化应激和炎症反应是百草枯诱导肺损伤和纤维化的重要病理过程[14-15]。本研究结果显示,金丝桃甙上调了大鼠肺组织中抗氧化酶SOD 水平,下调了膜脂质氧化产物MDA水平,有效缓解了百草枯诱导的肺氧化应激。此外,金丝桃甙下调了大鼠BALF中炎症细胞因子IL-1β[16]和IL-6[17]以及炎症细胞趋化因子MIP-2[18]水平,抑制了炎症反应。因此,金丝桃甙可能通过抑制氧化应激和炎症反应减轻百草枯诱导的肺损伤和纤维化。
EMT 在百草枯诱导的肺纤维化中起着至关重要的作用[19]。百草枯可增强大鼠肺组织中EMT 标志物的表达,包括α-SMA 和Vimentin[19]。有研究报道,金丝桃甙可抑制EMT 过程[11]。本研究结果显示,金丝桃甙上调了大鼠肺组织中E-cadherin 的表达水平,下调了α-SMA 和Vimentin 的表达水平,有效抑制了肺组织EMT。
Nrf2是一种可调节抗氧化系统组成成分的转录因子,在活性氧(reactive oxygen species,ROS)清除中起着关键作用。虽然百草枯可诱导Nrf2 的激活和抗氧化相关基因的转录,但内源性Nrf2 的激活不足以消除百草枯诱导的细胞损伤[14],并且百草枯仅在3 h 内诱导Nrf2 的表达,随着中毒时间的延长,Nrf2 的活性降低[20]。因此,寻找新的依赖于Nrf2 的抗氧化剂是百草枯新药研发的关键。本研究结果显示,金丝桃甙诱导了大鼠肺组织中Nrf2 的表达,提示金丝桃甙可能通过激活Nrf2 信号通路清除ROS,从而减轻百草枯诱导的氧化应激。目前,金丝桃甙激活Nrf2 信号通路的作用已被广泛报道,本研究观点与之一致[21-23]。
NF-κB信号通路在百草枯诱导的肺损伤和炎症中起重要作用。据报道,百草枯诱导IκB 家族的抑制蛋白IκBα 降解和磷酸化,从而增加肺组织中NF-κB p65的水平[24]。此外,NF-κB 信号通路的激活与百草枯触发的ROS 的产生有关[15]。本研究结果显示,金丝桃甙抑制了大鼠肺组织NF-κB 信号通路的活化,进而减轻了炎症反应。目前,金丝桃甙抑制NF-κB 信号通路的作用也已被广泛报道[25-26]。
TGF-β/Smad 信号通路是抗肺纤维化治疗的有效靶点,已被证明在体内和体外参与百草枯诱导的EMT[19],其通过调节EMT 诱导纤维化[27]。有研究表明,金丝桃甙通过抑制TGF-β1/Smad通路减轻大鼠肝纤维化[9]。本研究结果显示,金丝桃甙抑制了大鼠肺组织TGF-β1/Smad2/3 信号通路的激活,从而抑制了百草枯诱导的大鼠肺纤维化。
综上,金丝桃甙可有效减轻百草枯诱导的大鼠急性肺损伤,其可能是通过调节Nrf2、NF-κB 和TGF-β1/Smad2/3信号通路减轻肺部氧化应激、炎症和纤维化。