BMP7 过表达慢病毒载体构建及其对小鼠主动脉平滑肌细胞钙化的影响
2024-02-13付仕林易雪娇潘文旭康华利钱德慧陆军军医大学第二附属医院心血管内科重庆400037
付仕林,易雪娇,潘文旭,尹 纯,康华利,钱德慧 (陆军军医大学第二附属医院心血管内科,重庆 400037)
近年来,血管外科和介入手术飞速发展,大大优化了狭窄和闭塞性血管疾病的治疗。但合并血管钙化严重影响了上述治疗的效果,同时增加了术后血栓形成风险[1]。传统观念认为血管钙化是被动退化过程,近年来发现血管钙化与骨形成相似,是血管壁微环境内主动可调控的细胞介导过程。多种细胞如血管平滑肌细胞(vascular smooth muscle cells,VSMCs)、内皮细胞、巨噬细胞等参与了血管钙化的发生发展,也包括细胞间对话调节[2],其中VSMCs 向成骨细胞样表型转化是这一过程的核心环节[3]。有研究发现,内皮细胞Jagged1 在抑制VSMCs 向其他表型转化方面具有重要作用[4],而骨形态发生蛋白7(bone morphogenetic protein7,BMP7)是促进VSMCs向成骨表型转化的关键因子[5]。同时,在成骨细胞中BMP7可通过下游信号转导蛋白抑制Jagged1 蛋白表达[6]。因此,我们推测内皮细胞Jagged1 可能是BMP7 调控VSMCs 钙化的中间分子。本研究采用基因重组方法,构建BMP7 过表达慢病毒载体,分析BMP7 过表达对小鼠主动脉内皮细胞Jagged1 表达的影响及其对共培养VSMCs 钙化的影响,以期为血管钙化的机制研究提供新的思路。
1 材料与方法
1.1 材料与试剂
20 只2~3 周龄SPF 级KM 小鼠购自陆军军医大学实验动物中心,实验动物生产许可证号:SCK(渝)20170002。胎牛血清、DMEM 培养基购自美国Gibco公司;RNAiso plus,DH5α 感受态,核酸内切酶BamHⅠ、XholⅠ购自日本TaKaRa 公司;质粒小量抽提试剂盒购自美国Omega 公司;Hifair®Ⅱ 1st Strand cDNASynthesis Kit (gDNA digester plus)、Hieff UNICON®Universal Blue QPCR SYBR Green Master Mix 购自上海YEASEN公司。Jagged1抗体(兔来源)购自英国Abcam公司,HRP 标记山羊抗兔IgG 二抗购自上海碧云天公司。
1.2 方法
1.2.1 小鼠主动脉内皮细胞原代培养及鉴定 参考Kobayashi 等[7]的方法并改良,将10 只KM 小鼠采用颈椎脱臼法快速处死后消毒,在无菌操作台上分离完整的主动脉,剥离主动脉血管周围的脂肪组织以及血管外膜,PBS 反复冲洗后,将主动脉切成大小为1 mm×1 mm的组织块,并内膜朝下均匀种植在多聚赖氨酸包被后的6孔培养皿上;于37 ℃、5%CO2细胞培养箱中静置培养3 d 后换液;待组织块周围爬出的细胞达到培养皿底面积80%后,用0.25%的胰酶消化传代。通过检测CD31 的方法,免疫组化染色后荧光显微镜下观察鉴定血管内皮细胞。本实验使用的是第3代细胞。
1.2.2 小鼠主动脉VSMCs 原代培养及鉴定 参考郝思雨等[8]的方法进行VSMCs 原代培养及鉴定。按1.2.1中的方法分离10 只KM 小鼠主动脉后,使用显微弹簧剪沿血管纵轴剪开主动脉,用显微镊子剔除血管外膜层,再翻转至内侧轻轻刮去血管内膜层。用PBS冲洗血管中膜层,眼科剪将组织剪至1 mm×1 mm×1 mm 大小。用胶原蛋白酶Ⅰ消化30 min 后,加入5 mL含10%胎牛血清的DMEM 培养基吹散细胞,移入培养瓶,于37 ℃、5%CO2细胞培养箱中静置培养3 d 后换液。待组织块细胞长满培养皿底面积80%后,用0.25%的胰酶消化传代。通过检测α-SMA 的方法,免疫组化染色后荧光显微镜下观察鉴定VSMCs。本实验使用的是传代至第3代的细胞。
1.2.3 BMP7 过表达慢病毒载体构建 根据目的基因信息Mouse-BMP7(NM_007557.3)进行序列合成,5'端加上限制性核酸内切酶位点XholⅠ,3'端加上限制性核酸内切酶位点BamH Ⅰ,并将其连入载体pLVX-zsGreen-C1 中(图1)。将合成质粒转化感受态细胞,从平板上挑取克隆菌落,小量抽提质粒并进行鉴定挑出阳性克隆。分别利用限制性核酸内切酶BamHⅠ、XholⅠ双酶切提取的质粒,将酶切产物进行1%琼脂糖电泳,切下片段与目的DNA 大小一致的质粒载体,命名为Mouse-BMP7-pLVX-zsGreen-C1,送上海生工测序鉴定。

图1 质粒信息
1.2.4 慢病毒包装纯化和滴度测定 制备慢病毒穿梭质粒及其辅助包装原件载体质粒,组成为pLVXIRES-ZsGreen1、psPAX2、pMD2. G。其中穿梭质粒pLVX-IRES-ZsGreen1上携带有CMV启动的目的基因,且能表达绿色荧光蛋白筛选标记基因;psPAX2、pMD2.G 含有病毒包装所必须的元件。3 种质粒载体分别进行高纯度无内毒素大量抽提,共转染人胚肾细胞293T细胞,转染后16~24 h更换为完全培养基,继续培养48 h 后,多次收集富含慢病毒颗粒的细胞上清液;最后,Amicon Ultra-15 100 kDa 对上清液进行浓缩处理,得到高滴度的慢病毒浓缩液,于-80 ℃冰箱保存备用。通过荧光显微镜或FACS 计数荧光细胞,结合稀释倍数计算病毒滴度。
1.2.5 BMP7 过表达慢病毒感染 在原代培养的第3 代小鼠主动脉内皮细胞上应用制备完成的BMP7过表达慢病毒感染48~96 h 后,通过荧光显微镜检查荧光蛋白表达的情况,以此估算慢病毒对目标细胞的感染效率。提取感染后细胞的RNA,先用随机引物将RNA 反转录成cDNA,随后用qPCR 法对BMP7 过表达慢病毒的感染效率进行检测。内参和目的基因引物如下:GAPDH-F 为GGCAAGTTCAACGGCA CAG,GAPDH-R 为CGCCAGTAGACTCCACGACAT;BMP7-F 为CAGCCAGAATCGCTCCAAGA,BMP7-R 为TGCAATGATCCAGTCCTGCC。
1.2.6 Western blot 检测Jagged1蛋白 设置3组细胞实验:正常内皮细胞为正常对照组,内皮细胞+BMP7 过表达慢病毒感染为BMP7 过表达组,内皮细胞+慢病毒空载体为空载体对照组,每组重复3次。各组细胞裂解后,转移到1.5 mL 离心管中剧烈振荡30 s后放入离心机,于4 ℃下以12 000 r/min 离心15 min,吸取上清液用BCA 法测定蛋白浓度,取等量预处理的蛋白样品上样进行SDS-PAGE 电泳,恒流200 mA 电转1 h至PVDF 膜,5%脱脂奶粉-PBST 室温封闭1 h后,加入Jagged1 和内参GAPDH 一抗,于4 ℃孵育过夜。用山羊抗兔IgG 二抗37 °C 温育1 h。按照ECL 发光试剂盒的说明进行操作,并使用凝胶成像装置进行曝光和拍照。
1.2.7 内皮细胞和VSMCs 共培养体系建立与诱导钙化 参照Fillinger 等[9]的方法建立间接共培养体系。将1.2.6 中3 组细胞分别接种于Transwell 膜上,同时将VSMCs接种于6孔培养板的底部。加入钙化培养基(10 mmol/L β-磷酸甘油、1×10-7mol/L 胰岛素及50 µg/L维生素C)以诱导主动脉VSMCs 钙化,继续培养14 d,每2~3 d 更换培养液。最后用茜素红染色检测VSMCs的钙化情况。每组3 枚盖玻片置入6 孔培养板制备小鼠主动脉VSMCs 爬片。4 ℃冲洗液洗涤细胞爬片2 次,冰丙酮固定20~30 min 后取出。每个VSMCs 爬片加入10 g/L 的茜素红S 试剂(pH=6.3),室温下染色5~10 min,用蒸馏水冲洗1~2 次后,显微镜下观察染色效果。用紫外可见分光光度计测定562 nm 波长处的光密度(optical density,OD)值。
1.3 统计学分析
使用SPSS 26.0 软件进行数据的统计学分析,呈正态分布且方差齐性的数据2组间比较采用t检验,否则采用校正t检验或秩和检验,多组间比较使用单因素方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 小鼠主动脉内皮细胞及VSMCs培养及鉴定
将分离培养的第3代内皮细胞及VSMCs经免疫组化后在荧光显微镜下观察发现,分离的细胞为内皮细胞及VSMCs,且纯度均在95%以上。
2.2 BMP7过表达慢病毒载体酶切鉴定
分别利用限制性核酸内切酶BamHⅠ、XholⅠ酶切重组质粒,将酶切产物电泳,电泳结果见图2;基因测序证实酶切的重组质粒为实验所需的BMP7 过表达慢病毒载体。

图2 BMP7过表达慢病毒载体酶切鉴定结果
2.3 BMP7过表达慢病毒感染细胞荧光鉴定
荧光显微镜观察结果显示,空载病毒与BMP7 过表达慢病毒均成功转染至小鼠主动脉内皮细胞,其转染效率分别约为70%和30%(图3)。
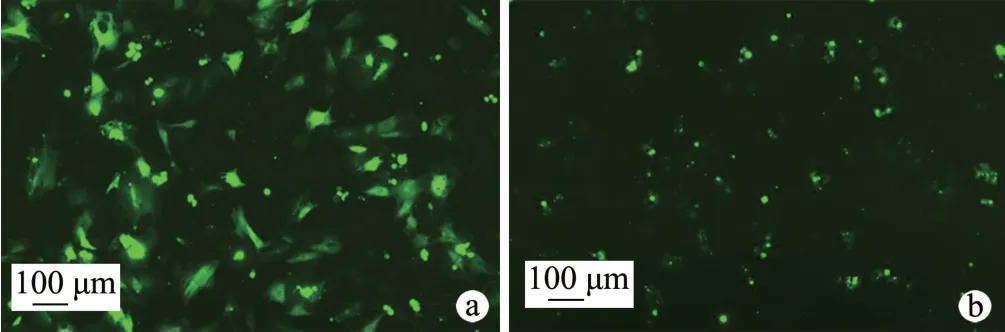
图3 BMP7过表达慢病毒感染细胞与空载病毒感染细胞观察
2.4 BMP7 过表达慢病毒感染主动脉内皮细胞后BMP7 mRNA变化
qPCR 检测结果显示,与正常对照组比较,BMP7过表达组的BMP7 mRNA 相对表达量显著升高(P<0.01),空载体对照组BMP7 mRNA 无显著变化(P>0.05),见图4。

图4 各组mRNA相对表达量
2.5 BMP7 过表达慢病毒感染主动脉内皮细胞后Jagged1蛋白表达变化
Western blot 检测结果显示,与正常对照组比较,BMP7 过表达组的Jagged1 蛋白表达水平明显降低(P<0.01),而空载体对照组的Jagged1 蛋白表达水平无明显差异(P>0.05),见图5。
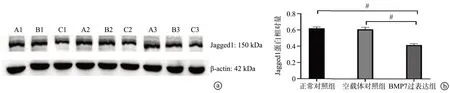
图5 Western blot检测小鼠主动脉内皮细胞Jagged1蛋白的表达
2.6 BMP7 过表达内皮细胞对共培养VSMCs 钙化的影响
茜素红染色结果显示,与感染BMP7 过表达慢病毒的内皮细胞共培养后,BMP7 过表达组VSMCs 的钙化程度较正常对照组和空载体对照组均明显增加(P<0.01),见图6。
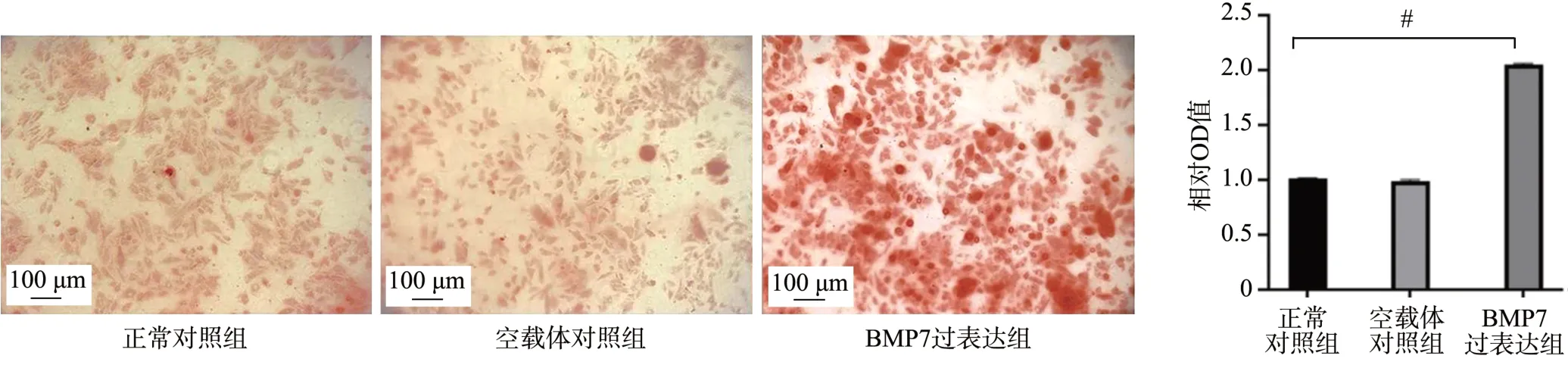
图6 各组茜素红染色情况
3 讨论
VSMCs 向成骨细胞样表型转化包括VSMCs 收缩表型标志物表达降低和成骨细胞标志物表达增高的演化过程,是血管钙化的核心环节[3]。在高龄动脉血管壁中,BMP-Smads、Wnt/β-catenin、Notch、Hedgehog等骨形成关键信号通路的激活以及钙调蛋白、骨保护素等抑制钙化因子的丢失会促使VSMCs 向成骨样表型转化[10]。在老年人主动脉中层及高龄小鼠主动脉VSMCs 中均发现成骨标志物蛋白高表达,同时VSMCs收缩表型标志物明显降低[11]。因此,血管的钙化与VSMCs的成骨细胞样表型转化密切相关。
既往研究提示,BMP7 在血管钙化中可能发挥关键作用。首先,BMP7 通过调节血管相关多能祖细胞的表型可塑性来调节血管钙化[12]。在钙化性动脉粥样硬化标本中,BMP7表达上调最为显著[13]。我们前期研究也发现,衰老可以通过下调miR542-3p 增加其靶基因BMP7 的表达,从而发挥促进VSMCs 向成骨细胞样表型转化的作用[14],而上调BMP7 是如何导致VSMCs向成骨细胞样表型转化的机制尚不明确。
本实验成功构建了小鼠BMP7 过表达慢病毒载体并感染至小鼠主动脉内皮细胞。qPCR 检测结果提示:转染BMP7 过表达慢病毒的小鼠主动脉内皮细胞中BMP7 mRNA 的表达水平显著上调。Notch 信号通路在血管的发生发展中发挥了较为重要的调控作用[15]。血管壁组织中的Notch 信号系统包括Notch 受体(Notch1~4)和配体(Jagged1、2 和DLL1、3、4)等,其中Jagged1是主要分布在内皮细胞的Notch配体[16]。既往研究表明,在多种细胞中BMP7 可通过下游信号转导蛋白抑制Jagged1 蛋白的表达[6,17]。本研究也观察到BMP7 过表达慢病毒转染的内皮细胞中Jagged1 蛋白表达水平明显降低。因此,Jagged1可能是内皮细胞中BMP7的下游信号分子。
本研究还发现,感染BMP7 过表达慢病毒的内皮细胞与VSMCs 共培养后,VSMCs 的钙化程度增加了2倍。内皮细胞调控VSMCs功能主要通过细胞间直接接触和旁分泌作用实现。有研究发现,Jagged1-Notch3通路是内皮细胞和VSMCs 间交流的关键信号通路[18]。细胞间调控可激活VSMCs 的Notch3 信号并维持其收缩表型,减少其向成骨细胞样表型转化。提示上调内皮细胞BMP7 表达,可降低其Jagged1 表达,并促进共培养体系中VSMCs的钙化。
综上所述,本研究成功构建了BMP7 过表达慢病毒载体并感染至小鼠主动脉内皮细胞。在细胞实验中,我们发现上调小鼠主动脉内皮细胞BMP7 的表达后,其Jagged1 的表达降低,并促进了共培养体系中VSMCs 的钙化。但目前只是内皮细胞调控VSMCs 钙化分子机制的初步探索,内皮细胞Jagged1究竟是通过何种途径影响VSMCs钙化尚需进一步研究。