关节腔内注射脂肪干细胞对颞下颌关节骨关节炎模型兔关节软骨破坏的修复作用及其机制
2024-02-12李男男帕丽孜阿不力克木吴国民
何 静, 孙 高, 李男男, 帕丽孜·阿不力克木, 吴国民
(1. 吉林大学口腔医院口腔颌面外一科与口腔整形美容外科,吉林 长春 130021; 2. 吉林大学口腔医院吉林省牙发育及颌骨重塑与再生重点实验室,吉林 长春 130021)
颞下颌关节骨关节炎(temporomandibular joint osteoarthritis,TMJOA)是一种慢性退行性病变,主要临床特点是颞下颌关节疼痛、畸形和功能障碍, 严重影响患者的生活质量[1-2]。 目前TMJOA 的临床治疗方法主要包括保守治疗(药物、物理治疗和咬合稳定板)、微创治疗(腔内注射药物)和手术治疗(关节置换和骨软骨移植)[3],但保守治疗只能缓解症状,不能阻止病变进一步发展,而手术治疗创伤大且风险高,因此关节腔内注射药物治疗受到关注[4-5]。 间充质干细胞(mesenchymal stem cells,MSCs) 是多能祖细胞,来源于多种组织,包括骨髓、肌肉、脂肪、牙髓和血液等,通过软骨分化、纤维软骨再生、免疫调节和抗炎等多种机制发挥治疗作用[4]。多项研究[6-7]表明:MSCs 对于修复骨关节炎的软骨及软骨下骨破坏具有积极作用。脂肪干细胞(adipose derived stem cells,ADSCs) 具备来源广泛、取材方便和创伤小等优点,近年来越来越受到研究者的重视[8]。有研究者[9]将ADSCs 与软骨细胞体外共培养,结果显示:细胞中Ⅱ型胶原、聚集蛋白聚糖和SRY 相关高迁移率族盒基因9(SRY-related high mobility group box gene 9,SOX9) 表达水平明显升高,而白细胞介素1β(interleukin-1β,IL-1β)促进活性氧和炎症因子水平升高的作用得到抑制,在体内实验中也证实ADSCs 可以降低骨关节炎(osteoarthritis,OA) 大鼠炎症因子水平,进而修复软骨破坏。目前,越来越多的研究者将ADSCs应用于临床试验,LEE 等[10]将ADSCs 单次注射至膝关节骨关节炎(knee osteoarthritis,KOA)患者的关节腔中,6 个月后ADSCs 组患者软骨损伤无明显变化,生理盐水注射组患者的软骨损伤加重。多项研究[11-14]表明:ADSCs 对OA 治疗有积极作用。但目前的研究大多针对KOA,而采用ADSCs治疗TMJOA 鲜有报道。为探讨关节腔内注射ADSCs 对TMJOA 软骨的影响,本研究采用碘乙酸钠(monosodium iodoacetate,MIA) 注射法制备兔TMJOA 模型,观察关节腔内注射ADSCs 对OA 状态下颞下颌关节软骨破坏的修复作用,并阐明ADSCs 修复TMJOA 的可能机制,为TMJOA的干细胞疗法提供理论依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器5 月龄清洁级新西兰纯种雄性白兔27 只,体质量2.0~3.0 kg,由吉林大学实验动物中心提供,实验动物使用许可证号:SYXK (吉) 2018-0001。实验动物处置符合动物伦理学标准。DMEM 培养液(美国Hyclone 公司),Ⅰ型胶原酶(苏州新赛美生物科技有限公司),胎牛血清(江苏沪酶生物技术有限公司),兔链霉卵白素-生物素法检测试剂盒(北京中杉金桥生物有限公司),SOX9 抗体(批号:67439-1-Ig)、基质金属蛋白酶13 (matrix metalloproteinase-13,MMP-13)抗体(批号:18165-1-AP)和血管内皮生长因子 (vascular endothelial growth factor,VEGF)抗体(批号:19003-1-AP,武汉三鹰生物技术有限公司)。生物安全柜和旋转石蜡切片机(美国Thermo Scientific 公司),显微CT (Micro-CT)系统(瑞士Scanco Medical AG 公司),生物组织自动包埋机(TB-718E 型,湖北维泰医药科技有限公司),流式细胞仪(美国BD 公司)。
1.2 动物分组及ADSCs 的分离和培养27 只实验兔随机分为对照组、模型组和ADSCs 组,每组9 只。ADSCs 组兔肌肉注射麻醉后,在颈后方做长约4 cm 的正中切口,取出脂肪组织约5 mL,去除脂肪周围组织,将脂肪组织切碎,用0.1% Ⅰ型胶原酶37 ℃水浴中消化1 h,每10 min 摇动1 次。1 500 r·min-1离心5 min,弃上清,重悬,转移至37 ℃、5% CO2饱和湿度培养瓶中。于37 ℃和5% CO2饱和湿度条件下孵育细胞。当细胞生长至80%~90%时传代,24 h 后第一次换液,后每3 d换液1次。
1.3 流式细胞术检测ADSCs 表面标志物取第3 代ADSCs,胰酶消化,培养基中和后收集到离心管中,离心去上清,加入多聚甲醛固定30 min 后收集ADSCs,分装到EP 管。再离心去上清,加入100 μL 相应抗体(CD34、CD45、CD29 和CD44),孵育30 min,PBS 缓冲液冲洗,离心去上清,加入PBS 缓冲液重悬细胞、过滤,采用流式细胞仪检测ADSCs 中CD34、CD45、CD29 和CD44 的表达情况,以阳性和阴性结果表示。
1.4 TMJOA 动物模型制备模型组和ADSCs 组兔制备TMJOA 模型。全麻下,助手托住兔子上下颌模拟开口和闭口,此时用手指触诊颞下颌关节区,感受髁突运动和关节腔位置。回抽无血后模型组和ADSCs 组兔各注射0.2 mL MIA;对照组兔注射等量生理盐水,然后移动针尖各方向注射0.1 mL。用60 μL 生理盐水将1×106个ADSCs 重悬后分别于建模后1 和2 周连续2 次同种同体注射至ADSCs 组兔的颞下颌关节腔内,对照组和模型组同时注射等量生理盐水。注射8 周后处死各组兔,收集双侧颞下颌关节标本。
1.5 Micro-CT 扫描分析各组兔髁突骨结构参数取出各组兔颞下颌关节标本于4%多聚甲醛中固定24 h,行Micro-CT 扫描。计算骨体积分数(bone volume fraction,BV/TV)和骨表面积/骨体积比(bone surface area/bone volume,BS/BV),测量骨小梁厚度(trabecular thickness,Tb.Th)和骨小梁间距(trabecular spacing ,Tb.Sp),计数骨小梁数(trabecular number,Tb. N),BV/TV 和BS/BV 为比值,Tb.Th 和Tb.Sp 的单位为mm。
1.6 HE 染色观察各组兔髁突组织病理形态表现各组兔颞下颌关节标本经10% EDTA 溶液脱钙8 周,针尖刺穿组织无阻力后脱水、透明、包埋、切片和固定,进行HE 染色,观察各组兔髁突组织病理形态表现。
1.7 免疫组织化学染色法检测各组兔髁突组织中SOX9、MMP-13 和VEGF 定位情况及蛋白表达水平各组兔颞下颌关节标本制作的石蜡切片常规脱蜡,胃蛋白酶抗原修复,内源性过氧化物酶、山羊血清、一抗(SOX9、MMP-13 和VEGF) 和二抗依次孕育标本;DAB 显色,苏木精复染,光学显微镜下观察SOX9、MMP-13 和VEGF 在髁突组织中的定位情况,采用Image J 软件进行分析,将图片灰度单位转化为吸光度(A)值,计算目的蛋白表达水平。目的蛋白表达水平=区域内特定染色部分累积A 值/区域面积。
1.8 Western blotting 法检测各组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达水平将各组兔颞下颌关节软骨组织用剪刀尽量剪碎,放入研磨器中研磨,加入RIPA 裂解液,提取总蛋白。电泳分离蛋白质后,加入新鲜制备的一抗(SOX9、MMP-13 和VEGF)。4 ℃条件下轻轻摇晃过夜后,TBST 冲洗3 次,每次10 min。 加入二抗,室温下摇晃60 min,TBST 冲洗3 次,每次10 min。 加入ECL 显影剂后,在扫描仪中成像,采用Image J 软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参蛋白条带灰度值。
1.9 统计学分析采用SPSS 22.0 统计软件进行统计学分析。各组兔髁突骨结构参数和髁突组织中SOX9、MMP-13 及VEGF 蛋白表达水平均符合正态分布,以表示,多组间样本均数比较采用单因素方差分析,组间样本均数两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 ADSCs 的形态表现倒置显微镜下可见培养24 h 后的ADSCs 形态不规则,呈短梭形或多角形(图1A);传代后的ADSCs 体积增大,数量增多,由不规则形变为长梭形,聚集成漩涡状(图1B)。

图1 倒置显微镜观察ADSCs 的形态表现Fig. 1 Morphology of ADSCs observed by invert microscope
2.2 流式细胞术检测ADSCs 表面标志物采用流式细胞术检测ADSCs 表面标志物,结果显示:ADSCs 中CD29 和CD44 呈强阳性表达,CD34 和CD45 呈阴性表达,表明所提取的细胞为ADSCs。见图2。

图2 流式细胞术检测ADSCs 表面标志物Fig. 2 Surface markers of ADSCs detected by flow cytometry
2.3 各组兔髁突骨结构参数三维重建图像显示:对照组兔髁突表面较光滑,未观察到明显的骨质改变;模型组兔髁突软骨下骨上端骨皮质大量缺失,髁突表面骨质不连续,骨密度降低;ADSCs 组兔髁突表面有轻微的骨密度改变。见图3。与对照组比较,模型组兔髁突组织的BV/TV、Tb.Th 和Tb. N 明显降低(P<0.05),BS/BV 和Tb. Sp 明显升高(P<0.05);与模型组比较, ADSCs 组兔髁突组织的BV/TV、Tb. Th 和Tb. N 明显升高(P<0.05), BS/BV 和Tb. Sp 明显降低(P<0.05)。见表1。
表1 各组兔髁突骨结构参数Tab.1 Structural parameters of condyles bone of rabbits in various groups(n=9,)

表1 各组兔髁突骨结构参数Tab.1 Structural parameters of condyles bone of rabbits in various groups(n=9,)
*P<0.05 vs control group;△P<0.05 vs model group.
?

图3 各组兔髁突三维重建图像Fig. 3 3D reconstructed images of condyles of rabbits in various groups
2.4 各组兔髁突组织病理形态表现对照组兔髁突软骨表面光滑,层次清晰,结构完整,纤维层、增生层、肥大层和钙化软骨层由外向内依次排列;模型组兔髁突表面不规则,肥大层增厚,出现细胞缺失区和细胞簇状区;ADSCs 组兔髁突有轻度炎症反应,肥大层略增厚。见图4。

图4 各组兔髁突组织病理形态表现Fig. 4 Pathomorphology of condyles tissue of rabbits in various groups
2.5 各组兔髁突组织免疫组织化学染色结果及SOX9、MMP-13 和VEGF 蛋白表达水平与对照组比较,模型组兔髁突组织中棕褐色颗粒增多,主要集中于肥大层,特别是骨软骨结合部位,显示SOX9、MMP-13 和VEGF 表达明显增强;与模型组比较,ADSCs 组兔髁突组织肥大层和骨软骨结合部位棕褐色颗粒明显减少,显示SOX9、MMP-13和VEGF 表达明显减低(图5)。与对照组比较,模型组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达水平明显升高(P<0.05);与模型组比较,ADSCs 组兔髁突组织中SOX9、MMP-13 和VEGF蛋白表达水平明显降低(P<0.05)。见表2。
表2 免疫组织化学染色法检测各组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达水平Tab. 2 Expression levels of SOX9,MMP-13,and VEGF proteins in condyles tissue of rabbits in various groups detected by immunohistochemical staining method(n=9,)
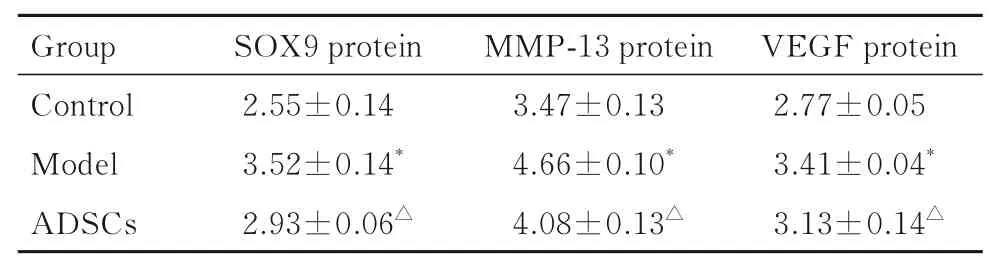
表2 免疫组织化学染色法检测各组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达水平Tab. 2 Expression levels of SOX9,MMP-13,and VEGF proteins in condyles tissue of rabbits in various groups detected by immunohistochemical staining method(n=9,)
*P<0.05 vs control group;△P<0.05 vs model group.
?

图5 各组兔髁突组织免疫组织化学染色结果Fig. 5 Immunohistochemical staining results of condyles tissue of rabbits in various groups
2.6 各组兔髁突组织中SOX9、MMP-13 和VEGF蛋白表达水平Western blotting 法检测结果显示:与对照组比较,模型组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达水平明显升高(P<0.05);与模型组比较,ADSCs 组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达水平明显降低(P<0.05)。见图6 和表3。
表3 Western blotting 法检测各组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达水平Tab. 3 Expression levels of SOX9, MMP-13, and VEGF proteins in condyles tissue of rabbits in various groups detected by Western blotting method(n=9,)

表3 Western blotting 法检测各组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达水平Tab. 3 Expression levels of SOX9, MMP-13, and VEGF proteins in condyles tissue of rabbits in various groups detected by Western blotting method(n=9,)
*P<0.05 vs control group;△P<0.05 vs model group.
?

图6 Western blotting 法检测各组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达电泳图Fig. 6 Electrophoregram of expressions of SOX9,MMP-13,and VEGF proteins in condyles tissue of rabbits in various groups detected by Western blotting method
3 讨 论
TMJOA 是一种慢性退行性疾病,其特征是疼痛、滑膜炎和软骨退化[15],其发病机制尚不明确,普遍认为是滑膜关节受到机械、炎症和代谢因素的刺激,关节结构的适应能力下降导致关节重塑功能失调,从而影响整个关节,包括关节软骨、软骨下骨、韧带、滑膜和邻近肌肉[16]。为了从根本上防止软骨和软骨下骨的破坏,恢复颞下颌关节的功能,建立动物模型模拟TMJOA 的病变过程至关重要。本研究所采用的建模方法为MIA 注射法,其机制为:MIA 可以抑制软骨细胞糖代谢过程中的关键酶,从而使其代谢过程受阻并产生细胞凋亡,进而出现软骨及软骨下骨代谢紊乱,最终形成骨破坏[17]。研究[18]表明:MIA 诱导的OA 模型具有很大的优势,通过改变MIA 的浓度可以很容易地调节关节病变的进展和严重程度,同时可以减少外科手术等建模方法本身对关节产生的损伤,能较好地模拟OA 的发展过程。
既往研究[19]表明: 骨髓间充质干细胞、ADSCs 和脐带干细胞等可用于KOA 的治疗。ADSCs 具有如下优点:来源广泛,易获得;增殖速度快,易培养[20-21];受患者年龄和性别差异的影响较小。ADSCs 可用于全身大关节炎的治疗,如膝关节炎和髋关节炎,而ADSCs 用于TMJOA 治疗的研究较少。本研究模拟了兔TMJOA 后,将从兔自身皮下脂肪中提取的ADSCs 重悬注射入关节腔内,观察其治疗效果。尽管ADSCs 的免疫原性较低,但本课题组前期研究[22]证实:将ADSCs 注射到大鼠体内1 周后,移植处有炎症细胞浸润,提示局部有炎症反应。为了避免免疫排斥对实验的影响,本研究采取同种同体ADSCs 注射,结果显示:模型组兔髁突骨结构参数BV/TV、Tb. Th 和Tb. N 值降低,BS/BV 和Tb. Sp 值升高,表明建模后兔髁突骨量减少,骨负荷能力下降,出现骨质疏松;ADSCs 组兔各项骨参数结果均明显改善,表明ADSCs 疗法可以修复颞下颌关节软骨损伤,改善骨质量,增加骨的抗压能力和力学性能。软骨形成是由软骨形成基因和转录因子介导的严格调控的多步骤过程,在软骨形成过程中,增殖的软骨细胞生长并分化为肥大软骨细胞,随后经历终末分化并产生MMP-13, 激活细胞外蛋白调节激酶(extracellular protein regulatory kinase,ERK)信号通路,与其上游因子VEGF 相互影响,使血管侵入软骨[23],最后软骨细胞发生凋亡并被骨组织取代。SOX9 是多能间充质干细胞向软骨细胞转化和分化所必需的细胞因子,还可以通过直接控制软骨细胞特异性基因的表达来调节软骨细胞的增殖和分化[24]。ADSCs 的软骨分化是受到严格调控的多步骤过程,大量已知和未知的细胞因子发挥不同的作用。本研究结果显示:模型组兔髁突组织中SOX9、MMP-13 和VEGF 蛋白表达水平升高,表明上述炎症因子与骨代谢和软骨下骨的降解有密切关联,OA 发生时软骨和软骨下骨代谢活跃,骨损伤和骨修复同时发生,且骨损伤大于骨修复,软骨及软骨下骨损伤明显且持续发生;ADSCs 治疗后,兔髁突组织中SOX9、MMP-13 和VEGF 表达水平降低,表明骨代谢过程被逆转,骨修复超过骨损伤,因此骨修复状态持续存在;HE 染色结果显示:ADSCs 组兔髁突组织病理损伤程度较模型组明显减轻,细胞层次结构紊乱和炎症反应明显改善。
近年来,研究者对OA 的ADSCs 疗法越来越关注,在某些方面ADSCs 比骨髓MSCs 更具优势,但由于监管限制、可用技术的异质性、成本效益和缺乏有关其有效性的客观数据等原因,目前ADSCs 疗法在临床中仍不成熟[25],因此针对ADSCs 的基础研究非常必要,ADSCs 的注射量、注射频率和预培养等问题有待进一步研究。
综上所述,采用关节腔内注射ADSCs 治疗TMJOA 可以明显抑制关节软骨破坏,修复缺损软骨及软骨下骨,其具体分子机制仍有待深入研究。
利益冲突声明:
所有作者声明不存在利益冲突。
作者贡献声明:
何静参与研究设计和论文撰写,孙高参与研究设计和数据分析,李男男和帕丽孜·阿不力克木参与论文撰写和论文校对,吴国民参与论文写作指导、论文审校和统计学分析。
