寄生虫抗药性及其对水产动物寄生虫病药物防治的启示
2024-02-07李文祥习丙文王桂堂
李文祥 王 浩 习丙文 李 明 聂 品, 4 王桂堂
(1.中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2.上海海洋大学, 上海 201306;3.中国水产科学研究院淡水渔业研究中心, 无锡 214081; 4.青岛农业大学, 青岛 266109)
为减少细菌性疾病的发生, 抗生素被大量用于陆生动物[1]和水生动物[2,3] 的养殖生产, 从而引起细菌对抗生素产生了抗性(Antimicrobial resistance),这不仅影响养殖动物疾病的药物防控效果, 而且还会使人类相关疾病的病原菌产生抗药性[4]。细菌的抗药性(Drug resistance)已成为全球关注的热点问题[5]。
抗药性原本是指微生物能经受住药物毒性的一种能力, 少数个体在药物作用下发生遗传变异,并在持续的药物选择压力下存活, 从而形成对药物具有耐受力的种群[6,7]; 且抗药能力取决于抗性个体在种群中的比例和抗药机制[8]。目前陆生动物寄生虫病的防治仍然依靠化学药物, 由于驱杀虫药物(Anthelmintics)的长期大量使用, 寄生虫产生了严重的抗药性[9]。抗寄生虫药物的种类本来就很有限, 随着抗药性的出现, 可用的药物越来越少, 且短期内有效的疫苗难以研制出来, 加之新药研制是个漫长的过程, 造成了当前寄生虫病的药物防治越来越困难[10], 寄生虫抗药性受到广泛关注[11—15]。
与陆生动物相比, 水生动物寄生虫的抗药性研究较少[16], 虽然在20世纪90年代发现了欧洲鳗鲡(Anguilla anguilla)的拟指环虫(Pseudodactylogyrusspp.)的抗药性问题[17], 但针对抗药性的系统研究目前仅限于鲑鳟类寄生的鲑疮痂鱼虱(Lepeophtheirus salmonis)[18—20]。高密度养殖中杀虫药物的反复使用是产生抗药性的前提条件[16], 随着我国水产养殖集约化程度逐渐提高和养殖规模逐渐扩大, 寄生虫病的发生越来越严重, 杀虫药物被大量使用, 有些寄生虫病的防治效果已呈现明显下降趋势, 表明寄生虫可能已经产生抗药性, 然而缺乏相关研究。
本文将通过对寄生虫病主要防治药物、寄生虫抗药性机制、抗药性测定方法、减缓抗药性措施及水产养殖动物寄生虫抗药性的研究现状进行综述, 为我国水产养殖中寄生虫抗药性研究提供思路, 同时为寄生虫病的合理用药提供策略, 避免或减缓抗药性的产生。
1 寄生虫病主要防治药物及驱杀虫的作用机制
世界上几乎所有的杀虫药物都是为了防治农作物害虫(主要是昆虫和螨)、家禽家畜的寄生虫(球虫、吸虫、绦虫和线虫等)和人体寄生虫而研发的。目前使用的抗寄生虫药物主要涵盖以下几类:有机磷类(Organophosphates)、拟除虫菊酯类(Pyrethroids)、大环内酯类(Macrocyclic lactone)、苯甲酰脲类(Benzoyl ureas)、新烟碱类(Neonicotinoid)、咪唑并噻唑类(Imidazothiazole)、苯并咪唑类(Benzimidazoles)和异喹啉类(Isoquinoline), 还有一些化学合成抗球虫药, 以及驱虫杀虫的无机化合物、消毒剂和中草药等。
寄生虫的抗药性与药物种类和作用方式(Mode of action)密切相关, 以下是几类主要杀虫药物的作用方式或作用机制。
1.1 有机磷类
有机磷类是应用最为广泛的一类杀虫剂, 以胃毒、触杀、熏蒸或内吸等多种方式作用于虫害[21]。该类药物的主要靶标为乙酰胆碱酯酶, 可使传导神经冲动的乙酰胆碱无法水解, 在突触处大量积累,干扰神经冲动的正常传导, 使虫体因过度兴奋死亡[22]。常用的有敌百虫(Trichlorfon)、甲基吡啶磷(Azamethiphos)、辛硫磷(Phoxim)和马拉硫磷(Malathion)[23]等, 可用于寄生蠕虫(吸虫、绦虫、线虫、棘头虫和鱼蛭)和甲壳类寄生虫病的防治。
1.2 拟除虫菊酯类
该类杀虫剂包括从除虫菊属植物中提取的天然除虫菊酯(Pyrethrin)及经合成衍生而成, 对昆虫有强烈的触杀、胃毒和熏蒸作用, 而对哺乳动物和禽类毒性低, 主要作用于轴突膜上的电压门控钠离子通道, 引起去极化过程, 扰乱虫体神经的正常生理活动[24]。常用的有溴氰菊酯(Deltamethrin)、氰戊菊酯(Fenvalerate)、氯氰菊酯(Cypermethrin)、高效氯氰菊酯(Beta-cypermethrin)和高效氟氯氰菊酯(Lambada-cyhalothrin)[25]等, 主要用于甲壳类寄生虫病的防治。
1.3 大环内酯类
大环内酯类抗寄生虫药是一类天然的或是半合成的具有十六元大环内酯环化合物, 该类化合物由两大类组成, 即阿维菌素类(Avermectins)和美贝霉素类(Milbemycins)。阿维菌素类有阿维菌素(Abamectin)、伊维菌素(Ivermectin)、埃玛菌素(Emamectin benzoate, 也叫甲维盐)[26]等。该类药物是一种神经毒剂, 主要激活存在于无脊椎动物中的谷氨酸门控氯离子通道(GluCls), 同时可以激活其他具有半胱氨酸环的离子通道, 如γ-氨基丁酸(GABA)受体、甘氨酸受体和烟碱型乙酰胆碱受体等, 促进相应神经递质与次级神经元细胞膜或效应器细胞膜的结合, 产生抑制效应, 使虫体麻痹死亡, 具有触杀和胃毒作用[27,28], 常用于甲壳类寄生虫病和线虫病的防治。
1.4 苯甲酰脲类
苯甲酰脲类化合物是一种昆虫几丁质抑制剂,抑制几丁质合成酶的活性, 进而抑制几丁质合成和沉积, 从而阻止脱皮过程, 使昆虫变态受阻, 导致不育及直接杀卵等而杀死害虫[29,30]。常用的有二氟脲(Diflubenzuron, 除虫脲)、氟苯脲(Teflubenzuron)和八氟脲(Lufenuron, 虱螨脲)[18]等, 可用于甲壳类寄生虫病的防治。
1.5 新烟碱类
该类杀虫剂来源于烟叶中提取的活性成分烟碱经修饰而成的化合物, 主要作用于烟碱型乙酰胆碱受体, 引起过度兴奋而导致麻痹和死亡, 具有触杀和胃毒作用, 高效低毒[31]。主要包括吡虫啉(Imidacloprid)、啶虫脒(Acetaniprid)、噻虫啉(Thiacloprid)、噻虫胺(Clothianidin)和呋虫胺(Dinotefuran)等, 常用于甲壳类寄生虫病的防治。
1.6 咪唑并噻唑类
该药物是一类化学合成的广谱驱线虫药, 能选择性地打开线虫神经和肌肉中乙酰胆碱受体(AChR)离子通道产生去极化, 钙大量进入后导致肌浆钙增加, 产生痉挛性肌肉收缩, 然后虫体被机体清除[32]。主要有四咪唑(Tetramisole, 噻咪唑)和左旋咪唑(Levamisole)等, 常用于线虫病的防治。
1.7 苯并咪唑类
目前认为此类药物的作用机理是抑制蠕虫的延胡索酸还原酶复合体, 影响其糖酵解途径使得虫体代谢障碍; 也有观点认为该类药物是细胞微管蛋白抑制剂以及能量代谢抑制剂, 阻碍虫体在微管装配过程中微管蛋白的聚合[33,34]。常用的有甲苯咪唑(Mebendazole)、芬苯达唑(Fenbendazole)、三氯苯达唑(Triclabendazole)和阿苯达唑(Albendazole)[35]等, 可用于扁形动物寄生虫、线虫和棘头虫引起的寄生虫病。
1.8 异喹啉类
该类药物中常用于驱杀寄生虫的是吡喹酮(Praziquantel), 是一种含有吡嗪(Pyrazino-)和异喹啉(Isoquinolin-)杂环的衍生物[36], 通过改变电压门控的钙离子通道活性, 提高虫体膜通透性, 导致钙离子流入, 引起肌肉收缩和外皮出现空泡[37], 但可能有多种作用方式[38,39], 是一种高效的驱杀吸虫和绦虫的药物[40,41]。
2 寄生虫的抗药性机制
药代动力学描述的是药物进入虫体后的过程,包括吸收、分布、代谢和排出。药物发生作用就是药物分子与分子靶点(作用位点)发生相互作用的过程, 一方面是药物分子对机体细胞产生毒性, 引起虫体死亡; 另一方面虫体会发生相应的生理变化和遗传变异, 改变药物吸收、分布、代谢和排出过程, 降低虫体内的药物浓度, 减少药物的有害影响,从而保证机体存活[12]。使这个药物动力学发生改变的生化和生理过程就是抗药性机制(Mechanisms of resistance)[8]。
2.1 抗药性机制类型
抗药性机制主要包括3类(图1): 通过改变穿透性(Penetration)或药物吸收系统减少药物进入和增加药物外排(Efflux); 通过改变作用位点(Modified site of action)或靶标改变(Target modification)减少与杀虫药物结合; 通过增加新陈代谢(Enhanced metabolism)提高虫体对杀虫药物的降解能力, 使药物失活[8,42]。
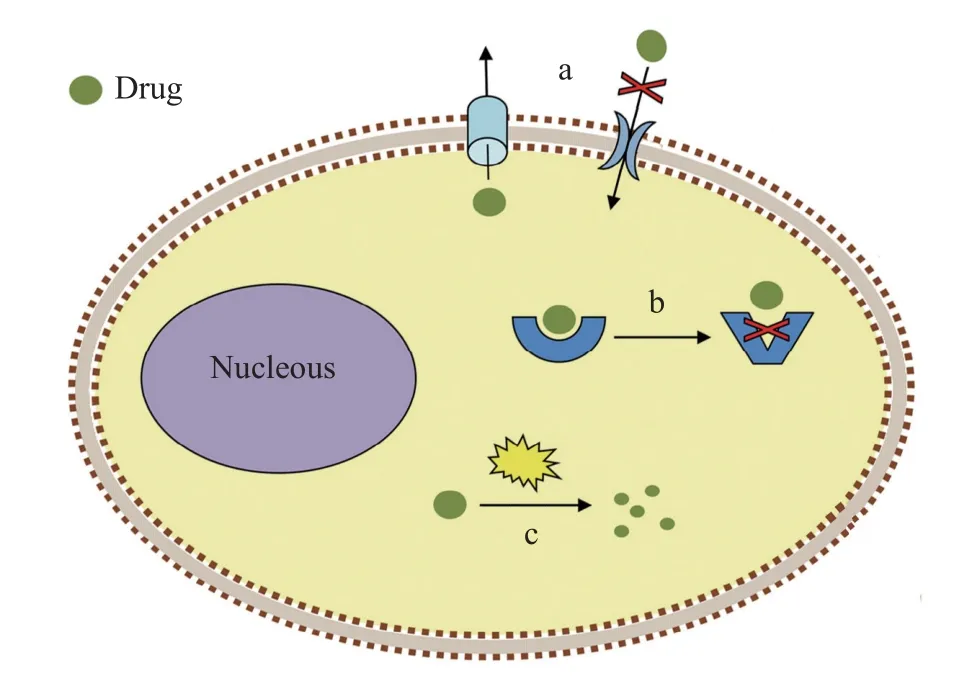
图1 寄生虫常见的抗药性机制(修改自Garcia-Salcedo等[44])Fig.1 Common mechanisms for drug resistance of parasites(Modified from Garcia-Salcedo, et al.[44])
研究寄生虫抗药性产生机制不仅可开发检测抗药性的分子标记, 进行早期识别, 避免一些无效、有害的药物治疗, 而且有助于制定更合理的联合用药方案, 减少抗药性产生, 延长药物的有效性[12];另外, 还有助于准确锚定药物靶标, 开发药物类似物(Drug analogue)[43]。
穿透抗药性机制通过虫体的渗透屏障(表皮、消化道外膜和血脑屏障)结构和渗透性的改变,减少杀虫药物在体内的渗透量和残留量, 主要包括减少表皮的药物渗透 , 以及增加药物的运输和排出[42],如通过上调表皮沉积蛋白基因和几丁质合成酶基因来增厚表皮[45,46], 以及通过P-糖蛋白(ABC转运蛋白中的一种)增加药物外排[47]。
靶标改变抗药性机制指与杀虫剂作用的靶标分子发生突变或者表达水平的改变, 减少了与杀虫药物结合, 从而降低虫体对药物的敏感性[43]。离子通道由一类膜蛋白组成, 起神经系统传导信号和胞内信息交流作用, 是杀虫药物的主要靶标, 包括电压门控的(Voltage-gated)离子通道, 如电压门控钠离子通道、钙离子通道和钾离子通道等, 以及配体门控的(Ligand-gated)离子通道, 也称离子型受体; 配体结合导致通道蛋白结构的构象变化而打开通道, 离子流通过质膜, 如烟碱型乙酰胆碱受体(nAChRs) 、乙酰胆碱门控的氯离子通道(ACCs)或乙酰胆碱受体(AChRs)、谷氨酸盐门控的氯离子通道(GluCls)、γ-氨基丁酸(GABA)门控的氯离子通道等[48]; 另外, 可水解神经递质乙酰胆碱的乙酰胆碱酯酶(AChE)[49]和组成细胞骨架的β-微管蛋白也是重要的药物靶标[50], 它们的基因突变会增加虫体对药物的耐受性。
增加新陈代谢抗药机制通过体内解毒酶系表达量或活性的增加来提高虫体对杀虫剂的降解能力, 使药物失活(Inactivation), 如将药物由疏水型转化为更易排出的亲水型的细胞色素P450酶系(CYP450), 对药物具有解毒作用的谷胱甘肽转移酶(GST) 和羧酸酯酶(CarE)[11,51]。
2.2 主要寄生虫类群的抗药性机制
在通常情况下, 同种寄生虫对同一类药物的抗药性机制是相同的。当寄生虫对某种药物产生抗药性后, 对于结构近似或作用方式相同的药物也会产生抗药性, 这种现象被称为交叉抗药性(Cross-resistance)[10]。而多药抗性(Multidrug resistance)则是寄生虫对某种药物产生抗药性后, 对具有不同化学结构或不同作用方式的多种药物产生抗药性, 如ABC(ATP binding cassette)转运蛋白中的P-糖蛋白过量表达就是较常见的多药抗性机制[47,52]。
不同类别的寄生虫具有不同的身体结构和生理机能, 对不同的杀虫药物产生的抗药机制不尽相同, 以下是几种主要寄生虫类群的抗药性机制。
寄生原虫的抗药性机制寄生原虫的抗药性机制研究主要集中在人类的疟原虫、非洲锥体虫和利什曼原虫[43,53]。氯喹(Chloroquine)曾是治疗疟疾的特效药, 但现在世界各地的疟原虫对氯喹产生了普遍的抗药性。氯喹的主要作用是抑制虫体食物泡内血红蛋白酶活性和降低pH, 从而使疟原虫不能消化所摄取的血红蛋白而致使核破裂。因此,疟原虫对氯喹的抗药机制是位于食物泡膜的一种ATP结合盒转运蛋白(ATP-Binding-Cassettes, ABC)Pgh1基因发生点突变, 表达上调, 增加了对氯喹的泵出[54]。另外, 编码食物泡另一种膜蛋白PfCRT基因的突变, 通过调节食物泡内的pH增加对氯喹的抗性[55]。后来随着叶酸拮抗剂(Antifolates)大量使用, 疟原虫很快也产生了抗药性, 主要通过二氢叶酸还原酶(DHFR)和二氢蝶酸合成酶(DHPS)的点突变, 改变叶酸拮抗剂药物与作用靶点叶酸的结合[56]。现在尽管青蒿素(Artemisinin)及其衍生物是治疗疟疾的常用药物, 但是疟原虫也产生了抗药性, 由于虫体食物泡附近编码Kelch13蛋白的基因发生点突变, 失活的蛋白减少了血红蛋白的内吞作用, 进而减少了对青蒿素及其衍生物的激活, 导致疟原虫对青蒿素及其衍生物产生抗药性[57]。
鸡的球虫病非常普遍和严重, 莫能菌素(Monensin)等聚醚类离子载体(Polyether ionophores)是常用药物, 主要作用于孢子体(Sporozoites)和裂殖体(Merozoites)的细胞膜, 大量的阳离子进入细胞内使细胞内外形成渗透压差, 大量水分进入虫体, 最终导致虫体膨胀破裂[15], 艾美球虫(Eimeria tenella)对这类药物产生了抗药性, 但其复杂的抗药性机制仍不清楚[58]。
寄生蠕虫的抗药性机制寄生线虫的抗药性机制是研究最多的。线虫常用的杀虫药物有苯并咪唑类、大环内酯类、左旋咪唑和噻嘧啶[13]。线虫对苯并咪唑类药物的抗药性机制是虫体β-微管蛋白基因点突变, 引起微管蛋白与药物结合减少而导致抗药性产生[59—61]。而线虫对大环内酯类药物的抗药性则是由于Pgp基因点突变, 导致P糖蛋白上调, 而引起药物外排增加[62], 以及多种离子通道或受体改变, 如烟碱型乙酰胆碱受体、乙酰胆碱门控的氯离子通道、谷氨酸盐门控的氯离子通道和γ-氨基丁酸门控的氯离子通道等, 从而减少药物与作用靶点的结合[48]。
其次, 抗药性研究较多的是人类的肝吸虫(包括片吸虫、华支睾吸虫和后睾吸虫等)和血吸虫,吡喹酮和苯并咪唑类是扁形动物寄生虫的常用杀虫药物[63]。多种片吸虫对三氯苯咪唑(Triclabendazole)都产生了抗药性, 抗药性机制包括P-糖蛋白增加药物外排和谷胱甘肽转移酶增加药物代谢作用[11,64];在一些地区, 血吸虫对吡喹酮也产生了抗药性, 主要通过点突变减少药物与电压门控的钙离子通道β亚基(一种胞浆蛋白)的结合[65]。
绦虫的抗药性机制也有少量报道, 电压门控的钙离子通道同样也是吡喹酮在猪肉绦虫(Taenia solium)上的关键作用靶点[66], 犬复孔绦虫(Dipylidium caninum)在对吡喹酮出现明显抗药性后检测到β亚基类似物的[67]。钙离子通道β亚基的突变, 降低了吡喹酮与虫体钙离子通道的结合, 不会引起肌肉收缩和外皮出现空泡[38,39]。
甲壳类寄生虫的抗药性机制甲壳类和昆虫都属于节肢动物, 昆虫的杀虫药物也常用于甲壳类寄生虫, 因此, 甲壳类寄生虫的抗药性机制与昆虫的类似[18]。Heumann等[68]在鲑疮痂鱼虱克隆到一种新的P-糖蛋白基因SL-PGY1, 后被证实鲑疮痂鱼虱对甲维盐的抗药性是通过增加P糖蛋白表达量从而增加了药物的外排[69]; 另外, 还在抗甲维盐的鱼虱检测到乙酰胆碱受体和GABA-gated的氯离子通道的mRNA 转录水平显著降低, 推测是因为点突变引起这两类离子型受体表达量降低, 从而减少作用靶点与药物结合[70]; 鲑疮痂鱼虱对甲基吡啶磷的抗药性机制是乙酰胆碱酯酶基因(ace1a)上一个等位基因(362Tyr)突变而引起[71]; 它对拟除虫菊酯类药物的抗药性机制则是单氧化酶介导的解毒作用增强[72]。
不管是陆生动物的寄生虫, 还是水生动物的寄生虫, 相同类群的寄生虫产生的抗药性机制应该是相同或类似的。因此, 上述陆生动物和人类的寄生虫抗药性研究可为水产养殖中原生动物寄生虫、寄生蠕虫和甲壳类寄生虫的抗药性机制研究提供参考, 以及为新型杀虫药物开发提供靶标。
3 抗药性控制策略
抗药性产生的遗传机制是在药物选择压力下虫体发生基因突变, 因此, 若要减少抗药性的产生,就必须从治疗策略(Treatment strategies)和保护敏感虫体种群两方面来采取措施。合理的治疗策略可以阻止和减少抗药性产生, 保护敏感虫体种群则可促进抗药性逆转。
3.1 治疗策略
在陆生系统中, 主要通过在时间和空间上改变化学药物使用模式, 通过增加治疗的异质性来减少抗药性产生, 这是因为多种药物联用或交替使用可延缓某一种药物带来强大选择压力, 通常治疗的异质性越高, 抗药性进化越慢[10]。这些用药策略主要包括以下四种: 响应换药(Responsive alternation),当虫体对一种药物产生抗药性后, 换用另一种药物,这种策略一般在不易产生抗药性的寄生虫中使用;定期使用或轮换用药(Periodic application, sequential use, rotation), 即两种或多种药物定期轮换使用,换药时间可长于虫体世代, 也可短于世代; 错区用药(Mosaic), 两种或多种药物同时在不同区域使用,即一个区域分别用一种不同的药物; 联用或混用(Combination, mixture), 两种或多种药物同时在一次治疗中使用, 联用药物可以是全剂量, 也可是半剂量[10, 16]。
尽管联合用药比其他几种用药策略更优, 但在实际应用中到底使用哪一种策略, 主要取决于治疗对象, 在人类的疟疾和农作物害虫防治中, 常采用联合用药策略, 但在细菌病的抗生素治疗中, 特别是群体中, 联用策略并不合适[10]。基于海虱病原模型, 模拟了7种用药场景并同时检测海虱种群产生抗药性水平, 结果发现联合用药是最有效的策略[16]。鸡球虫病的用药策略是比较成熟的, 在某一生长阶段采用联合用药策略, 而在整个养殖过程中采用定期轮换用药计划[15]。
3.2 敏感虫体种群保护
理论上讲, 建立未用药保护区或残遗种保护区(Refugia), 保护部分敏感虫体种群可增加敏感等位基因频率, 延缓或逆转抗药性[73]。在家畜寄生线虫的抗药性管理中, 基于残遗种保护区的控制策略就是进行选择性治疗, 即只有一部分家畜种群用药。但是很多因素会影响该策略的使用效果, 如保护区寄生虫种群的抗药性水平和遗传多样性、治疗寄生虫种群的比例和治疗效果以及寄生虫生长、繁殖的生活史特征等[73]。
已经产生的抗药性一般难以逆转。吸虫和线虫对苯并咪唑类药物产生了抗药性, 停止用药后表型抗性仍能保持多年[74, 75]; 将具有甲维盐抗性的海虱(Caligus rogercresseyi)在实验室连续养殖7代后,对甲维盐的敏感性仍然没有恢复[76]; 对有机磷和拟除虫菊酯具有抗药性的鲑疮痂鱼虱在第十代子代中也没有发现抗药性降低[18]。但是通过从保护区内引入敏感种群来增加敏感等位基因频率, 可恢复抗药虫体的敏感性或逆转抗药性[77,78]。
3.3 对水产动物寄生虫抗药性控制的启示
从降低寄生虫抗药性产生的策略来分析, 抗药性产生速度与养殖方式和寄生虫种类密切相关。我国大部分是室外的池塘养殖, 而这种养殖方式通常只在生长季节用药, 药物压力是不持续的; 而且池塘一般呈现斑块分布, 具有空间异质性, 不同养殖区域的养殖品种不同, 用药种类和时间也不同,可看作错区用药策略; 另外, 大多数寄生虫的宿主特异性不强, 如原生动物寄生虫、甲壳类寄生虫、复殖吸虫和线虫, 那么邻近区域其他鱼类上的相同寄生虫可起到残遗种保护区作用。因此, 我国池塘养殖模式中大多数鱼类寄生虫产生的抗药性相对较慢。
从抗药性产生的遗传机制来看, 生活世代短、具有有性繁殖的寄生虫更容易产生抗药性[14]。单殖吸虫不仅具有直接的生活史, 世代短, 有性生殖,且具有较强的宿主特异性[79], 因此, 单殖吸虫可能是最容易产生抗药性的寄生虫类群之一。寄生于鳗鲡的拟指环虫在低剂量甲苯咪唑的作用下, 经过7个世代后开始出现明显的抗药性[80], 在短短的十年内, 甲苯咪唑对欧洲鳗鲡的指环虫病几乎没有治疗效果[17]; 在我国的鳗鲡养殖中, 也发现了拟指环虫的抗药性问题[81]。
不管是室外的池塘养殖和设施养殖, 还是室内的循环水养殖, 高密度的集约化养殖是我国水产养殖的一种趋势, 针对频频发生的寄生虫病使用药物防治不可避免。根据陆生动物寄生虫抗药性的控制策略, 首先要布局好养殖品种和养殖方式, 如多品种混养, 不同品种的错区养殖; 其次是在用药方式上, 不能长期只用一种药物, 要多种药物联用。
4 抗药性的主要检测方法
抗药性虫体表型特征变化是最直接的抗药性识别方法。生物体在产生抗药性过程中, 会消耗较高能量代价, 或者产生一些不利因素来降低适合度,称为适合度代价(Fitness costs), 如繁殖力降低、扩散力削弱等种群生物学性状的表型变化[82]。鉴定适合度代价在识别和限制抗药虫体种群的综合管理中具有明显优势, 种群相对适合度的表征有两种,即种群抗药性基因突变频率的变化, 以及抗药性种群生物学性状的变化[83]。这种抗药性引起的适合度代价在昆虫中比较常见[82], 在抗药疟原虫中也存在[84,85], 但在抗甲维盐鱼虱的第四代子代中没有发现适合度代价[86]。
4.1 生物测定法(Bioassays)
利用生物体对杀虫药物的反应来定性或定量测定抗药性强弱, 这些反应包括死亡或停止运动等,衡量参数常用半致死浓度或90%致死浓度等, 这是传统的抗药性检测方法。该方法的优点是在抗药性机制未知情况下仍然可以检测, 缺点是测试敏感性低, 在比较不同地区生物体的抗药性水平时受到限制[18]。在鲑疮痂鱼虱的抗药性测定中, 50%的有效浓度(EC50)的估计需要多个药物浓度[87]; 因此, 后来又有人建立了一种基于剂量-杀虫效果模型的单剂量快速测定方法[88]。
4.2 分子检测法(Molecular assays)
在抗药性机制已知情况下, 利用分子生物学技术检测杀虫药物作用靶标的抗性点突变或解毒代谢酶基因的增强表达, 其中基因突变检测技术可应用于检测杀虫药物作用靶标的基因突变, 而基因差异表达技术则应用于检测解毒代谢酶基因的增强表达[89]。有时候具体的抗药性机制可通过抗性个体展示的表型特征进行鉴别, 但通常情况下需要高通量测序, 并对大量的候选基因进行功能鉴定[18]。
5 水产动物寄生虫抗药性研究现状
寄生原虫、扁形动物寄生虫和甲壳类寄生虫是水产养殖动物重要的寄生虫类群。在寄生原虫引起的寄生虫病中, 小瓜虫病危害最严重, 但由于缺少真正的有效药物, 没有一种药物是长期使用的,因此还没有抗药性的研究报道[90]。
在扁形动物寄生虫病中, 吡喹酮是常用药物,尽管人类的血吸虫、肝吸虫和绦虫都对该药物产生了抗药性, 但鱼类寄生的绦虫和复殖吸虫仍然保持较高的敏感性, 可能是吡喹酮在水产中的使用时间较短, 而且也没有反复使用[40]。在挪威的大西洋鲑养殖中, 吡喹酮常用于真沟绦虫(Eubothriumspp.)的治疗, 该绦虫对吡喹酮已经产生了抗药性[91,92]。拟指环虫是欧洲鳗鲡养殖中危害最严重的单殖吸虫, 甲苯咪唑是最有效的药物[93], 最开始1 mg/L的甲苯咪唑在24h内可100%杀灭拟指环虫[94,95], 由于循环水养殖模式和长期只使用这一种杀虫药物, 甲苯咪唑的治疗效果越来越差, 使用浓度每年要提高6—12倍, 而且已经很难有效控制指环虫病的发生[17]。
在甲壳类寄生虫中, 海虱(L.salmonis,Caligusspp.)是影响大西洋鲑养殖最重要的寄生虫, 尽管每个国家采取的防治方案不同, 但由于杀虫药物的长期使用, 对海虱的治效果已明显下降[18]。挪威从2014年开始对鲑疮痂鱼虱的抗药性进行监测, 发现对溴氰菊酯、甲基吡啶磷和甲维盐一直保持较高的抗药性, 对过氧化氢和淡水的耐受性也在增加[96]。2008年苏格兰报道鲑疮痂鱼虱对甲维盐的敏感性降低了7倍[68]。加拿大在2010—2012年对22个大西洋鲑养殖场的调查中, 发现鱼虱对甲维盐敏感性降低[97]。在智利, 甲维盐和溴氰菊酯对海虱(C.rogercresseyi)的治疗效果也明显降低[76,98]。
综上所述, 单殖吸虫和甲壳类寄生虫的抗药性都是在欧洲鳗鲡和大西洋鲑的集约化养殖中, 长期反复使用杀虫药物而产生的。在我国, 水产养殖历史更悠久, 在一些常见、频发的寄生虫病防治中,药物使用年限更长, 不规范用药也更严重, 尽管抗药性的研究报道较少, 但在一些水产养殖区域, 寄生虫病的防治效果明显变差, 杀虫药物的使用剂量越来越高, 这已经成为摆在水产养殖生产面前的重要问题。而且随着水产养殖规模和集约化程度逐渐提高, 寄生虫抗药性问题将会更加严重和突出。
6 水产动物寄生虫抗药性研究展望
陆生动物寄生虫和鲑鳟鱼类寄生海虱的抗药性研究提供了成功案例和经验, 但我国水产养殖动物寄生虫的抗药性研究几乎还是空白。因此, 选择合适的寄生虫类群, 开展寄生虫抗药性研究, 是亟待开展的基础研究工作。
我国水产养殖动物寄生虫抗药性可从以下几个方面开展研究: (1)建立抗药性生物检测方法, 在重点养殖区域调查寄生虫对药物的敏感性, 看哪些寄生虫类群产生了抗药性。(2)针对抗药寄生虫, 通过对敏感和抗性虫株进行转录组测序, 找出差异表达的候选基因, 再利用生物信息学分析、RNAi 技术或CRISPR-Cas9基因编辑技术鉴定出抗药性基因, 阐明抗药性分子机制[18]。(3)利用抗药性基因,建立抗药性的分子检测方法, 对全国范围内主要水产养殖区进行寄生虫抗药性普查。(4)研究寄生虫抗药性产生规律, 建立合理的药物轮用和组合策略,以及残遗种保护区等措施, 避免或减缓抗药性产生。(5)将抗药性基因作为抗药性治疗靶点, 利用RNAi 技术抑制抗药性基因的过量表达[48,99], 研发P-gp转运蛋白和解毒酶系的抑制剂[100]等, 以减少寄生虫的抗药性产生。
通过上述研究, 最终形成一个完整的寄生虫抗药性监测和防治体系, 保证现有杀虫药物的有效性,保障水产养殖的绿色健康和可持续发展。
