西番莲中夜来香花叶病毒实时荧光定量PCR检测方法的建立及应用
2024-02-06顾佩佩王莹杨之巽韩俊娜黄爱军
顾佩佩 王莹 杨之巽 韩俊娜 黄爱军




摘要
夜來香花叶病毒(telosma mosaic virus, TeMV)是对西番莲危害较大的一种病毒病原。根据病毒末端结合蛋白(VPg)序列设计引物,建立了以Vpg334F/506R为特异性引物,退火温度54℃,引物浓度0.6 μmol/L的SYBR Green Ⅰ实时荧光定量PCR检测方法。该方法可特异性扩增TeMV基因组6 483~6 675 nt区域,所得标准曲线扩增效率为102.77%,决定系数为0.996 1,最低检测浓度为2.370×102 拷贝/μL,灵敏度是普通PCR的1 000倍。应用该方法对接种TeMV的西番莲进行检测,发现接种3 d后可在叶片中检测到TeMV,定量分析不同温度下TeMV在叶片中的积累,发现26~28℃下病毒积累速度最快,且植株症状表现与病毒积累量密切相关。对赣南地区采集的76份西番莲田间样品进行检测,共检出71份阳性样品,检出率为93.4%。综上,本研究建立的实时荧光定量PCR方法特异性强,灵敏度高,适于TeMV的快速检测。
关键词
夜来香花叶病毒; 西番莲; 实时荧光定量PCR
中图分类号:
S 436.67
文献标识码: A
DOI: 10.16688/j.zwbh.2022713
Establishment and application of a realtime fluorescence quantitative PCR method for detection of telosma mosaic virus in Passiflora edulis
GU Peipei, WANG Ying, YANG Zhixun, HAN Junna, HUANG Aijun*
(College of Life Sciences, Gannan Normal University, Ganzhou 341000, China)
Abstract
Telosma mosaic virus (TeMV) is a devastating virus infecting Passiflora edulis populations. In this study, the specific primer pair, Vpg334F/506R, was designed based on the conserved region of the viral protein genomelinked (VPg) gene of TeMV, and a method of the SYBR Green Ⅰbased realtime fluorescent quantitative PCR (qPCR) assay was established with optimal annealing temperature of 54℃ and primer concentration of 0.6 μmol/L, respectively. This method specifically amplified the nucleotide sequence region of 6 483-6 675 nt in the genome of TeMV. The cycle threshold of the qPCR standard curve exhibited a positive linear relationship with template concentrations, and the amplification efficiency and R2 value were 102.77% and 0.996 1, respectively. This method could detect a minimum concentration of 2.370×102 copies/μL DNA, which was 1 000 folds of conventional PCR detection. Monitoring the virus accumulation at different temperatures after inoculation revealed that TeMV could be detected at day 3 after inoculation, and that accumulated in leaves could be more readily detected at 26-28℃ than at other temperatures. The symptoms were highly correlated with the content of virus accumulation. Finally, the developed assay was used to detect TeMV in 76 passion fruit samples, showing that the detection rate of TeMV was 93.4%. Thus, this assay can be served as a powerful tool for detecting TeMV and is valuable for further research on TeMV.
Key words
telosma mosaic virus; Passiflora edulis; qPCR
西番莲Passiflora edulis Sims又名百香果,属于西番蓮科Passifloraceae、西番莲属Passiflora,为多年生藤本植物,其果实营养丰富,具有较高的经济价值,在我国主要种植于台湾、广东、广西、福建、海南、云南、贵州等省区[13]。据农业农村部2018年统计,我国西番莲种植面积已达到44 466 hm2,年产量为59.03万t,全年总产值达到30亿元[45]。病毒病害是为害西番莲产业发展的重要因素之一。20世纪80年代,台湾省西番莲产业因遭到病毒病大范围肆虐,最终导致全省西番莲种植面积由1 392 hm2降至540 hm2,年总产量由16 020 t降至8 045 t[6]。病毒病的发生已严重影响西番莲产业的发展,目前西番莲上已报道的病毒病种类超过40种[78]。
夜来香花叶病毒(telosma mosaic virus,TeMV)是一种正义单链RNA病毒,隶属于马铃薯Y病毒属,该病毒侵染西番莲后可引起叶片花叶、皱缩、畸形,植株矮化、衰弱,果实果皮木质化等症状,其可通过扦插、嫁接以及机械接种等多种途径传播[9]。自然条件下除西番莲外,TeMV还可侵染夜来香Telosma cordata[10]、翅荚决明Senna alata[11]、广藿香Pogostemon cablin[12];实验室条件下可侵染多种豆科及苋科植物[9]。
我国于2017年在福建西番莲上首次报道了TeMV的发生[13]。目前我国西番莲产区TeMV发生越来越普遍,在福建、广西和贵州等地区该病毒田间检出率高达80%以上,对该产业的危害愈发严重[1415]。因此建立TeMV快速、准确的检测方法,对该病毒的防控具有重要意义。目前已基于多种技术建立了TeMV的检测方法,其中包括:常规 RTPCR[13]、逆转录环介导等温扩增(reversetranscription loopmediated isothermal amplification,RTLAMP)[16]、血清学检测[9]等。
实时荧光定量PCR(realtime fluorescence quantitativ PCR,qPCR)作为一种灵敏度高、特异性强、稳定性好的检测技术,已广泛应用于多种植物病毒检测中。该方法能够定量监测病毒在植物体内的分布情况,对于病毒生物学特性研究具有重要意义。本研究旨在建立TeMV实时荧光定量 PCR检测方法,为 TeMV的快速检测和病毒研究提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 供试植物
以实验室保存的单独感染TeMV的西番莲样品作为qPCR引物筛选的测试样品。试验中所用携带西番莲潜隐病毒(passiflora latent carlavirus, PLV)、西番莲严重花叶病毒(passion fruit severe mottle virus, PFV)、东亚西番莲病毒(East Asian passiflora virus, EAPV)、黄瓜花叶病毒(cucumber mosaic virus, CMV)和柑橘相关弹状病毒(citrusassociated rhabdovirus, CiaRV)的西番莲样品均保存于实验室。田间检测样品于2020年分别采自江西省赣州市寻乌县、瑞金市、于都县及赣县西番莲种植园,共获得76份表现为花叶、皱缩及畸形等疑似病毒病症状的西番莲叶片,叶片样品提取总RNA后于-80℃冰箱保存备用。
1.1.2 主要试剂与仪器
RNAeasy Isolation Reagent、HiScript Ⅱ One Step RTPCR Kit购自南京诺唯赞生物科技股份有限公司;PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit、TaKaRa MiniBEST Plasmid Purification Kit Ver.4.0、DL 2000/5000 DNA Marker、TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0、pMDTM19T Vector Cloning Kit、DH5α 感受态细胞,购自宝生物工程(大连)有限公司;FastStart Essential DNA Green Master,购自Roche公司。
Nanodrop 2000c超微量核酸蛋白测定仪,美国Thermo Scientific公司; S1000TM Thermal Cycler,美国BioRad公司;DYY6C型电泳仪,北京六一仪器厂;JS2012型凝胶成像系统,上海培清科技有限公司;LightCycler 96 System,瑞士Roche公司;GPX250C光照培养箱,上海南荣实验室设备有限公司。
1.2 方法
1.2.1 RNA提取及反转录
参照试剂盒RNAeasy Isolation Reagent说明书提取西番莲叶片样品总RNA,并于-80℃保存备用。采用反转录试剂盒PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit合成病毒的cDNA模板。
1.2.2 引物设计与合成
根据本实验室获得的TeMV江西分离物TeMVXW、TeMVRJ、TeMVYD(GenBank登录号分别为ON932194、ON932195、ON932196)以及GenBank中已报道的TeMV分离物(MK340754、MK340755、MT557572等)的病毒末端结合蛋白 (viral protein genomelinked,VPg)保守序列,使用引物设计软件Oligo 7设计一对用于TeMV实时荧光定量PCR检测的特异性引物VPg334(5′GAATTGGATAGACAAGCCAT3′)/VPg506R
(5′GAAGTGTTTGTGGCATACC3′)。本研究所得引物VPg334F/506R以及试验中所用西番莲内参引物C21209F(5′AGCTCTTCTACATCTGCGCT3′)/C21209R(5′TTCTTGTGCATCTTCCCCCG3′)[17]均由南京金斯瑞生物科技有限公司合成。
1.2.3 TeMV质粒标准品制备
以RNA为模板,利用引物VPg334F/506R通过一步法RTPCR扩增TeMV基因组的6 483~6 675 nt区域,PCR扩增产物采用1.2%琼脂糖凝胶电泳检测。反应总体积50.0 μL:RNA模板 2.0 μL,10 μmol/L上、下游引物各1 μL,2×One Step Buffer 25 μL,One Step Enzyme Mix 2 μL,ddH2O 19 μL。反应条件:50℃反转录30 min;94℃预变性4 min;94℃变性20 s,56℃退火20 s,72℃延伸20 s,共35个循环。
PCR产物用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit回收,回收产物与pMD19T载体连接后转化至大肠杆菌DH5α感受态细胞,挑选经菌液PCR鉴定后的阳性克隆子送至苏州金唯智生物科技有限公司进行测序。选择测序结果中序列完全正确的阳性克隆样品,参照TaKaRa MiniBEST Plasmid Purification Kit说明书提取质粒,所得质粒命名为VPg192。利用Nanodrop 2000c超微量核酸蛋白测定仪检测质粒纯度与浓度,
并将获得的质粒作为后续试验的标准品。
质粒拷贝数计算公式:拷贝数(拷贝/μL)=[质粒浓度(g/μL)×10-9×6.02×1023(拷贝/mol)]/[660(g/mol)×(载体长度+片段长度)][18]。
1.2.4 实时荧光定量PCR检测体系的优化
以质粒VPg192为模板,进行PCR扩增,反应总体积20.0 μL:Master mix (SYBR Green)10.0 μL、10 μmol/L上、下游引物(分别设置0.4、0.6、0.8 μL和1.0 μL共4個引物用量)、质粒模板1.0 μL, ddH2O补足体系至20.0 μL。反应程序:95℃预变性10 min;95℃变性10 s;以引物的退火温度Tm值为基础,分别以52、52.4、53.2、54、55.1、56.2、57.3、58.2、59.1、60℃为温度梯度,退火10 s,72℃延伸10 s,共40个循环。对扩增效率和熔解曲线进行分析,选择合适的引物用量和退火温度。
1.2.5 实时荧光定量PCR标准曲线的建立
用ddH2O按10倍梯度稀释质粒标准品,浓度分别为2.370×100、2.370×101、2.370×102、2.370×103、2.370×104、2.370×105、2.370×106、2.370×107、2.370×108拷贝/μL和2.370×109 拷贝/μL。分别以这10个质粒样品为模板,在优化后的反应条件下进行实时荧光定量PCR检测,反应中以健康西番莲样品的cDNA作为阴性对照,以无酶水作为空白对照,每个样本设置3个技术重复。反应结束后,以扩增得到的Ct值和模板质粒拷贝数的对数值构建标准曲线。
1.2.6 实时荧光定量PCR检测体系灵敏度和特异性检测
以10倍梯度稀释的质粒标准品为模板,分别进行普通PCR和实时荧光定量PCR检测,比较两种方法的灵敏度,质粒初始浓度为2.370×109 拷贝/μL。用经检测后确定含有PLV、PFV、EAPV、CMV和CiaRV,但不含TeMV的cDNA样品进行TeMV的实时荧光定量PCR特异性检测。
1.2.7 西番莲中TeMV的定量检测
采用汁液摩擦接种的方法接种西番莲实生幼苗,并以0.1 mol/L PBS接种作为阴性对照。接种后将植株置于恒温光照培养箱中培养,定期观察植株发病情况。培养箱设置光周期L∥D=16 h∥8 h,分组设置3个不同温度条件:低温组夜间最低温为17℃,白天最高温为19℃;中温组夜间最低温26℃,白天最高温28℃;高温组夜间最低温35℃,白天最高温37℃。在接种后的第0、3、6、9、12 天,采用实时荧光定量PCR对样品进行病毒的定量检测,以对照植株cDNA作为阴性对照,以无酶水作为空白对照,每个样本设置3个技术重复。
提取感病西番莲植株不同组织(花、嫩叶、老叶、嫩茎、老茎、根)RNA,利用上述建立的方法定量测定不同组织内TeMV含量,共设3次重复。
1.2.8 田间样品检测
从赣南地区不同县区共采集76份疑似感染TeMV的西番莲样品,采用qPCR技术检测田间样品感染TeMV的情况。
2 结果与分析
2.1 TeMV实时荧光定量PCR检测体系的优化
将TeMV质粒标准品作为模板,通过对引物用量和退火温度进行筛选,最终确定当引物VPg334F和VPg506R用量均为0.6 μL,退火温度为54℃时,扩增曲线良好且熔解曲线峰单一。优化后的反应总体积20.0 μL:Master mix (SYBR Green) 10.0 μL,10 μmol/L上、下游引物各0.6 μL,质粒模板1.0 μL,ddH2O补足体系至20.0 μL。反应程序:95℃预变性10 min;95℃变性10 s;54℃退火10 s,72℃延伸10 s, 40个循环。后续试验均使用优化后的反应体系进行扩增。
2.2 标准曲线的建立
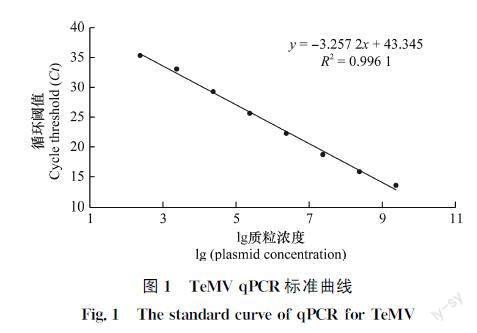
采用优化后的qPCR反应体系进行检测,结果显示,浓度在2.370×102~2.370×109 拷贝/μL范围内的质粒模板经扩增后,所得Ct值与模板浓度呈良好的线性关系。标准曲线斜率为-3.257 2,决定系数R2为0.996 1,扩增效率为102.77%,直线方程为y=-3.257 2x+43.345,y为Ct值,x为质粒浓度的对数值(图1)。
2.3 实时荧光定量PCR体系特异性检测
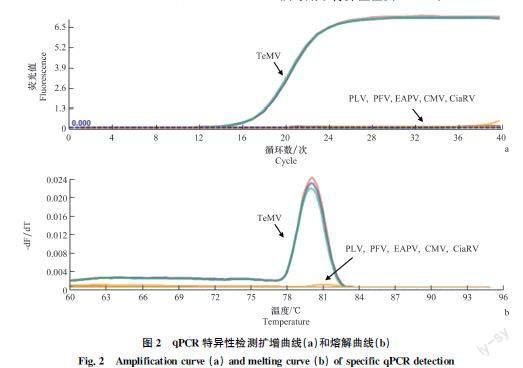
采用qPCR方法分别检测携带TeMV、PLV、PFV、EAPV、CMV和CiaRV的西番莲样品。结果显示仅携带TeMV的样品出现正常的扩增曲线,3次重复所得Ct值分别为15.68、15.44、15.72(图2a),且熔解曲线峰值相同(图2b)。其他感病样品均无明显扩增曲线,且熔解曲线无峰,结果表明该方法可用于特异性检测TeMV。
2.4 实时荧光定量PCR和普通PCR灵敏度比较
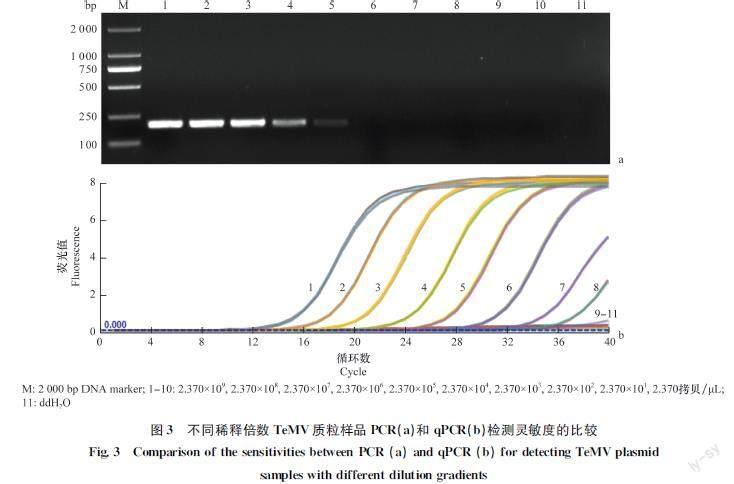
将初始浓度为2.370×109 拷贝/μL的TeMV质粒标准品按10倍梯度稀释,分别以稀释后的质粒作为模板。结果显示,普通PCR最低可检测到浓度为2.370×105 拷贝/μL的TeMV质粒标准品(图3a),qPCR可检测到浓度为2.370×102 拷贝/μL的TeMV质粒标准品(图3b)。上述结果表明本研究建立的TeMV实时荧光定量PCR检测体系是普通PCR检测灵敏度1 000倍。
2.5 西番莲接种TeMV后的症状观察及叶片病毒含量的定量检测
从接种TeMV的第0天起,定期观察不同温度条件下培养的西番莲叶片症状发展情况(图4)。在17~19℃范围内,第9天接种叶上部嫩叶出现卷叶症状,第12天时症状加重,顶部新叶表现为卷叶以及轻微花叶症状; 26~28℃下,第6天便出现较明显的卷叶症状; 35~37℃下,癥状出现缓慢,观察期间内未出现明显卷叶及花叶症状。
接种后第0、3、6、9、12天采集接种植株的上部叶片,采用引物VPg334F/506R以及西番莲内参基因引物C21209F/R对样品进行定量检测(图5)。结果显示,接种3 d时就可在接种植株上部未接种叶中检测到TeMV,且12 d内,不同温度条件下西番莲叶片中TeMV的相对表达量变化总体呈上升趋势;在26~28℃条件下,TeMV的含量快速上升,远高于其余2组;17~19℃以及35~37℃条件下,上升趋势在9 d后趋于平缓,2组间病毒相对表达量无显著差异。
以上结果表明,温度能够影响TeMV在西番莲内的增殖速率以及植株的症状表达情况。26~28℃下病毒在植株内快速增殖,症状发展快,且该条件下TeMV增殖速率高于35~37℃与17~19℃;35~37℃条件不仅会降低病毒的积累速率,对植株的症状表达亦有影响。
2.6 西番莲各组织部位TeMV相对表达量
针对病毒含量高的组织进行检测可提高病毒检出率。本试验通过优化后的体系定量检测感病西番莲植株花、嫩叶、老叶、嫩茎、老茎、根等组织样本中TeMV含量, 3次重复所得平均Ct值分别为19.47、20.5、20.74、19.03、34.04和32.54,依据标准曲线方程计算出样品中病毒含量分别为1.297×107、6.38×106、5.41×106、1.75×107、5.92×102拷贝/μL和1.66×103拷贝/μL(图6)。可见植株较老的茎秆以及根部组织中病毒含量相对较低,在花、嫩茎、嫩叶等新生组织中病毒含量相对较高。因此,在检测西番莲感染TeMV情况时,以叶片作为检测样本可有效保障病毒检测的准确性。
2.7 田间西番莲样品的TeMV检测
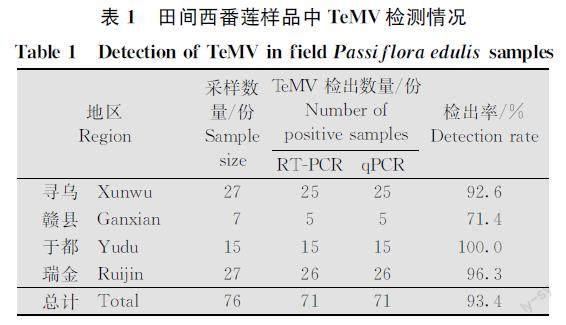
应用本试验所建立的荧光定量PCR检测体系对采自赣南地区不同县区的76份田间样品进行分析,结果显示(表1),76份样品中,TeMV感病样本共71份,不同地区所采集样本中该病毒检出率达到71.4%~100.0%,表明TeMV在所调查地区田间检出率较高,推测该地区TeMV田间发生较为普遍。
3 结论与讨论
近年来,TeMV在中国不同省(区)西番莲产区蔓延,严重威胁了西番莲产业的健康发展,因此对田间病毒发生情况进行早期的定性定量检测与监控十分有必要。本研究建立了该病毒的实时荧光定量PCR检测方法。该方法特异性好,灵敏度高,灵敏度是常规PCR检测的1 000倍,可用于检测低丰度病毒样本。田间样品检测结果也表明该方法可用于TeMV的田间检测。由于植物不同组织中所含的次生代谢产物存在差异,可能会影响RNA的提取及PCR检测结果[19],且病毒在植株不同部位积累量亦有较大差异,本研究所建立的实时荧光定量PCR检测方法,对于感病西番莲植株的不同组织部位均有良好的检测效果。
有研究表明病毒侵染寄主植物过程中受温度等外界环境因子影响,较高的环境温度可能抑制病毒的快速积累,减弱植株的症状表现[2021]。类似结果已经在多种病毒上报道,如Tu研究发现,豆类作物感染菜豆黄花叶病毒(bean yellow mosaic virus,BYMV)后,其症状发展受温度影响较大,16~24℃下病毒滴度较高且症状发展迅速,当温度高于28℃时,植株尖端坏死症状的发展受到抑制[22]。Chung等发现33℃高温条件下,芜菁花叶病毒(turnip mosaic virus,TuMV)侵染白菜时的症状发展较18~28℃缓慢[23]。同样,高温也可降低马铃薯Y病毒(potato virus Y,PVY)在本生烟中的积累速率并只引起轻微的症状[24]。本研究中所得结果表明TeMV侵染西番莲过程中,病毒在叶片中的增殖和植株症状表现情况也会受到温度影响,适宜温度能够加速TeMV的增殖以及植株的症状表现,而35~37℃高温条件将抑制病毒在植株内的增殖速率并延緩症状的出现,且病毒的积累量与植株症状表现之间存在一定联系。
目前西番莲广泛种植于热带与亚热带地区,以上结果表明夏季高温条件下,植株感病初期可能不易出现明显病害症状。本研究中将实时荧光定量PCR技术应用于TeMV的快速检测,在分子水平上为TeMV的检测提供了一种快速、灵敏的方法。在此基础上结合田间不同温度条件以及寄主感病程度等因素监测TeMV的发生情况,对该病毒的田间防控具有实际应用价值。
参考文献
[1] 赵兴蕊, 陈玲玲, 王洪云, 等. 西番莲属植物资源的研究概况[J]. 云南化工, 2021, 48(4): 1719.
[2] 余东, 熊丙全, 袁军, 等. 西番莲种质资源概况及其应用研究现状[J]. 中国南方果树, 2005(1): 3637.
[3] 霍丹群, 蒋兰, 马璐璐, 等. 百香果功能研究及其开发进展[J]. 食品工业科技, 2012, 33(19): 391395.
[4] 唐语琪, 杨其军, 冼淑颜, 等. 百香果产业支撑乡村振兴的现状与对策建议[J]. 中国农业文摘农业工程, 2021, 33(3): 3133.
[5] XIA Zhiqiang, HUANG Dongmei, ZHANG Shengkui, et al. Chromosomescale genome assembly provides insights into the evolution and flavor synthesis of passion fruit (Passiflora edulis Sims) [J/OL]. Horticulture Research, 2021, 8(1): 14. DOI: 10.1038/s41438020004551.
[6] 陈光禄. 台湾西番莲生产现状及其栽培管理[J]. 福建果树, 1991(4): 2627.
[7] 罗金水, 周知恩, 王隆燊, 等. 西番莲病毒病的发生与防控[J]. 东南园艺, 2019, 7(6): 3640.
[8] 陈礼浪, 杨天章, 蔡儒平, 等. 海南西番莲主要病毒种类的分子检测与鉴定[J]. 园艺学报, 2022, 49(8): 17851794.
[9] CHIEMSOMBAT P, PRAMMANEE S, PIPATTANAWONG N. Occurrence of telosma mosaic virus causing passion fruit severe mosaic disease in Thailand and immunostrip test for rapid virus detection [J]. Crop Protection, 2014, 63: 4147.
[10]HA C, COOMBS S, REVILL P A, et al. Design and application of two novel degenerate primer pairs for the detection and complete genomic characterization of potyviruses [J]. Archives of Virology, 2008, 153(1): 2536.
[11]YAO Lizhen, LI Xiaoqin, WANG Jianguang, et al. First report of telosma mosaic virus infecting Emperor’s Candlesticks (Senna alata) in China [J]. Plant Disease, 2019, 103(3): 594.
[12]NOVERIZA R, SUASTIKA G, HIDAYAT S H, et al. Potyvirus associated with mosaic disease on patchouli (Pogostemon cablin (Blanco) Benth.) plants in Indonesia [J]. Journal of International Southeast Asian Agricultural Sciences, 2012, 18 (1): 131146.
[13]謝丽雪, 张小艳, 郑姗, 等. 侵染西番莲的夜来香花叶病毒的分子鉴定及特异性检测[J]. 中国农业科学, 2017, 50(24): 47254734.
[14]YU Chaowei, LIAN Qin, LIN Huihuang, et al. A clade of telosma mosaic virus from Thailand is undergoing geographical expansion and genetic differentiation in passionfruit of Vietnam and China [J/OL]. Phytopathology Research, 2021, 3: 24. DOI: 10.1186/s42483021001011.
[15]任羽羽, 王立娟, 陈楠, 等. 三种百香果病毒在贵州的发生分布[J]. 中国南方果树, 2022, 51(3): 7982.
[16]FU Xiaodong, JIANG Junmei, LUO Liting, et al. Development of reverse transcription loopmediated isothermal amplification assay for rapid and visual detection of telosma mosaic virus (TeMV) in passion fruit [J/OL]. Crop Protection, 2021, 150: 105795. DOI: 10.1016/j.cropro.2021.105795.
[17]WU Yanyan, TIAN Qinglan, HUANG Weihua, et al. Identification and evaluation of reference genes for quantitative realtime PCR analysis in Passiflora edulis under stem rot condition [J]. Molecular Biology Reports, 2020, 47(4): 29512962.
[18]孙晓辉, 潘睿婧, 刘永光, 等. 甜瓜黄斑病毒SYBR Green Ⅰ实时荧光定量PCR方法[J]. 植物病理学报, 2023, 53(1): 119125.
[19]郗娜娜, 李紫腾, 张静怡, 等. 苹果锈果类病毒实时荧光定量反转录PCR检测及其在苹果树体内的扩散转移规律[J]. 植物保护学报, 2020, 47(6): 13041312.
[20]WANG Yi, BAO Zhilong, ZHU Ying, et al. Analysis of temperature modulation of plant defense against biotrophic microbes [J]. Molecular PlantMicrobe Interactions, 2009, 22(5): 498506.
[21]VELAZQUEZ K, RENOVELL A, COMELLAS M, et al. Effects of temperature on RNA silencing of a negativestranded RNA plant virus: Citrus psorosis virus [J]. Plant Pathology, 2010, 59(5): 982990.
[22]TU J. The role of temperature and inoculum concentration in the development of tip necrosis and seedling death of beans infected with bean yellow mosaic virus [J]. Plant Disease, 1989, 73(5): 405407.
[23]CHUNG B N, CHOI K S, AHN J J, et al. Effects of temperature on systemic infection and symptom expression of turnip mosaic virus in Chinese cabbage (Brassica campestris) [J]. The Plant Pathology Journal, 2015, 31(4): 363370.
[24]DEL TORO F J, AGUILAR E, HERNANDEZWALIAS F J, et al. High temperature, high ambient CO2 affect the interactions between three positivesense RNA viruses and a compatible host differentially, but not their silencing suppression efficiencies [J/OL]. PLoS ONE, 2015, 10(8): e0136062. DOI: 10.1371/journal.pone.0136062.
(責任编辑:田 喆)
