分枝列当寄生甜瓜时吸器形成过程中内源激素的动态变化
2024-02-06田芳张学坤姚兆群董雪曹小蕾赵思峰
田芳 张学坤 姚兆群 董雪 曹小蕾 赵思峰


摘要
本研究采用石蜡切片和显微观察分析分枝列当寄生甜瓜时的吸器形成过程,利用液相色谱质谱联用 (LCMS) 检测吸器形成过程中24种植物内源激素变化。结果表明:分枝列当种子在接种甜瓜根部第3 天开始萌发,接种第7 天分枝列当吸器顶端稳固地附着在寄主根部,吸器侵入甜瓜根皮层,并在甜瓜根皮层细胞内扩展,扩展过程中形成大量的爪状结构,接种第11 天时分枝列当吸器细胞与寄主根维管束连接。共有17种植物激素参与了吸器形成过程,其中生长素类吲哚3甲醛含量在列当吸器形成过程中降低了83.36%,细胞分裂素类反式玉米素核苷的含量在增长了5.02倍;油菜素內酯含量增长了481.95倍,推测这3类植物激素在分枝列当吸器形成过程中可能起到重要的调控作用。
关键词
分枝列当; 甜瓜; 吸器; 内源激素
中图分类号: S 451
文献标识码: A
DOI: 10.16688/j.zwbh.2022696
Dynamic change of endogenous hormones during the formation of haustorium of Orobanche aegyptiaca parasitizing melon
TIAN Fang, ZHANG Xuekun, YAO Zhaoqun, DONG Xue, CAO Xiaolei, ZHAO Sifeng*
(Key Laboratory at the Universities of Xinjiang Uygur Autonomous Region for Oasis Agricultural Pest Management
and Plant Protection Resource Utilization, College of Agriculture, Shihezi University, Shihezi 832003, China)
Abstract
In this study, the formation process of haustorium of Orobanche aegyptiaca was analyzed by paraffin section and microscopic observation, and the dynamic changes of endogenous hormones in O.aegyptiaca at different stages of haustorium formation during parasitism to melon roots were detected by liquid chromatography mass spectrometry (LCMS). The results show that the seeds of O.aegyptiaca began to germinate on the third day after inoculation, the haustorium top was firmly attached to the melon root on the 7th day, and then haustorial cell invaded the cortex of melon root, forming a large number of clawlike structures in the cell layer of the cortex of melon root. On the 11th day, haustorial cells were connected with host vascular bundle. Phytohormone test results showed that a total of 17 phytohormones were involved in the formation process of haustorium in O.aegyptiaca, and the contents of auxin, cytokinin and brassinolide changed significantly. The content of auxin indole3carboxaldehyde decreased by 83.36%, the content of cytokininlike transzeatinriboside increased by 5.02 times and brassinolide increased by 481.95 times in the formation process of haustorium. These three phytohormones might play an important role in regulating haustorium formation in O.aegyptiaca.
Key words
Orobanche aegyptiaca; melon; haustorium; endogenous hormones
分枝列当 Orobanche aegyptiaca Pers.可寄生甜瓜、西瓜、向日葵、番茄等重要经济作物并造成严重经济损失[12],其通过吸器与寄主建立寄生关系并从寄主中获取生长发育所需要的水分和各種营养物质。吸器对分枝列当的生长发育至关重要[34]。列当种子感受到寄主植物根系分泌物后开始萌发,萌发后朝向寄主根部生长,胚根贴附到寄主根表后,在黄酮类、酚酸类、醌类、细胞分裂素以及cyclohexene oxides等寄主分泌的诱导因子作用下开始形成吸器,吸器的形成是列当由自养生长阶段向异养生长阶段(寄生状态)转变的重要步骤[58]。在列当吸器形成的不同阶段,吸器内部的氨基酸、糖类、酚类、酶等物质会发生显著变化[3]。生长素和细胞分裂素是具有拮抗作用的植物激素,两者在大麻列当O.ramosa吸器发育早期高表达从而调节吸器发育[5] ,采用RNAi技术沉默分枝列当乙烯合成路径相关基因PaACS,调控寄主向寄生物传递养分的基因Pam6PR和列当感知寄主分泌物信号的基因PaPrx1、PaACS和Pam6PR后,分枝列当产生的瘤节数量和生物量显著降低[6]。细胞分裂素及一种苔藓植物内生真菌Diplodia cupressi分泌的两种环氧环己烷类的植物毒素可诱导弯管列当Orobanche crenata和向日葵列当O.cumana的吸器发育[9];用细胞分裂素处理O.ramosa愈伤组织后将其与番茄根共培养,愈伤组织的侵袭力显著增强,且与细胞分裂素相关的吸器诱发基因PrRR5、PrCKX2、PrCKX4、PrTRN2和PrZFP6表达量迅速增加,说明细胞分裂素与吸器形成密切相关[5]。
马来酰肼是一种能在植物韧皮部和木质部传递的植物生长调节剂,可干扰瓜列当吸器的形成,被用于番茄上防治瓜列当,并已在以色列登记使用[7]。
为了明确分枝列当侵染甜瓜时吸器的形成过程及参与吸器形成的内源激素含量的变化,在分枝列当萌发和寄生甜瓜的不同阶段连续取样,采用石蜡切片技术和显微观察分析分枝列当吸器形成过程,明确分枝列当吸器形成的细胞学特征;同时利用液相色谱质谱联用技术(LCMS)检测分枝列当侵染甜瓜时吸器形成过程中植物激素的种类及含量,探究植物激素在分枝列当吸器形成过程中的作用。为进一步明确分枝列当吸器形成机制以及为后续建立有效列当防治措施提供理论依据。
1 材料与方法
1.1 材料
供试甜瓜品种‘K1076 ’由新疆农业科学院哈密瓜研究中心提供,分枝列当种子采集于新疆昌吉呼图壁县军户农场,经形态学和分子生物学鉴定为分枝列当。
1.2 试验方法
1.2.1 甜瓜幼苗培育
甜瓜种子用2%的次氯酸钠溶液处理15 min,再用75%乙醇处理3 min,最后用无菌水冲洗5次后放入装有200 mL无菌水的三角瓶中,置于恒温摇床中在27℃和170 r/min条件下培养,24 h后选取露白的种子播种于装有纯蛭石的128孔穴盘中,保湿并置于温室(温度28℃、光照强度10 000 lx, L∥D=16 h∥8 h)中培养2~3周。待幼苗长出第一片真叶后,用蒸馏水冲洗甜瓜幼苗根部,随后将其根平铺在根室(直径15 cm培养皿中依次放入一层12 cm×12 cm无菌海绵和2张直径15 cm滤纸)中,并用锡箔纸覆盖根室遮光,加水继续培养[10]。
1.2.2 列当种子接种甜瓜
选取完全成熟的分枝列当种子,用1%的次氯酸钠溶液处理15 min,75%乙醇处理2 min,再用无菌水冲洗4次备用。待根室中甜瓜幼苗培养1周后,在每株甜瓜幼苗新根周围接种0.08 g列当种子。
1.2.3 列当寄生过程观察
分枝列当种子接种甜瓜根部后3 d开始萌发,在显微镜下观察分枝列当初始吸器状态(S0:接种第5天)、附着状态(S1:接种第7天)、吸器基部开始膨大(S2:接种第9天)及寄生基部膨大形成小瘤,与寄主建立寄生关系(S3:接种第11天)4个发育阶段的组织形态。分别选取4个发育阶段的分枝列当与甜瓜连接部位组织,将其置于2.5%戊二醛固定液中固定,制作石蜡切片,在显微镜下观察寄生甜瓜根部的分枝列当的细胞结构。石蜡切片的制作参照白金瑞的方法[11]:将样品置于2.5%戊二醛固定液中固定24 h,依次用75%、85%、90%、95%及100%乙醇进行脱水处理,随后用二甲苯溶液处理15 min,将样品置于融化的石蜡液与二甲苯溶液的混合液(V∶V=1∶1)中,在45℃的烘箱中浸蜡4 h,随后置于纯蜡液中于65℃烘箱中浸蜡8 h。用包埋机包埋样品,于-20℃下冷却,以10 μm的厚度连续切片,并置于45℃的烘箱中烤片。将烤过的切片依次置于二甲苯溶液7 min,二甲苯溶液5 min、无水乙醇5 min、无水乙醇5 min进行脱蜡,清水冲洗干净,最后用加拿大树胶进行封片,在光学显微镜下观察和拍照。
1.2.4 列当寄生过程中植物激素的检测
待分枝列当生长到S0、S1、S2、S3阶段时,剪取列当与甜瓜幼苗根连接部位组织的样品,每个阶段3个重复,每个重复取约0.15 g连接组织,将其迅速置于液氮中冷冻,于-80℃保存,委托诺禾致源科技股份有限公司进行LCMS/MS检测,具体操作如下:
准确称取24种植物激素标准品,制备成混标母液,用甲醇将其稀释一系列浓度的工作液。配制一定浓度的indole3acetic acidD4、jasmonic acidD5、N6isopentenyladenineD6、dihydrozeatinD3、gibberellin A1D4、salicylic acidD4、abscisic acidD6溶液得到内标溶液(IS)。线性、内标和质控的母液及工作溶液均保存于-20℃冰箱。
液氮研磨组织样本,迅速称取100 mg粉末置于2 mL离心管,加入400 μL预冷的含混合内标的提取液(50%乙腈),涡旋混匀,4℃低温萃取30 min,经12 000 r/min离心10 min后,取上清液并将其缓慢经过Oasis PRiME HLB小柱;再次加入1 mL 30%乙腈,缓慢经过小柱,收集溶液,将两次溶液合并到1个离心管中,混匀后通过LCMS分析。色谱柱:Waters XSelect HSS T3(2.1 mm×150 mm,2.5 μm);A相:含0.01%甲酸的水;B相:含0.01%甲酸的乙腈;柱温45℃,进样量:10 μL;流速:0.3 mL/min。质谱条件:电喷雾电离(ESI),离子源温度550℃,负模式离子源电压-4 500 V,正模式离子源电压4 500 V,气帘气35 psi,雾化气60 psi,辅助气60 psi。采用多反应监测(MRM)进行扫描,对标准液的浓度系列分别进行 LCMS 检测。
1.2.5 数据处理
试验数据采用Excel 2010和IBM SPSS statistics 20进行方差统计分析。用Duncan氏新复极差法检验不同发育阶段之间的差异显著性(P<0.05),利用Origin 2020软件进行绘图。
2 ;结果与分析
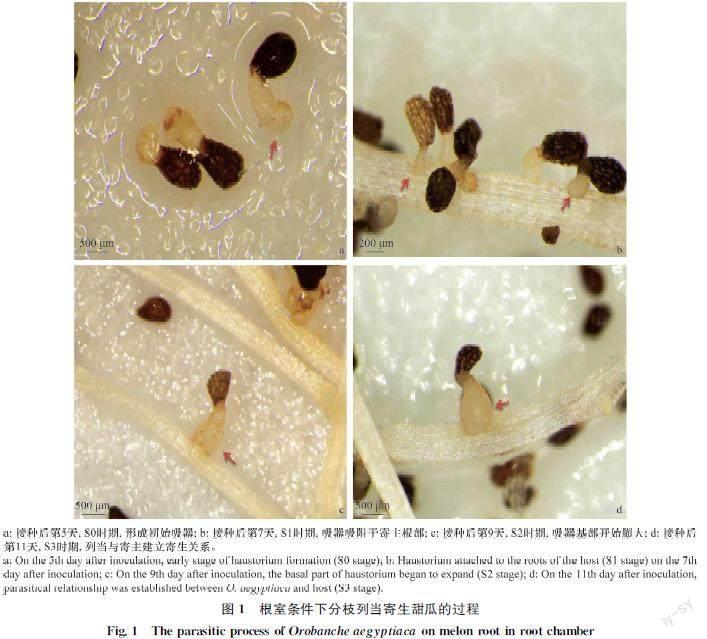
2.1 分枝列当寄生甜瓜过程观察
在根室条件下,分枝列当种子在接种至甜瓜根部后第3 天开始萌发,第5 天芽管顶端膨大形成初始吸器(S0时期,图1a),第7 天时稳固地贴附在寄主根部(S1时期,图1b),第9 天时列当寄生基部开始膨大(S2时期,图1c),接种后第11 天,寄生部位形成瘤节(S3时期,图1d),形成完整的寄生体系。
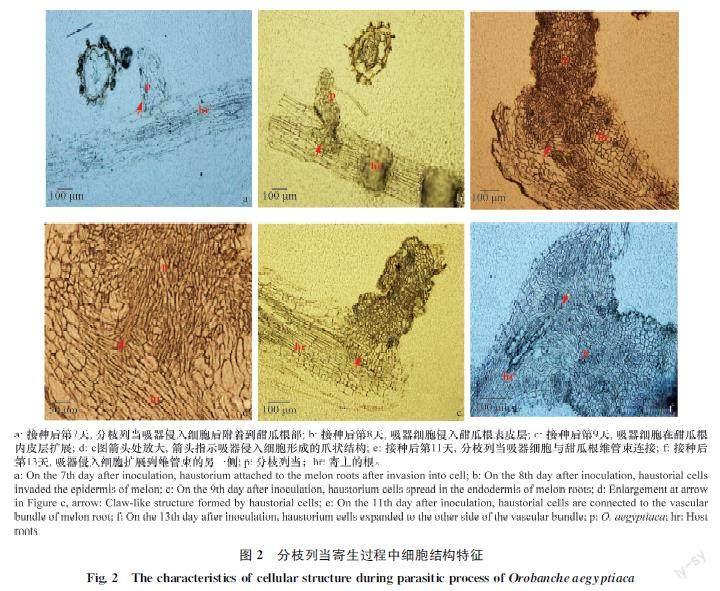
2.2 分枝列当吸器形成过程中细胞结构观察
石蜡切片结果表明,接种后第7天,分枝列当成功附着在甜瓜根上,此时分枝列当的吸器细胞贴附在甜瓜根表皮(图2a)。接种后第8天和第9天吸器细胞在甜瓜根皮层细胞间隙扩展,侵入根表皮组织(图2b, c),在此过程中吸器会特化形成一个爪状的结构,利于吸器侵入细胞后在甜瓜根皮层组织中固着(图2d)。接种后第11天,列当吸器的侵入细胞呈栅栏状整齐排列在寄主维管束周围(图2e),与寄主维管束建立连接关系,在此基础上列当吸器侵入细胞继续扩展到寄主维管束的另一端与维管束连接(图2f),完全建立起寄生关系。
2.3 吸器形成过程中内源激素变化情况
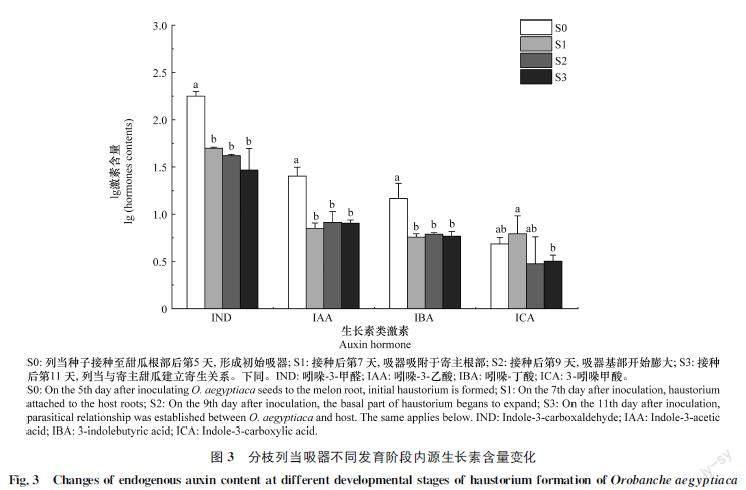
2.3.1 分枝列当吸器形成过程中生长素类激素含量变化
分枝列当吸器形成过程中生长素类激素吲哚3甲醛(indole3carboxaldehyde, IND)、3吲哚甲酸(indole3carboxylic acid, ICA)、吲哚丁酸(3indolebutyric acid, IBA)和吲哚3乙酸(indole3acetic acid, IAA)等生长素类激素含量变化情况见图3。IND、IAA、IBA在S0时期的含量显著高于S1、S2、S3时期。在S0、S1、S2、S3时期IND含量分别为179.9、49.95、42.21 ng/g和29.93 ng/g,从形成初始吸器(S0时期)到吸器细胞与维管束连接(S3时期)IND含量降低83.36%;在S0~S3时期IAA含量依次为26.21、7.21、8.71 ng/g和11.67 ng/g,S0時期的IAA含量为S1时期的3.6倍。S0~S3时期IBA含量依次为15.61、5.77、6.16 ng/g和7.71 ng/g,IBA在S0时期的含量比S1时期高1.71倍。ICA含量在吸器形成过程中变化不明显。
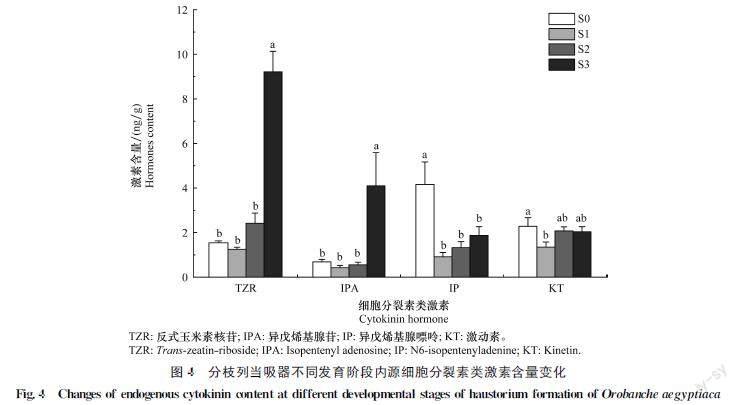
2.3.2 分枝列当吸器形成过程中细胞分裂素类含量变化
本研究共检测到了异戊烯基腺嘌呤(N6isopentenyladenine, IP)、异戊烯基腺苷(isopentenyl adenosine, IPA)、反式玉米素核苷(transzeatinriboside, TZR)和激动素(kinetin, KT)4种细胞分裂素,但未检测到反式玉米素(transzeatin, tZ)和双氢玉米素(dihydrozeatin, DhZ)。从分枝列当初始吸器形成时期(S0时期)至吸器细胞与维管束连接时(S3时期),TZR含量依次为1.53、1.25、2.42 ng/g和9.21 ng/g,IPA含量依次为0.68、0.42、0.55 ng/g和4.09 ng/g,相比S0时期,S3时期TZR含量增加了约5.02倍,而IPA含量增加了约5.01倍。IP在S0~S3时期的含量依次为4.16、0.91、1.32 ng/g和1.87 ng/g,相比S0时期,S3时期IP的含量下降了约55%;KT在S0~S3时期的含量依次为2.28、1.35、2.07 ng/g和2.03 ng/g,其中S0时期的含量显著高于S1时期(图4)。
2.3.3 分枝列当吸器形成过程中赤霉素类含量变化
共检测到了GA1、GA3、GA4 3种赤霉素类激素,但未检测到GA7。其中GA1在分枝列当吸器形成(S0时期)至吸器细胞与维管束连接(S3时期)含量依次为6.32、3.86、7.11 ng/g和4.26 ng/g,S0时期的含量显著高于S1时期。GA3在S0~S3时期含量依次为4.41、1.88、5.60 ng/g和5.08 ng/g,S0时期、S2时期、S3时期的含量显著高于S1时期;而GA4含量在分枝列当吸器形成过程中变化不显著(图5)。
2.3.4 分枝列当吸器形成过程中茉莉酸类激素含量变化
茉莉酸类化合物在植物的生长发育和抗逆性方面发挥重要作用。本研究检测到了N茉莉酸异亮氨酸(Njasimonic acidisoleucine,JAIle)、二氢茉莉酸(dihydrojasmonic acid,H2JA)、茉莉酸[(±)jasmonic acid, JA]3种茉莉酸类激素。JAIle在分枝列当吸器形成(S0时期)至吸器细胞与维管束连接(S3时期)含量依次为1.56、2.01、2.89 ng/g和2.32 ng/g,S2时期的含量显著高于S1、S0、S3时期。H2JA在S0~S3时期含量依次为0.69、1.49、0.85 ng/g和0.86 ng/g,S1时期的含量显著高于S0、S2、S3时期,JA在S0~S3时期含量依次为0.37、0.50、0.34 ng/g和1.38 ng/g,S3时期的含量显著高于S0、S1、S2时期(图6)。
2.3.5 分枝列当吸器形成过程中脱落酸、乙烯、水杨酸、油菜素内脂等激素含量变化
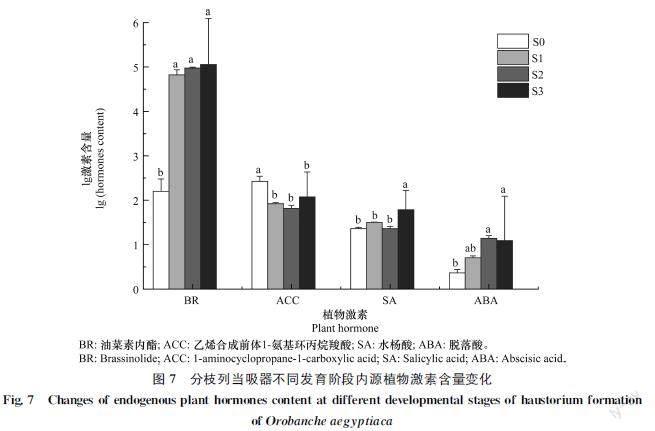
本研究检测了分枝列当吸器形成过程中脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)、乙烯合成前体1氨基环丙烷羧酸(1aminocyclopropane1carboxylic acid,ACC)、油菜素内酯(brassinolide,BR)等4种激素的含量。结果(图7)表明:SA在分枝列当吸器形成过程中含量呈现上升的趋势,在S3时期(61.24 ng/g)的含量显著高于S0(22.99 ng/g)、S1(31.85 ng/g)、S2(23.02 ng/g)时期;ACC在S0时期(284.96 ng/g)的含量显著高于S1(83.69 ng/g)、S2(83.69 ng/g)、S3(118.90 ng/g)时期;BR在S0时期的含量(237.04 ng/g),显著低于S1时期(71 197.51 ng/g)、S2时期 (98 420.24 ng/g)、S3时期(114 241.46 ng/g)。
3 结论与讨论
本研究采用显微镜观察,明确了分枝列当种子
接种到甜瓜根部第11 天时可完成种子萌发、侵入细胞和与甜瓜根部维管束建立连接的寄生过程。在列当种子接种甜瓜根部第8天、第9天、第10天时,分枝列当侵入细胞在甜瓜根皮层扩展过程中会形成大量的爪状结构,不仅扩大了侵入面积而且可起到固着作用。在接种第11 天时,分枝列当侵入细胞与甜瓜维管束连接,根据石蜡切片观察结果可将分枝列当吸器形成过程分为初始吸器状态(S0)、附着状态(S1)、吸器基部膨大(S2)及吸器细胞与维管束连接(S3)4个阶段。对4个阶段植物激素进行检测,生长素类激素在分枝列当S0时期的含量显著高于其他3个阶段。Zhang等对檀香Santalum album吸器形成过程转录组分析结果表明:生长素类激素合成基因在吸器形成前期处于高表达水平[12]。Ishida等研究表明生长素生物合成基因YUC3在根寄生植物松蒿Phtheirospermum japonicum吸器与寄主接触点的表皮细胞中特异性表达,说明生长素类激素在松蒿吸器的形成中起关键作用[13]。在本研究中生长素类激素IND、IAA、IBA含量在初始吸器階段(S0时期)的含量显著高于吸器形成后期,推测生长素类激素在分枝列当初始吸器形成过程中具有重要作用。
本研究结果表明,细胞分裂素类激素参与了分枝列当吸器形成,其中,反式玉米素核苷、异戊烯基腺苷在吸器形成前期含量保持稳定,后期含量显著上升,异戊烯基腺嘌呤、激动素在吸器形成前期含量显著下降后期保持稳定。推测异戊烯基腺嘌呤、激动素介导调控了吸器形成前期,而反式玉米素核苷、异戊烯基腺苷介导调控了吸器形成后期,说明细胞分裂素类激素在分枝列当吸器的形成过程中具有关键作用。寄生植物松蒿乙烯信号突变体在吸器的侵入细胞形成阶段和在寄主皮层扩展中表现出明显的缺陷[14],表明乙烯对吸器的形成具有重要的作用。在分枝列当吸器形成过程中乙烯合成前体1氨基环丙烷羧酸在初始吸器时期的含量显著高于吸器形成后期,推测1氨基环丙烷羧酸可能在分枝列当吸器侵入细胞形成时发挥重要作用。
Furuhashi等用油菜素内酯单独处理菟丝子时无法诱导出吸器[15],但在本研究中油菜素内酯在吸器形成后期的含量显著高于初始吸器时期。本研究检测了茉莉酸类、水杨酸、脱落酸、赤霉素类等植物激素在分枝列当吸器形成过程中的含量变化,检测结果显示:茉莉酸、N茉莉酸异亮氨酸、水杨酸在分枝列当吸器形成后期含量显著高于前期,说明这几类植物激素对寄生植物吸器形成具有关键作用,但植物激素调节植物生长发育是一个相互独立又协同作用的过程[16],分枝列当吸器形成或许是多种植物激素协同作用的结果,其中以生长素、细胞分裂素、油菜素内酯在分枝列当吸器形成过程中可能起主导作用。
參考文献
[1] EIZENBERG H, GOLDWASSER Y. Control of Egyptian broomrape in processing tomato a summary of 20 years of research and successful implementation [J]. Plant Disease, 2018, 102(2): 14771488.
[2] 张学坤, 姚兆群, 赵思峰, 等. 分枝(瓜)列当在新疆的分布, 危害及其风险评估[J]. 植物检疫, 2012, 26(6): 3133.
[3] HACHAM Y, HERSHENHORN J, DOR E, et al. Primary metabolic profiling of Egyptian broomrape (Phelipanche aegyptiaca) compared to its host tomato roots [J]. Journal of Plant Physiology, 2016, 205: 1119.
[4] YOSHIDA S, CUI S K, ICHIHASHI Y, et al. The haustorium, a specialized invasive organ in parasitic plants [J]. Annual Review of Plant Biology, 2016, 67: 643667.
[5] GOYET V, BILLARD E, POUVREAU J B, et al. Haustorium initiation in the obligate parasitic plant Phelipanche ramosa involves a hostexudated cytokinin signal [J].Journal of Experimental Botany, 2017, 68(20): 55395552.
[6] DUBEY N K, EIZENBERG H, LEIBMAN D, et al. Enhanced hostparasite resistance based on downregulation of Phelipanche aegyptiaca target genes is likely by mobile small RNA [J/OL].Frontiers in Plant Science, 2017, 8: e1574. DOI: 10.3389/fpls.2017.01574.
[7] VENEZIAN A, DOR E, ACHDARI G, et al. The influence of the plant growth regulator maleic hydrazide on Egyptian broomrape early developmental stages and its control efficacy in tomato under greenhouse and field conditions [J/OL]. Frontiers in Plant Science, 2017, 8: e691. DOI: 10.3389/fpls.2017.00691.
[8] BILLARD E, GOYET V, DELAVAULT P, et al. Cytokinin treated microcalli of Phelipanche ramosa: an efficient model for studying haustorium formation in holoparasitic plants [J]. Plant Cell, Tissue and Organ Culture, 2020, 141: 543553.
[9] FERNANDEZAPARICIO M, MASI M, MADDAU L, et al. Induction of haustorium development by sphaeropsidones in radicles of the parasitic weeds Striga and Orobanche. A structureactivity relationship study [J]. Journal of Agricultural and Food Chemistry, 2016, 64(25): 51885196.
[10]曹小蕾, 孫畅, 赵秋月, 等. 野生和栽培甜瓜对瓜列当抗性鉴定及评价[J]. 西北农业学报, 2020, 29(11): 17581766.
[11]白金瑞. 番茄抗寄生性杂草列当的遗传与调控机制[D]. 北京: 中国农业科学院, 2020.
[12]ZHANG Xinhua, BERKOWITZ O, DA SILVA J A T, et al. RNASeq analysis identifies key genes associated with haustorial development in the root hemiparasite Santalum album [J/OL]. Frontiers in Plant Science, 2015, 6: 661. DOI: 10.3389/fpls.2015.00661.
