聚乙烯亚胺修饰化二硫化钼光控纳米粒在阿替洛尔经皮递药中的应用
2024-02-05崔艺舰张凯乔天琪刘晓畅
崔艺舰,张凯,乔天琪,刘晓畅
(1.沈阳医学院基础医学院病原生物学专业2021级硕士研究生,辽宁 沈阳 110034;2.河北农业大学理工学院;3.河北北方学院研究生院;4.沈阳医学院药学院;5.沈阳医学院辽宁省过敏性疾病过敏原致病机制研究重点实验室)
高血压是世界范围内的健康问题之一,具有较高的发病率[1]。高血压的常规疗法是口服治疗,导致患者的依从性差,生物利用度低[2]。经皮给药系统 (transdermal drug delivery systems,TDDS)具有提高患者依从性、延长治疗效果、减少副作用、提高生物利用度等优势[2-3],可克服口服给药带来的问题。随着材料科学和纳米技术的发展,多种无机纳米材料作为载体材料广泛应用于TDDS, 如金、 银的纳米粒(nanoparticles,NPs)[4-5]、氧化石墨烯[6-7]等。其中,二硫化钼(MoS2)由于较高比表面积、易于表面改性、优异的光热转换能力而备受关注,已被用于多种药物递送的研究中[8-9]。Liu 等[10]研究了聚乙二醇(PEG)修饰的MoS2纳米片,发现MoS2的药物装载率远远高于氧化石墨烯的装载率。Chou等[11]描述了层状MoS2作为近红外光热剂的光热特性,并证明层状MoS2比石墨烯和金纳米棒表现出更好的光热性能。本研究开发了一种三维花状的聚乙烯亚胺修饰的二硫化钼纳米粒(polyethyleneiminemodified MoS2nanoparticles,PEI-MoS2NPs)作为光热剂和药物载体,并对其进行了体外药物释放、皮肤渗透、光热转化效率和载药效率研究,以期建立一种可以通过近红外激光照射控制药物释放的TDDS(图1)。
图1 PEI-MoS2 NPs作为载体的示意图
1 材料与方法
1.1 药品与试剂 四水合钼酸铵、硫脲、氨基甲酸乙酯、十二烷基硫酸钠(SDS)、聚乙烯亚胺(polyethyleneimine,PEI,M.W. =10 000 g/mol)均为分析纯,购于上海麦克林生化科技有限公司;阿替洛尔(色谱纯)购于上海罗恩化学技术有限公司;聚乙二醇400(PEG400,分析纯)购于天津百伦斯生物技术有限公司。甲醇、磷酸,均为色谱纯,购于山东禹王集团;HE 染色液试剂盒购于北京索莱宝科技有限公司。
1.2 实验动物 SPF级雄性Wistar大鼠6只,体重180~220 g,6~8 周龄,实验动物许可证号SCXK(辽)2019-0001;健康家兔4只,体重1.8~2.2 kg,3 月龄,雌雄不限,实验动物许可证号SCXK(辽)2019-0001,均购于辽宁长生生物有限公司。适应性喂养1周。本研究经学校实验动物福利伦理委员会审查,动物使用符合动物福利要求。
1.3 仪器 SYT-102 型多功能透皮扩散仪(延吉艾迪扼科技有限公司);Perkin Elmer 2000红外光谱仪(美国Perkin Elmer公司);Rigaku SmartLab SE X 射线衍射仪(日本Rigaku 公司);日立SU8100 扫描电子显微镜、日立L-2000 高效液相色谱仪(日本Hitachi 公司);JEOL JEM-2100F 透射电子显微镜(日本电子株式会社);H01-1D 磁力搅拌器(上海驰久仪器仪表制造有限公司);Spherisorb ODS2 C18 色谱柱(200 mm×4.6 mm,5 μm,美国Waters 公司);Mexameter® MX 16皮肤色素检测仪(德国Courage&Khazaka 公司);Phars 450/808-10W 多模泵浦激光器(深圳市启扬光学科技有限公司);DZF-6051 真空干燥箱(上海一恒科学仪器有限公司);BT-Zeta100 电位/粒度/分子量分析仪(丹东百特仪器有限公司);TSJ-Q组织脱水机、BMJ-III 包埋机(常州中威电子仪器厂);CM1950 冷冻切片机、DM4 B 显微镜(德国徕卡生物系统有限公司);Hamamatsu NanoZoomer-SQ数字切片扫描仪(日本滨松光子学株式会社)。
1.4 方法
1.4.1 PEI-MoS2NPs 的合成 采用一步水热法合成PEI-MoS2NPs[12]。将1.24 g 四水合钼酸铵、2.28 g硫脲和1.24 g PEI加入36 ml水中,搅拌溶解。将上述溶液转移至50 ml特氟隆内衬不锈钢高压釜中,在烘箱中220 ℃加热6 h。5 000 r/min离心10 min 后收集合成的产物,并用去离子水和无水乙醇洗涤3次。在60 ℃真空下干燥24 h后即得PEI-MoS2NPs。
1.4.2 PEI-MoS2NPs 的表征 使用BT-Zeta100 电位/粒度/分子量分析仪对PEI-MoS2NPs 进行粒径大小及Zeta 电位的表征。使用Perkin Elmer 2000红外光谱仪和KBr 压片法表征纳米粒的化学结构,扫描范围为400~4 000 cm-1。通过Rigaku SmartLab X 射线衍射仪表征NPs 的结构信息。扫描电子显微镜和透射电子显微镜用于观察NPs 的形态。
1.4.3 光热转换性能 配制不同浓度的 PEIMoS2NPs 溶液(0.1、0.5、1.0 mg/ml),在溶液中放入温度监测器,使用808 nm 多模泵浦激光器照射PEI-MoS2NPs 溶液5 min,记录溶液的温度变化。并通过3 次开闭循环实验探究光热稳定性。研究不同浓度PEI-MoS2NPs 在不同激光强度(0.2、0.5、1.0 W/cm2)对光热转化性能的影响。
1.4.4 HPLC-UV 法测定阿替洛尔的浓度 HPLCUV法色谱条件:流动相为甲醇-水-磷酸溶液(70∶30∶0.1,v/v/v),ODS-2 C18 色谱柱(200 mm×4.6 mm,5 μm),柱温为25 ℃,流速设定为0.7 ml/min,检测波长为275 nm。
1.4.5 载药效率的测定 称取适量PEI-MoS2NPs,分散于pH 7.0 磷酸盐缓冲液中超声30 min 后,制成1.0 mg/ml 的PEI-MoS2NPs 的混悬液。然后将相同体积不同浓度的阿替洛尔溶液加入到PEI-MoS2NPs溶液中,使药物与纳米粒的质量比在0.5∶1至1∶8 范围内。32 ℃恒温振荡48 h 后,室温下以13 300 r/min 离心5 min,分离游离药物和载药PEI-MoS2NPs。取上清液按“1.4.4 HPLC-UV 法测定阿替洛尔的浓度”项下测定样品中游离药物浓度,按下述公式计算载药效率:
1.4.6 体外释放实验 将水平双室扩散池置于32 ℃的加热槽中,扩散池的有效面积为1.5 cm2,体积为4 ml。在2个扩散池之间放置0.22 μm的尼龙滤膜,接收池中加入4 ml 含有15% PEG400 的pH 7.4 PBS溶液,供给池中加入4 ml供给液,其中非激光照射组和激光照射组为0.5 mg/ml 载药PEI-MoS2NPs溶液(药物浓度为0.27 mg/ml),对照组为0.27 mg/ml 的阿替洛尔水溶液。在8 h 内每小时从接收池中吸取2 ml 的样品,并用相同体积的新鲜PBS 替换。在1、3、5 和7 h 取样后,激光照射组使用激光(0.5 W/cm2)照射供给液5 min。按“1.4.4 HPLC-UV 法测定阿替洛尔的浓度”项下测定样品中药物浓度。
1.4.7 体外透皮实验 使用氨基甲酸乙酯(20%,w/v,5 ml/kg)腹腔注射麻醉大鼠后,脱脊椎法处死大鼠后切除腹部皮肤,仔细清除皮下组织。使用生理盐水清洗后,置于-80 ℃冰箱中备用。将准备好的皮肤固定于水平双室扩散池之间,使角质层面对供给池。供给池中加入4 ml 供给液,其中非激光照射组和激光照射组为0.5 mg/ml载药PEI-MoS2NPs溶液(药物浓度为0.27 mg/ml),对照组为0.27 mg/ml的阿替洛尔水溶液。在第2、4、6、8 h 取样2 ml 用于测定,并用相同体积的新鲜PBS 溶液替换。激光照射组于每个采样点后使用激光(0.5 W/cm2)照射供给液5 min。按“1.4.4 HPLC-UV 法测定阿替洛尔的浓度”项下测定样品中药物浓度。
1.4.8 在体皮肤的组织刺激性 采用在体皮肤红斑指数(erythema index,EI)实验及苏木精-伊红染色法(HE 染色)用于观测给药系统的皮肤刺激性。剃除家兔背部毛发,将皮肤分为4个面积为2.5 cm×2.5 cm 的区域,使用皮肤色素检测仪测定初始皮肤红斑指数(EI0)。使用10%(w/v)十二烷基硫酸钠(SDS) 水溶液作为阳性对照。将500 μl 水、0.5 mg/ml PEI-MoS2NPs 溶液和10%SDS 溶液分别涂布于皮肤分区内,另一空白区与PEI-MoS2NPs 溶液区需使用0.5 W/cm2激光每2 h照射5 min。每2 h测量EIt值,通过以下公式计算ΔEI值:
测量后用棉签清洁皮肤,将家兔处死后取皮,进行HE染色。
1.5 统计学方法 采用SPSS 16.0 软件进行统计学分析,符合正态分布的计量资料采用均数±标准差表示,组间比较采用方差分析和t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PEI-MoS2NPs 的表征 PEI-MoS2NPs 的平均直径为(486±81.70) nm。PEI-MoS2NPs 的Zeta 电位为(-27.023±0.63)mV,与MoS2NPs 的Zeta 电位[(-14.64 ±1.72)mV][13]相比,NPs电量增加,表明PEI 修饰后可增加NPs 的稳定性。使用红外光谱、X 射线衍射、透射电镜和扫描电镜对PEI-MoS2NPs 的结构进行表征,结果见图2。图2A 显示了PEI-MoS2NPs 的扫描电镜图片。MoS2纳米片卷曲成不规则的花状。样品的透射电镜结果(图2B、2C)与扫描电镜结果一致。PEI-MoS2NPs 的HREM 结果显示样品的晶型结构不明显,说明样品的结晶度不够,这与下述X射线衍射的结果一致。PEI-MoS2NPs 的红外光谱(图2D)所示。1573 cm-1和881 cm-1处的峰为-NH的弯曲振动。1 051 cm-1和1 090 cm-1处为MoS2的特征峰。结果表明,PEI 成功地修饰在了MoS2表面。PEI-MoS2NPs 的X 射线衍射结果(图2E)表明PEI-MoS2纳米颗粒具有相对较低的结晶度,与MoS2六方晶相的晶体结构相匹配[14],表明PEI对MoS2的结晶度有一定的影响,降低了结晶度,这与文献中的结论[9]一致。
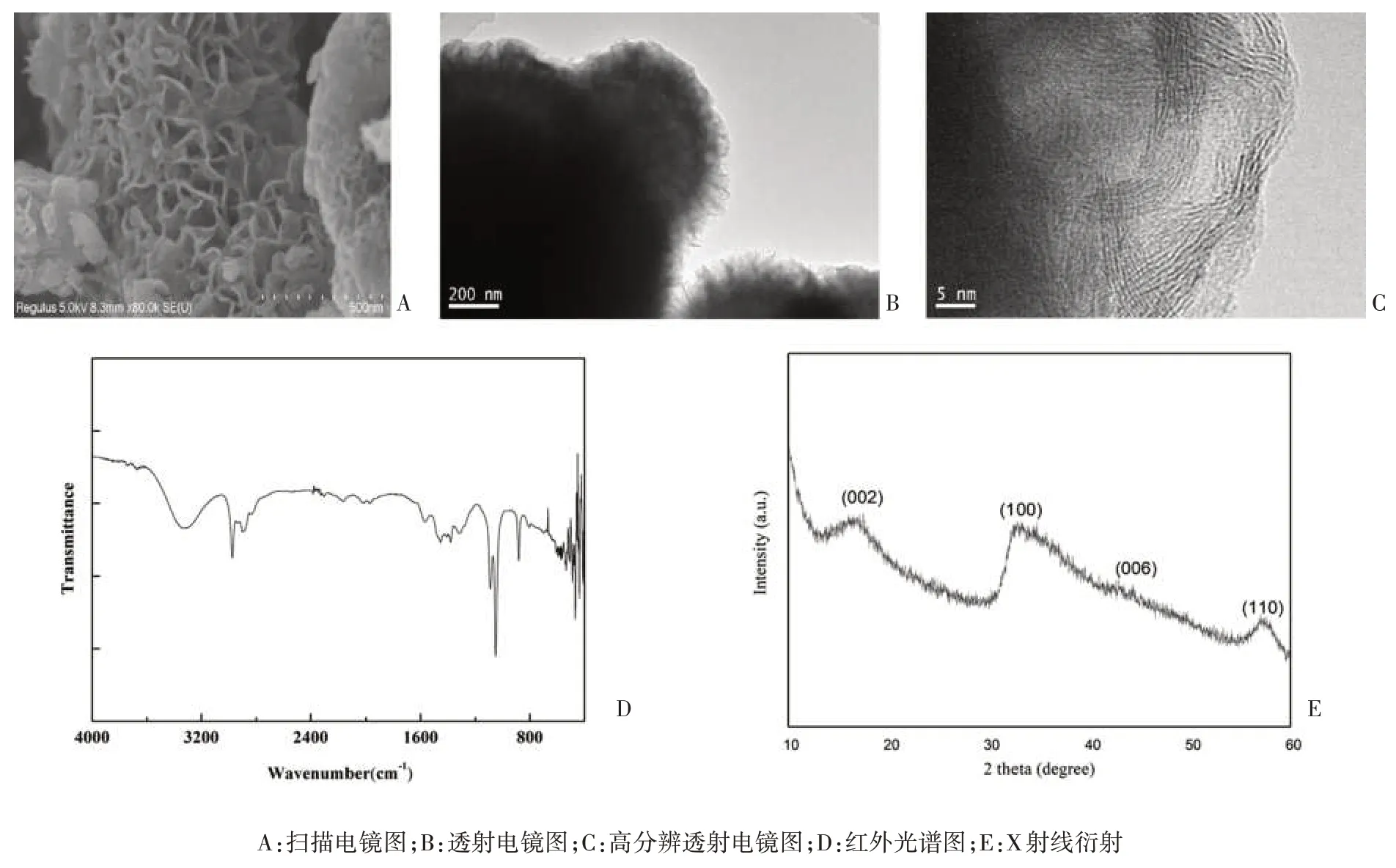
图2 PEI-MoS2 NPs的表征
2.2 光热转换性能研究 通过测定不同浓度的PEIMoS2NPs 溶液在近红外激光照射(0.5 W/cm2、5 min)下的温度,探讨PEI-MoS2NPs 的光热特性。对照组(水)在近红外激光照射后表现出小而缓慢的温度上升,而PEI-MoS2NPs 溶液的温度在激光照射期间迅速上升。当1.0 mg/ml NPs 溶液受到0.5 W/cm2的刺激时,温度达到了71.5 ℃。见图3。研究结果表明,溶液温度与PEI-MoS2NPs 的浓度和激光密度成正比。考虑到对皮肤的刺激,后续研究选取0.5 mg/ml的PEI-MoS2NPs溶液,激光强度0.5 W/cm2进行后续研究,使用该条件溶液温度可升至64.8 ℃。此外,光热循环实验结果表明PEIMoS2NPs具有良好的光热稳定性。总的来说,PEIMoS2NPs具有较好的光热转化能力。
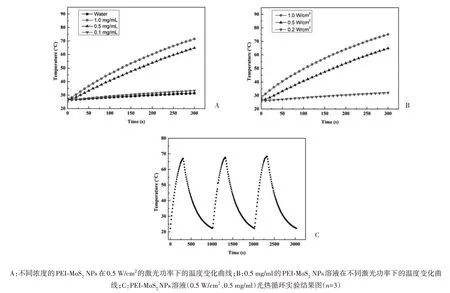
图3 PEI-MoS2 NPs的光热转化能力
2.3 载药效率的测定 载药效率随着阿替洛尔浓度的增加而增加,当阿替洛尔与PEI-MoS2NPs 的比例为4∶1(w/w)时,载药效率最高,可达到53.86%,见图4A。
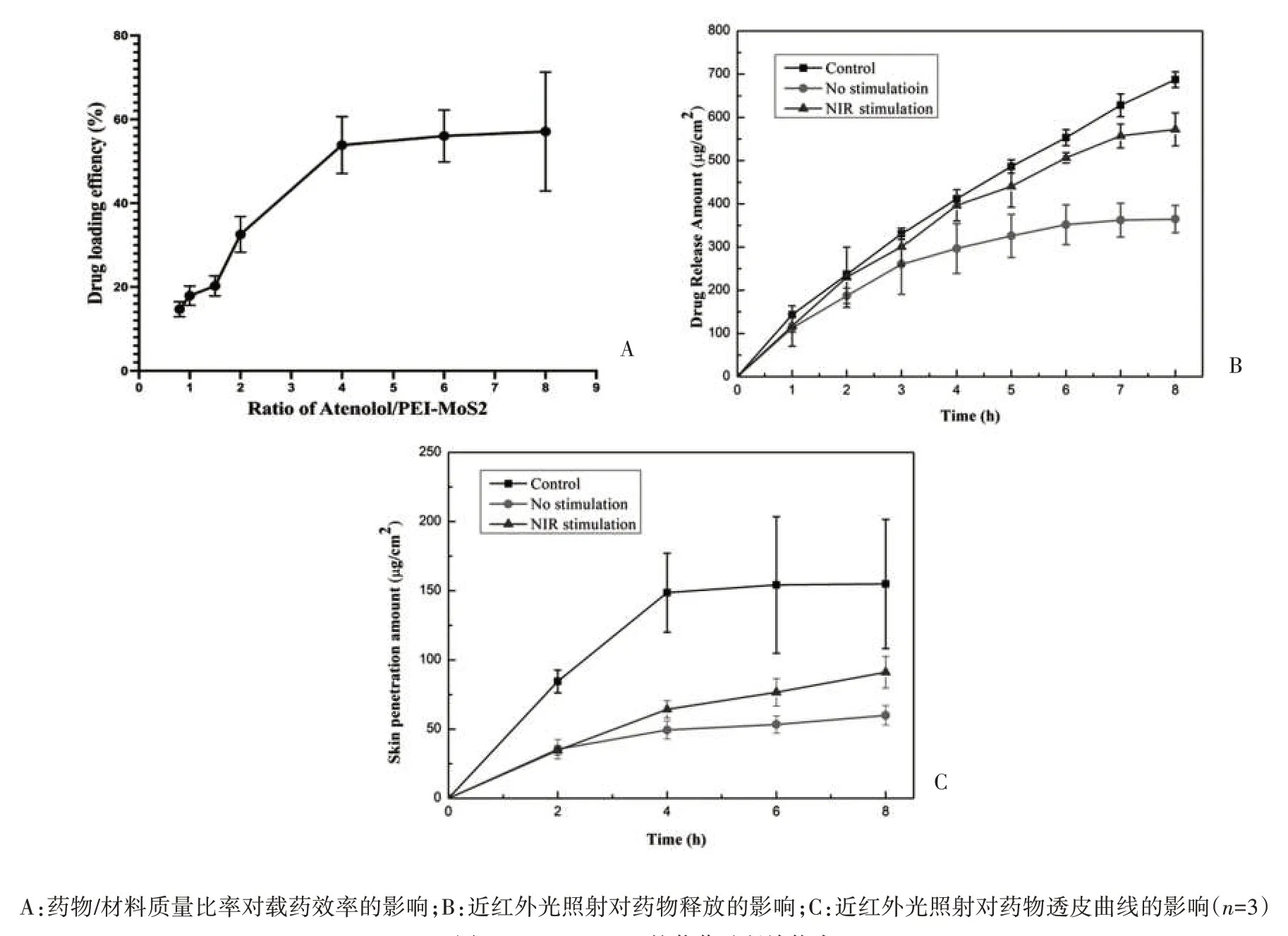
图4 PEI-MoS2 NPs的载药及释放能力
2.4 体外药物释放实验及体外透皮实验 使用PEI-MoS2NPs 作为载体装载阿替洛尔的释放速度显著慢于直接使用同浓度的阿替洛尔溶液(P<0.05);当PEI-MoS2NPs 未采用NIR 激光照射时,阿替洛尔在3 h 后释放浓度增长没有显著差异(P>0.05),8 h 累积释放量为(364.64±31.67)μg/cm2。而NIR 照射组8 h 累积释放量高达(572.11±37.99)μg/cm2,显著增加1.56 倍(P<0.05),表明近红外光可作为载药PEI-MoS2NPs 中药物的释放开关,见图4B。NIR 照射组的8 h 累积皮肤透过量为(91.09±11.36)μg/cm2,是未进行光照组(59.98±7.14)μg/cm2的1.5 倍,且在8 h 内没有出现剂量衰竭效应,而未经载药的阿替洛尔溶液在3 h 后出现剂量衰竭效应,表明808 nm 激光控释的PEI-MoS2NPs适用于TDDS,见图4C。
2.5 在体皮肤的组织刺激性 与空白对照组比较,局部使用10% SDS 后,ΔEI 非常显著增加(P<0.01),表明家兔可对皮肤刺激物产生正常的反应;与空白对照组比较,PEI-MoS2组、NIR组ΔEI差异无统计学意义,见图5。空白对照组、NIR 组和PEI-MoS2NPs 组均可以看到清晰的皮肤结构,角质层的片层结构完整,各组未有显著病理变化;而SDS 组角质层变薄,真皮层可见大量嗜酸性粒细胞,见图6。在体皮肤红色素指数实验与HE 染色结果均表明PEI-MoS2NPs 和NIR 对皮肤无刺激性,具有高生物相容性。
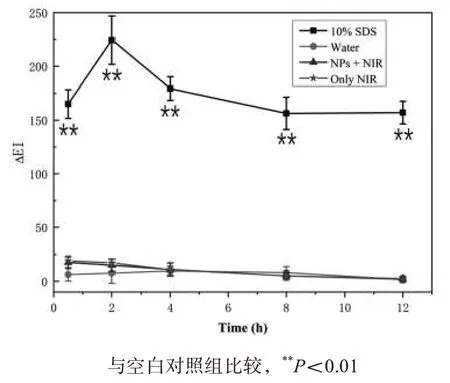
图5 在体皮肤红色素指数实验结果(n=3)
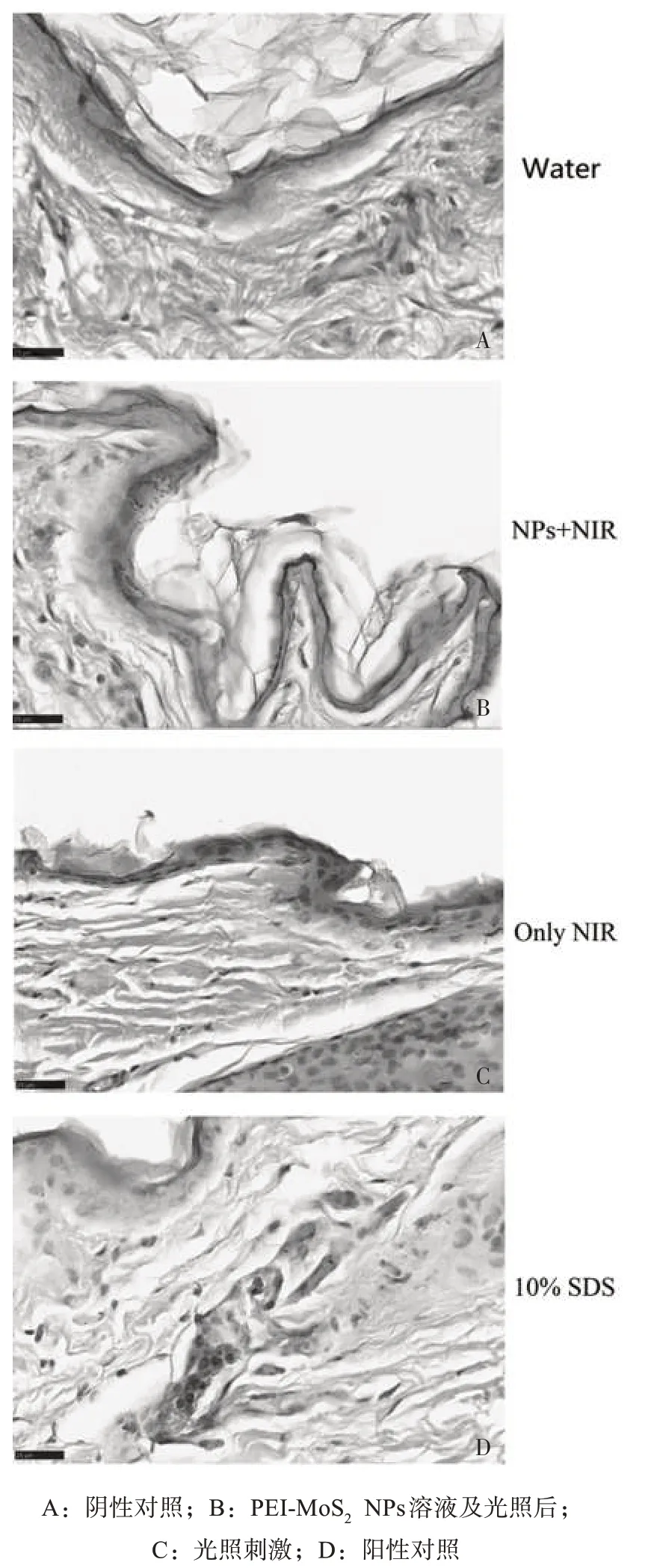
图6 活体刺激后兔皮的HE染色结果(×80)
3 讨论
聚合物修饰化无机纳米材料是药物递送领域的研究热点之一。本文通过静电吸附作用,采用一步水热合成法成功制备了PEI-MoS2NPs[15-16]。PEI 作为改良剂,常用以提高纳米材料的溶解度,增加纳米材料在药物递送中的应用[17-18]。本研究中PEI 修饰可以增加MoS2NPs 的带电量,从而增加其在水溶液中的稳定性。X 射线衍射结果表明,与纯MoS2相比,N 掺杂的PEI-MoS2NPs的(002)峰从14.11°移动到17.02°[19]。这可能与纳米粒片层结构层间距变窄有关,由于PEI 的N 原子的半径(0.80 Å)小于取代的S 原子(1.04 Å),N 进入MoS2的结构,从而导致片层间距减小。此外,傅里叶变换红外光谱、扫描电镜和透射电镜表征结果表明,PEI 成功地修饰在了MoS2的表面,形成新型3D花状PEI-MoS2NPs。
光刺激是常用的药物释放控释开关之一,常用于按需给药系统[20-21]。无机纳米材料的光热性能是一种很有前景的控释特性。一般来说,光热材料具有较高的光吸收率,光热材料通过光照后,光能被吸收,会激发材料内部的电子或原子,使其处于高能态。这些高能态的电子或原子会与材料内部其他的原子或自由电子振动模式相互作用,通过这种能量传递和能级转化从而将光能转化成热能。研究表明,MoS2在近红外区域(808 nm)表现出强烈的吸收,MoS2的浓度和激光功率是影响转换性能的重要因素[8,17]。本研究结果表明,PEI-MoS2NPs可以有效地将近红外转换为热能而不损伤皮肤。皮肤温度的增加也会增加药物释放和药物经皮吸收。药物释放和皮肤渗透是药物经皮吸收的2 个重要步骤,一般认为是被动扩散过程[22]。皮肤温度升高可以增加药物分子在角质层中细胞间脂质的扩散[23]。皮肤角质层由细胞间脂质和角质细胞组成,是大多数物质经皮吸收的天然屏障[24]。由于角质层的屏障功能,粒径较大的PEI-MoS2NPs,不能以整体的形式跨过皮肤角质层,只能在制剂基质中起到调控药物释放的作用[25]。本研究开发基于PEI-MoS2NPs的NIR响应的药物递送系统,可通过激光照射的方式增加药物从纳米粒中的释放,为按需给药提供了新的思路。与单纯使用药物溶液相比,避免了剂量衰竭问题,可以延长给药系统的作用时间,为提高患者的依从性提供了新思路。
此外,药物装载效率是影响给药系统的另一个重要因素。尽管二维MoS2纳米片具有出色的光热性能,但较低的药物装载能力仍然限制了其在载药系统的应用[10]。Yang 等[9]的研究表明具有较大表面积的三维MoS2NPs 表现出较高的药物装载能力。因此,本研究使用三维MoS2NPs作为TDDS平台,以达到持续释放阿替洛尔的需求。除了PEI-MoS2NPs 的三维花状结构外,PEI 的-NH2也可能提供了阿替洛尔的结合位点。因此,PEI-MoS2NPs 表现出较高的药物负载量,1 g PEI-MoS2NPs 可负载0.54 g 阿替洛尔,为开发新的可持续释放的长效TDDS提供了可能性。
本研究合成了PEI-MoS2NPs,用于递送β1-肾上腺素能受体阻滞剂阿替洛尔,PEI-MoS2NPs 能够有效地结合阿替洛尔,实现约54%的药物负载。NIR 刺激有效增强了药物的释放,并促进了药物在皮肤中的渗透。将PEI-MoS2NPs 作为透皮递送系统,为按需光控递药系统的开发提供了新的思路。此外,由于实验条件所限,本文缺少在体研究和PEI-MoS2NPs 载药机制研究,后续将进一步从孔隙变化、药物与纳米粒相互作用等角度评估这种新型材料在TDDS应用的潜力。
