长链非编码RNA RMST通过靶向微小RNA-24-3p抑制口腔鳞癌细胞增殖、迁移和侵袭
2024-02-03李逸舒屠淑贞
李逸舒 屠淑贞
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)占口腔恶性病变的90%以上,全世界每年约有30万新病例报告,患者5 年总生存率不足50%[1-3]。长非编码RNA(long non-coding RNA,lncRNA)异常表达已被证实参与口腔癌前病变[4-9]。研究显示横纹肌肉瘤2相关转录本(rhabdomyosarcoma 2 associated transcript, RMST)能够抑制乳腺癌细胞增殖和转移,抑制胶质瘤细胞线粒体自噬发挥肿瘤抑制因子的作用[10]。miR-24是一种肿瘤调控因子,在许多肿瘤组织中异常高表达[11-12]。生物信息学分析发现RMST和miR-24-3p可能存在靶向关系。本研究主要探讨RMST靶向miR-24-3p调控OSCC增殖、迁移和侵袭进程及分子机制。
1 材料与方法
1.1 生物信息学分析
UALCAN数据库分析癌症基因图谱头颈部鳞状细胞癌(head and neck squamous cell carcinoma, HNSC)组织中RMST表达。
1.2 实验材料
人口腔角质细胞NHOK和OSCC细胞株SCC25、HN6、HN4、Tca8113和CAL27(中国科学院上海生物化学与细胞生物学研究所)。
1.3 实验试剂
脂质体转染试剂Lipofectamine 3000(Thermo Fisher公司,美国);RPMI-1640培养基(Hyclone公司,美国);荧光定量试剂盒和反转录试剂盒(Takara公司,日本);MTT检测试剂盒和BCA蛋白定量试剂盒、pmirGLO reporter、pcDNA3.1空载体和RMST过表达载体(pcDNA3.1-RMST)(南京曼夫特生物科技有限公司);miR-24-3p mimics、NC(上海吉玛制药技术有限公司);兔源一抗E-钙粘蛋白(E-cadherin)、N-钙粘蛋白(N-cadherin)、c-myc(transcriptional regulator Myc-like)、GAPDH及HRP标记的二抗(武汉三鹰生物技术有限公司)。
1.4 细胞培养及处理
将2.5 μg pcDNA3.1空载、RMST过表达载体pcDNA3.1-RMST和miR-24-3p mimics与转染试剂Lipofectamine 3000混合孵育。细胞生长至密度60%更换无血清培养基,加入转染混合液。将CAL27细胞分为:control组(A)、pcDNA3.1组(B)、pcDNA3.1-RMST+mimics-NC组(C)和pcDNA3.1-RMST+miR-24-3p mimics组(D)。
1.5 荧光定量PCR(qRT-PCR)实验
细胞处理48 h后加入800 μL Trizol试剂裂解细胞,加入200 μL氯仿提取细胞总RNA。使用分光光度计检测RNA浓度,挑选A260/A280在1.8~2.0之间的RNA样本进行反转录合成cDNA,随后以此cDNA为模板进行荧光定量PCR检测。反应条件为:95 ℃ 30 s; 40 个循环的95 ℃ 5 s; 60 ℃ 30 s。本实验中RMST、E-cadherin、N-cadherin和c-myc的表达使用GAPDH作为内参,miR-24-3p的表达使用U6作为内参,定量结果采用2-ΔΔCt表示。
1.6 双荧光报告检测实验
通过PCR扩增miR-24-3p与RMST结合的种子序列,双酶切法将扩增片段插入双荧光报告质粒pmirGLO,得到荧光报告质粒pRMST,构建突变质粒pMut-RMST。将miR-24-3p mimics和阴性对照分别与报告质粒共同转染, 24 h后检测细胞荧光素酶活性。
1.7 MTT检测细胞增殖
分别在转染0、 24、 48、 72 h加入浓度5 μg/μL的MTT工作溶液,孵育4 h加入DMSO溶液。利用酶标仪测定490 nm的波长下吸光度A值。
1.8 细胞划痕实验
使用无菌枪头,垂直细胞划一条直线,显微镜下观察并拍照。置于无血清RPMI-1640培养基中培养。24 h之后,显微镜下观察并拍照。根据公式划痕愈合率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,计算24 h细胞划痕愈合率。
1.9 细胞侵袭实验
Transwell小室底部加入100 μL工作液水化基底膜,风干后加入100 μL培养基静置。细胞按照1×105/孔密度接种至小室,下室加入含10%FBS的完全培养基,培养24 h。 4%多聚甲醛固定30 min, 0.1%晶紫染液工作液染色20 min,显微镜下观察并照相。
1.10 Western blot实验
RIPA提取细胞总蛋白。每孔加样40 μg,加入缓冲液混匀,沸水蒸煮蛋白质变性。SDS-PAGE电泳,湿转法转膜, 5% BSA封闭2 h。4 ℃条件过夜孵育一抗。次日室温条件孵育二抗1 h。避光环境曝光显影。以目标条带与内参光密度比值作为蛋白相对表达量。
1.11 统计学分析

2 结 果
2.1 OSCC组织RMST表达
UALCAN数据库分析显示RMST在HNSC组织中低表达(P<0.01)(图1A)。且RMST表达与HNSC患者临床分期相关(图1B)。
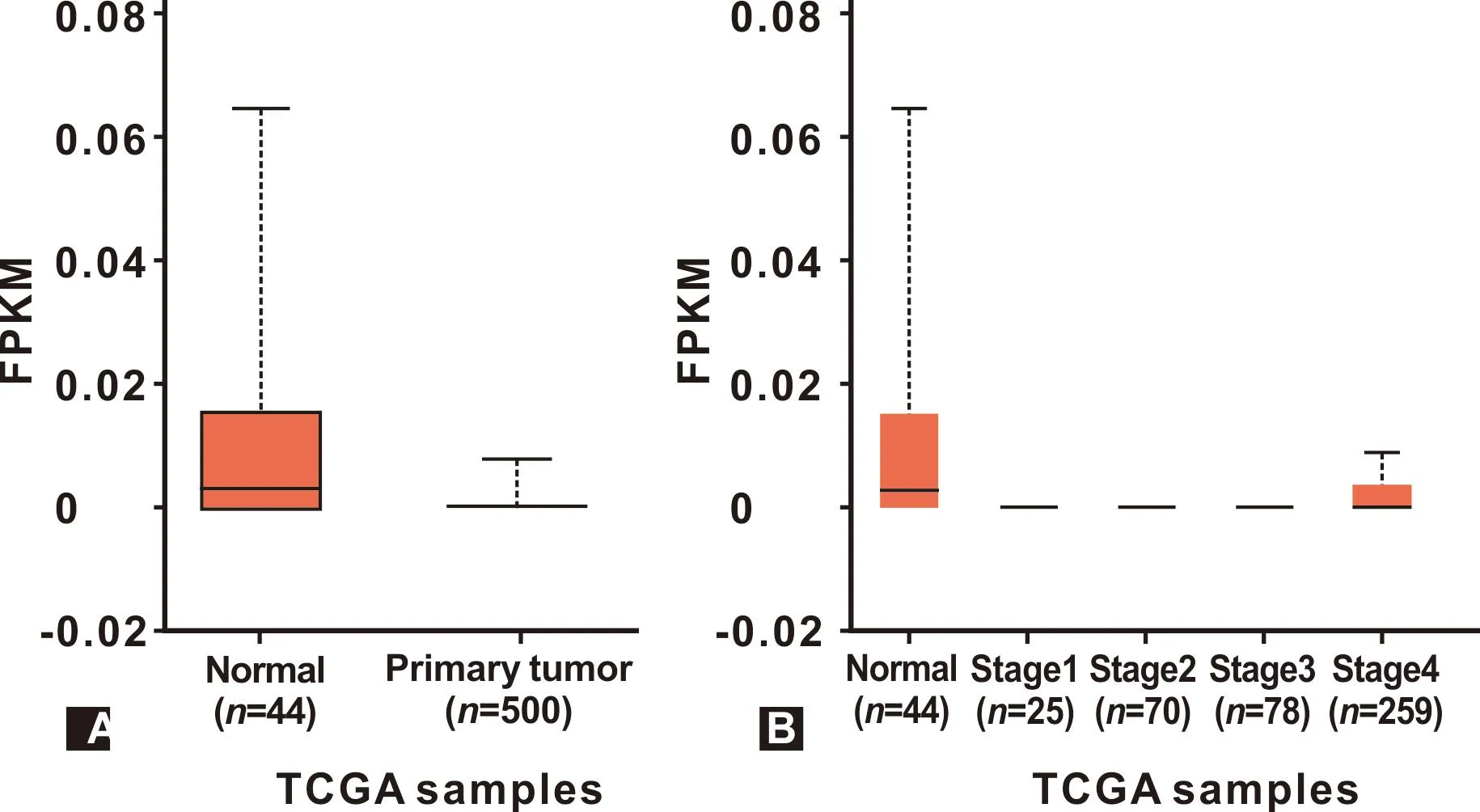
图1 HNSC组织中RMST的表达
2.2 OSCC细胞中RMST和miR-24-3p表达
RMST在OSCC细胞SCC25、HN6、HN4、Tca8113和CAL27中的相对表达水平低于NHOK细胞(P<0.05)(图2A);miR-24-3p在OSCC细胞SCC25、HN6、Tca8113和CAL27的相对表达水平高于NHOK细胞(P<0.05)(图2B)。
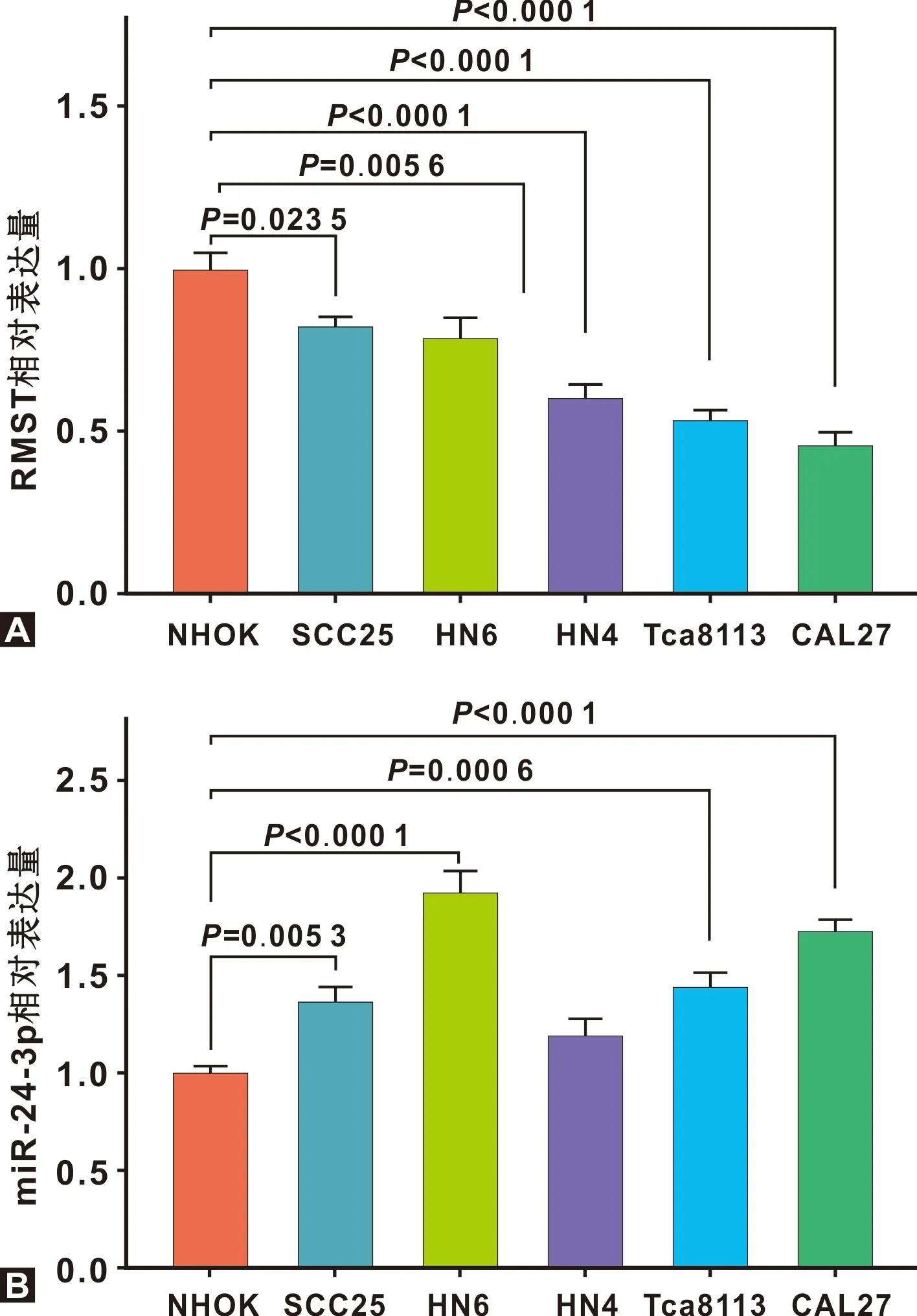
图2 RMST和miR-24-3p在OSCC细胞系中的表达
2.3 pcDNA3.1-RMST和miR-24-3p mimics转染效率
pcDNA3.1-RMST组CAL27细胞中RMST相对表达水平高于pcDNA3.1组(P<0.01),见图3A。miR-24-3p mimics组CAL27细胞中miR-24-3p相对表达水平高于mimics-NC组(P<0.01)(图3B)。说明pcDNA3.1-RMST和miR-24-3p mimics转染效果显著。

图3 pcDNA3.1-RMST和miR-24-3p mimics在CAL27细胞中转染效率
2.4 RMST靶向调控miR-24-3p
在线DIANA tools LncBase Predicted v.2预测显示RMST序列中含有miR-24-3p互补结合核苷酸序列(图4A)。荧光素酶基因报告检测显示,转染miR-24-3p mimics抑制野生型RMST的细胞荧光素酶活性(P<0.01),而对突变型RMST的细胞荧光素酶活性影响无统计学意义(图4B)。pcDNA3.1-RMST组miR-24-3p的相对表达水平低于pcDNA3.1组(P<0.01)(图4C)。
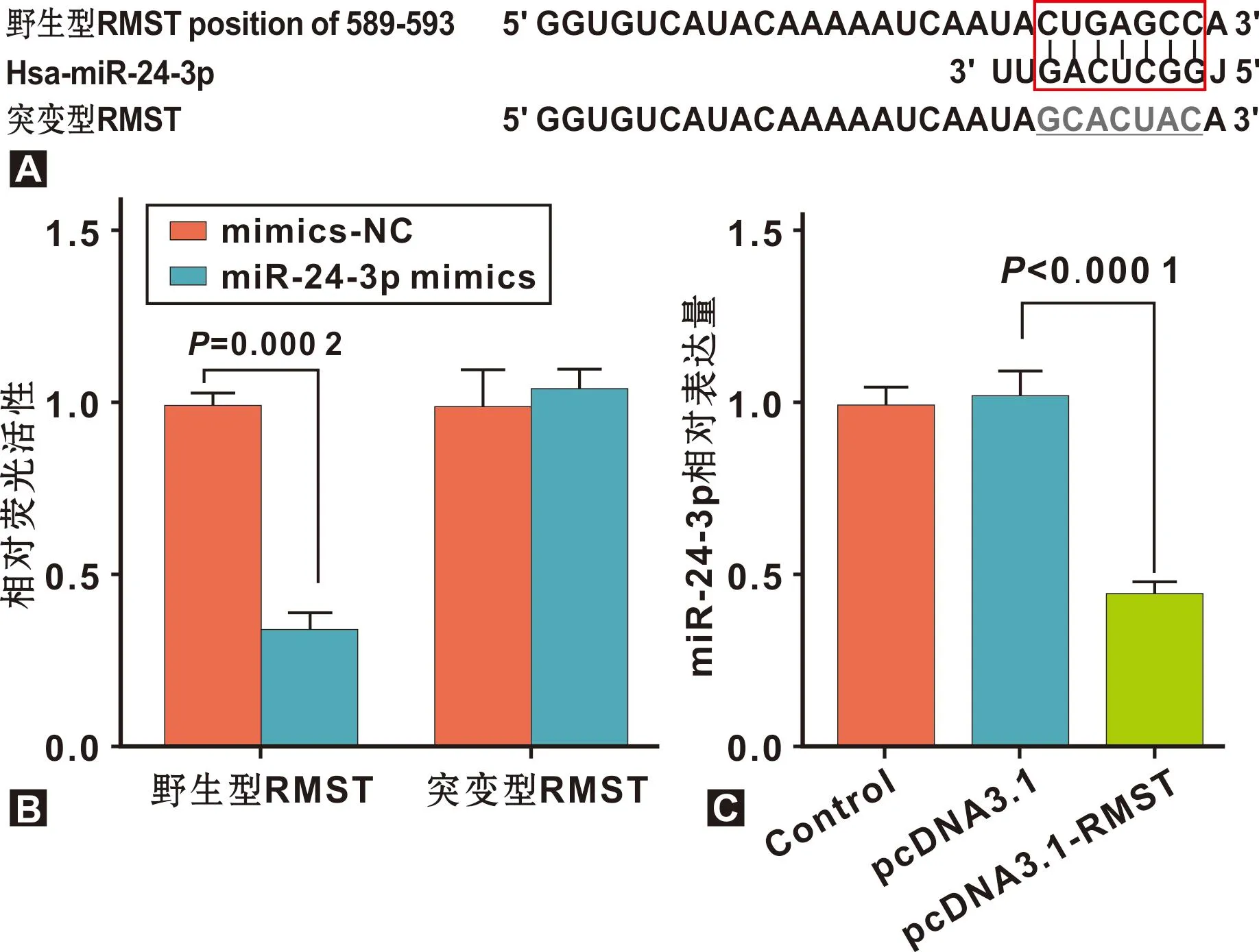
图4 RMST靶向调控miR-24-3p表达
2.5 RMST靶向miR-24-3p抑制CAL27细胞增殖
pcDNA3.1-RMST+mimics-NC组CAL27细胞增殖活力低于pcDNA3.1组(P<0.01);pcDNA3.1-RMST+miR-24-3p mimics组CAL27细胞活力高于pcDNA3.1-RMST+mimics-NC组(P<0.01)(图5)。
2.6 RMST靶向miR-24-3p抑制CAL27细胞迁移
pcDNA3.1-RMST+mimics-NC组细胞划痕愈合率低于pcDNA3.1组(38.707%±2.545vs86.910%±2.342,P<0.01);另外,pcDNA3.1-RMST+miR-24-3p mimics组细胞划痕愈合率高于pcDNA3.1-RMST+mimics-NC组(83.990%±2.677,P<0.01)(图6)。

图6 RMST靶向miR-24-3p影响CAL27细胞迁移(×100)
2.7 RMST靶向miR-24-3p抑制CAL27细胞侵袭
pcDNA3.1-RMST+mimics-NC组细胞穿膜数量少于pcDNA3.1组(24.333个±1.764vs80.667个±3.383,P<0.01);另外,pcDNA3.1-RMST+miR-24-3p mimics组细胞穿膜数量多于pcDNA3.1-RMST+mimics-NC组(75.333个±5.783,P<0.01)(图7)。
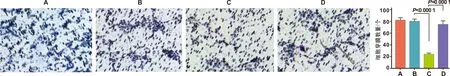
图7 RMST通过靶向miR-24-3p影响CAL27细胞侵袭(×100)
2.8 RMST通过靶向miR-24-3p影响CAL27细胞转移相关因子表达
相较于pcDNA3.1组,pcDNA3.1-RMST+mimics-NC组E-cadherin表达升高,N-cadherin和c-myc表达降低(P<0.01)。相较于pcDNA3.1-RMST+mimics-NC组,pcDNA3.1-RMST+miR-24-3p mimics组E-cadherin表达降低,N-cadherin和c-myc表达升高(P<0.01)(图8)。

图8 RMST靶向miR-24-3p影响CAL27细胞转移相关因子表达
3 讨 论
E-cad、 N-cad、 c-myc在肿瘤中意义,及与RMST、miR-24-3p的相关性及在肿瘤侵袭转移等中的意义尚需进一步理顺及完善。
LncRNA在OSCC等肿瘤疾病中发挥多种功能。RMST最初被鉴定是横纹肌肉瘤中潜在功能性非编码RNA[13],随后被证实对大脑发育、神经发生至关重要[14]。最近,人们逐渐开始关注RMST在肿瘤生理中的作用。Yang等[15]发现低表达RMST的三阴性乳腺癌患者总生存期更短。Wang等[16]证实RMST抑制三阴性乳腺癌细胞增殖、侵袭和迁移,促进细胞凋亡,调节细胞周期,发挥抑癌作用。最近,有学者通过芯片分析发现RMST在OSCC组织中表达异常,可能和has-mir-204/211/31发生互作[17]。然而目前RMST在OSCC生物学过程中功能尚不清楚。本研究通过生物信息学分析TCGA数据库发现RMST在HNSC组织中低表达,检测发现其在OSCC细胞中表达量减少,其中CAL27细胞中表达量仅为NHOK细胞约0.46倍。CAL27细胞中构建RMST过表达载体,检测发现增强RMST表达明显抑制CAL27细胞的增殖、迁移和侵袭,同时上调细胞中E-cadherin的表达、下调N-cadherin和c-myc的表达。E-cadherin在细胞间粘附中起核心作用,其表达丧失是上皮间质转化(EMT)的标志之一,而EMT被认为是转移的早期关键步骤[18-19]。E-cadherin表达的缺失通常伴随着间充质和细胞外基质生物标志物N-cadherin、MMP-9和波形蛋白(vimentin)水平的增加。 c-myc对维持上皮源性癌症转移至关重要,它可以通过TGF-β/Snail和RhoA信号通路等激活EMT表型,使E-cadherin表达丧失,进而引起肿瘤细胞侵袭和迁移[20]。通过上述结果可知RMST影响OSCC细胞增殖和转移恶性表型,参与OSCC的肿瘤发展,然而RMST调控OSCC的机制尚不清楚。
LncRNAs可以通过ceRNA机制参与调控癌症进程[21-22]。本研究预测并结合双荧光基因报告确认miR-24-3p是RMST的靶miRNA,RMST能够通过互补结合负调控miR-24-3p的表达。最近,唾液外泌体miR-24-3p被发现能够作为OSCC筛选的新型诊断生物标志物,并且通过靶向PER1维持OSCC细胞增殖[23]。为验证RMST调控OSCC恶性表型是否通过靶向miR-24-3p实现,在转染RMST过表达载体基础上加入miR-24-3p mimics,检测发现miR-24-3p过表达处理明显逆转RMST对CAL27细胞增殖、迁移和侵袭的抑制作用,同时下调E-cadherin表达、上调N-cadherin和c-myc的表达。有研究证实miR-24可以靶向调控c-myc表达,消除c-myc过表达对肿瘤细胞侵袭的促进作用,并与E-cadherin表达恢复有关抑制EMT过程[24]。由此可见RMST能够通过竞争性靶向并抑制miR-24-3p表达,上调癌基因c-myc和N-cadherin、下调E-cadherin表达,加速OSCC细胞的增殖、迁移和侵袭。先前有研究报道,RMST能够结合miR-204-5p、 miR-377等影响大脑微血管内皮细胞损伤和神经元凋亡[25-26]。目前需要大量研究进一步证实RMST利用ceRNA机制调控肿瘤进程。
综上所述,RMST在OSCC细胞中表达水平异常降低,过表达RMST可能通过负调控miR-24-3p抑制OSCC细胞的增殖、迁移与侵袭,在OSCC发展中发挥肿瘤抑制基因作用。本研究仍具有局限性,在今后的研究中将深入探究miR-24-3p下游调控靶点,并在动物水平进行验证。
