癸酸咪唑啉季铵盐缓蚀剂对HEDP体系的缓蚀与阻垢性能影响
2024-02-03温福山刘文亮
温福山,徐 渊,刘文亮
(1.中国石油大学(华东)材料科学与工程学院材料化学系,青岛 266580;2.中国石油大学(华东)化学化工学院生物与能源化工系,青岛 266580)
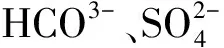
向体系中加入阻垢剂可以有效防止水垢形成。羟基乙叉二膦酸 (HEDP) ,作为一种代表性的有机膦酸阻垢剂,是国内产量最大的阻垢剂之一, 也是国内外广泛应用的阻垢剂[3-5]。HEDP不仅有良好的化学稳定性,而且对CaCO3垢有较好的螯合清除作用[6]。郭静等[7]研究发现HEDP对碳钢有一定的缓蚀阻垢效果,加量60 mg/L时其缓蚀率为62.54%,阻垢率为82.68%。但作为一种弱酸,HEDP会对金属基体造成腐蚀。黄金营等[8]研究发现,含1%(质量分数,下同)HEDP条件下,Q235钢挂片的腐蚀速率为3.86 g/(m2·h)。该课题组同时研究了HEDP体系下,IS-129 (咪唑啉类) 、苄基季铵盐、酮醛胺缩合物以及乌洛托品等缓蚀剂的缓蚀效果,发现咪唑啉类缓蚀剂的效果最佳,但没有研究缓蚀剂与阻垢剂之间的相互作用。
体系中,阻垢剂和缓蚀剂会同时存在,两者之间的相互作用对实际应用具有重要的意义,但体系中缓蚀剂与阻垢剂相互影响的研究却鲜见报道。研究阻垢剂体系下,缓蚀剂对阻垢剂阻垢效果的影响可以为实际阻垢体系中缓蚀剂的选择提供理论指导。因此,笔者以癸酸咪唑啉缓蚀剂为例,研究其在HEDP体系中的缓蚀效果及对其阻垢效果的影响,以期为后续阻垢体系下缓蚀剂的选择提供思路。
笔者首先根据文献[9]简单合成了癸酸咪唑啉季铵盐缓蚀剂 (DI)。通过静态失重法、电化学方法以及表面形貌观察等研究了其在含1%HEDP水溶液中的缓蚀性能。同时,通过碳酸钙沉积法研究了癸酸咪唑啉季铵盐对HEDP水溶液阻垢性能的影响。利用Materials Studio软件对DI以及HEDP在碳酸钙方解石 (104) 和 (102) 晶面的吸附行为进行了分子动力学模拟,结合试验结果,从分子水平上研究了DI对HEDP阻垢性能的影响机理。
1 试 验
1.1 材料与仪器
试验材料有羟基乙叉二膦酸 (HEDP ) (净含量≥90%),癸酸,二乙烯三胺,甲苯,氢氧化钾,碳酸氢钠,氯化钙,溴甲酚绿,甲基红,钙-羧酸指示剂。上述溶液均为分析纯级。
试验仪器有电子分析天平 (ML304T/02) ,电热恒温干燥箱 (DHG-9023A),循环水真空泵 (SHB-Ⅲ G),旋转蒸法器 (RE-52AA),电热式恒温搅拌器 (SZCL-3A),傅里叶红外光谱仪 (TENSOR II),X射线衍射仪(XRD-7000L),场发射扫描电子显微镜(FEI Quanta FEG 250)。
1.2 咪唑啉季铵盐缓蚀剂的合成
根据文献[9]报道的方法,以癸酸、二乙烯三胺和氯化苄为原料制备癸酸咪唑啉季铵盐化合物。将0.1 mol癸酸和30 mL甲苯放入三颈烧瓶中,加热、升温至363 K,通过恒压滴液漏斗向烧瓶中缓慢加入0.12 mol二乙烯三胺,升温至443 K,反应4 h;再升温至493 K,环化反应8 h;将反应物冷却至373 K,向反应物中缓慢滴加0.12 mol氯化苄,373 K保温3 h,通过旋转蒸发仪除去多余的溶剂,得到癸酸咪唑啉季铵盐化合物 (DI),其熔点为338~340 K。采用压片法对合成的癸酸咪唑啉季铵盐化合物进行了红外光谱测试。
1.3 缓蚀性能评价
1.3.1 静态失重法
根据SY/T 5405-2019《酸化用缓蚀剂性能试验方法及评价指标》,采用静态失重法评价癸酸咪唑啉季铵盐在含1% HEDP体系中的缓蚀性能。试样为N80钢片,尺寸为50 mm × 10 mm × 3 mm,试样表面用金相砂纸打磨至平整光洁且无痕后,用丙酮和无水乙醇对其洗涤三次,冷风吹干,待试样完全干燥后称量。腐蚀介质为含1%(质量分数)HEDP的水溶液(下文简称1% HEDP水溶液),在腐蚀介质中加入不同量的癸酸咪唑啉季铵盐,测试温度为303 K,测试时间为24 h。
通过测量试样试验前后质量变化,并结合腐蚀面积计算腐蚀速率,如式 (1) 所示:

(1)
式中:vcorr为试样的腐蚀速率,g/(m2·h);W0和Wt分别为试样腐蚀前后的质量,g;A为试样的表面积,m2;t为腐蚀时间,h。
缓蚀率(η)的计算公式如式 (2) 所示:
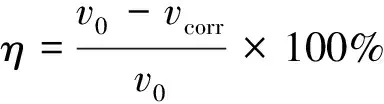
(2)
式中:η为缓蚀率;v0为未加缓蚀剂的空白试样的平均腐蚀速率,g/(m2·h);vcorr为加入缓蚀剂后试样的平均腐蚀速率,g/(m2·h)。
1.3.2 电化学测试
电化学试验在上海辰华公司的CHI760E型电化学工作站上进行,采用三电极体系:参比电极为饱和甘汞电极 (SCE),辅助电极为铂片电极,工作电极为试样,其有效工作面积为1 cm2,其余部分使用环氧树脂封装,有效工作区域的处理方法与静态失重试验相同。电解液为加入不同量癸酸咪唑啉季铵盐的1%HEDP水溶液,测试温度为303 K。测试前,将电极置于溶液中一段时间,待体系的开路电位稳定后再进行测试。电化学阻抗谱 (EIS) 测量频率为0.01 Hz~100 kHz,交流激励信号幅值为5 mV,延迟时间为3 600 s。极化曲线扫描范围为-150~150 mV(相对于开路电位),扫描速率为1 mV/s。通过程序对所得数据进行拟合,得到腐蚀电化学参数βa(阳极极化曲线斜率),βc(阴极极化曲线斜率) 和Jcorr(腐蚀电流密度)。
1.3.3 表面形貌及物相分析
采用环氧树脂将尺寸为10 mm×10 mm×3 mm的 N80钢试样封装后对其表面进行打磨,并抛光至镜面。洗涤干燥之后,分别将试样放置在1% HEDP水溶液和含400 mg/L DI的1% HEDP水溶液中24 h,温度为303 K。采用扫描电子显微镜(SEM)观察试样浸泡前后的表面形貌,并通过X射线衍射(XRD)确定腐蚀产物以及垢层的物相组成。
1.4 静态阻垢试验


(3)
式中:V1为含不同量DI的1% HEDP水溶液中,试验结束时消耗的EDTA的体积,mL;V2为空白水样中试验后消耗的EDTA的体积,mL;V3为配制用水所消耗的EDTA的体积,mL。
1.5 分子动力学模拟
采用Materials Studio(MS)软件[10]进行分子动力学 (MD) 模拟,选择Forcite模块及Compass力场、NVT系综、Andersen恒温器,对方解石晶体的主要生长晶面 (104)与 (102) 晶面在303 K及353 K条件下,与DI及HEDP构成的体系进行模拟计算。
在众多碳酸钙晶型中,方解石是最稳定的晶体结构, (104)、(102) 晶面是它的主要生长晶面[11]。采用MS软件中的Cleave方法构造晶体表面,采用超晶胞构建三维模拟空间,模拟周期真空箱的三维尺寸为477.516 nm×809.540 nm× 499.000 nm,共分为三层,上部是真空层,中间是DI/HEDP和水分子,下部是方解石晶面;模拟时间为1 000 ps(前500 ps用于体系平衡,后500 ps用于取样分析),最后通过几何优化模块对分层模型进行优化。优化后方解石晶面模型如图1所示,HEDP与DI分子最优构型如图2所示。

图1 方解石几何优化后的 (104)和 (102)晶面(Ca=绿; O=红; C=灰)Fig.1 (104) and (102) crystal planes of calcite after geometric optimization (Ca=green; O=red; C=gray): (a) calcite(104); (b) calcite(102)

图2 DI和HEDP几何优化后的分子结构Fig.2 Molecular structure of DI and HEDP after geometricoptimization: (a) DI; (b) HEDP
为了研究DI及HEDP分子对碳酸钙垢的吸附能力,在水相中进行了分子动力学模拟。DI与方解石(104)及HEDP与方解石(104)在分子动力学模拟期间温度和总能量波动曲线如图3所示。可以看出,两个系统的温度和总能量波动曲线轨迹较为平稳,表明体系已经达到平衡状态,计算结果可靠。

图3 HEDP与DI在与方解石(104)结合过程中能量和温度的波动曲线Fig.3 Fluctuation curves of energy and temperature of HEDP and DI during combination with calcite (104): (a) HEDP; (b) DI
2 结果与讨论
2.1 红外光谱及物性参数
由图4可见:合成物1 610 cm-1附近的吸收峰为咪唑啉环中C=N伸缩振动吸收峰;2 930,2 860 cm-1两处的强吸收峰为-CH3及-CH2-中的C-H对称伸缩振动和反对称伸缩振动峰;3 300 cm-1附近的吸收峰是N-H的伸缩振动峰;在760,1 460 cm-1两处有明显的苄基吸收峰,与文献[12]报道基本吻合,初步证明合成了目标产物。此外,测试了中间体癸酸咪唑啉以及癸酸咪唑啉季铵盐(DI)的溶解度,发现DI在水中的溶解度要远大于中间体中。
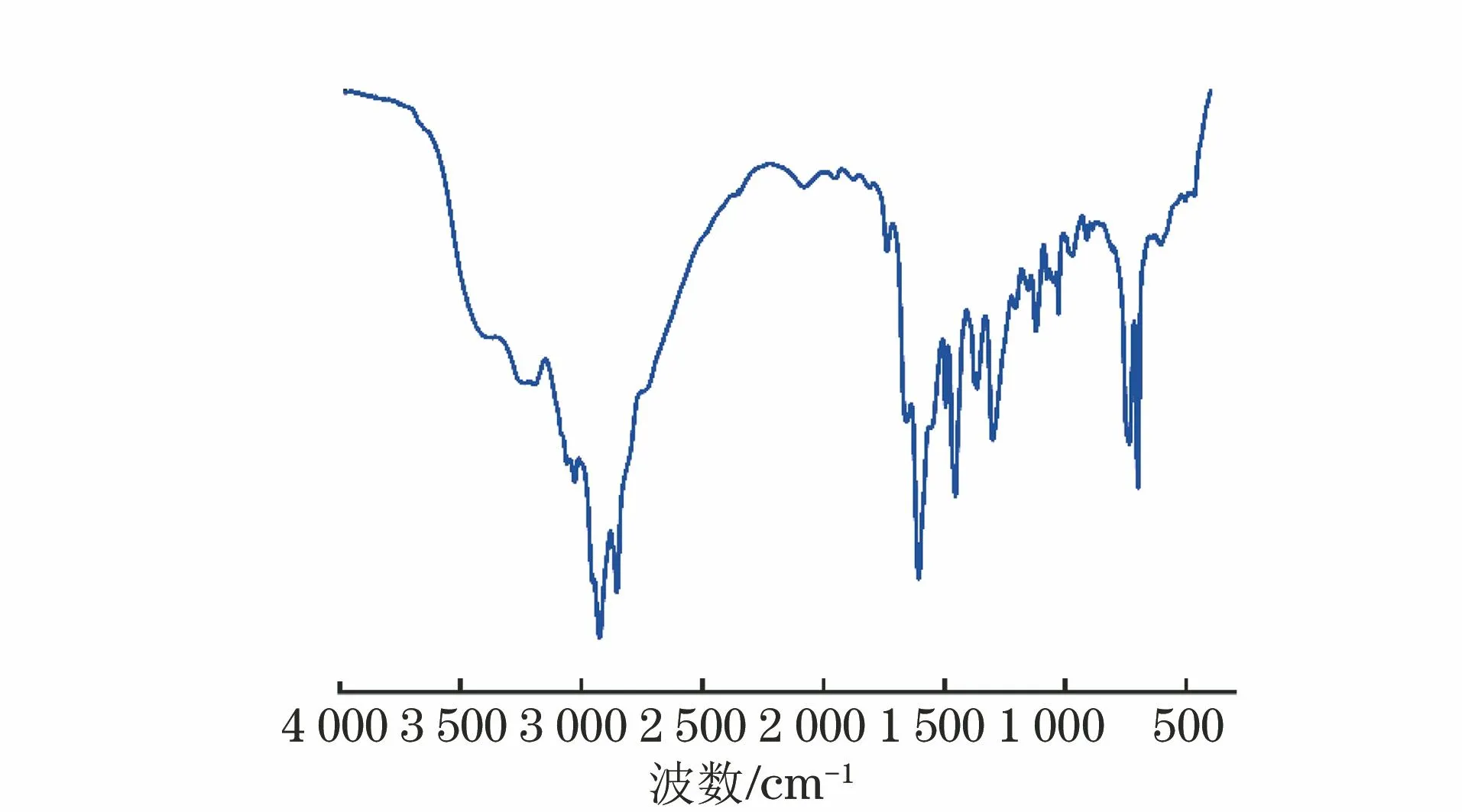
图4 癸酸咪唑啉季铵盐的红外谱Fig.4 Infrared spectrum of decanoic acid imidazolinequaternary ammonium salt
2.2 缓蚀性能
2.2.1 静态失重法
缓蚀剂DI加量分别为0,50,100,200,400,600 mg/L时,试样在1% HEDP水溶液中的静态失重试验结果见表1。由表1可知,在1% HEDP体系中,试样的缓蚀率随DI含量的增加而增加,但是,当DI的质量浓度为600 mg/L时,缓蚀率又降低。这是因为在低浓度DI条件下,缓蚀剂分子并没有完整覆盖在试样表面,腐蚀并未得到有效抑制。

表1 DI含量对试样在1% HEDP水溶液中缓蚀率的影响
随着缓蚀剂浓度的进一步增大,试样表面形成了一层致密的保护膜,阻碍了金属和腐蚀介质之间的电子转移和物质交换,腐蚀减缓。当DI质量浓度为400 mg/L时,试样的缓蚀率达到74.94%。但当DI质量浓度为600 mg/L时,缓蚀率反而下降,这可能是缓蚀剂分子浓度过高,其从试样表面脱附或者是缓蚀剂分子之间复合等原因造成的[13]。
2.2.2 电化学测试
(1) 极化曲线
极化曲线所得缓蚀率的计算公式见式 (4):
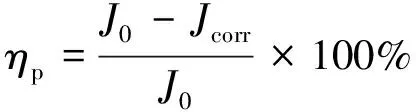
(4)
式中:J0为试样在未添加缓蚀剂的1% HEDP水溶液中的腐蚀电流密度,μA/cm2;Jcorr为试样在添加缓蚀剂的1% HEDP水溶液中的腐蚀电流密度,μA/cm2。
由表2和图5可见:加入DI后,试样的腐蚀电位(Ecorr)明显正向移动,阴极和阳极极化曲线都分别向低电位方向移动,腐蚀电流密度(Jcorr)逐渐变小。这表明在1% HEDP水溶液中,缓蚀剂DI对N80钢的腐蚀产生了明显的抑制作用。随着缓蚀剂浓度的提高,缓蚀剂吸附在试样表面所形成的膜越来越致密,阻止了腐蚀介质和试样基体的接触,所以其缓蚀率也逐渐提高。当缓蚀剂质量浓度为400 mg/L时,缓蚀效果最佳,缓蚀率为78.98%。但当缓蚀剂的质量浓度为600 mg/L时,缓蚀率反而下降,这是因为缓蚀剂分子浓度过高,分子间发生吸附或者从金属试样表面脱落[13],腐蚀介质与试样表面相接触,增大了腐蚀速率。极化曲线所得结果和静态失重试验所得结果基本一致。

表2 极化曲线拟合结果
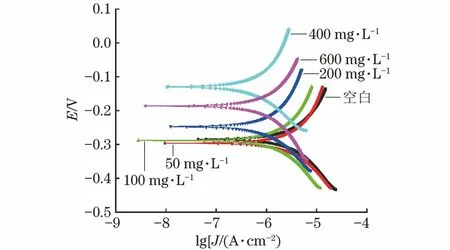
图5 试样在含不同量DI的1% HEDP水溶液中的极化曲线Fig.5 Polarization curves of samples in 1% HEDP solutioncontaining different content of DI
(2) 电化学阻抗谱
通过电化学阻抗谱考察了缓蚀剂的缓蚀性能,并采用Zview软件对数据进行拟合,详见表3与图6,等效电路图见图7。其中,Rs是溶液电阻,Rp是极化电阻,CPE1表示电容。Rp与容抗半圆弧的直径成正相关,其数值越大,腐蚀反应越不易进行,缓蚀剂的缓蚀性能越好[14]。通过电化学阻抗谱中相关电化学参数计算缓蚀率(ηR),如式 (5) 所示。
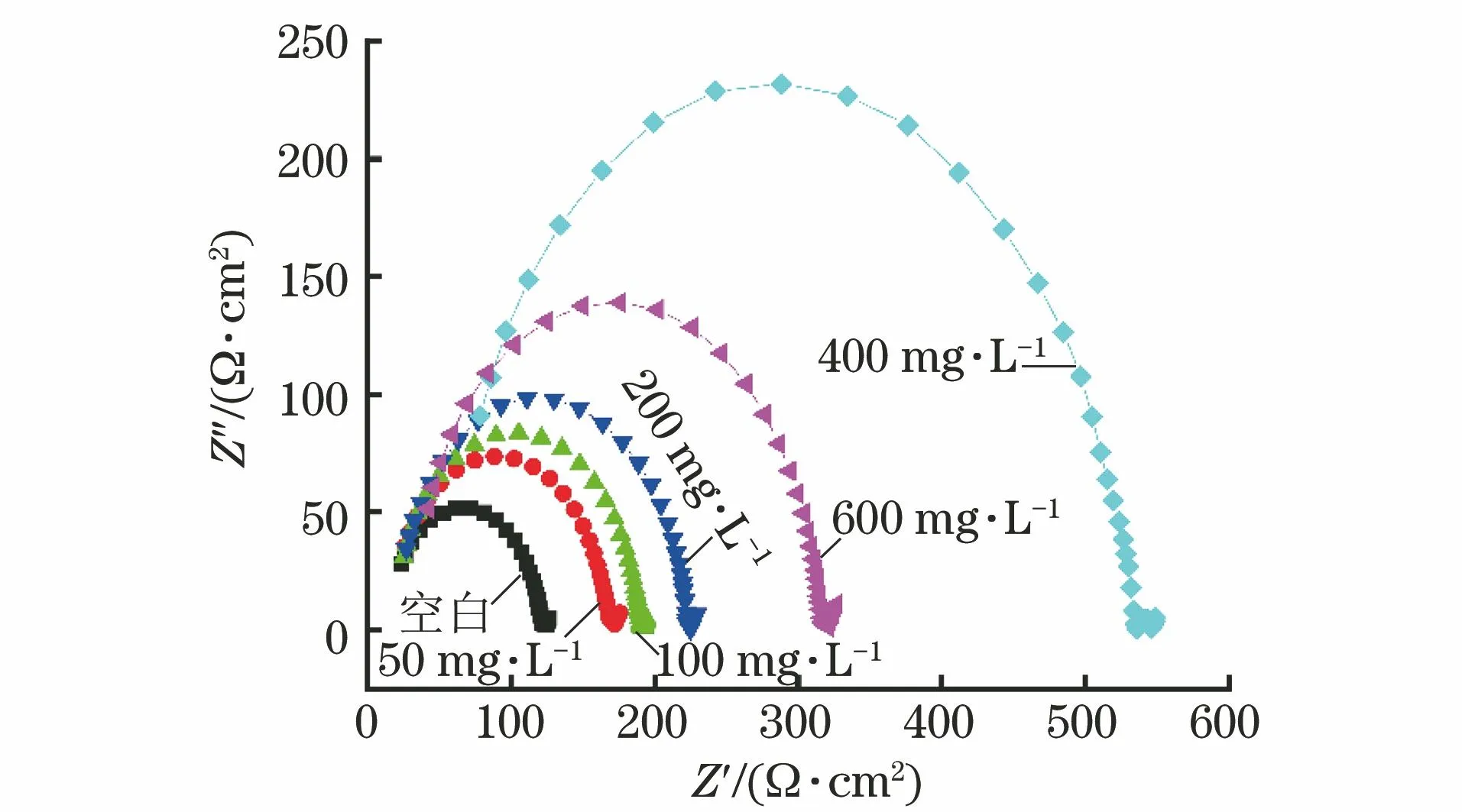
图6 试样在不同含量DI的1% HEDP水溶液中的Nyquist图Fig.6 Nyquist diagram of samples in 1% HEDP solutionwith different content of DI
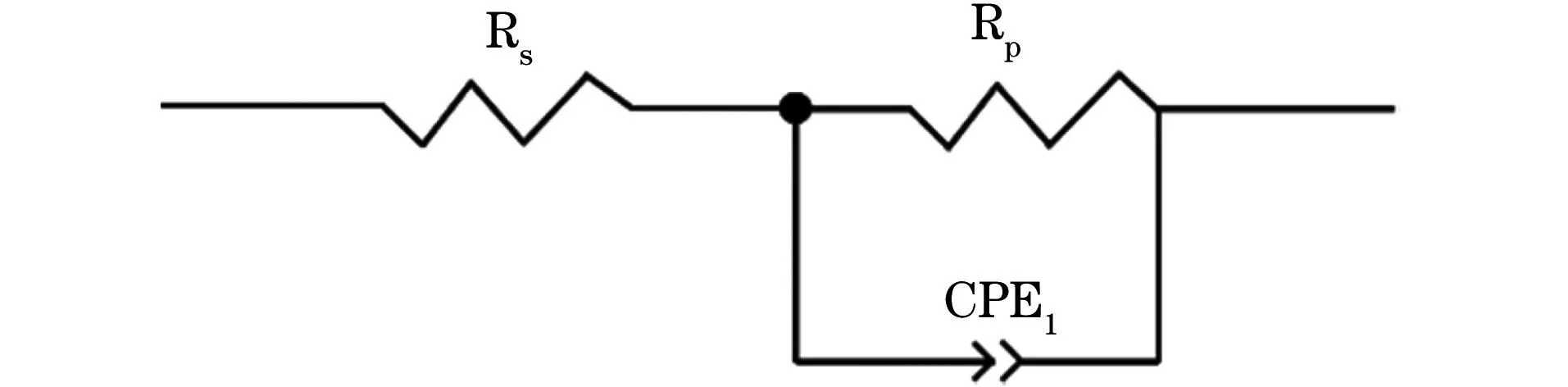
图7 电化学阻抗谱拟合的等效电路图Fig.7 Equivalent circuit diagram of electrochemicalimpedance spectrum
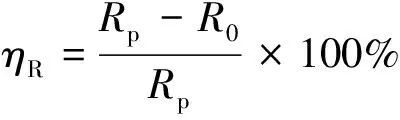
(5)
式中:R0为未添加缓蚀剂条件下的极化电阻,Ω·cm2;Rp为添加缓蚀剂条件下的极化电阻,Ω·cm2。
如表4和图6所示:相对于未添加缓蚀剂的1% HEDP水溶液,加入DI后,容抗弧增大,试样的耐蚀性增强。随着DI含量的增大,容抗弧直径逐渐递增,腐蚀速率下降,缓蚀率提高;当缓蚀剂质量浓度大于400 mg/L时,缓蚀率反而下降,这是因为缓蚀剂含量过高,缓蚀剂分子相互吸附或从试样表面脱附[13],腐蚀介质和试样表面接触面积变大,缓蚀率降低,试验结果与静态失重试验和极化曲线的结果相同。
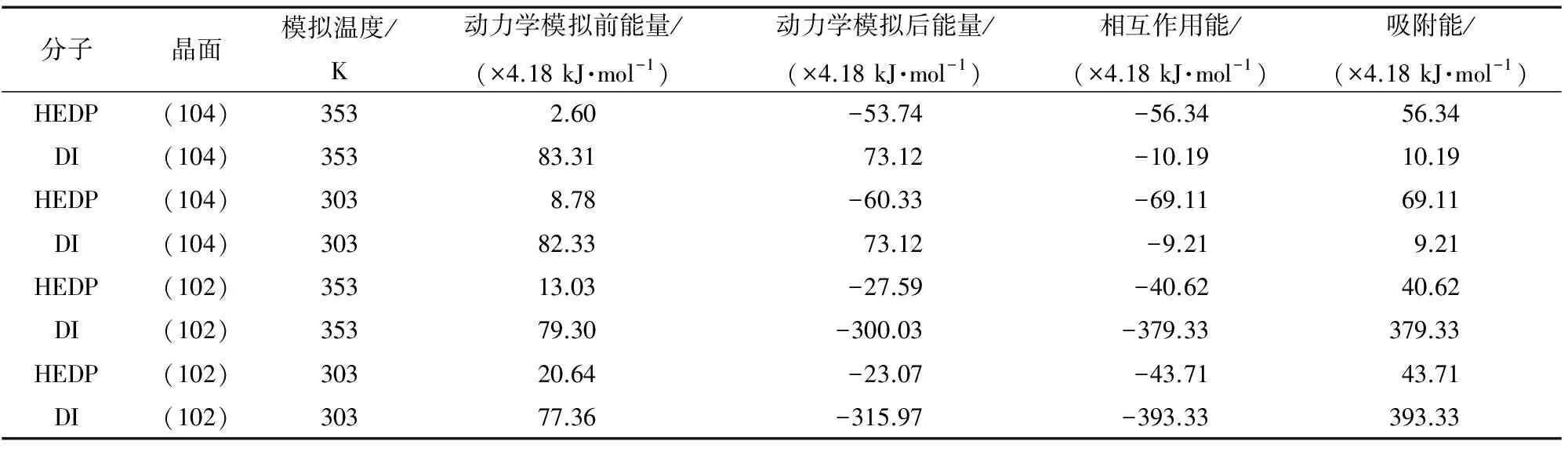
表4 HEDP和DI分子与方解石(104) (102)晶面吸附能
2.2.3 表面形貌及物相分析
如图8所示:未腐蚀试样表面平整光洁;经1% HEDP水溶液腐蚀24 h后,试样表面凹凸不平,腐蚀较为严重;而在1% HEDP水溶液中添加400 mg/L DI后,试样表面依然平整,无大面积腐蚀,仅产生了一层薄薄的腐蚀层(不规则灰色区域),大部分金属基体维持原状,腐蚀程度大幅降低。

图8 原始试样及在不含和含DI的1% HEDP水溶液中浸泡24 h后试样的表面SEM形貌Fig.8 Surface SEM morphology of the original sample(a) and the samples(b,c) soaked in 1% HEDP aqueous solutionwithout and without DI for 24 hours
由图9可见:在1% HEDP水溶液中腐蚀24 h后,试样表面腐蚀产物主要成分为Fe2O3,还含有少量Fe3O4和FeO等。而沉积在试样表面的垢样的主要成分为方解石型碳酸钙,故在模拟过程中采用方解石结构模型。
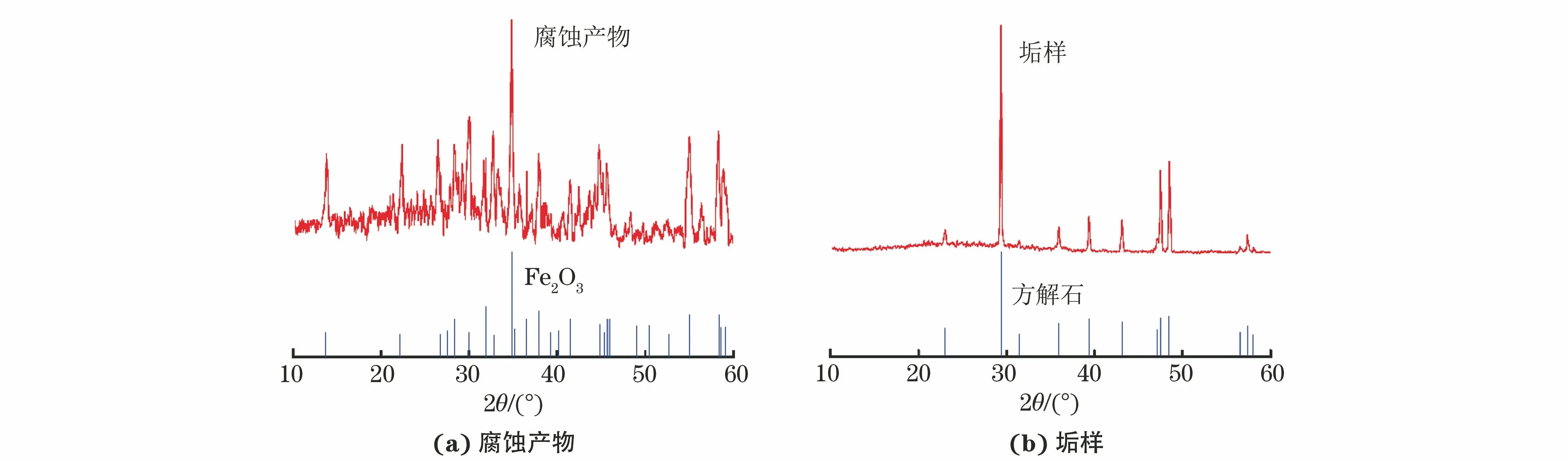
图9 在1% HEDP水溶液中腐蚀24 h后,试样表面腐蚀产物及垢样的XRD谱图Fig.9 XRD pattrens of corrosion products (a) and scale samples (b) on the surface of samples after 24 h of corrosion in 1% HEDP solution
2.3 阻垢性能影响
如图10所示:缓蚀剂DI的加入对试样在1%HEDP水溶液中的阻垢性能无拮抗作用,随着DI含量的提高,阻垢性能有所提高。当DI质量浓度升至600 mg/L,体系的阻垢率提升至93.64%。

图10 DI质量浓度对1% HEDP水溶液阻垢性能的影响Fig.10 The effect of DI content on the scale inhibitionperformance of 1% HEDP solution
由图11可见:垢样呈一簇一簇的晶体,在试样表面零散分布。试样表面其余部分区域都较为平整,有轻微腐蚀,未见明显的坑蚀、点蚀,说明缓蚀剂DI在HEDP溶液中具有较好的缓蚀性能。

图11 试样表面结垢形貌Fig.11 Surface scale morphology of the sample
2.4 分子动力学模拟结果
阻垢剂分子与方解石晶体表面的相互作用能(ΔE)的计算公式如式 (6) 所示[15]:
ΔE=Esystem-(Emolecule+Esurface)
(6)
式中:Esystem、Emolecule、Esurface分别代表计算后系统的能量,计算前吸附分子的能量和计算前方解石表面的能量[16]。定义吸附能Eadsorption为相互作用能的负值,即Eadsorption=-ΔE。ΔE的大小代表了吸附体系的稳定性,ΔE越大,表明吸附质与吸附剂相互作用越强,吸附体系越稳定[17]。
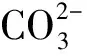
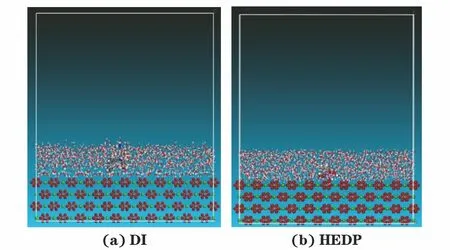
图12 MD模拟分子与方解石晶体(104)面相互作用Fig.12 Interaction between MD simulated molecule and calcitecrystal (104) surface:(a) DI; (b) HEDP
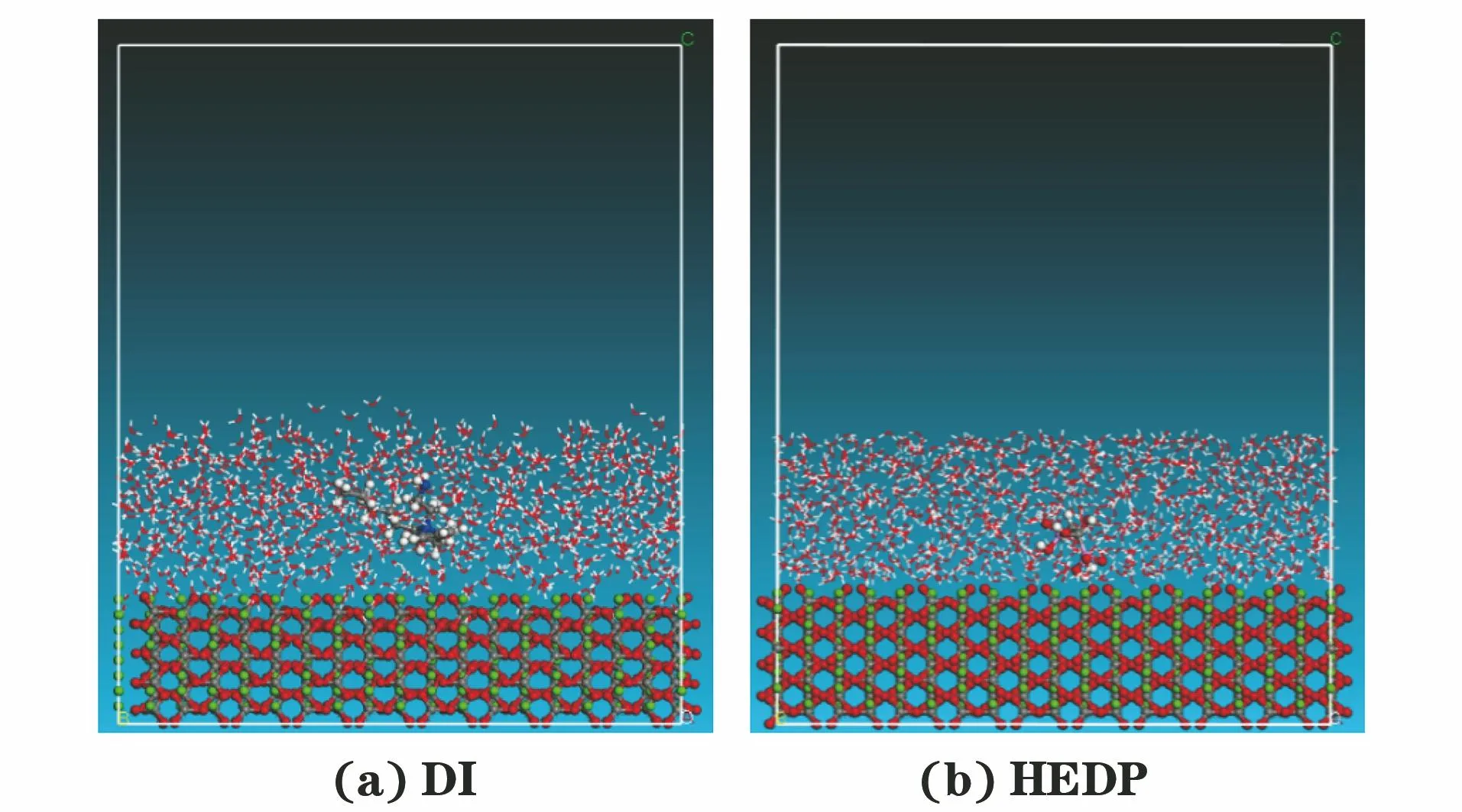
图13 MD模拟分子与方解石晶体(102)面相互作用Fig.13 Interaction between MD simulated molecule and calcitecrystal (102) surface: (a) DI; (b) HEDP
一方面,在该体系中,不仅HEDP分子中的两个膦酸根基团可与溶液中的Ca2+形成稳定的可溶多环螯合物[22],而且DI分子的N杂环也可能和Ca2+形成螯合物,变相增大了碳酸钙的溶解度;另一方面, HEDP与DI分子均可吸附在方解石(104)和(102)晶面上,并且DI对(102)晶面的吸附能远大于HEDP,进一步抑制了方解石晶体的生长或者导致其晶格畸变,使得晶体内部应力增大以及产生错位,形成不稳定的晶型,最终阻碍垢的沉积。在这些因素的共同作用下,HEDP和DI分子的阻垢性能起到了一加一大于二的效果,使得该体系的阻垢性能增强,这也与静态阻垢试验结果相符。
3 结 论
(1) 采用静态失重法和电化学方法在1% HEDP水溶液中测试了缓蚀剂DI对碳钢的缓蚀性能。结果表明,随着DI含量的增加,缓蚀率先增加后降低。缓蚀率下降的原因可能是DI分子含量过高,导致其从N80钢表面脱附或者是分子之间复合等。
(2) 通过静态阻垢试验,考察了DI对 HEDP水溶液阻垢性能的影响,DI对1% HEDP水溶液的阻垢性能无拮抗作用,并且随着DI含量的提高,体系的阻垢性能有所提升;综合缓蚀效果和阻垢效果,缓蚀剂DI的最佳使用质量浓度为400 mg/L。
(3) 通过分子动力学模拟,得到了HEDP和DI在303 K及353 K条件下与碳酸钙方解石晶体(104)和(102)晶面的吸附能,从分子水平上解释了缓蚀剂与阻垢剂的作用。
