GW501516对低氧致肺动脉内皮细胞损伤的影响及机制 Δ
2024-02-02陈昌贵易春峰余志华李立为贺立群武汉市第一医院心血管内科武汉430022
陈昌贵,易春峰,余志华,王 栋,李立为,贺立群 (武汉市第一医院心血管内科,武汉 430022)
低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是低氧所致的肺动脉高压,属于肺动脉高压的第三大类。持续的低氧可引起肺血管重构,进而导致HPH,长期过高的肺动脉压力会诱发患者出现难以控制的右心衰竭而死亡。肺动脉内皮细胞(pulmonary artery endothelial cells,PAECs)在低氧肺血管重构中起至关重要的作用,一旦PAECs 发生损伤,肺血管重构过程即同步启动,表现为血管收缩与舒张功能紊乱、肺动脉平滑肌细胞异常迁移与增殖、细胞外基质合成增加,最终导致肺动脉高压[1]。此外低氧还可诱导PAECs产生氧化应激,进而损伤PAECs,导致低氧肺血管重构和HPH[1]。因此,具有逆转低氧致PAECs 损伤作用的药物,可能会改善低氧肺血管重构。
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是一种核受体,在配体激活时充当转录因子促进细胞转录,包含PPARα、PPARγ和PPARδ 3种亚型。既往研究发现,PPARδ具有抑制炎症反应、抗氧化应激、改善内皮细胞功能、抗动脉粥样硬化等作用[2]。GW501516 是一种人工合成的PPARδ 激动剂,已被用于治疗肥胖症、脂质紊乱和心血管疾病。动物实验发现,每天以3 mg/kg GW501516 喂食低密度脂蛋白受体基因敲除小鼠,可减轻小鼠高脂饮食诱导的血管重构[3];体外细胞实验发现,GW501516能够改善内皮细胞功能[4]。活性氧(reactive oxygen species,ROS)是参与氧化应激的主要分子之一,在血管紧张素Ⅱ诱导的血管平滑肌细胞肥大模型中,GW501516可抑制血管平滑肌细胞内产生ROS[5]。由此推测GW501516可能通过抑制氧化应激,保护PAECs,从而在低氧肺血管重构中发挥保护作用。因此,本研究从GW501516 调控氧化应激的角度探讨了其对低氧致PAECs损伤的影响及机制,以期为GW501516用于临床治疗HPH提供参考。
1 材料
1.1 主要仪器
本研究使用的主要仪器包括Dmil Led 型倒置荧光显微镜(德国Leica 公司)、3131 型和311 型细胞培养箱(美国Thermo Fisher Scientific公司)、Synergy HT型多功能酶标仪(美国Bio-Tek 公司)、NovoCyte 型流式细胞仪(美国ACEA Biosciences 公司)、ChemiDoc XRS 型化学发光成像系统(美国Bio-Rad公司)。
1.2 主要药品与试剂
GW501516(批号SML1491)、二甲基亚砜(dimethyl sulfoxide,DMSO)(批号D2625)、抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)(批号A0150000)均购自美国Sigma-Aldrich 公司,纯度均≥98%;核因子E2 相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)激活剂富马酸二甲酯(dimethyl fumarate,DMF)(批号S2586)、Nrf2 抑制剂ML385(批号S8790)均购自美国Selleck 生物科技有限公司,纯度均≥99%;CCK-8 试剂盒购自日本同仁化学研究所;Annexin Ⅴ-FITC/PI 凋亡检测试剂盒(批号556547)购自美国BD 公司;乳酸脱氢酶(lactate dehydrogenase,LDH)(批号C0017)、ROS(批号S0033S)、超氧化物歧化酶(superoxide dismutase,SOD)(批号S0101S)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPx)(批号S0058)、过氧化氢酶(catalase,CAT)(批号S0051)、丙二醛(malondialdehyde,MDA)(批号S0131S)检测试剂盒、BCA 试剂盒(批号P0012S)、细胞核蛋白与细胞浆蛋白抽提试剂盒(批号P0028)均购自上海碧云天生物技术有限公司;兔源PPARδ(批号74076)、Nrf2(批号12721)、血红素加氧酶1(heme oxygenase-1,HO-1)(批号43966)、裂解型胱天蛋白酶3(cleaved-caspase-3,C-caspase-3)(批号9661)、核纤层蛋白B1(Lamin B1)(批号13435)、甘油醛-3-磷酸脱氢酶(GAPDH)(批号5174)等一抗均购自美国Cell Signaling Technology 公司;辣根过氧化物酶标记的山羊抗人IgG二抗(批号ab6858)购自英国Abcam公司。
1.3 实验细胞
人PAECs 购自中国典型培养物保藏中心,批号为GPC0037。
2 方法
2.1 GW501516对PAECs的细胞毒性检测
2.1.1 实验分组与给药
将细胞分为对照组和GW501516 组,对照组给予0.1%DMSO 孵育12、24、48 h,GW501516 组给予100 nmol/L GW501516[6]孵育12、24、48 h。
2.1.2 PAECs相对存活率的检测
采用CCK-8 试剂盒检测细胞相对存活率,评估GW501516 的细胞毒性。细胞以5×103个/孔均匀接种于96孔板,每组设6个复孔。按“2.1.1”项下方法分组及给药后,按照试剂盒说明书加入CCK-8 溶液,同时设置空白组(培养基 100 μL+CCK-8 溶液 10 μL),继续孵育3 h 后于450 nm 波长处测定吸光度(OD)值。细胞的相对存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。
2.2 低氧条件下PAECs 中PPARδ 蛋白表达水平的检测
2.2.1 实验分组与给药
将细胞分为对照组(常氧+0.1%DMSO)、低氧组(低氧+0.1%DMSO)、GW501516 干预组(低氧+100 nmol/L GW501516),低氧刺激时间为24 h。低氧刺激前1 h 用GW501516 孵育PAECs,当PAECs 融合度达到80%~90%时,1∶2 传代培养。各组细胞在低氧刺激前用不含胎牛血清的DMEM培养基培养12 h使细胞同步化。模拟低氧条件为含1%O2、5%CO2和94%N2的空气,模拟常氧为含5%CO2的空气(下同)。
2.2.2 PAECs中PPARδ蛋白表达水平的检测
采用Western blot 法检测PPARδ 蛋白的表达水平。细胞以1.5×105个/孔均匀接种于6 孔板,每组设3 个复孔。按“2.2.1”项下方法分组及给药后,使用细胞裂解液裂解细胞提取细胞总蛋白,通过BCA 试剂盒检测细胞总蛋白浓度。采用沸水浴灭活蛋白,上样前将各组细胞蛋白稀释成相同浓度,每个样本取15 μg总蛋白加样,并用10%聚丙烯酰胺凝胶电泳分离蛋白质,再转移至聚偏氟乙烯膜中,用5%脱脂奶粉室温封闭2 h,TBST 缓冲液洗膜,接着加入PPARδ、GAPDH 一抗(稀释比分别为1∶1 000、1∶5 000),4 °C 孵育过夜;洗膜后加入二抗(稀释比为1∶10 000),然后于室温下孵育1 h,TBST 缓冲液洗膜后,滴加ECL混合溶液,暗室中曝光,测定蛋白条带灰度值。以PPARδ 和GAPDH 条带灰度值的比值表示PPARδ蛋白的表达水平。
2.3 低氧条件下PAECs 的凋亡率、细胞活力、LDH 活性和ROS水平的检测
2.3.1 实验分组与给药
将细胞分为对照组(常氧+0.1%DMSO)、低氧组(低氧+0.1%DMSO)、NAC 干预组(阳性对照,低氧+10 mmol/L NAC[7])、GW501516 干预组(低氧+100 nmol/L GW501516)。各药物干预组在低氧刺激前1 h给予不同药物孵育PAECs,低氧刺激时间为24 h。
2.3.2 细胞凋亡率的检测
采用Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒联合流式细胞仪检测细胞凋亡情况。细胞以1.5×105个/孔均匀接种于6 孔板,每组设3 个复孔。按“2.3.1”项下方法分组及给药后,以胰酶消化收集细胞,取约1×106个细胞,用磷酸盐缓冲液(PBS)洗涤后,依次加入PBS 200 μL、Annexin Ⅴ-FITC 10 μL 和PI 10 μL 重悬细胞,4 ℃避光孵育30 min后加入PBS 200 μL,通过流式细胞仪检测细胞凋亡率,使用NovoExpress软件分析数据。
2.3.3 细胞活力的检测
采用CCK-8 试剂盒检测细胞活力。细胞以5×103个/孔均匀接种于96孔板,每组设6个复孔。按“2.3.1”项下方法分组及给药后,按“2.1.2”项下方法操作,检测细胞存活率。
2.3.4 LDH活性的检测
使用LDH检测试剂盒检测细胞中LDH活性。细胞以5×103个/孔均匀接种于96孔板,每组设6个复孔。按“2.3.1”项下方法分组及给药后,每孔加入LDH 释放液10 μL,孵育1 h后以400×g 离心5 min,取上清液,按试剂盒说明书加入LDH 检测液后,于450 nm 波长处测定OD,检测LDH活性。
2.3.5 ROS水平的检测
采用二乙酰二氯氢化荧光素(DCFH-DA)探针联合荧光酶标仪测定细胞内ROS水平。细胞以3×104个/孔均匀接种于24孔板,每组设6个复孔。按“2.3.1”项下方法分组及给药后,吸出培养基,加入10 μmol/L无血清培养基稀释的DCFH-DA,37 ℃孵育20 min后将培养基吸出,PBS 洗涤3 次后,置于荧光酶标仪(激发波长为488 nm,发射波长为525 nm)下检测细胞内ROS水平。
2.4 GW501516对低氧致PAECs损伤的作用机制研究
2.4.1 实验分组与给药
将细胞分为对照组(常氧+0.1%DMSO)、低氧组(低氧+0.1%DMSO)、DMF 干预组(阳性对照,低氧+75 μmol/L DMF[8])、GW501516 干预组(低氧+100 nmol/L GW501516)、GW501516+ML385 干预组(低氧+100 nmol/L GW501516+5 μmol/L ML385[9])。各药物干预组在低氧刺激前1 h 给予不同药物孵育PAECs,低氧刺激时间为24 h。
2.4.2 PAECs中HO-1蛋白和细胞核内Nrf2蛋白表达水平的检测
采用Western blot 法检测HO-1 蛋白和Nrf2 蛋白的表达水平。细胞以1.5×105个/孔均匀接种于6 孔板,每组设3 个复孔。按“2.4.1”项下方法分组及给药后,使用细胞裂解液裂解细胞提取细胞总蛋白,使用细胞核蛋白与细胞浆蛋白抽提试剂盒提取细胞核蛋白。按“2.2.2”项下方法检测HO-1蛋白和Nrf2蛋白的表达水平,HO-1、Nrf2、Lamin B1 和GAPDH 的稀释比例分别为1∶1 000、1∶1 000、1∶2 000、1∶5 000,以HO-1蛋白与GAPDH蛋白的灰度值比值表示HO-1 蛋白的表达水平,以Nrf2 蛋白与Lamin B1 蛋白的灰度值比值表示Nrf2 蛋白的表达水平。
2.4.3 PAECs 中SOD、GPx、CAT、MDA、ROS 水平的检测
采用ELISA 法检测PAECs 中SOD、GPx、CAT、MDA水平;采用DCFH-DA探针联合荧光酶标仪测定细胞中ROS 水平。细胞以1.5×105个/孔均匀接种于6 孔板,每组设6个复孔。按“2.4.1”项下方法分组及给药后,按试剂盒说明书检测PAECs 中SOD、GPx、CAT、MDA水平;细胞中ROS水平的检测方法同“2.3.5”。
2.4.4 PAECs 的凋亡率、细胞活力、LDH 活性和Ccaspase-3蛋白表达水平的检测
按“2.4.1”项下方法分组及给药后,按“2.3.2”项下方法检测细胞凋亡率;按“2.1.2”项下方法检测细胞活力;按“2.3.4”项下方法检测LDH 活性;按“2.2.2”项下方法检测C-caspase-3 蛋白表达水平,其中C-caspase-3 一抗稀释比例为1∶1 000,以C-caspase-3与GAPDH条带灰度值的比值表示C-caspase-3蛋白的表达水平。
2.5 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量数据以±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准α=0.05。
3 结果
3.1 GW501516对PAECs的细胞毒性
GW501516 组PAECs 孵育12、24、48 h 后的细胞相对存活率[(98.37±2.14)%、(102.10±4.61)%、(103.24±3.66)%]与对照组PAECs孵育12、24、48 h后的细胞相对存活率[(100.00±2.68)%、(100.00±3.75)%、(100.00±4.23)%]比较,差异无统计学意义(P>0.05)。
3.2 低氧条件下GW501516 对PAECs 中PPARδ 蛋白表达水平的影响
与对照组比较,低氧组PAECs中PPARδ蛋白表达水平显著降低(P<0.05);与低氧组比较,GW501516 干预组PAECs 中PPARδ 蛋白表达水平显著升高(P<0.05)。结果见图1。
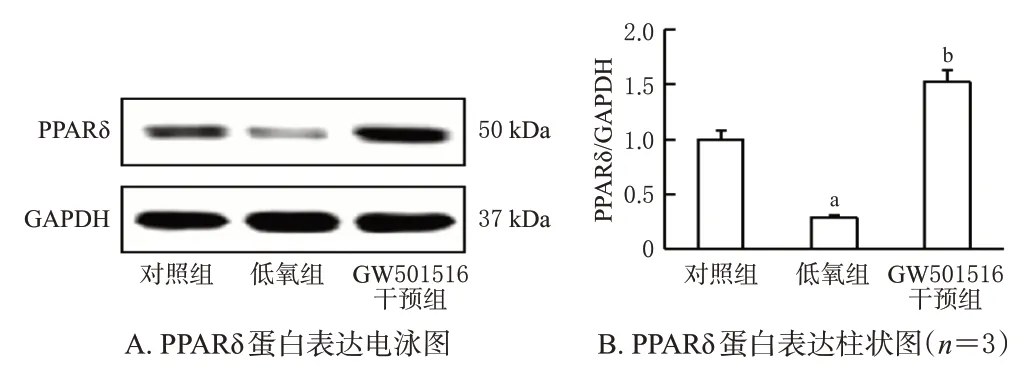
图1 低氧条件下GW501516 对PAECs 中PPARδ 蛋白表达的影响
3.3 低氧条件下GW501516 对PAECs 的凋亡率、细胞活力、LDH活性和ROS水平的影响
与对照组比较,低氧组PAECs的凋亡率、LDH活性、ROS 水平均显著升高(P<0.05),细胞活力显著降低(P<0.05);与低氧组比较,NAC干预组和GW501516干预组细胞凋亡率、LDH活性、ROS水平均显著降低(P<0.05),细胞活力均显著升高(P<0.05)。结果见图2、表1。
表1 低氧条件下PAECs 的凋亡率、细胞活力、LDH 活性和ROS水平的检测结果(±s)

表1 低氧条件下PAECs 的凋亡率、细胞活力、LDH 活性和ROS水平的检测结果(±s)
a:与对照组比较,P<0.05;b:与低氧组比较,P<0.05。
组别对照组低氧组NAC干预组GW501516干预组ROS水平(n=6)1.00±0.15 8.85±0.96a 2.14±0.38b 3.81±0.27b细胞凋亡率(n=3)/%6.03±1.34 20.42±4.47a 13.55±2.06b 11.37±1.85b细胞活力(n=6)/%100.00±5.67 70.91±5.23a 85.13±4.25b 88.86±5.92b LDH活性(n=6)1.00±0.12 6.26±0.51a 3.32±0.23b 2.14±0.27b
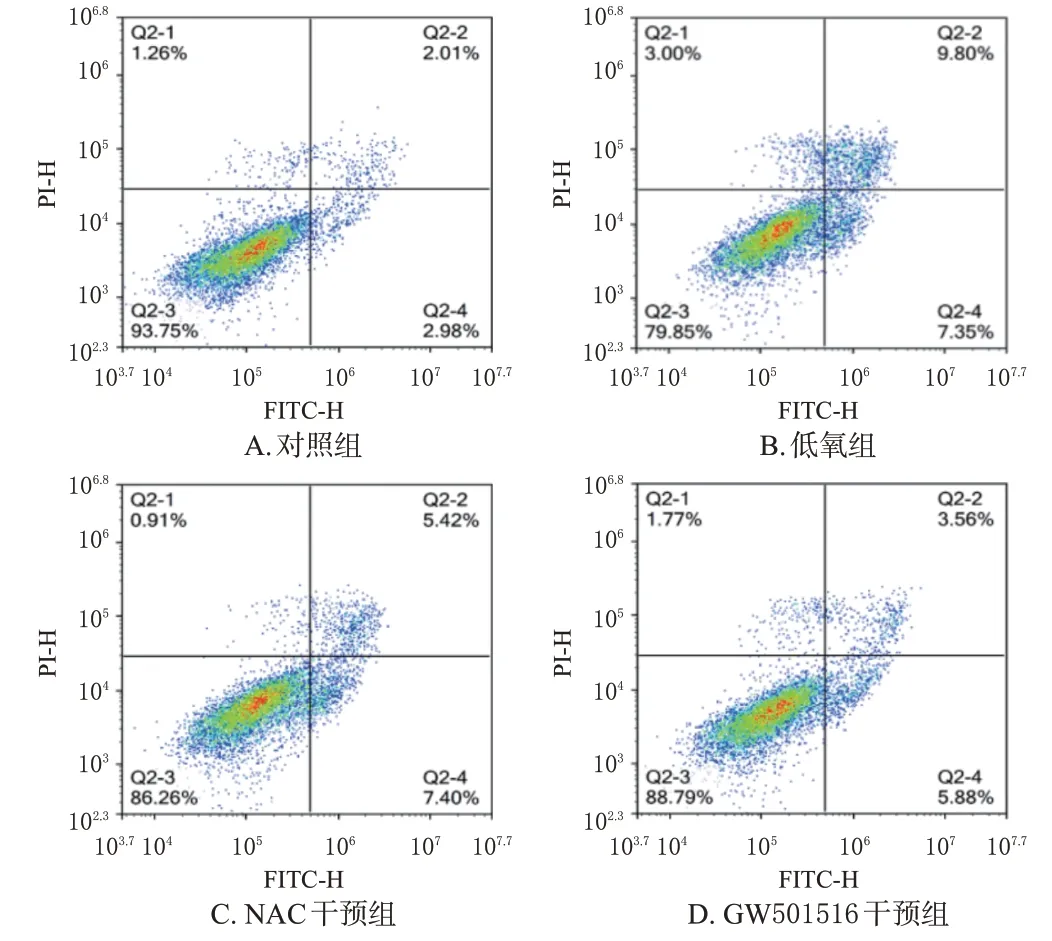
图2 各组细胞的凋亡流式图
3.4 GW501516对低氧致PAECs损伤的作用机制
3.4.1 PAECs中HO-1蛋白和细胞核内Nrf2蛋白表达水平的检测结果
与对照组比较,低氧组PAECs 中HO-1 蛋白和细胞核内Nrf2 蛋白表达水平均显著降低(P<0.05);与低氧组比较,DMF干预组和GW501516干预组PAECs中HO-1 蛋白和细胞核内Nrf2 蛋白表达水平均显著升高(P<0.05);与GW501516 干预组比较,GW501516+ML385 干预组PAECs中HO-1蛋白和细胞核内Nrf2蛋白表达水平均显著降低(P<0.05)。结果见图3。
3.4.2 PAECs 中SOD、GPx、CAT、MDA、ROS 水平的检测结果
与对照组比较,低氧组PAECs中SOD、GPx、CAT水平均显著降低(P<0.05),MDA、ROS 水平均显著升高(P<0.05);与低氧组比较,DMF干预组和GW501516干预组PAECs 中SOD、GPx、CAT 水平均显著升高(P<0.05),MDA、ROS 水平均显著降低(P<0.05);与GW501516 干预组比较,GW501516+ML385 干预组PAECs 中SOD、GPx、CAT 水平均显著降低,MDA、ROS水平均显著升高(P<0.05)。结果见表2。
表2 PAECs 中SOD、GPx、CAT、MDA、ROS 水平的检测结果(±s,n=6)
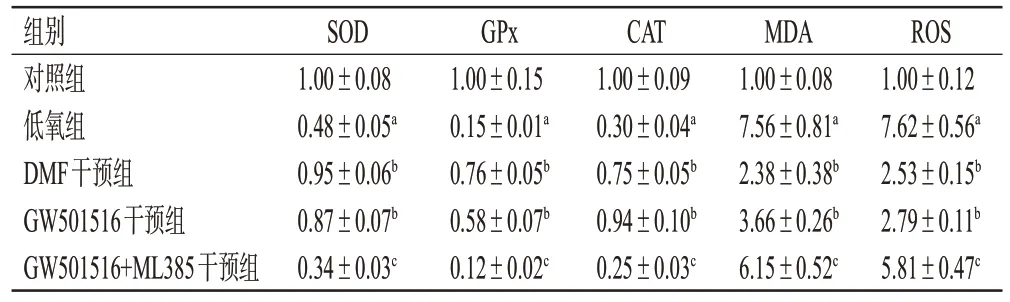
表2 PAECs 中SOD、GPx、CAT、MDA、ROS 水平的检测结果(±s,n=6)
a:与对照组比较,P<0.05;b:与低氧组比较,P<0.05;c:与GW501516干预组比较,P<0.05。
组别对照组低氧组DMF干预组GW501516干预组GW501516+ML385干预组SOD 1.00±0.08 0.48±0.05a 0.95±0.06b 0.87±0.07b 0.34±0.03c GPx 1.00±0.15 0.15±0.01a 0.76±0.05b 0.58±0.07b 0.12±0.02c CAT 1.00±0.09 0.30±0.04a 0.75±0.05b 0.94±0.10b 0.25±0.03c MDA 1.00±0.08 7.56±0.81a 2.38±0.38b 3.66±0.26b 6.15±0.52c ROS 1.00±0.12 7.62±0.56a 2.53±0.15b 2.79±0.11b 5.81±0.47c
3.4.3 PAECs 的凋亡率、细胞活力、LDH 活性和Ccaspase-3蛋白表达水平的检测结果
与对照组比较,低氧组PAECs的凋亡率、C-caspase-3蛋白表达水平、LDH活性均显著升高,细胞活力显著降低(P<0.05);与低氧组比较,DMF干预组和GW501516干预组PAECs 的凋亡率、C-caspase-3 蛋白表达水平、LDH活性均显著降低,细胞活力均显著升高(P<0.05);与GW501516 干预组比较,GW501516+ML385 干预组PAECs 的凋亡率、C-caspase-3 蛋白表达水平、LDH 活性均显著升高,细胞活力显著降低(P<0.05)。结果见图4、表3、图5。
表3 机制研究中PAECs 的凋亡率、细胞活力、LDH 活性的检测结果(±s)
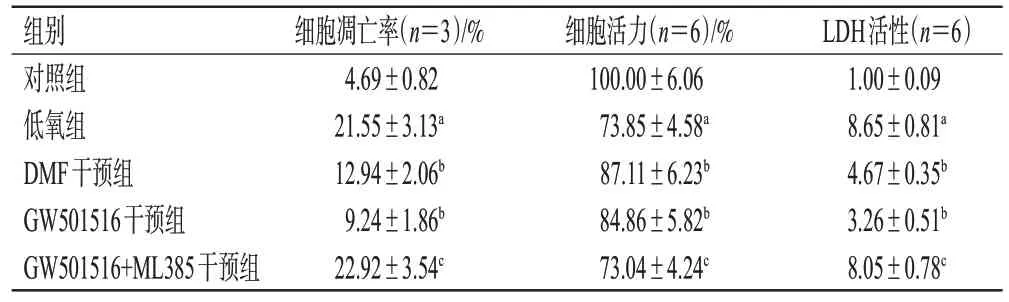
表3 机制研究中PAECs 的凋亡率、细胞活力、LDH 活性的检测结果(±s)
a:与对照组比较,P<0.05;b:与低氧组比较,P<0.05;c:与GW501516干预组比较,P<0.05。
LDH活性(n=6)1.00±0.09 8.65±0.81a 4.67±0.35b 3.26±0.51b 8.05±0.78c组别对照组低氧组DMF干预组GW501516干预组GW501516+ML385干预组细胞凋亡率(n=3)/%4.69±0.82 21.55±3.13a 12.94±2.06b 9.24±1.86b 22.92±3.54c细胞活力(n=6)/%100.00±6.06 73.85±4.58a 87.11±6.23b 84.86±5.82b 73.04±4.24c

图4 机制研究中各组细胞的凋亡流式图

图5 GW501516 对低氧条件下PAECs 中C-caspase-3蛋白表达水平的影响
4 讨论
低氧能够诱导PAECs 损伤,使其凋亡增加,抑制PAECs 损伤和凋亡能够逆转HPH[1]。正常条件下LDH不能穿透细胞膜,但当细胞受损或死亡后,LDH 可以释放到细胞外,其释放水平能够反映细胞损伤程度[10]。caspase-3 是调控细胞凋亡的关键介质,可被外源性(死亡配体)和内源性(线粒体)凋亡途径激活,是最重要的胱天蛋白酶。caspase-3 激活后生成的C-caspase-3 是细胞凋亡的主要执行者之一,亦是细胞凋亡的标志蛋白[11]。研究发现,PPARδ合成型激动剂L-165041能够抑制H2O2诱导的人脐静脉血管内皮细胞损伤,抑制其凋亡,而PPARδ的沉默逆转了这种作用[2]。此外,PPARδ可通过激活磷脂酰肌醇-3-激酶/蛋白激酶B通路来抑制缺氧诱导的内皮祖细胞凋亡[12]。本研究发现,在低氧刺激下,PAECs 中PPARδ 蛋白表达水平降低,细胞凋亡率升高,C-caspase-3表达水平升高,细胞活力降低,LDH活性升高;而GW501516 可上调PPARδ 蛋白的表达,抑制低氧诱导的PAECs 损伤,且实验浓度的GW501516 对PAECs无明显细胞毒性。因此,本课题组推测低氧通过抑制PPARδ蛋白表达来损伤内皮细胞,GW501516则通过激活PPARδ来发挥保护内皮细胞的作用。
低氧能够诱导氧化应激,导致PAECs 的损伤和凋亡,抑制氧化应激可抑制PAECs 损伤及HPH 的形成[1,13―14]。有研究表明,PPARδ能够抑制高糖诱导的血管内皮功能障碍及ROS 的产生[15]。在动脉粥样硬化的动物模型中发现,PPARδ 可减少ROS 的产生,从而发挥保护内皮细胞的作用[16]。另有研究表明,GW501516 能够通过抑制ROS 产生而抑制血管紧张素Ⅱ诱导的血管平滑肌细胞肥大[5]。本研究发现,GW501516 及NAC 均可抑制低氧诱导的PAECs损伤及ROS产生。因此,本课题组推测GW501516 可通过抑制氧化应激来抑制低氧诱导的PAECs损伤。
Nrf2是一种参与氧化应激的关键转录因子,其在细胞核内可与抗氧化反应元件结合,来促进下游抗氧化酶或蛋白的表达,从而发挥抗氧化应激作用。CAT、GPx、HO-1 和SOD 是Nrf2 通路下游的主要抗氧化酶。其中,HO-1 可降解血红素,产生一氧化碳、亚铁和胆绿素,而HO-1以及血红素分解代谢产物均具有抗氧化作用,并能够缓解肺血管重构[17];SOD可将超氧化自由基分解为H2O2,促进氧自由基的清除,上调SOD活性,减轻肺血管重构[18];GPx可催化谷胱甘肽与H2O2或其他过氧化物的反应,生成氧化型谷胱甘肽和H2O,从而消除ROS[11];CAT 能催化H2O2生成H2O 与O2。氧化应激能导致细胞脂质过氧化,MDA是脂质过氧化的产物,其水平与氧化应激呈负相关。Nrf2 激活剂能够通过上调肺动脉组织内SOD、HO-1 活性,降低MDA 及ROS 水平,抑制低氧诱导的氧化应激,从而缓解大鼠低氧肺血管重构[19]。在高糖诱导人脐静脉血管内皮细胞氧化应激的细胞模型中发现,PPARδ 激动剂GW0742 和L165041 可激活Nrf2,并以浓度依赖的方式上调人脐静脉血管内皮细胞内HO-1 蛋白和mRNA 的表达,抑制ROS 产生,从而发挥保护人脐静脉血管内皮细胞的作用[20]。在内皮细胞中,GW0742通过诱导SOD、CAT等抗氧化酶的表达,减少肿瘤坏死因子α诱导的内皮细胞产生ROS[2]。内皮细胞特异性PPARδ基因敲除小鼠主动脉内CAT 和GPx 的表达降低,氧化应激增强[21]。本研究发现,Nrf2 激活剂DMF 和GW501516 均可升高Nrf2 蛋白、HO-1 蛋白的表达水平及SOD、GPx、CAT 水平,降低MDA、ROS 水平,减轻低氧诱导的PAECs 损伤,且Nrf2 抑制剂ML385 能够逆转GW501516 的上述作用。这说明GW501516 可通过抑制氧化应激,减轻低氧诱导的PAECs 损伤,其机制可能与激活Nrf2有关。
综上所述,GW501516可通过激活Nrf2,抑制氧化应激来减轻低氧诱导的PAECs 损伤。本研究仅从细胞水平探讨了GW501516 对低氧诱导PAECs 损伤及氧化应激的影响,本课题组将在后续动物实验中观察GW501516 对低氧诱导的肺动脉高压大鼠内皮细胞功能、氧化应激及肺血管重构的影响。
