代谢工程产2′-岩藻糖基乳糖的研究
2024-02-02涂班策黄广文黄明珠刘斌陈雪岚
涂班策,黄广文,黄明珠,2,刘斌,陈雪岚,2*
1(江西师范大学 生命科学学院, 国家淡水鱼加工技术研发专业中心,江西 南昌, 330027) 2(江西师范大学 健康学院,江西 南昌, 330027)
对于刚出生的婴幼儿来说,母乳是一种重要的营养资源。它不仅给新生儿提供生长所需的营养物质,而且对新生儿肠道微生物和免疫系统的发育有着重要影响。人乳低聚糖(human milk oligosaccharide,HMOs)作为人乳中最关键的碳水化合物,在其中发挥着重要的作用。迄今,已发现超200种HMOs,其中2′-岩藻糖基乳糖(2′-fucosyllactose,2′-FL)是母乳中含量最丰富的人乳低聚糖,约占其总含量的30%[1],在人母乳中的含量达到2 g/L[2],其结构如图1所示[3]。研究表明,2′-FL可以在婴儿肠道上皮细胞上形成一种糖脂类似物,竞争性地和病原菌结合,从而抑制病原菌对婴儿机体的侵染[4-5],如2′-FL能降低导致婴儿腹泻的主要原因之一的空肠弯曲杆菌对肠上皮细胞的侵染,效率达到80%。2′-FL的发酵产物,包括乳酸和一些短链脂肪酸,可以调节肠道pH值,从而提高乳酸菌和双歧杆菌在肠道的定殖能力,并协同发挥抗炎作用[6];此外2′-FL对肠道细胞和呼吸道上皮细胞的黏附有明显的抑制作用[7],且发现婴儿感染人体免疫缺陷病毒(human immunodeficiency virus,HIV)的存活率与母乳中2′-FL的含量有关。因此,美国食品和药物管理局和欧洲食品安全局先后批准其成为婴幼儿配方食品及儿童和成人健康食品中的有益制剂[8]。
鉴于此,2′-FL作为营养健康与药用的功能性食品成分受到了极大的关注,越来越多的科研人员投入到对2′-FL生产研究中。本文对2′-FL的合成方法、生物合成途径及构建高产工程菌的策略等进行了综述,以期为相关研究者提供参考。
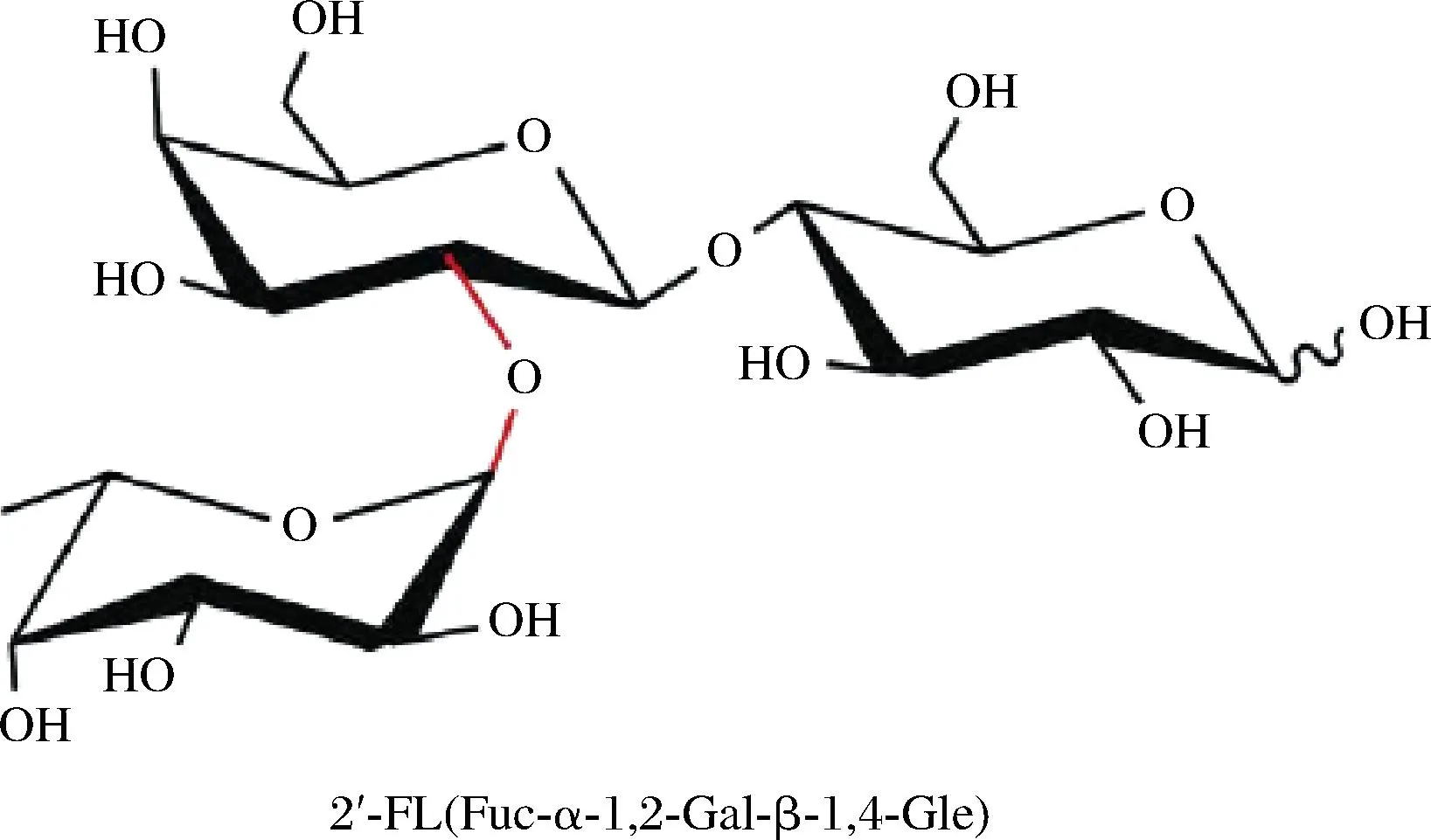
图1 2′-FL结构示意图[3]Fig.1 Structural of 2′-FL[3]
1 2′-FL的合成
1.1 2′-FL的合成方法
目前合成2′-FL的方法有4种,包括直接提纯法、化学合成法、酶促合成法及微生物合成法[9],这几种方法的优缺点具体见表1。从表1中比较可看到,目前已知最高效环保的方法就是微生物生产2′-FL,而且微生物合成的2′-FL与天然的2′-FL功能相同,临床试验也不会引起不良反应。此外微生物合成法与上述其他3种方法相比,生产2′-FL 的方法更加方便快捷,合成过程不会添加有毒试剂,大大提高了产物的安全性,且成本低廉,合成底物可以是葡萄糖和甘油等。因此微生物合成法生产2′-FL成为研究热点。

表1 2′-FL的合成方法Table 1 Synthesis methods of 2′-FL
1.2 2′-FL的生物合成途径
2′-FL的微生物合成是在α-1,2-岩藻糖及转移酶的作用下,将岩藻糖残基从GDP-岩藻糖转移到乳糖上,因此GDP-岩藻糖是合成2′-FL的重要前体物质。在微生物内合成2′-FL有2条代谢途径,分别是从头合成途径(denovo)和补救途径(salvage)[17]。合成途径如图2所示。
GDP-岩藻糖的从头合成途径始于果糖-6-磷酸,然后经过甘露糖-6-磷酸异构酶(ManA)、磷酸甘露糖变位酶(ManB)、甘露糖-1-磷酸鸟苷酸转移酶(ManC)、GDP-甘露糖4,6-脱水酶(Gmd)和GDP-L-岩藻糖合成酶(WcaG)等一系列酶的催化反应。合成的GDP-岩藻糖在1,2-岩藻糖基转移酶(FT)的作用下使GDP-岩藻糖转化成最终产物2′-FL[18]。

图2 2′-FL的合成途径Fig.2 Metabolic pathway for 2′-FL biosynthesis
而补救合成途径则是通过外源添加GDP-岩藻糖,然后经过双功能酶[19](Fkp)-岩藻糖激酶和GDP-岩藻糖焦磷酸化酶的作用形成前体物质GDP-岩藻糖,再经过1,2-岩藻糖基转移酶催化合成2′-FL。补救合成途径只需要经过2个酶的作用即可形成最终产物,比从头合成途径方便快捷。但前体物质GDP-岩藻糖的价格极高,造成成本很高。因此大部分研究都是通过从头合成途径来产生2′-FL[20]。
2 从头合成途径提高2′-FL产量的策略
2.1 GDP-岩藻糖的积累
GDP-岩藻糖是2′-FL合成的关键前体,因此提高GDP-岩藻糖的在胞内的积累能有效提高2′-FL的产量。
大肠杆菌作为最简单的模式生物之一,且其自身能内源性合成GDP-岩藻糖,使大肠杆菌成为2′-FL合成研究里最常用的宿主[21-22]。在大肠杆菌中,RcsA是大肠杆菌可拉酸合成的正向转录因子,GDP-岩藻糖合成途径上的基因,包括manB、manC和gmd、wacG都受到rcsA基因的正向调控,因此,rcsA的过表达能上调合成GDP-岩藻糖的基因。但是RcsA会被温度敏感的ATP依赖性蛋白Lon迅速降解,因此在大肠杆菌中敲除lon基因能提高胞内GDP-岩藻糖的积累[23-24]。对于不能内源性合成GDP-岩藻糖宿主,如谷氨酸棒杆菌[25]、枯草芽孢杆菌[26-27]和酿酒酵母菌[28]等。则需要引入外源基因,构建一条合成GDP-岩藻糖的通路。在报道的通过从头合成途径生产GDP-岩藻糖的策略中,共同过表达4个基因,包括manB、manC和gmd、wacG,有利于前体物质GDP-岩藻糖的积累。LI等[29]利用不同拷贝的质粒过表达manB、manC和gmd、wacG4个基因,发现高拷贝质粒中的manB和wacG的转录水平比低拷贝高出11.8和12倍,细胞内GDP-岩藻糖的量相比也有明显提高,最终2′-FL的产量提高到1.45 g/L,提高了70.6%。表明提高这些基因的表达量能有效促进细胞内前体物质GDP-岩藻糖的积累,前体物质积累量提高,2′-FL产量也会随之提高。LI等[30]也通过对加强上述4个基因的表达水平提高了GDP-岩藻糖的产量,使之从0.2 mg/L达到了11.2 mg/L。因此,提高GDP-岩藻糖是促进2′-FL产量的一个重要策略。
2.2 竞争模块的调控
为了最大化使代谢物流向目标途径而不被其他路径分流,很多研究者都着手调控竞争路径的基因[31]。如在大肠杆菌中GDP-岩藻糖会在wacJ表达的UDP-葡萄糖脂质载体转移酶的作用下生成与细胞壁合成有关的可拉酸,因此wacJ基因的失活明显提高了2′-FL的产量[30]。2′-FL另一个前体物质为乳糖,有效地利用乳糖亦是生产2′-FL的重要因素之一。在生命体内,乳糖会被β-半乳糖苷酶水解成葡萄糖和半乳糖,因此敲除胞内编码β-半乳糖苷酶的基因能有效减少乳糖的消耗。
除了上述描绘的直接影响前体物质的竞争途径,糖酵解和PPP途径某种意义上来说也是影响产物的竞争模块。细胞需要生长,代谢流需要流向糖酵解、PPP等途径;细胞需要生产,代谢流则需要流向生产代谢途径。但是细胞的生产离不开细胞的生长,细胞足够的生长量是生产的前提。而单独的删除或弱化糖酵解途径基因会极大地影响细胞的生长,因此平衡细胞的生长和终产物的积累,即实现动态调控策略成为科研工作者的思考[32]。如WU等[31]利用一个双功能的温度传感器,通过控制不同的温度来调控不同基因的表达量。在细胞前期生长阶段时,提高糖酵解和PPP途径的表达量而抑制生产途径基因的表达;在细胞生长到平稳期时则抑制生长途径相关的基因而提高生产途径基因的表达[33],作者通过对细胞生长的不同时期动态调控不同模块基因的表达,经过18 h摇瓶发酵,使2′-FL的产量从356.5 mg/L显著增加到了1 399.5 mg/L,极大的提高了2′-FL产量。因此,合理地通过动态调控生长和生产的平衡是提高2′-FL生产的一个有效策略。
2.3 α-1,2-FT的高效表达
无论是从头合成途径或补救途径,都需要在合成途径的关键限速酶α-1,2-岩藻糖基转移酶(α-1,2-FT)的作用下使前体物质最终变成2′-FL。然而,微生物来源的α-1,2-FT活性是一般代谢酶的1%,且该酶的水溶性较差,因此在合成2′-FL的过程中,筛选出高活性的α-1,2-FT及提高该酶的溶解性是积累2′-FL的重要手段。HUANG等[23]挑选了10个来源不同物种的α-1,2-FT进行实验,发现在这10个岩藻糖基转移酶中来自幽门螺旋杆菌的α-1,2-FT效果最好。并且在目前研究中该酶也是使用最多的酶。但是,该酶的溶解性依旧处于一个非常低的水平,因此研究者们还采用各种手段来设法提高α-1,2-FT的溶解性。
早在大肠杆菌中已经证实表达标签的使用能提高α-1,2-FT的表达量,用GST、脂肪酶前肽、麦芽糖结合蛋白和富含天冬氨酸的小肽来标记FT,都有助于此酶在大肠杆菌中的溶解性[34-35]。因此,科研工作者进一步研究了不同标签对FT功能的影响。HOLLANDS等[28]在FutC酶上添加了一段SUMOstar®标签,发现含有带标签的FutC酶的耶式酵母中2′-FL的产量比未带标签的高出30%,产量近60 mmol/L。WAN等[36]在利用短肽RIDD-RIAD将Fkp和FutC酶组装成多酶复合物来提高2′-FL产量时,发现其中短肽RIDD也能提高FutC酶的溶解性,并且2′-FL的产量相比原始菌株有了显著提高,达到了1.2 g/L,比不带标签的产量提高约50%。这表明,可以探索更多的融合标签来提高α-1,2-FT的溶解性。
2.4 辅因子的再生
NADPH和GTP是参与生物能量和碳代谢的重要辅助因子,有助于维持细胞内的氧化还原平衡。目前,加强与代谢产物相关的内源性辅助因子已成为提高工业微生物化学品产量的有效方法。因此加强2′-FL代谢途径中所需要的NADPH和GTP的再生也能有效提高2′-FL的产量[37]。其中NADPH的主要来源是磷酸戊糖途径(PPP途径),因此过表达PPP途径中的关键基因可以促进NADPH的生成。
在合成过程中由甘露糖-1-磷酸到GDP-甘露糖的合成过程需要消耗一个GTP,因此GTP作为合成过程的一个关键辅因子,不仅为代谢过程提供能源物质,也作为GDP的一个供体,因此提高GTP的供给能有效的促进2′-FL代谢途径。LI等[29]在大肠杆菌中共同过表达gsk和zwf基因促进了GTP和NADPH的再生,得到的重组菌中2′-FL的产量达到了2.24 g/L,相较于对照菌产量提高了53.8%。而GTP的代谢调控与鸟苷酸激酶(GMK)、核苷二磷酸(NDK)和黄嘌呤磷酸核糖转移酶(XPT)3个酶息息相关。研究表明,过表达ndk和gmk可以优化GTP供应并提高2′-FL的产量。如YU[38]通过启动子动态调控GTP供应模块来加强GTP的供应,在枯草芽孢杆菌中过表达GTP供应模块中的基因gmk和ndk,使得2′-FL的产量达到了1 839.7 mg/L,相较未过表达的菌株2′-FL产量提高了31.5%。
2.5 2′-FL的输出
对于所有的宿主菌,大部分的2′-FL都存在细胞内,而胞内积累过多的2′-FL可能会通过反馈作用来抑制2′-FL的产生,从而影响2′-FL的产量[39-40]。因此,筛选一个合适的糖转运体也是很重要的。HOLLANDS[28]通过筛选27个糖转运体,通过检测发酵液中2′-FL的产量,结果发现来自大肠杆菌的SetA和粗糙脉孢菌的纤维糊精转运体CDT2能够较好地将2′-FL从酵母细胞中输出。
3 结论与讨论
2′-FL在婴幼儿的健康及发育中起着重要的作用,其化学结构简单,可通过母乳直接提取、化学合成、酶促合成以及微生物生产4种方式获得;而微生物合成由于其安全经济等优势,成为研究者所关注的热点。微生物高效合成2′-FL有5个关键部分需要关注,包括GDP-岩藻糖的生产、竞争途径的调控、岩藻糖基转移酶的选择、辅因子的供给以及2′-FL的排出,表2对上述采用这5种策略的科研工作进行了总结。在早期研究中,大部分只是通过过表达或者敲除等常规方式来调控基因的表达,但在不同的生长时期所需要调控的基因并不相同,例如在前期细胞生长阶段,更期望细胞专注于自身生长;而在细胞趋于成熟后,则调控细胞成为生产的工厂,生产所需要的终产物。因此在改造微生物工厂时,要获得终产物高产和细胞工厂数量的平衡,选择一个合适的动态调控的方式可能是一个较好的策略。此外,大多数研究都引用了外源质粒,而质粒的引入需要抗生素筛选,但抗生素的使用在食品安全生产中存在风险,因此尽量避免质粒的运用,将外源基因直接整合到基因组会是更为安全可靠的策略。此外,大肠杆菌由于能直接合成GDP-岩藻糖而被大多数研究者所青睐,但大肠杆菌会有产内毒素的风险,因此选用更为安全的食品级微生物作为工程菌来生产2′-FL将会更有前景。
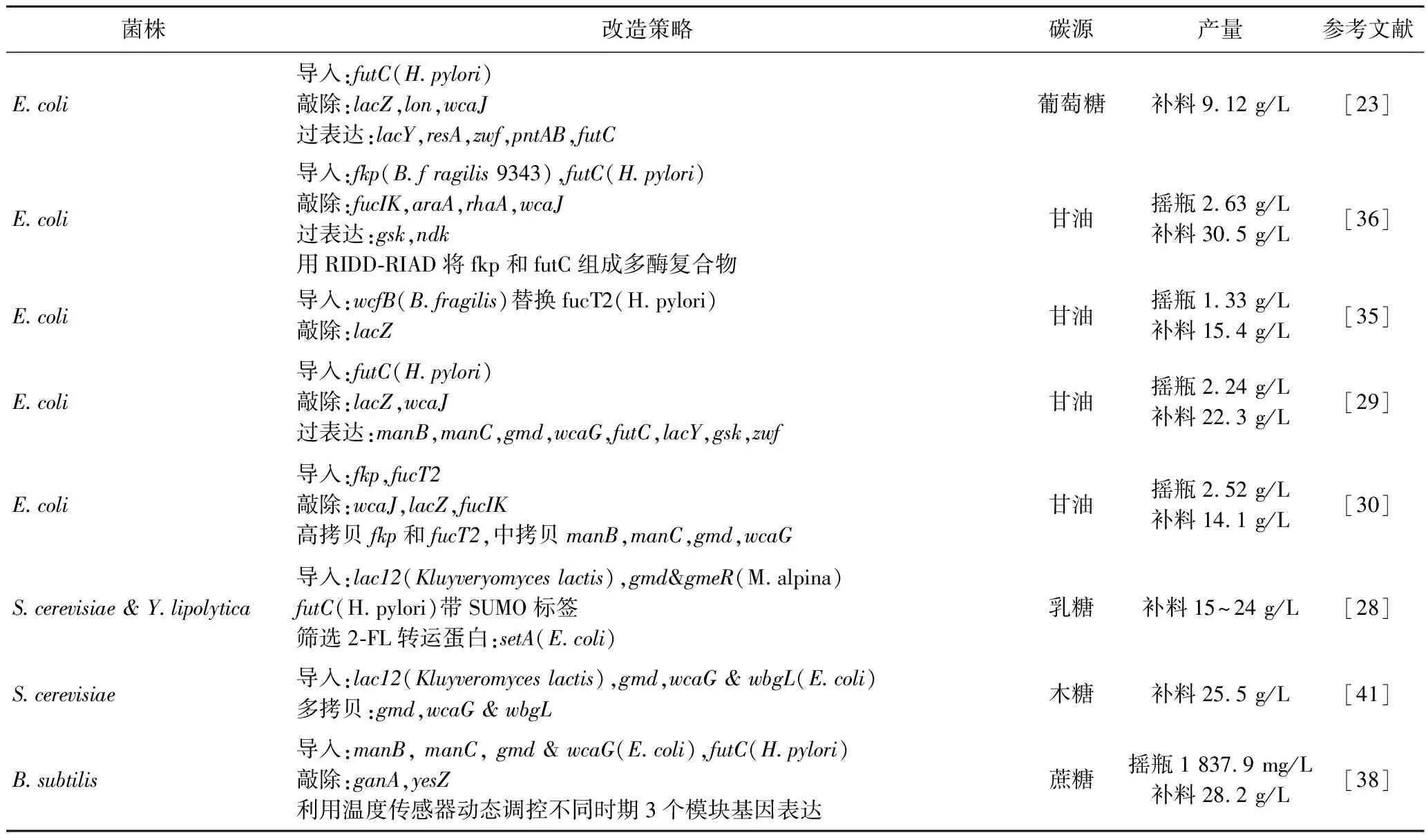
表2 生产2′-FL工程菌株的构建Table 2 Construction of Engineered Strains for 2′-FL Production
