刺梨不同提取物的非靶向代谢组学比较与分析
2024-02-02刘含郭银萍穆兴燕刘晓燕岑顺友
刘含,郭银萍,穆兴燕,刘晓燕,2*,岑顺友
1(贵阳学院 食品与制药工程学院,贵州 贵阳,550005)2(贵州省果品加工工程技术研究中心,贵州 贵阳,550005) 3(贵州宏财聚农投资有限责任公司,贵州 六盘水,553535)
刺梨(RosaroxburghiiTratt)系蔷薇科蔷薇属药食同源植物[1],主要分布在我国西南地区[2]。因其独特的风味而备受关注,并且富含多糖、维生素、黄酮、多酚等具有药理功效的成分[3],使得刺梨果实在医药领域拥有较高的保健和药用价值[4]。在药理方面的研究显示,刺梨具有抗氧化、抗衰老、降血糖[5]、治疗胃溃疡、促进消化、抗动脉粥样硬化等多种药理作用[6]。
国内对刺梨的研究已经十分火热,但也局限于传统方法的研究,如营养特性及产品开发,抗氧化、降血糖、降血脂等。针对刺梨活性成分的研究大多是从多酚、多糖等单一化合物的角度进行,且刺梨在代谢组学方面的研究鲜有报道。同一物质用不同溶剂提取,其含量、特性都可能发生改变,非靶向代谢组学能系统、全面地分析,获取大量代谢物的数据,从而解析提取物中小分子的差异。代谢物提取是代谢组学研究中最关键的一步,选择合适的提取方法为后续利用代谢组学寻找刺梨具有功能活性的关键代谢产物提供了有效的方法,有利于对刺梨中各代谢物进行深入研究。
代谢组学(metabolomics)是在特定条件下对生物体所含代谢物整体进行定性定量,可揭示特定时间和特定条件下代谢物的种类和含量,覆盖范围广[7],对于20多万种的植物代谢物[8],代谢组学的思路对其具有较大的意义。依据检测方式与研究目的的不同,代谢组学被分为非靶向和靶向[9]。非靶向旨在检测出样品中所有的代谢物,能发现一些新的化合物。由于数据库数据不全,定性时较为困难,也只能相对定量[10]。但它的优势在于整体性的检测出样品中的化合物,以便于后续鉴定分析。靶向代谢组学能较为精确的定量出目标代谢物[11]。本文采用非靶向代谢组学对刺梨不同提取物进行分析,通过整体检测刺梨中的化合物,结合多元统计方法筛选出目标代谢物,对代谢物进行分析,查阅文献发现其具有的功能活性,为进一步研究提供数据支持。
1 材料与方法
1.1 材料与仪器
刺梨,贵州省龙里县;甲醇、乙腈(纯度≥99.9%),美国Thermo公司;2-氯苯丙氨酸(纯度98.5%),上海阿拉丁生化科技股份有限公司;甲酸(纯度≥ 98%),东京化成工业株式会社;甲酸铵(纯度≥ 99%),美国Sigma-Aldrich公司;H2O(纯度100%),美国Millipore公司。
Vanquish液相色谱仪、Q-Exactive质谱仪,美国Thermo公司;ACQUITY UPLC®HSS T3 1.8 μm (2.1 mm×150 mm)色谱柱,美国Waters公司。
1.2 实验方法
1.2.1 提取物制备
刺梨全果提取物水-乙醇(占比60%)溶液的制备:称取刺梨样品按料液比1∶10(g∶mL)与混合,45 ℃水浴2 h,45 ℃、功率200 W超声30 min,过滤,收集滤渣,重复提取2次合并滤液,蒸发浓缩至浸膏状,分别用水和60%乙醇定容得到25 mL刺梨粗提物,置于-20 ℃冰箱保存备用(6个生物学重复样本)。
刺梨果渣(由同批次刺梨果压榨干燥得到)提取物的处理同1.2.1节。
1.2.2 样本预处理
精确称量样本200 mg(±1%)于2 mL EP管中,准确加入0.6 mL 2-氯苯丙氨酸(4 mg/L)甲醇(-20 ℃)配制,涡旋振荡30 s加入100 mg玻璃珠,放入组织研磨器中,55 Hz研磨60 s室温超声15 min;12 000 r/min,4 ℃离心10 min,取上清液300 μL 过0.22 μm膜过滤,过滤液加入到检测瓶中用剩余待测样本进行超高效液相色谱-高分辨质谱技术(ultra high performance liquid chromatography high resolution mass spectrometry, UPLC-HRMS)检测。
1.2.3 色谱-质谱分析
色谱条件:采用ACQUITY UPLC®HSS T3 1.8 μm (2.1 mm×150 mm)色谱柱,自动进样器温度设为8 ℃,以0.25 mL/min的流速,40 ℃的柱温,进样2 μL进行梯度洗脱,流动相为正离子0.1%(体积分数)甲酸水(C)-0.1%甲酸乙腈(D);负离子5 mmol/L甲酸铵水(A)-乙腈(B)。梯度洗脱程序为0~1 min,2%B/D;1~9 min,2%~50% B/D;9~12 min,50%~98% B/D;12~13.5 min,98% B/D;13.5~14 min,98%~2% B/D;14~20 min,2% D-正模式(14~17 min,2% B-负模式)。
质谱条件:仪器使用电喷雾离子源(electron spray ionization,ESI),正负离子电离模式,正离子喷雾电压为3.50 kV,负离子喷雾电压为2.50 kV,鞘气30 arb,辅助气10 arb。毛细管温度325 ℃,以分辨率70 000进行全扫描,扫描范围81~1 000,并采用HCD进行二级裂解,碰撞电压为30 eV,同时采用动态排除去除无必要的MS/MS信息[12]。
1.2.4 数据预处理
通过Proteowizard软件对原始数据进行分析及处理,利用R语言的XCMS程序包进行峰识别、峰过滤、峰对齐;得到包括质荷比、保留时间及峰面积等信息的数据矩阵。
1.2.5 物质鉴定
代谢物的鉴定首先根据精确分子质量进行确认,后续根据MS/MS碎片模式对HMDB、METLIN、Massbank、LipidMaps以及mzClound标准品数据库确认注释获得代谢物。
1.3 数据处理
利用SIMCA 14.1软件进行主成分分析(principal component analysis, PCA),可以判断不同样本生物学重复之间代谢组的数据可靠性和稳定性[13]。正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)模型表明各提取物组与其他3个提取物组之间的差异性[14]。对差异代谢物的筛选依据是SIMCA 14.1软件导出的变量重要性投影(variable importance projection value,VIP)值、P值和差异倍数(fold change,FC)。VIP值>1,P值<0.05及FC≥2和FC≤0.5为一般的差异代谢物筛选标准。在此基础上,本实验设定VIP值>1.3、P值<0.01、FC≥3和FC≤0.1筛选最终的显著差异代谢物。通过MBRole 2.0代谢通路分析功能,根据筛选出来的差异代谢物KEGG ID获得刺梨不同提取物代谢物的代谢途径[15]。
2 结果与分析
2.1 提取物数据的稳定性考察
UPLC-HRMS有较高的灵敏性和较广的分析范围,样本中含量极低的物质也能检测出,因此非靶向代谢组学常用UPLC-HRMS检测样品。在刺梨的提取实验中,常用的方法是水提、醇提。刺梨工业中,刺梨果渣产量巨大且利用率不高,但根据已有研究发现果渣中的活性成分十分丰富,研究前景可观。故设计以下4种提取方法:刺梨全果水提、刺梨全果醇提、刺梨果渣水提、刺梨果渣醇提,这4种不同提取物的正负离子模式下重叠的总离子流图(total ion chromatogram,TIC)如图1所示。
ESI+模式获得22 447个前体分子,ESI-模式获得11 835个前体分子。在二级质谱信息中,4种提取方式共得到316种代谢物。主要包括脂类、氨基酸类、糖类、酚类、维生素等,其中脂类68种、氨基酸52种、糖类48种、酚类28种、维生素14种。
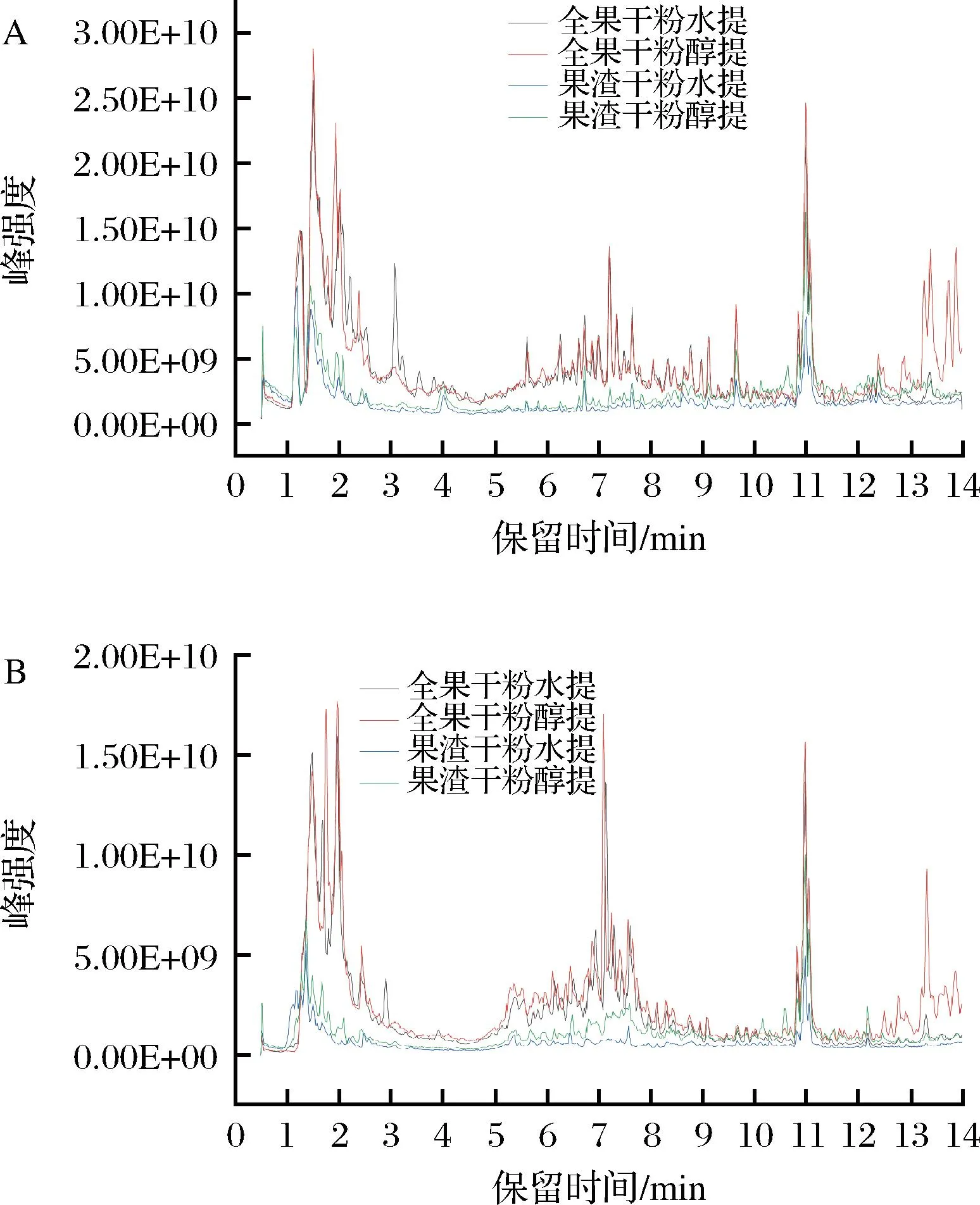
A-ESI+;B-ESI-图1 刺梨不同提取物总离子流图Fig.1 Total ion flow diagram of different extracts of Rosa roxburghii Tratt
PCA结果(图2)显示,刺梨不同提取物的生物学重复都汇集在一起,且全部样本均位于95%置信区间内[16],表明不同提取物数据的可靠性与稳定性较好,在测定过程中未出现明显偏差[17]。每个图形表示一个样本,不同的组根据图形的颜色和形状来区别。图形之间越近,样品中代谢物越相似;反之,样本越远,其整体代谢物差异越大。通过观察全部样本的PCA得分图,可以体现样本的总体分布趋势。PCA显示出4个主成分,其中主成分1(PC1)的贡献率为45.8%,主成分2(PC2)的贡献率为23.2%,不同样品组在两个坐标轴上彼此分离,说明刺梨不同提取物的代谢物有一定的差异。
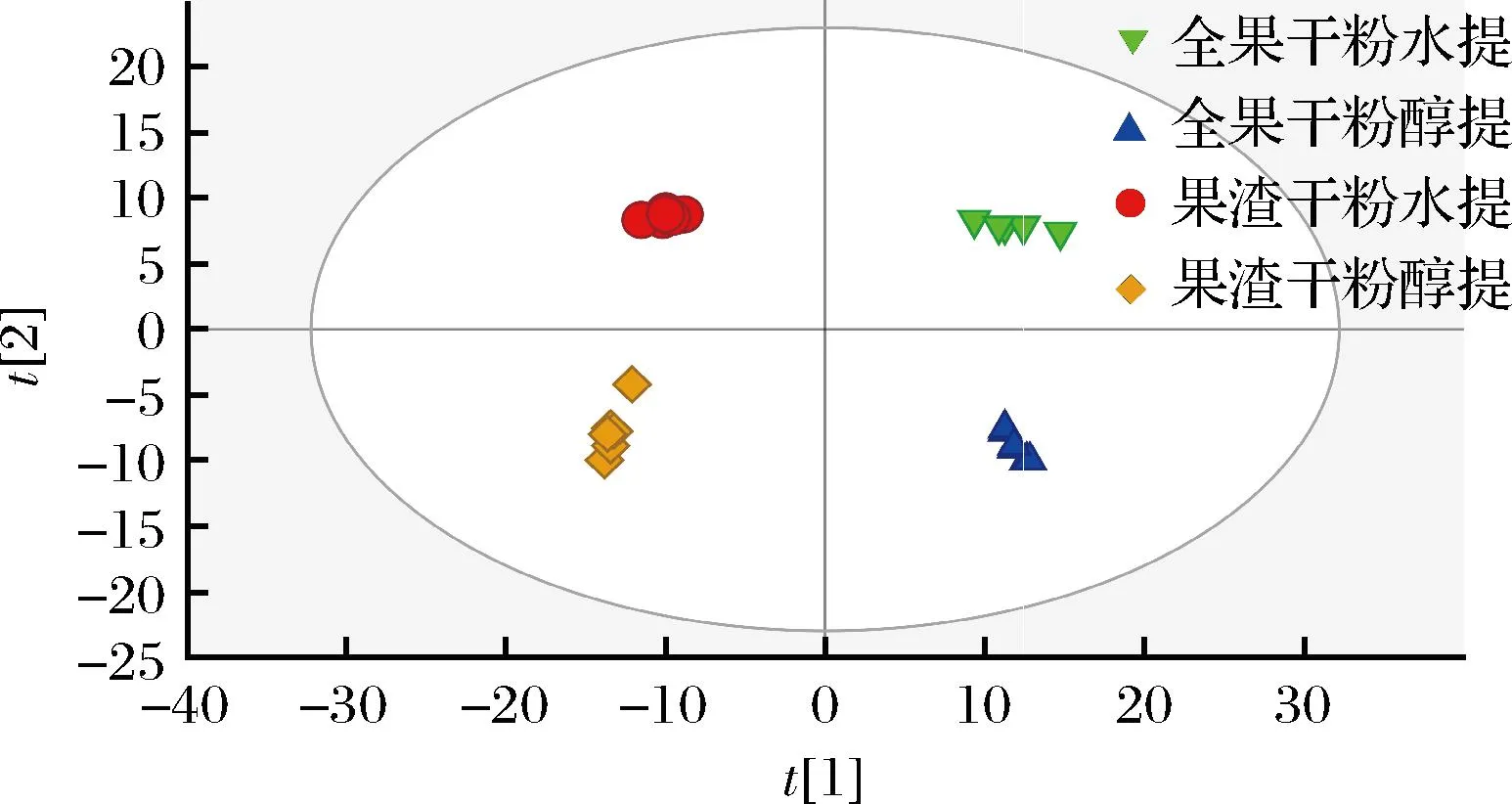
图2 刺梨不同提取物代谢组的PCA得分Fig.2 PCA scores of different extracts of Rosa roxburghii Tratt
2.2 刺梨不同提取物的差异性比较
为了提高分类效能,在PCA模型初步处理样本后,采用能降低系统噪声干扰的OPLS-DA模型分析数据[18]。95%置信区间是衡量样本可取性的重要指标[19],本次实验的全部样本处于区间内,表明本次样本具有可取性。不同提取物OPLS-DA分析结果表明,每个提取物与其他3个提取物在第一主成分轴上明显分开,说明其代谢物之间代谢成分差异明显(图3)。在图3四幅OPLS-DA得分图中样本间横向距离越远说明组间差异越大,纵向距离越近说明组内重复性越好。图中数据表明,2组样本存在明显差异性。
置换检验能够判断OPLS-DA模型是否过拟合,对于OPLS-DA模型导出的VIP值、P值和FC才更具说服力[20]。图中横坐标为保留原始数据的百分比,纵坐标为R2Y或Q2值[21]。最右边横纵坐标均为1的点为真实值,左边所有的模拟预测的R2(>0.9)和Q2(>0.9)都要低于真实值[22],并且R2总是大于Q2,Q2的回归线截距要小于0.05。对OPLS-DA模型进行200次排列实验,得到模型评估指标见表1。本次实验数据均满足以上条件,表明模型可靠没有过拟合[23]。
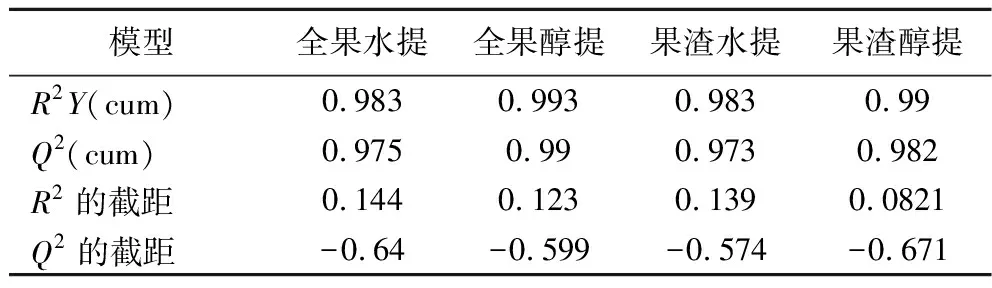
表1 OPLS-DA模型的主要评估指标Table 1 Main evaluation indexes of OPLS-DA model
2.3 差异代谢物的筛选与表征
对316个物质进行差异代谢物筛选,根据VIP值>1、P值<0.05、FC≥2和FC≤0.5共筛选出168个差异代谢物。各提取组相较于其他3组分别筛选到30、42、75、21个差异代谢物。在此基础上,对不同样本组之间具有差异的代谢物进行更严格的筛选,最终得到49种显著差异代谢物(VIP>1.3、P<0.01、FC≥3和FC≤0.1)(表2)。
如表2所示,各提取组相较于其他3组筛选出的49种差异代谢物为5种、17种、21种、6种。其中脂类11种、维生素2种、糖类10种、酚类10种、氨基酸6种、核苷酸4种、醇2种、萜类4种。刺梨中的许多代谢产物,如萜类、脂类、酚类、多糖等,对人体具有促进健康的功能。
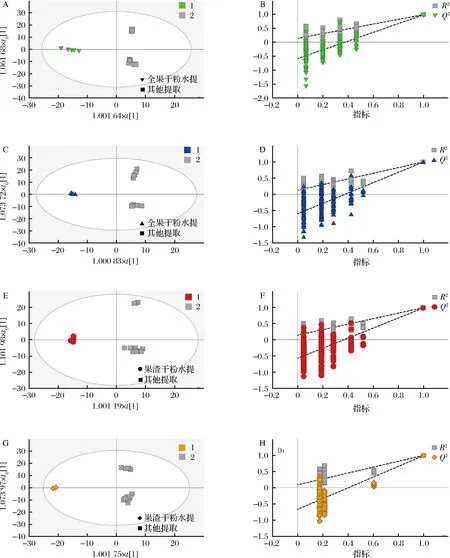
A-全果水提与其他组对比;B-全果水提置换检验;C-全果醇提与其他组对比;D-全果醇提置换检验;E-果渣水提与其他组对比; F-果渣水提置换检验;G-果渣醇提与其他组对比;H-果渣醇提置换检验图3 刺梨不同提取物代谢物的OPLS-DA得分和置换检验Fig.3 OPLS-DA score and displacement test of metabolites of different extracts of Rosa roxburghii Tratt
通过火山图可以直观地观察到各组分与其他组分的筛选出的显著差异代谢物(图4),图中横坐标表示log2FC纵坐标表示-log10P圆点为不显著代谢物,菱形为log2FC>0的代谢物,六边形为log2FC<0的代谢物,筛选出的49种差异代谢物用注释编号标出。其中全果干粉水提上调代谢物有2个,下调代谢物3个。全果干粉醇提上调代谢物有7个,下调代谢物有10个。果渣干粉水提上调代谢物有19个,下调代谢物有2个。果渣干粉醇提上调代谢物有1个,下调代谢物有5个。总体而言,上调差异代谢物多于下调差异代谢物。在本次实验中,上调差异代谢物黄酮类为最多。有研究发现在一定的条件下脂肪酸会降解为部分黄酮类化合物,这是因为脂类会被相应的酶分解成脂肪酸,并且因为脂肪酸的不稳定性,可在特定条件下分解为酮类和酚类[24]。
如图5所示,聚类热图可将代谢组学数据可视化[25]。每行代表一个代谢物,每列代表一个样本。4个不同提取物的代谢物水平存在显著差异,这些特征被投射到热图上,并用于样本聚类。图中颜色表示相对含量,红色块表示含量高表达,白色块表示含量低表达。差异代谢物在4种不同提取物中的相对含量明显区分。全果干粉水提中的积雪草酸、儿茶素、精氨基琥珀酸、富马酸、柚皮素7-O-β-D-葡萄糖苷含量相对较高。全果干粉醇提中的海藻糖、柚皮素查尔酮、抗坏血酸盐、蜜二糖含量相对较高。果渣干粉水提中的L-苹果酸、D-木糖、杜松酸、3-甲基硫代丙酸、(-)-表没食子儿茶素含量相对较高。果渣干粉醇提中的羟基异亮氨酸、异鼠李糖、青蟹肌醇、13-L-氢过氧基亚油酸含量相对较高。
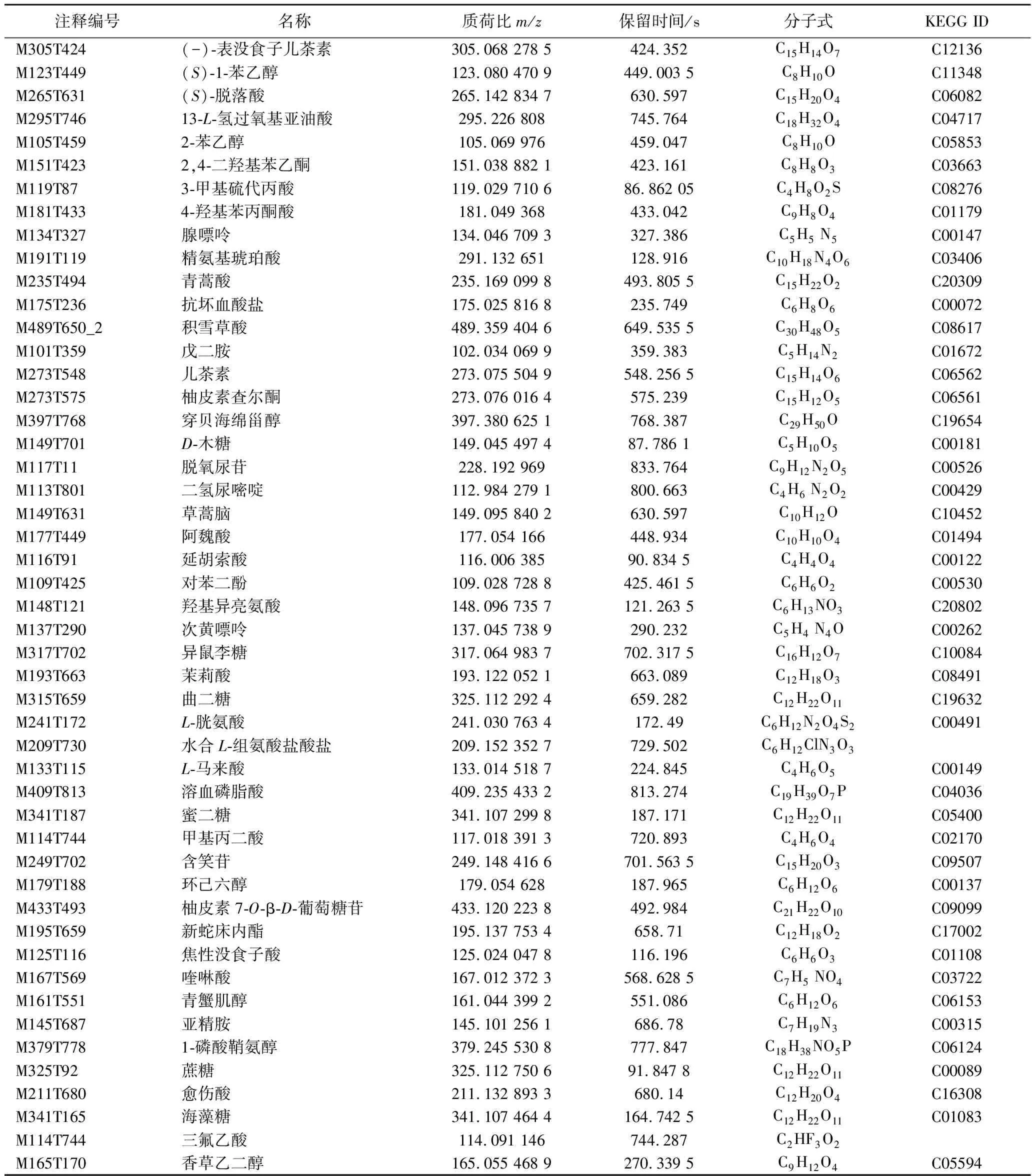
表2 刺梨提取物差异代谢物的鉴定信息Table 2 Identification information of differential metabolites in Rosa roxburghii Tratt extract
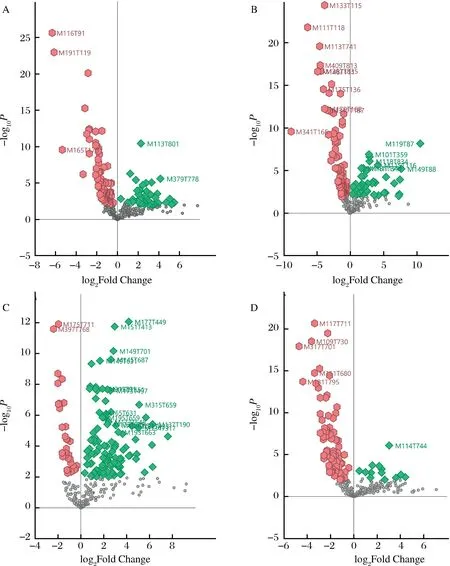
A-全果干粉水提;B-全果干粉醇提;C-果渣干粉水提;D-果渣干粉醇提图4 刺梨不同提取物差异代谢物的火山图Fig.4 Volcanic map of different metabolites from different extracts of Rosa roxburghii Tratt
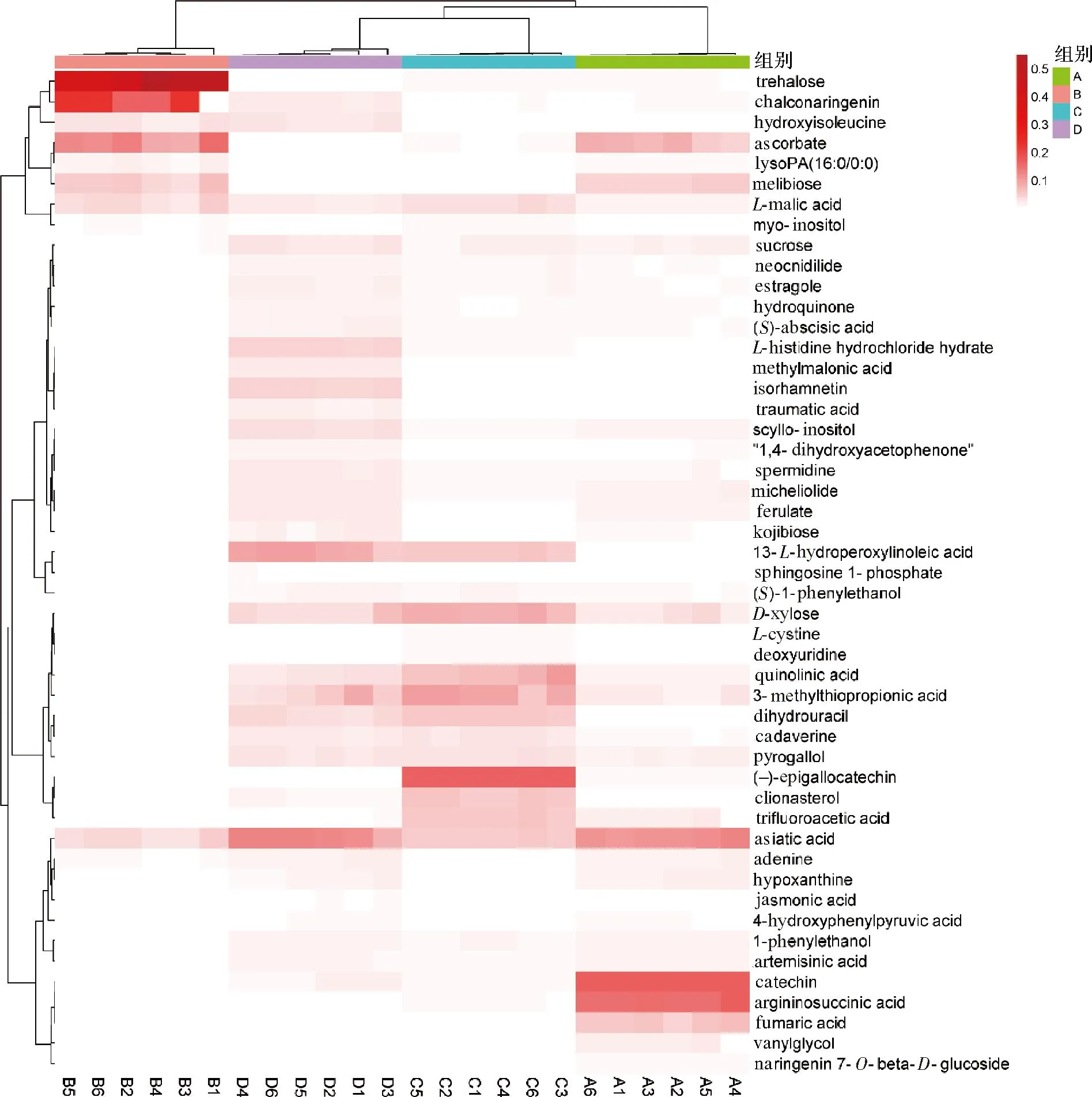
A-全果干粉水提;B-全果干粉醇提;C-果渣干粉水提;D-果渣干粉醇提图5 不同提取物的聚类热图Fig.5 Cluster heat map of different extracts
2.4 差异代谢物的代谢通路分析
利用筛选出的差异代谢物KEGG ID进行MBRole 2.0的通路分析,得到P<0.01的代谢途径有11条(P值越小,则该代谢通路的差异性越显著)。这11条代谢途径分别是淀粉与蔗糖的代谢、磷酸转移酶系统、半乳糖代谢、谷胱甘肽代谢、酪氨酸代谢、类黄酮生物合成、植物激素的生物合成、β-丙氨酸代谢、鸟氨酸、赖氨酸和烟酸生物碱的生物合成、苯丙烷类化合物的生物合成、ABC转运蛋白生物合成。结合P值与刺梨功能活性物质特征,本次实验的差异物代谢通路为类黄酮生物合成途径。如图6所示,参与类黄酮生物合成代谢通路的有4个代谢物,分别是有柚皮素查尔酮、儿茶素、柚皮素7-O-β-D-葡萄糖苷、(-)-表没食子儿茶素[(-)-epigallocatechin,EGC]。
由类黄酮生物合成代谢通路图可知(图7),对香豆酰辅酶a(C6-C3)与3个丙二酰辅酶a(C3)分子的缩合成柚皮素查尔酮与二苯基丙烷(C6-C3-C6)单元,通过共轭环闭合将其转化为柚皮素与黄酮(2-苯基色素-4-酮)主链,进一步的修饰产生多种结构形式,包括查尔酮、黄烷酮、黄酮以及异黄酮[26]。张帅[27]的研究表明柚皮素查尔酮具有抗肿瘤作用。
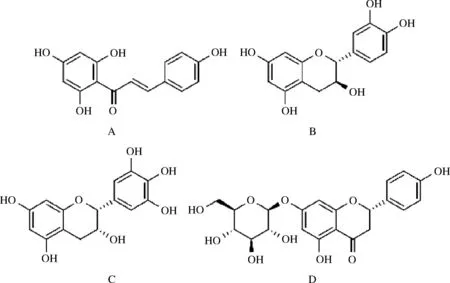
A-柚皮素查尔酮;B-(+)-儿茶素;C-(-)-表没食子儿茶素; D-柚皮素7-O-β-D-葡萄糖苷图6 类黄酮生物合成代谢通路的4个代谢物Fig.6 Four metabolites of flavonoid biosynthesis and metabolism pathway
(+)-儿茶素的合成路径为亮花青素+NADPH+H+生成(+)-儿茶素+NADP++H2O。KIM等[28]证明了植物源性儿茶素具有优异的抗感染、抗炎和抗氧化活性。儿茶素和富含儿茶素的植物材料通过体内研究中的炎症机制在短期和长期有效地抑制炎症应激。因此,儿茶素本身或含有儿茶素的营养制剂可作为强效抗感染剂或具有优异生理活性的功能性食品材料。
(-)-表没食子儿茶素的合成路径为delphinidin+2 NADPH+H+生成(-)-表没食子儿茶素+2 NADP+。KIM等[29]的研究表明,用EGC与没食子酸处理脂肪细胞可抑制脂肪细胞分化,表没食子儿茶素可显著调节成熟脂肪细胞的代谢基因转录,EGC确实在调节脂肪细胞分化和代谢方面发挥了有益的作用。在CHEN等[30]阿尔兹海默症的研究中,证明了多酚化合物EGC和表儿茶素没食子酸酯可以通过与Cu2+和Zn2+的螯合作用,有效缓解A40抗体聚集,减少活性氧的产生,从而降低Cu2+和Zn2+-A40诱导的神经元毒性。
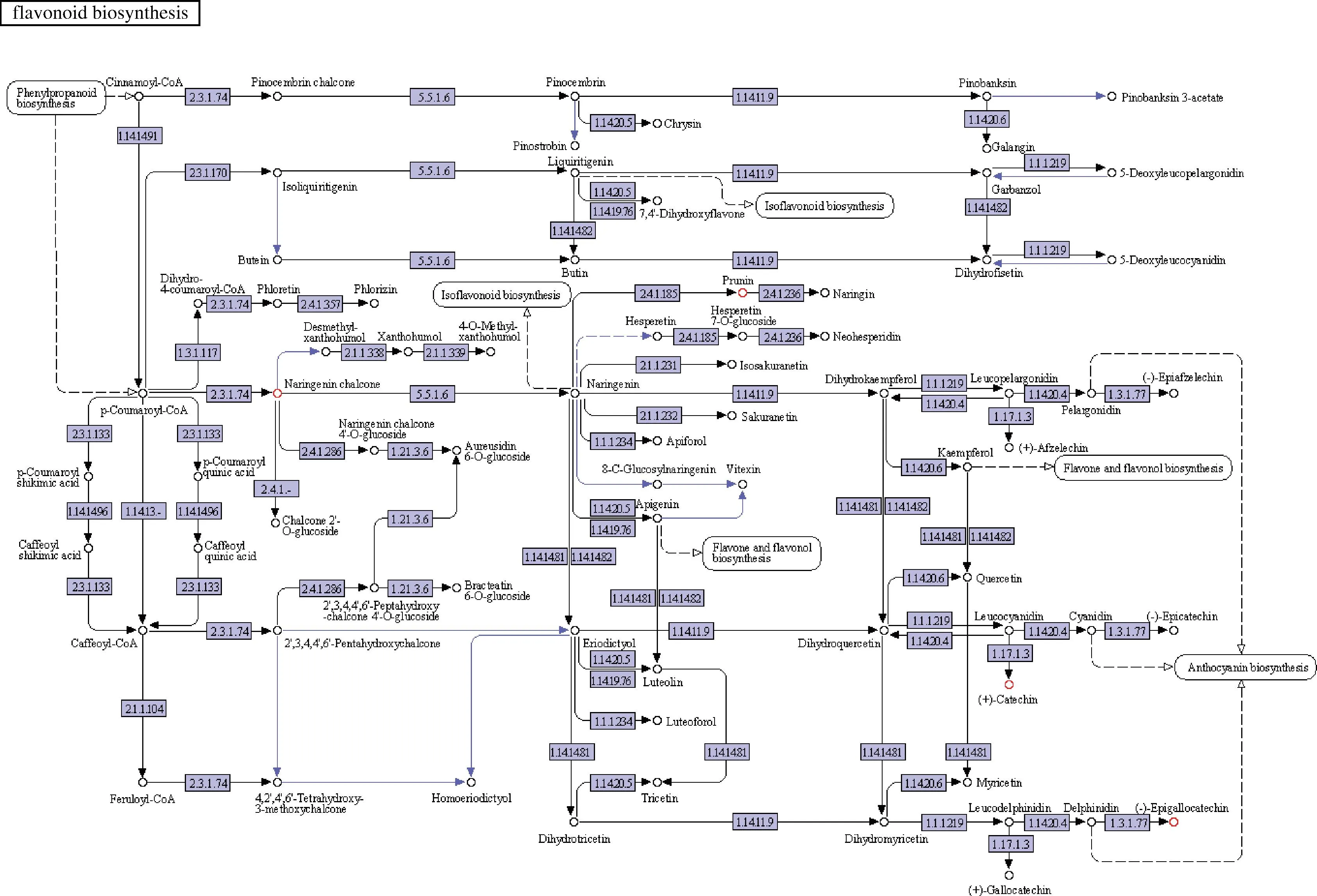
图7 类黄酮生物合成代谢通路图(来源:KEGG PATHWAY Database)Fig.7 Pathway map of flavonoids biosynthesis and metabolism (source:KEGG PATHWAY Database)注:方框为酶的国际命名编号;普通圆圈为化合物;红圆圈为本次的4个代谢物;实箭头为反应方向;虚箭头为与其他代谢途径的关系。
柚皮素7-O-β-D-葡萄糖苷的合成路径为黄烷酮7-O-β-D-葡萄糖基转移酶与柚皮素生成UDP和柚皮素7-O-β-D-葡萄糖苷[31],国内外对其研究较少,但它同属类黄酮一类,推测其也具备以上功能活性。在后续的研究中,可加强对刺梨抗肿瘤、抗氧化、抗感染、减肥等方面的研究。
3 结论
代谢组学是一门交叉学科,对于各学科的综合运用要求较高,能更全面,更精准地反馈物质的整体信息。全面、细致地了解代谢异常和差异是代谢组学的一个重要特性。本研究基于UPLC-HRMS非靶向代谢组学分析刺梨不同提取物,PCA结果显示,不同提取物的生物学重复都汇聚在一起,说明刺梨不同提取物数据的稳定性较好,在测定过程中未出现明显偏差。组内样本点都很好地聚集在一起,证明代谢物种类和含量都相近。OPLS-DA模型分析表明各组与其他提取物代谢物差异性较大,并根据VIP、P、FC值筛选出49种显著差异代谢物。总体而言,上调差异代谢物多于下调差异代谢物,上调差异代谢物黄酮类最多。经过MBRole 2.0通路分析,这49种差异代谢物参与的代谢通路有11条,其中类黄酮生物合成途径最为显著。参与类黄酮生物合成代谢通路的有4个代谢物,分别是有柚皮素查尔酮、儿茶素、柚皮素7-O-β-D-葡萄糖苷、(-)-表没食子儿茶素。儿茶素、柚皮素7-O-β-D-葡萄糖苷含量在全果水提中相对较高,柚皮素查尔酮含量在全果醇提中相对较高,(-)-表没食子儿茶素含量在果渣水提中相对较高。这4种代谢物在国内外的研究中展现出优异的功能活性特点。本文探究不同提取物的代谢物差异,为以后以代谢组学为基础的刺梨研究提供理论参考。在后续的实验中,可加强对刺梨抗肿瘤、抗氧化、抗感染、减肥等方面的研究。
