应用CRISPR/Cas9技术构建Raji-Luc CD19 KO淋巴瘤细胞系
2024-01-30刘静静刘秀盈冯娅茹冯义超于梦圆王建勋北京中医药大学生命科学学院北京0488深圳细胞谷生物医药有限公司广东深圳588深圳北京中医药大学研究院广东深圳588
刘静静,刘秀盈,冯娅茹,冯义超,于梦圆,王建勋,3(.北京中医药大学生命科学学院,北京 0488;.深圳细胞谷生物医药有限公司,广东深圳 588;3.深圳北京中医药大学研究院,广东深圳 588)
淋巴瘤是最常见的血液肿瘤之一,主要分为非霍奇金淋巴瘤(non-hodgkin lymphoma,NHL)和霍奇金淋巴瘤(hodgkin lymphoma,HL)两类[1]。其中,NHL 占所有淋巴瘤的90%,B 细胞非霍奇金淋巴瘤(B-cell non-hodgkin’s lymphoma,B-NHL)的发病率是T 细胞淋巴瘤的三倍,在我国常见的恶性肿瘤当中可以排在前10 位[2-3]。其发病率随年龄增长呈上升趋势,致死率较高。据中国国家癌症中心和美国国家癌症研究所预估数据显示,2022年我国NHL 患病人数97 788 例,死亡人数高达57 929例[4-5]。
白细胞分化抗原CD19 是一种表达于除浆细胞以外的所有B 细胞系、恶性B 细胞与滤泡树突状细胞(follicular dendritic cells,FDCs)上的表面蛋白,在B 细胞成熟并最终分化为浆细胞的整个过程中都有表达[6]。有研究表明,大多数B 细胞恶性肿瘤患者的癌细胞中CD19 表达均为正常至高水平。因此,CD19 是B 细胞恶性肿瘤中最重要的靶抗原之一,是开发嵌合抗原受体T 细胞(chimeric antigen receptor T-cell,CAR-T)对抗NHL 和B 细胞白血病(B cell leukemia,BCL)最有希望的靶点[7]。然而,约60%治疗后复发患者的癌细胞会出现CD19 表达减少或完全丧失的现象[8]。目前,尽管抗CD19 CAR-T 细胞在治疗B 细胞恶性肿瘤方面效果显著,但治疗后经常会出现肿瘤复发的现象,而肿瘤复发的主要原因与抗原逃逸有关[9-10]。因此,需要一种能够模拟CAR-T 治疗过程中免疫逃逸现象的细胞模型以用于相关研究。Raji 是一种非霍奇金淋巴瘤,起源于B 淋巴细胞,其CD19 和CD38 呈双阳性表达,常被用做靶细胞进行非霍奇金淋巴瘤的相关研究[11]。本研究通过CRISPR/Cas9 技术,构建了Raji-Luc CD19 KO 细胞,为后续探索如何解决CAR-T 细胞疗法由于抗原免疫逃逸而产生的肿瘤复发问题构建了细胞模型,并奠定了实验基础。
1 材料和方法
1.1 研究对象
1.1.1 细胞:Raji-Luc 细胞购自北京维通达生物技术有限公司,于液氮罐中冷冻保存。
1.1.2 质粒:电转所用的原始质粒pCAG-PBase,PB-CRISPR-Cas9,PB-CRISPR-sgRNA 均由中国农业大学吴森教授馈赠,于-20℃冰箱中冷冻保存。
1.2 仪器与试剂 RPMI 1640 培养液,AIM-V 培养液、PBS 溶液、青霉素-链霉素溶液、限制性内切酶、T4 连接酶、琼脂、酵母提取物、胰蛋白胨、氯化钠、氨苄青霉素、DH5α 感受态细胞、50×TAE 溶液、DNA marker 和琼脂糖(北京兰博利德商贸有限公司);胶回收试剂盒、质粒小提试剂盒、质粒大提试剂盒和DNA 纯化试剂盒(南京诺唯赞生物科技股份有限公司);FBS 胎牛血清(北京百诺威生物科技有限公司);7-AAD 抗体、PEMYC 抗体、APC anti human CD19 抗体和FITC anti human CD38 抗体(深圳市达科为生物技术股份有限公司)。
1.3 实验方法
1.3.1 构建PB-CRISPR-CD19 sgRNA 质粒:在NCBI 网站以“CRISPR/Cas9 CD19 sgRNA”为关键词进行相关文献检索,并通过IDT 网站验证off-target 以及on-target,按照打分由高到低的顺序,选择合适的sgRNA 序列,见表1。由擎科生物进行引物合成,将合成的引物片段退火形成所需的目的片段,将目的片段与线性化载体CRISPR-sgRNAvector 在16℃恒温条件下采用T4 连接12h,转化至感受态大肠埃希菌后扩大培养,提取质粒并进行浓缩。

表1 sgRNA 片段序列表
1.3.2 Raji-Luc 细胞的培养:复苏Raji-Luc 细胞,于37℃,5ml/dl CO2细胞培养箱中无菌培养,每48h 用含10g/dl FBS 的RPMI 培养液传代一次,使接种密度为5×105个/ml,培养至对数生长期用于后续实验。
1.3.3 筛选最优sgRNA 序列:将Raji-Luc 细胞分为4 组,每组1×106个,分别命名为sgRNA1,sgRNA2,sgRNA3 和sgRNA4,300g 离心5 min,弃去上清,加入无血清RPMI 培养液重悬,每组加入pCAG-PBase 转座酶,PB-CRISPR-Cas9 及PBCD19 sgRNA 质粒各4µg,混匀后转移至电转杯中。采用伯乐电转仪,选择K562 模式进行电转染。电击结束将细胞置于培养箱稳定30 min 后缓慢滴加双倍血清。电转染48 h 后,取适量电转后的4 组细胞和未电转的原始Raji-Luc 细胞,400g 离心5min,去除上清,用适量PBS 洗涤细胞,离心,去除上清,分别加入染色缓冲液重悬细胞,APC anti human CD19 流式抗体避光染色1h。染色结束后加入PBS洗涤细胞,离心后用PBS 重悬,用流式细胞仪检测细胞CD19 的表达情况。
1.3.4 电转染PB-CRISPR-CD19 sgRNA1 质粒制备Raji-Luc CD19 KO 细胞:取1×107个Raji-Luc 细胞原液量,350g 离心8min。弃去上清,加入含有sgRNA1 电转质粒的无血清RPMI 培养液重悬。采用伯乐电转仪,选择K562 模式进行电转染。电击结束将细胞置于培养箱稳定30min 后缓慢滴加双倍血清。
1.3.5 流式细胞术检测电转染效率并筛选稳定敲除的单克隆细胞株:电转染48h 后,取适量电转后的Raji-Luc CD19 KO 细胞和未电转的原始Raji-Luc细胞,400g 离心5min,去除上清,用适量PBS 洗涤细胞,离心,去除上清,分别加入2g/dl FBSPBS 染色缓冲液重悬细胞,并向其中加入FITC anti human CD38,APC anti human CD19 和7-AAD 流式抗体避光染色1h。染色结束后加入PBS 洗涤细胞,离心后用PBS 重悬,用流式细胞仪检测细胞的转染效率,将7-AAD-CD38+CD19-的分群设为目标细胞,进行流式分选,将分选后的细胞极限稀释至2.5 个/ml,在96 孔板中每孔加入200μl 筛选单克隆细胞。将96 孔板中的单克隆细胞株进行扩大培养,再次取适量单克隆细胞用抗体FITC anti human CD38,APC anti human CD19 染色,以未转染的Raji-Luc 细胞作为阳性对照,对比检测Raji-Luc CD19 KO 细胞表面CD19 和CD38 的表达情况,以确定筛选得到的细胞是否成功敲除表面CD19抗原。
1.3.6 细胞系表面荧光素酶表达的检测:分别取原始的Raji-Luc 细胞、Raji-Luc CD19 KO 细胞2 号单克隆、Raji-Luc CD19 KO 细胞20 号单克隆各1×105个,依次梯度稀释为1×105,1×104,1×103,102个/ml 接种于96 孔白板中,每孔分别加入100μl Bright-LumiTM萤火虫荧光素酶检测试剂,反应5min后,选择化学发光模式,检测各组各孔细胞的相对发光光度(relative light unit,RLU)。
1.3.7 Raji-Luc CD19 KO 细胞基因序列检测:扩大培养流式检测筛选出的单克隆细胞,分别取适量原始的Raji-Luc,Raji-Luc CD19 KO 2 号、20 号单克隆细胞提取基因组,以此为模板分别PCR 扩增出CD19 基因片段。引物序列为:FOR:5’-ATGCCA CCTCCTCGCCTC-3’,REV:5’-ACCTGGTGC TCCAGGTGC-3’,扩增程序为:①94℃,1min;②98 ℃,10s; ③55 ℃,15s; ④68 ℃,30s/kb;②③④30Cycles。将PCR 扩增产物送至金唯智测序公司进行测序。
1.3.8 荧光素酶化学发光法验证CAR-T 对Raji-Luc 和Raji-Luc CD19 KO 细胞的杀伤作用:取对数生长期的Raji-Luc 和Raji-Luc CD19 KO 细胞,以8×105个/ml 每孔50μl 的密度接种于96 孔白板中作为靶细胞。取适量实验室前期制备的Pan-T 以及CD19 CAR-T 和CD38 CAR-T 细胞为效应细胞[12-13]。各分为三个实验组:靶细胞+Pan-T 细胞组、靶细胞+CD19 CAR-T 细胞组、靶细胞+CD38 CAR-T 细胞组,每组分别设置效靶比为1∶1,1∶2,1∶4 和1∶8,各三个复孔。取适量CAR-T 和Pan-T 细胞,处理至合适密度,在上述96 孔板中每孔加入50μl CAR-T细胞或Pan-T 细胞,置于37℃,5ml/dl CO2细胞培养箱中共培养。培养8h 后,分别在各组每孔加入100μl Bright-LumiTM萤火虫荧光素酶检测试剂,反应5min 后,选择化学发光模式,检测各组各孔细胞的相对光单位(relative light unit,RLU),计算杀伤效率,计算公式:杀伤效率=1-(实验孔-空白孔)/(最大裂解孔-空白孔)×100%。
1.4 统计学分析 实验数据采用GraphPad Prism 8 统计软件进行分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 成功构建PB-CRISPR-CD19 sgRNA 质粒 测序结果见图1a,构建所得四组PB-CRISPR-CD19 sgRNA 质粒序列与预期序列一致,成功构建PBCRISPR-CD19 sgRNA 质粒,质粒构造见图1b。
2.2 sgRNA1 序列效果最佳 流式细胞术检测结果见图2。原始Raji-Luc 细胞CD19 表达率为98.52%,电转染48h 后sgRNA1,sgRNA2,sgRNA3 和sgRNA4 四组细胞CD19 的表达率均低于原始Raji-Luc 细胞,分别为58.96%,65.81%,70.83%和67.78%。sgRNA1 的序列靶向性较强,并且电转染过后细胞状态最佳。

图2 流式细胞术检测四组sgRNA 转染细胞及Raji Luc 细胞CD19 的表达率
2.3 电转染PB-CRISPR-CD19 sgRNA 质粒成功制备Raji-Luc CD19 KO 细胞 流式细胞术鉴定结果见图3a,极限稀释法筛选得到的单克隆细胞株中2号单克隆和20 号单克隆细胞表面CD19 表达缺失,而CD38 表达正常。进行冻存复苏后,两株单克隆细胞的CD19 表达依旧稳定缺失,且两组细胞电转导效率均达到99%以上(即CD19 阴性,CD38 阳性细胞),见图3b。
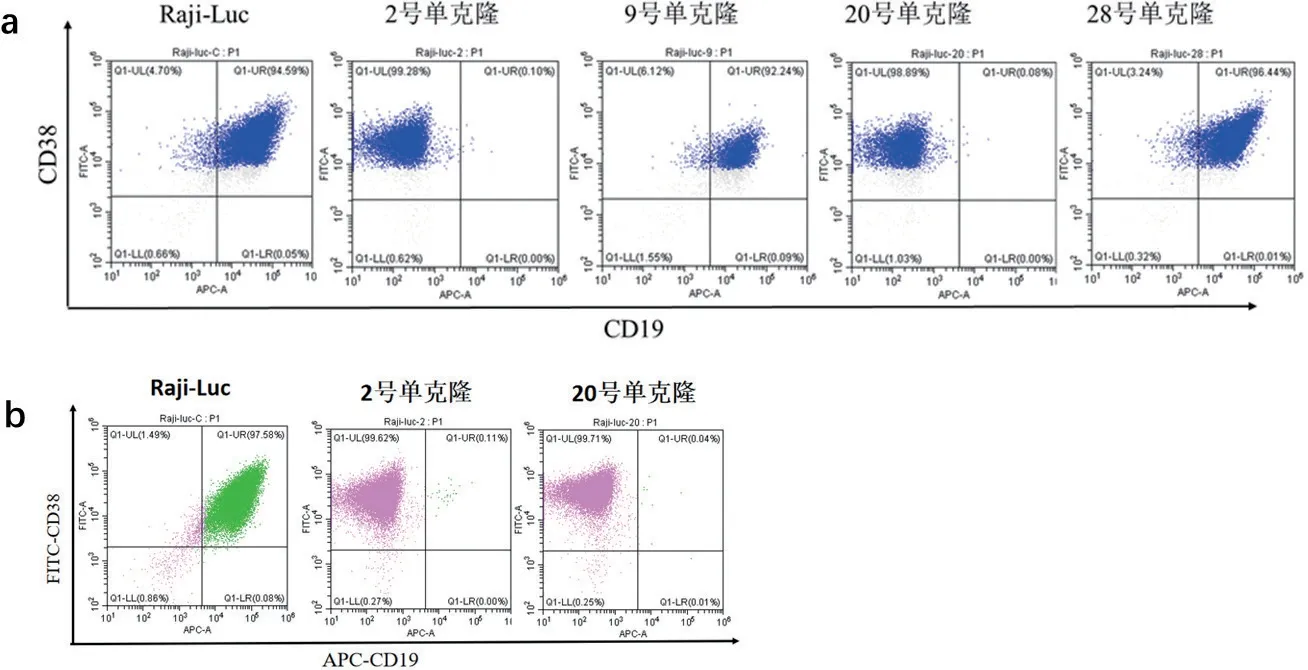
图3 流式细胞术检测Raji-Luc CD19 KO 单克隆细胞表面蛋白表达情况
2.4 Raji-Luc CD19 KO 细胞与原始Raji-Luc 细胞的荧光素酶表达比较 经酶标仪检测结果见图4。2 号单克隆Raji-Luc CD19 KO 细胞和20 号单克隆Raji-Luc CD19 KO 细胞与原始Raji-Luc 细胞相比荧光素酶表达差异无统计学意义。
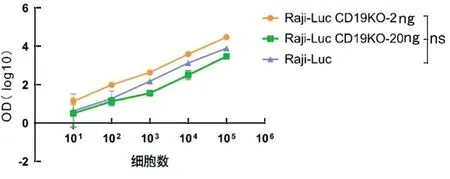
图4 Raji-Luc CD19 KO 细胞系荧光素酶检测
2.5 单克隆Raji-Luc CD19 KO CD19 细胞表面抗原的表达敲除 测序结果见图5。Raji-Luc CD19 KO 2号单克隆在CD19 基因处发生了大片段的碱基丢失,Raji-Luc CD19 KO 20 号单克隆细胞株的基因序列在该基因片段发生了小片段的丢失,两个细胞株CD19 表面抗原的表达都被成功敲除。

图5 原始Raji-Luc 细胞与CD19 KO 单克隆细胞基因序列对比图
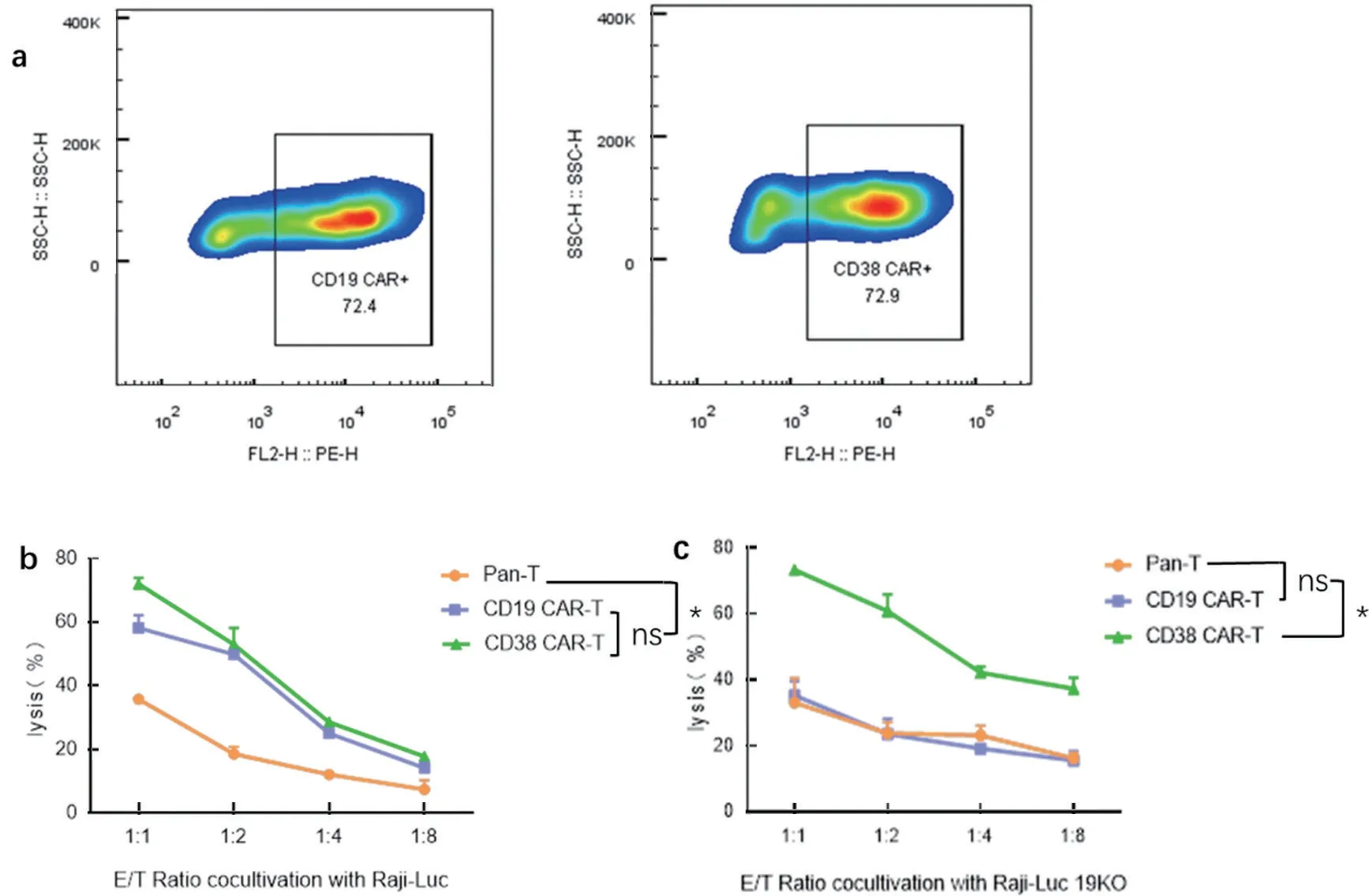
图6 CAR-T 细胞对Raji Luc 及Raji-Luc CD19 KO 细胞的杀伤效率检测
2.6 Raji-Luc CD19 KO 细胞不能激活对应的CAR-T细胞 流式检测结果显示,实验室此前构建成功的CD19 CAR-T 和CD38 CAR-T 细胞均出现明显细胞分群,转导效率分别为72.4%和72.9%,见图6a。荧光素酶测定杀伤效率实验结果显示,当靶细胞为Raji-Luc 细胞时,CD19 CAR-T 与CD38 CAR-T 细胞杀伤能力相当,且明显强于Pan-T 细胞,差异具有统计学意义(t=3.405~3.771,均P<0.05),见图6b。当靶细胞为Raji-Luc CD19 KO 细胞时,CD19 CAR-T 细胞与Pan-T 细胞的杀伤能力相当,CD38 CAR-T 细胞的杀伤能力明显强于Pan-T 细胞和CD19 CAR-T 细胞(t=5.428~6.804,均P<0.05),见图6c。该结果表明敲除CD19 的Raji-Luc 细胞株不能激活对应的CAR-T 细胞进行杀伤。
3 讨论
CD19 属于免疫球蛋白(immunoglobulin,Ig)超家族的成员,位于16 号染色体短臂上(16p11.2),在调节B 淋巴细胞选择、激活和分化的细胞表面受体的信号传导阈值中起到非常重要的作用。ENGEL等[14-15]人的研究表明CD19 的缺失会使小鼠外周血淋巴组织中B 细胞的数量明显减少,B 细胞对有丝分裂原的增殖反应明显降低,血清免疫球蛋白水平也显著降低。过表达CD19 的小鼠在骨髓早期B 细胞发育中存在明显的缺陷,有丝分裂反应增强,血清免疫球蛋白水平升高。
近年来,抗CD19 CAR-T 细胞在治疗复发或难治性急性B 淋巴细胞白血病(B-cell acute lymphoblastic leukemia,B-ALL)和非霍奇金淋巴瘤(NHL)方面取得了快速而持久的显著疗效[16]。目前有700 多项相关临床试验在 ClinicalTrials.gov中注册,其中41%针对CD19。PAN 等[17-18]人指出,在现有抗CD19 CAR-T 细胞的治疗过程中有相当大比例的患者由于CD19 抗原的逃逸或表达下调,复发率显著增加。RUELLA 等[19]人在临床研究当中发现,一例B-ALL 患者在接受抗CD19 CAR-T 细胞注入19 天后病情得到了完全缓解,但在治疗后第261 天出现病情复发并最终死亡,该患者复发后的白血病细胞均异常表达抗CD19 CAR,无法检测到CD19 的表达。
抗原逃逸现象的出现,迫使我们去探究如何使CAR-T 细胞在肿瘤细胞抗原丢失后仍然对其具有杀伤作用或是寻找更加合适的替代靶点[20]。ZHAO等[21]人开发了一种新型CD19/CD22/CD3 三特异性抗体,用于克服肿瘤免疫逃逸对CAR-T 的限制。DAI 等[22]人为了解决CD19 抗原丢失而造成肿瘤复发的情况,设计了一种靶向CD19 和CD22的双特异性CAR-T 细胞用于治疗成人B-ALL。然而,在上述的研究当中,实验者均采用对比单抗原CAR-T 与多抗原CAR-T 对同一肿瘤细胞的杀伤情况来验证CAR-T 对于肿瘤的体外治疗情况,并未通过产生CD19 抗原丢失的肿瘤细胞来进行直接验证,本研究所构建的Raji-Luc CD19 KO 细胞正是为此类研究提供了可以直接验证的模型支持,为后续研究者进行补充实验提供了研究对象。
CRISPR/Cas9 是继ZFN,TALENs 等基因编辑技术推出后的第三代基因编辑技术,在基因敲入、基因敲除、碱基突变等方面更加快速高效和便捷。近年来,CRISPR/Cas9 技术也被应用于构建各种细胞系以满足不同领域的研究,解决了很多在过去的科研过程中无法克服的困难[23]。黄小琴等[24]人通过CRISPR/Cas9 系统构建了敲除AMPKα1的A549 和H460 肺癌细胞的细胞株,为后续研究AMPKα1 对于肺癌的促癌机制提供了细胞模型。尽管CRISPR/Cas9 在肿瘤治疗研究方面显示出光明的前景,但它依赖DSB 刺激基因编辑过程可能会破坏其安全性,其基因敲除的随机性可能会产生新的基因型,其中一些可能会产生潜在致病后果[25]。在本研究中,筛选最适的sgRNA 弥补了CRISPR/Cas9 质粒敲除效率不一致的缺点,通过筛选单克隆以及基因测序解决了敲除随机性的问题。并且在敲除CD19 后仍不影响细胞原始荧光素酶基因的表达,这为后续在动物实验中对肿瘤进行长期观察提供了检验手段。
