重组溶瘤单纯疱疹病毒对小鼠结肠癌移植瘤的抑制作用*
2024-01-30朱彦斌彭瑞娟张磊张新强马正海
朱彦斌,彭瑞娟,张磊,张新强,马正海
(新疆大学生命科学与技术学院新疆生物资源基因工程重点实验室,新疆 乌鲁木齐 830017)
0 引言
溶瘤病毒(Oncolytic Virus,OV)能特异性感染和裂解肿瘤细胞,是肿瘤治疗领域的前沿和热点.近些年以1型单纯疱疹病毒(Herpes Simplex Virus-1,HSV-1)为基础改造的溶瘤单纯疱疹病毒取得了突破性进展,TVEC(talimogene laherparepvec)和Teserpaturev(G47Δ,Delytact)两种oHSV先后获批上市用于治疗转移性黑色素瘤和胶质瘤,并有多种oHSV治疗方案进入临床实验阶段[1].目前,oHSV主要通过删除神经毒性基因γ34.5、免疫抑制基因ICP47和病毒复制相关基因ICP6等获得,并在此基础上插入细胞因子和趋化因子等免疫调节因子以增强抗肿瘤免疫反应[1-2].本课题组前期构建了删除内部反向重复序列(Inverted Repeat,IR)的HSV-1载体MH1001,以及删除IR和ICP47的病毒载体MH1005,并在MH1001中插入抑癌基因p53获得oHSV MH1004、在MH1005中插入IL-12获得oHSV MH1006,以上oHSV在皮下黑色素瘤模型、结肠癌肺转移模型和小鼠皮下神经瘤模型中取得了良好的治疗效果,显著抑制了小鼠肿瘤的生长,延长了小鼠生存期[3-5],本文旨在探讨MH1004和MH1006对小鼠皮下结肠癌的抑制作用.
1 材料与方法
1.1 病毒株和细胞株
HSV-wt、HSV病毒载体MH1001和MH1005以及oHSV MH1004和MH1006均为实验室保存的病毒株,详见文献[3-4];小鼠结肠癌细胞系CT26、兔上皮细胞Rsc和人胚肾细胞HEK-293FT细胞均为实验室保存.
1.2 实验动物
4~6周雌性BALB/c小鼠60只,购自北京维通利华实验动物技术有限公司.
1.3 主要试剂
细胞裂解液、脱脂奶粉、TBST、DAB显色液、RPMI-1640培养基、磷酸缓冲液、0.25%胰蛋白酶购自Hyclone公司;胎牛血清FBS购自杭州四季青公司;吉姆萨染料为北京鼎国昌盛生物技术有限责任公司产品;IL-12检测试剂盒为Abcam产品;鼠抗人p53单克隆抗体购自博士德生物公司,辣根过氧化物酶标记山羊抗小鼠IgG为北京鼎国昌盛生物技术有限公司产品;其余试剂均为国产分析纯.
1.4 病毒的扩增与治疗基因的表达检测
1.4.1 病毒的扩增
重组HSV-1的扩增方法详见文献[2],简述如下:常规方法培养Rsc至细胞满度达到85%以上,以0.1 MOI病毒感染细胞,待90%以上细胞发生病理变化时收集细胞,加入1 mL病毒储存液,-80 ℃保存备用;病毒储液经超声波破碎细胞释放病毒后,按常规方法感染Rsc测定病毒滴度.
1.4.2 Western blot检测p53在MH1004感染细胞中的表达
以1 MOI MH1004感染HEK-293FT细胞,培养48 h后收集细胞悬液,提取细胞总蛋白;取30 μL样品进行SDS-PAGE电泳分离蛋白;湿转法将分离的蛋白转到PVDF膜上;PVDF浸于1%脱脂奶粉封闭液中,4 ℃过夜;1∶200稀释的鼠抗人p53单抗中室温孵育2 h,PBST快洗3次;1∶4 000稀释的山羊抗小鼠IgG中室温孵育1.5 h,PBST快洗3次;加入2 mL DAB显色液避光显影,拍照.
1.4.3 ELISA检测IL-12在MH1006感染细胞中的表达
以1 MOI MH1006感染HEK-293FT细胞,分别于感染后1、2、3、4 h收集细胞上清液检测IL-12含量,操作步骤按照Abcam IL-12 p40/p70 Human SimpleStep ELISA Kit使用说明书进行.
1.5 小鼠结肠癌肿瘤模型的建立
6~7周龄雌性BALB/c小鼠随机分为6组,分别为Mock(病毒储液)组、HSV-wt组、MH1001组、MH1004组、MH1005组和MH1006组,每组10只小鼠;将CT26细胞密度调至1×107个细胞/毫升,充分混匀后移至无菌EP管中;用酒精棉球浸湿小鼠背部右侧皮毛,使其皮肤裸露,揪起小鼠皮毛,将针头平行插入皮下,按1×106个细胞/100微升PBS进行皮下接种;正常饲养小鼠,观察小鼠成瘤情况.
1.6 重组oHSV抑瘤效果和生存时间的监测
待小鼠皮下肿瘤直径达到约6~7 mm时,挑选各组内肿瘤大小一致的小鼠(n=6)用于后续抑瘤实验;用病毒储液将各病毒调整至2×107PFU/mL,吸取100 μL各病毒或储液(Mock)肿瘤内多点注射,连续注射3次,间隔7 d,每3 d测量肿瘤的长度(Length,L)和宽度(Width,W),按照公式V=(L×W2)/2计算肿瘤体积,监测小鼠的肿瘤体积和生存时间,绘制抑瘤曲线;小鼠死亡后先冻存,首次注射病毒后第42 d对各组小鼠统一进行剥瘤和拍照,每组肿瘤组织从大到小排列.
1.7 统计分析
实验数据以“平均数±标准差”(X±S)表示,使用GraphPad Prism 5软件进行t检验.0.01<P<0.05、0.001<P<0.01和P<0.001分别为有差异、差异显著和差异极显著的判定标准.
2 实验结果
2.1 重组HSV-1的扩增与鉴定
HSV-wt、MH1001、MH1005、MH1004和MH1006感染Rsc 36 h时的滴度均达到1×108PFU以上.Western blot从MH1004感染细胞中检测到约55 kDa的p53蛋白质,且表达量明显高于未感染病毒的对照细胞(图1).MH1006感染细胞1、2、3、4 h后IL-12的表达量分别为37.44±9.67 pg·mL-1、77.34±6.94 pg·mL-1、83.39±7.25 pg·mL-1和92.51±14.41 pg·mL-1(图2),均显著高于对照组(0.001<P<0.01),感染2~4 h时,IL-12表达量高于1 h的表达量(0.01<P<0.05),说明MH1006感染细胞1 h时IL-12已开始表达,且2 h后达到平台期.
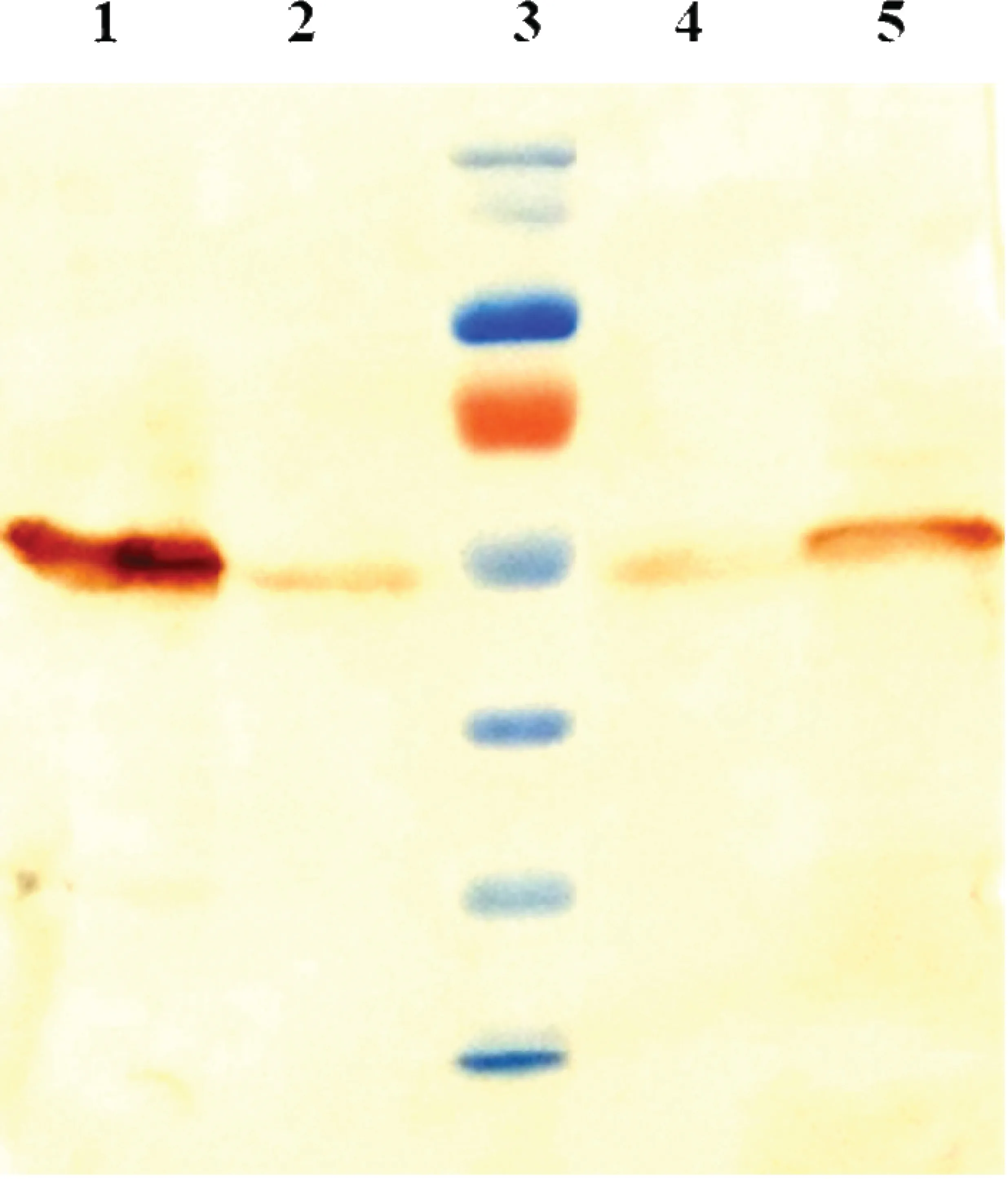
图1 Western blot检测MH1004感染细胞中p53蛋白质的表达

图2 ELISA检测MH1006感染细胞中IL-12的表达
2.2 重组oHSV对小鼠肿瘤体积的影响
oHSV抑制移植瘤效果见图3.治疗6~18 d时,MH-1006组小鼠的肿瘤体积小于Mock组(0.01<P<0.05),其中12 d时MH1004组小鼠肿瘤体积亦小于Mock组(0.01<P<0.05).治疗21 d后,MH1006组小鼠肿瘤体积为1 414.36±1 639.19 mm3,极显著小于Mock组肿瘤体积(7 682.92±2 648.74 mm3)(P<0.001);MH1004和MH1005组小鼠的肿瘤体积分别为2 820.69±2 539.35 mm3和2 127.31±2 017.02 mm3,均显著小于Mock组(0.001<P<0.01);MH1006和MH1005组小鼠肿瘤体积均小于MH1001组(0.01<P<0.05);另外,MH1006组小鼠肿瘤体积在3~21 d始终略小于MH1005组和MH1004组,但无统计学意义.
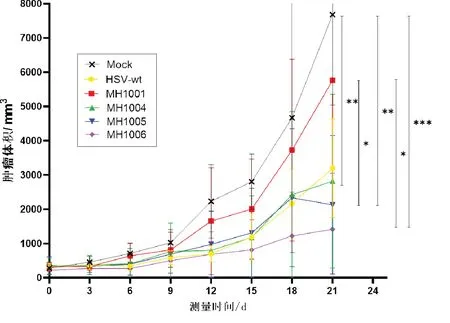
图3 重组oHSV对结肠癌荷瘤小鼠肿瘤生长的抑制
2.3 剥瘤实验结果
对各组小鼠进行剥瘤,肿瘤大小见图4.治疗42 d时,MH1004、MH1005和MH1006治疗组均有1只小鼠肿瘤消失,这3组小鼠肿瘤体积显著小于Mock、HSV-wt和MH1001组,且MH1006组小鼠肿瘤体积略小于MH1004和MH1005组(图3),表明3种oHSV-1均能有效抑制小鼠皮下结肠癌的生长,且MH1006抑瘤效果最佳.
2.4 重组oHSV对小鼠生存率的影响
荷瘤小鼠生存率统计结果显示:治疗42 d时,Mock和HSV-wt组各死亡3只,生存率均为50%,且Mock组存活小鼠行动迟缓、反应呆滞、喜聚集;MH1001和MH1005组各死亡2只,生存率为66.67%;MH1004和MH1006治疗组小鼠未见死亡,生存率(100%)高于其余各组(0.01<P<0.05)(图5).

图5 重组oHSV对结肠癌荷瘤小鼠生存率的影响
3 讨论
oHSV可以靶向性感染并裂解癌细胞,20世纪90年代初,Moolten等[6]报道了缺失胸苷激酶的HSV-1保留了复制能力,并延长了颅内胶质瘤裸鼠的存活率,之后又出现了许多oHSV,其中很多缺失RL1、UL39或两者都缺失[7].为了提高安全性,改造策略开始倾向于删除神经毒性基因γ34.5,其编码蛋白ICP34.5通过与蛋白磷酸酶1α直接作用使eIF2α去磷酸化,从蛋白激酶R介导的先天性免疫反应途径的主要宿主防御机制中脱离,从而发挥关键作用;相比之下,删除γ34.5的oHSV不能使eIF2α去磷酸化,导致宿主细胞蛋白质合成停滞,从而防止病毒在正常细胞中复制.然而,癌细胞的抗病毒机制受损,允许病毒复制[8].
结肠癌致死占全球死亡人数的9.2%[9],我国每年新发结肠癌55万例,新增结肠癌死亡28万例,中国新发结肠癌占世界新发结肠癌人数的28.4%[10].目前,手术切除、放疗及化疗仍是结肠癌治疗的主要手段,尽管取得了一定的效果,但患者生存结果较差[11],亟待新的治疗方案.本课题组前期构建了携载p53和IL-12的重组oHSV MH1004和MH1006,其对黑色素瘤和神经胶质瘤皮下移植瘤模型以及结肠癌肺转移模型均具有显著的溶瘤效应,可显著提高荷瘤小鼠的存活率,并延长生存期[3-5].本文以删除IR和ICP47的重组HSV-1载体MH1005以及MH1004和MH1006瘤内注射治疗结肠癌皮下移植瘤小鼠,治疗21 d后MH1006组小鼠肿瘤体积极显著小于对照组,其余两组小鼠肿瘤体积均显著小于对照组(图3),治疗42 d时,3组均有1只小鼠肿瘤完全消失(图4).小鼠生存率结果显示:MH1004和MH1006组可延长结肠癌荷瘤小鼠的生存期,42 d内的生存率为100%,显著高于Mock组(50%)、HSV-wt组(50%)、MH1001组(66.67%)和MH1005组(66.67%)(图5);组内小鼠肿瘤组织大小与生存期差异为小鼠个体差异所致[12].
MH1005为删除IR区和ICP47的重组HSV-1载体,删除区包括HSV-1的神经毒性基因γ34.5、潜伏相关转录本(Latency Associated Transcripts,LATs)、复制相关的立即早期基因ICP0和ICP4以及抑制抗原递呈的ICP47.本文发现MH1005作为病毒骨架载体亦表现出较强的溶瘤效应(图4),其一是MH1005复制能力较强,本课题组之前的研究表明,MH1005以及载入治疗基因的MH1004和MH1006在感染Neuro-2a细胞36 h时的滴度均达到1×108PFU以上[3-4],本文中MH1004和MH1006感染Rsc细胞36 h时的滴度亦达到1×108PFU以上,其复制水平与野生型HSV-1相当,故瘤内注射后可高效感染和抑杀肿瘤细胞.通常删除ICP0和ICP4等立即早期基因会降低HSV-1的复制能力,由于MH1005同时删除了LAT,LATs的缺失可在一定程度打破HSV-1的潜伏,促使病毒进入裂解增殖状态,从而保持了病毒在哺乳动物细胞中的复制能力.其二是ICP47产物可抑制抗原递呈,据报道,删除该基因的溶瘤病毒瘤内注射后可激发抗肿瘤免疫反应,从而促进溶瘤效应[13],本文中删除ICP47的MH1005可能诱发了较强的肿瘤免疫反应,加之MH1005神经毒性降低、载容量较大,可作为理想的复制型OV载体.
为提高OV抗肿瘤效应,可将具有抗肿瘤作用的基因载入OV中,如抑癌基因p53、增强免疫的细胞因子等.p53具有抗肿瘤作用,其用于肿瘤治疗已有广泛的研究[14].据Ⅰ/Ⅱ期临床研究表明,携载p53的溶瘤腺病毒单独或结合放化疗治疗多种肿瘤具有较高的安全性和抑癌活性[15-20];据报道,携载p53的水泡性口炎病毒亦能显著延长荷瘤小鼠的生存期[21].本文中MH1004抑瘤作用明显,并延长了结肠癌小鼠生存期(图5),据报道,很多恶性肿瘤细胞p53均发生突变并在肿瘤发生中发挥重要作用[22].MH1004感染细胞中p53的表达水平明显提高(图1),其瘤内注射治疗时通过高表达p53调节细胞周期,并发挥抑瘤作用.
目前,表达细胞因子的OV治疗肿瘤的研究较多,是OV研究的热点.其中表达IL-12的OV已用于多种肿瘤的治疗研究,表达IL-12的牛痘病毒和HSV-1用于治疗荷瘤小鼠均已见报道[23-24],IL-12还可与其它细胞因子协同促进OV治疗效果,如表达IL-12和IL-7的痘病毒瘤内注射可使小鼠移植瘤完全消退[25];表达IL-12和GMCSF的oHSV治疗黑色素瘤荷瘤小鼠显著抑制了肿瘤的生长,延长了小鼠的存活期[26].本文结果表明:MH1006感染HEK-293FT细胞后IL-12表达水平显著提高(图2),IL-12在体内表达后可以通过INF-γ诱导体内抗肿瘤免疫反应[12,27],故直接溶瘤和肿瘤免疫应答叠加使MH1006的抑瘤作用更为显著(图3~5).
