白芸豆提取物中α-淀粉酶抑制剂活性检测方法对比分析
2024-01-30俞超华曾傲琼
俞超华 曾傲琼
(1绍兴市食品药品检验研究院,浙江绍兴 312000;2国家黄酒产品质量检验检测中心,浙江绍兴 312000;3江南大学,江苏无锡 214000)
近年来,α-淀粉酶抑制剂(α-amylase inhibitor,α-AI)成为各国学者研究的热点,它属于糖苷水解酶抑制剂中的一种[1-2]。α-AI 能在一定程度上抑制胃肠道内胰淀粉酶的活性,从而延缓小肠中碳水化合物的分解,起到降低血糖和血脂的作用,同时能够改善肠道微生态和身体机能,在糖尿病患者的饮食治疗中起到了积极的作用[3](图1)。α-AI 具有减少糖向脂肪转化、延缓肠道排空速度和增加脂肪消耗的作用,在减轻肥胖患者体重方面表现出良好效果[4]。因此,α-AI 可作为有效的治疗手段,用于预防和治疗糖尿病、高血脂、脂肪过多症以及肥胖症等疾病。市场上标注不同α-AI 活力相关的产品种类繁多[5],其中从白芸豆提取物中获得α-AI 具有高效价及耐热性。
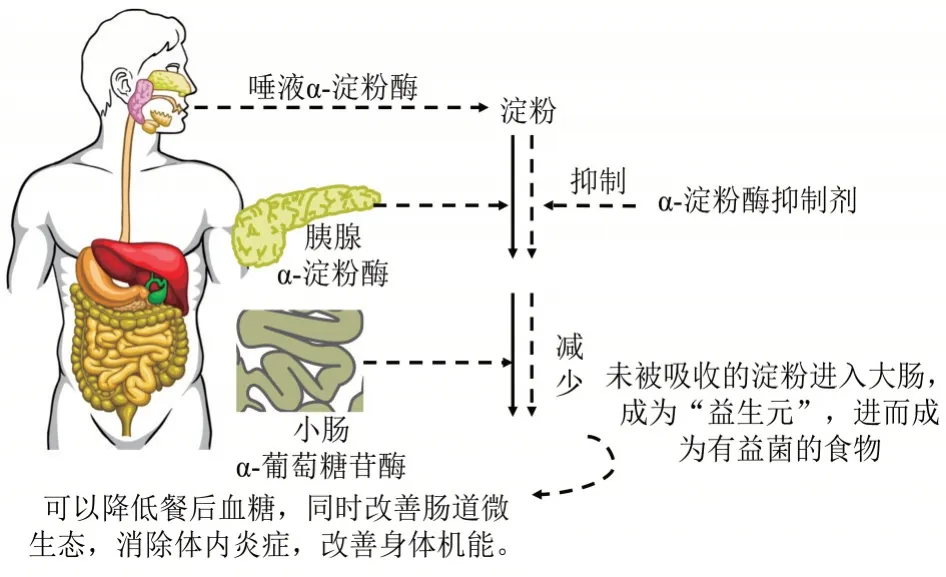
图1 α-淀粉酶抑制剂改善餐后高血糖的作用机理
目前,体外α-AI的筛选方法主要有3,5-二硝基水杨酸法和碘-淀粉显色法。3,5-二硝基水杨酸(DNS)法是指DNS会与还原糖中的游离羰基发生氧化还原反应,生成红棕色化合物(3-氨基-5-硝基水杨酸),在540 nm 波长下有最大的吸光度[6]。由于α-AI对淀粉的水解具有抑制作用,在使用3,5-二硝基水杨酸方法时,样品的吸光度值变低,从而通过计算样品中淀粉酶活性的抑制率来评估待测物对淀粉酶的抑制能力。该方法灵敏度高、准确性较好,因此使用DNS试剂量化还原糖含量的方法已被广泛应用于测量蛋白、多糖和多酚[7-9]等化合物对α-淀粉酶活性的抑制作用。碘-淀粉显色法是通过形成蓝色或紫色的复合物来表示样品中淀粉的含量,从而直观地观察到样品中淀粉的水解程度,属半定量方法,灵敏度低[10]。
本试验采用3,5-二硝基水杨酸法和碘-淀粉显色法,对从白芸豆提取物中的α-AI 活力进行测定,并对检测结果的准确性进行对比,为α-AI抑制α-淀粉酶活性的研究提供可借鉴的试验数据,为精准控制产品质量和指导生产过程提供参考。
1 材料与方法
1.1 材料与试剂
针对不同品类的白芸豆α-AI 产品,共收集4种样品。A:白芸豆提取物(型号:Destarch-01;苏州某公司,标注α-AI 活力:30 000 U/g);B:白芸豆提取物(型号:amyless;苏州某公司,标注α-AI 活力:100 000 U/g);C:白芸豆提取物(型号:P40 型;云南某公司,标注α-AI 活力:20 000 U/g);D:白芸豆提取物(型号:MIC 型;云南某公司,标注α-AI 活力:10 000 U/g)。每个样品至少4 份样品(其中2 份用于2 种方法的检测,另外2 份留样),每份样品不少于20 g。
α-淀粉酶(美国Sigma-Aldrich公司);3,5-二硝基水杨酸、麦芽糖、可溶性淀粉、磷酸氢二钠、磷酸二氢钠、柠檬酸、氯化钠、碘和碘化钾等(分析纯,国药集团化学试剂有限公司)。
1.2 仪器与设备
电子分析天平,瑞士梅特勒电子天平LE204E;数显恒温水浴锅,常州国华电器有限公司HH-4;涡旋混合器,德国IKA VORTEX 3;手动单道可调式移液器,美国赛默飞世尔科技公司thermo scientific 100~1 000 μL;全波长酶标仪,南京拜尔沃尔克智能科技有限公司Epoch。
1.3 试验方法
1.3.1 试验原理(1)3,5-二硝基水杨酸法。由于α-AI对淀粉水解产生的还原糖具有抑制作用,在进行3,5-二硝基水杨酸法测定时,样品中生成的棕红色氨基化合物的含量会减少,相应的最大吸光度值也会下降。通过构建标准曲线,测定不同样品中还原性糖的含量变化,并通过计算方法可以得出α-AI的活性[11]。(2)碘-淀粉显色法。通过在一定浓度范围内将淀粉溶液与碘-碘化钾反应,可以观察到蓝色反应产物。这种蓝色产物的吸光度在波长660 nm 处与淀粉的量之间存在线性关系。通过测量不同样品中的吸光值,并利用标准曲线计算出样品中淀粉的含量。在检测之前和之后分别加入α-AI,通过测量吸光度值,可以确定α-淀粉酶分解淀粉的量。通过计算吸光度值的差异,即可计算出α-AI的活性[12]。
1.3.2 测定方法(1)3,5-二硝基水杨酸法[13]。首先将浓度为0.05 mg/mL的α-淀粉酶溶液0.25 mL与α-AI 样品0.25 mL 在37 ℃下结合10 min。随后加入1%可溶性淀粉0.50 mL,在37 ℃下保温反应5 min。接着加入1.00 mL 的DNS 试剂,并在沸水浴中加热10 min。待冷却后,稀释适当倍数并在540 nm波长测定OD 值。(2)碘-淀粉显色法。测定过程在试管中进行。首先取1.00 mL 浓度为0.15 mg/mL 的α-淀粉酶,用磷酸缓冲液(PBS,pH 值6.9)配制而成,其次加入1.00 mL 待测液,在37 ℃下结合10 min。接着加入0.2%可溶性淀粉溶液5.00 mL,同时保持在37 ℃下反应一定时间后进行碘显色,最后根据显色程度来确定α-AI 的相对活力。
1.4 数据处理
1.4.1 3,5-二硝基水杨酸法测定α-AI 活力过程中,在PBS(pH 值为6.9)溶液体系下,使用可溶性淀粉作为底物,通过测定酶解反应后释放的葡萄糖与DNS 反应产生的有色产物来评估淀粉酶活性的抑制情况。具体的添加量如表1所示。

表1 α-AI活力测定体系单位:mL
样品中α-AI对α-淀粉酶的抑制率计算公式如下。
式(1)中,A1、A2、A3和A4分别为540 nm 空白管、空白对照管、抑制管和抑制对照管的吸光度值。α-淀粉酶的抑制率为20%~50%,相关数据才可以用于计算α-AI活力。
α-AI活力(U/g)为在37 ℃、pH值6.9的情况下,在α-淀粉酶催化淀粉水解的反应中,1 min 内抑制1 μg麦芽糖生成所需α-AI的量。样品中α-AI活力按下式计算。
式(2)中,U2为对照管中α-淀粉酶活力(U);U1为抑制管中α-淀粉酶活力(U);M为白芸豆提取物的取样量(g)。
1.4.2 碘-淀粉显色法通过碘-淀粉显色反应测定淀粉的降解程度。在淀粉酶作用下,淀粉会被水解成小分子的糖,而未被酶降解的淀粉可以与碘化钾形成深蓝色络合物。因此,通过测定α-AI 处理后淀粉溶液中的碘化钾复合物的吸光度来判断淀粉酶抑制剂的效果。具体的添加量如表2所示。

表2 α-AI活力测定体系单位:mL
试样中的α-AI含量计算公式如下。
式(3)中,A1为淀粉酶对照品的吸光度;A2为白芸豆提取物的吸光度;M取样量为白芸豆提取物的取样量(g);342.3 为麦芽糖的摩尔质量(g/mol);T为反应时间(min);F为样品的转化系数,即固定值1 000;106为摩尔与微摩尔的单位转化系数。本品按干燥品计算,其淀粉酶抑制活性不得低于1 000 U/g。
1.5 数据统计与分析
每组试验重复3次。采用OriginPro 9.0绘图,结果用均值±标准偏差来表示。使用SPSS进行方差分析(one-way ANOVA),不同字母代表在P<0.05 下差异显著。
2 结果与分析
2.1 2种方法测定α-AI活力原理比较
如图2A 所示,DNS 与还原糖中的还原羰基发生氧化还原反应可产生的红棕色化合物(3-氨基-5-硝基水杨酸)。该反应被广泛应用于测定α-AI活性,因为它具有高准确度和灵敏度[14],同时该化学反应在相对较短的时间内就可以完成[15]。需要注意的是,使用3,5-二硝基水杨酸法测定α-AI 活性时,需要建立一系列含有已知浓度还原糖标准溶液的标准曲线,并间接准确地计算出待测样品中α-AI 活力。碘-淀粉显色法测定α-AI 活力的原理是基于直链淀粉与碘之间的化学反应[16]。如图2B所示,直链淀粉与碘形成的直链淀粉-碘复合物会呈现蓝色。这是因为碘分子会插入直链淀粉分子的内部,围出了一个“圆筒”(I2-I-键对)[17],从而形成蓝色的化合物。与此不同,支链淀粉的分支结构会阻碍碘分子的插入,因此支链淀粉不会与碘发生颜色反应,溶液的颜色不会变深(图2C)。在试验中,通常会将直链淀粉与淀粉酶和α-AI 样品一起加入试管中,并设定一定的反应时间。然后通过加入含碘的溶液来观察试管内的颜色变化。在酶对照组中,淀粉被酶降解,导致与碘的反应减弱,使得颜色变浅。而在样品组中,由于添加了α-AI,它会与淀粉结合,防止酶降解淀粉的发生。因此,样品组中的直链淀粉的降解较少,与碘的反应增强,使颜色变深。需要注意的是,在缺乏样品对照的情况下,可能难以完全排除样品本身颜色对结果的影响。一些物质本身可能具有颜色,当与碘反应时会产生颜色变化,这可能会干扰对试验结果的正确解读。因此,在今后的试验中,最好同时进行一个样品的对照试验,其中只添加α-AI 样品,可以更准确地观察并分析颜色变化,从而得出对α-AI 活力的正确评估。
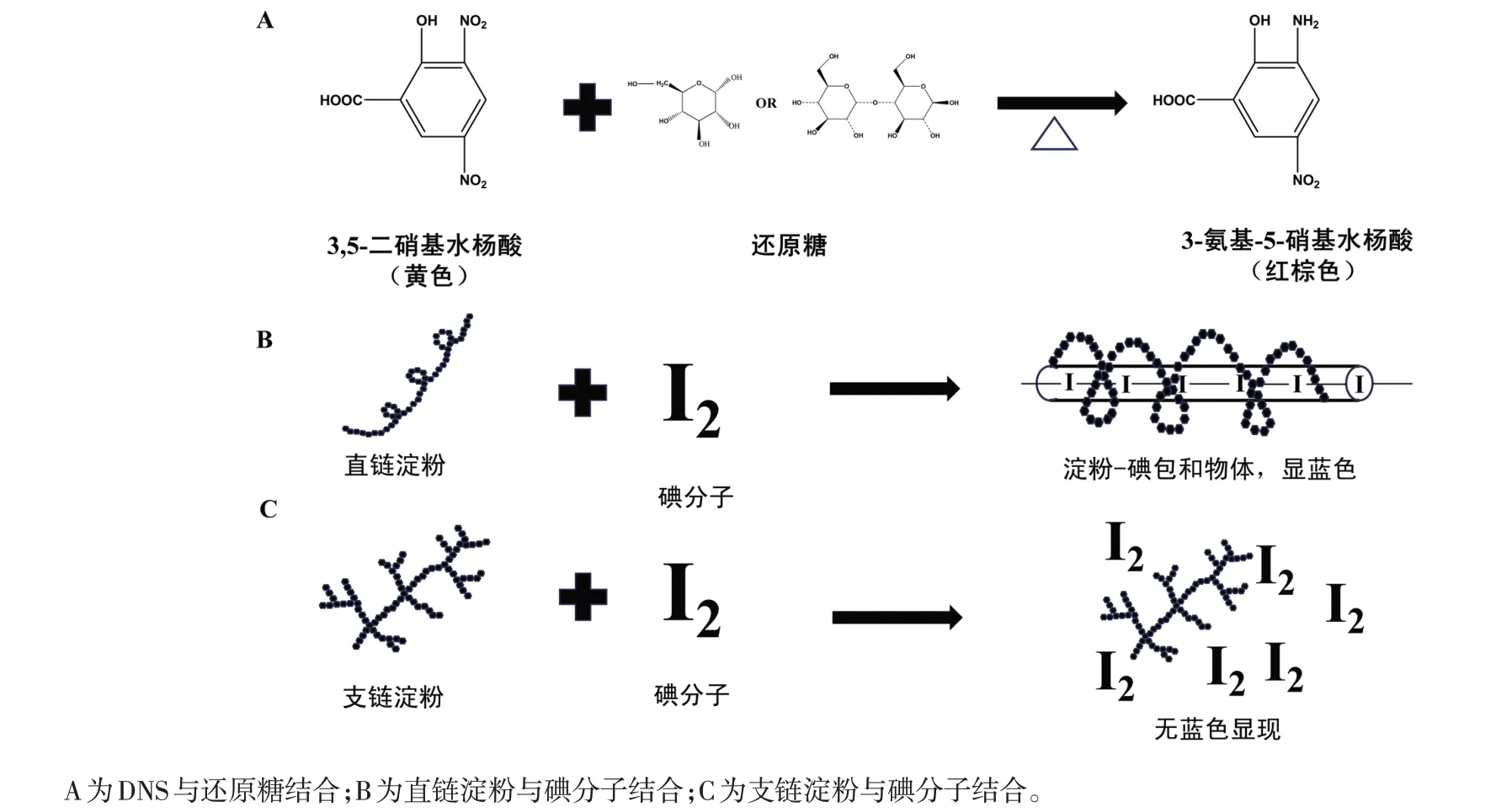
图2 2种方法测定α-AI活力原理比较
2.2 2种方法测定α-AI活力比较
由表3 可知,通过3,5-二硝基水杨酸法所获得的α-AI活力与标注值之间的存在正偏差,这表明通过该方法得到的测定结果高于标注值。同时,偏差率随着测定α-AI活力的增加而逐渐减小,说明在较低的α-AI活力水平下,偏差较大,而在较高的α-AI活力水平下,偏差相对较小。此外,偏差率D>偏差率C>偏差率A>偏差率B,可以推断出测定结果的准确性随着测定α-AI 活力的增加而提高。以上结果表明,随着测定α-AI 活力的增加,通过3,5-二硝基水杨酸法所获得的测定值更接近标注值。结果表明标注的α-AI 活力越高,所获得的α-AI活力测定值更接近产品的标注值。这也可能暗示着样品性质或反应条件对2 种方法的测定结果产生了影响。

表3 不同白芸豆提取物中α-AI活力数值
由表4 可知,通过碘-淀粉显色法所获得的α-AI 活力与标注值之间存在负偏差,这表明通过该方法得到的测定结果低于标注值,且该偏差率的绝对值随着测定α-AI 活力的增加而逐渐减小。
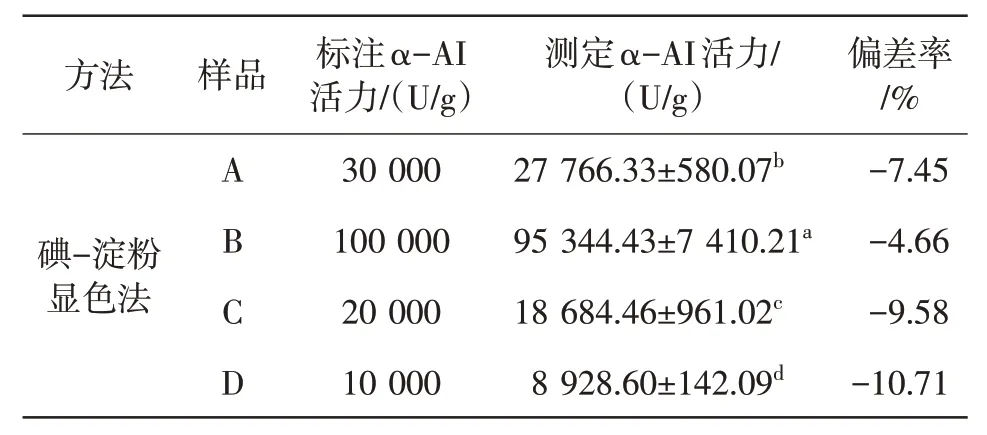
表4 不同白芸豆提取物中α-AI活力数值
一些原因可能导致这2 种方法获得不同α-AI活力结果。(1)反应机理不同。3,5-二硝基水杨酸法和碘-淀粉显色法在测定α-AI活力时使用了不同的反应机理。不同的反应机理可能导致2种方法对α-AI 的测定结果有一定的差异。(2)选择的试剂。在2 种方法中,所使用的试剂也可能不同。不同试剂可能对α-AI的反应具有不同的选择性和灵敏度,导致2 种方法下α-AI 活力检测结果存在差异。(3)试验条件的不同。试验条件如反应温度、反应时间和溶液pH值等,也可能对测定结果产生影响。如果在2种方法中使用的试验条件不同,那么所获得的α-AI 活力结果可能不一致。(4)样品处理的差异。样品的制备和处理过程也可能引起2 种方法之间的差异。样品的制备过程中可能存在一些误差或不一致性,这可能导致2种方法对α-AI活力的测定结果有不同的影响。(5)测定范围不同。2种方法可能在测定α-AI 活力的线性范围或灵敏度方面存在差异。这就意味着2 种方法在不同浓度范围内可能显示出不同的准确性和可靠性。
由上可得,3,5-二硝基水杨酸法和碘-淀粉显色法在测定α-AI 活力时可能存在多个差异源,包括反应机理、试剂选择、试验条件和样品处理等。这些差异可能导致2 种方法获得不同的α-AI 活力结果。上述的研究和试验数据显示,3,5-二硝基水杨酸法的偏差更小且更接近实际值,表明在测定α-AI活力时,该方法可能更具有准确性和可靠性。
2.3 2种方法测定方法比较
α-AI 对α-淀粉酶的抑制模式如图3 所示。α-淀粉酶是一个催化淀粉分子降解的酶,α-AI 通过与α-淀粉酶结合,并干扰其催化淀粉分子降解的过程,从而达到抑制的目的。具体来说,在没有α-AI 的情况下,α-淀粉酶能够将淀粉分子催化为麦芽糖或麦芽糊精等。当α-AI 存在时,它会与α-淀粉酶结合,形成一个复合物,从而阻止α-淀粉酶催化淀粉分子的能力。这种结合可能是可逆的或不可逆的,具体取决于α-AI 本身的特性。3,5-二硝基水杨酸法和碘-淀粉显色法都可以用于测定α-AI 的含量,但原理有所不同。3,5-二硝基水杨酸法基于α-AI 对淀粉的降解作用。在反应体系中,α-AI 会减缓或抑制淀粉的降解速率,导致与淀粉降解相关的酶促反应也会减缓。这使得DNS 的还原速率减慢,从而影响比色反应的结果。通过测量淀粉降解速率的变化,可以间接测定α-AI 的含量。碘-淀粉显色法基于α-AI 的影响会导致淀粉降解速率减慢。在碘和淀粉溶液反应时,如果存在α-AI,它会减慢淀粉的降解速度,从而碘与淀粉进行反应,导致较多的蓝色产物形成。通过测量蓝色产物形成深浅的变化,可以间接测定α-AI 的活性。
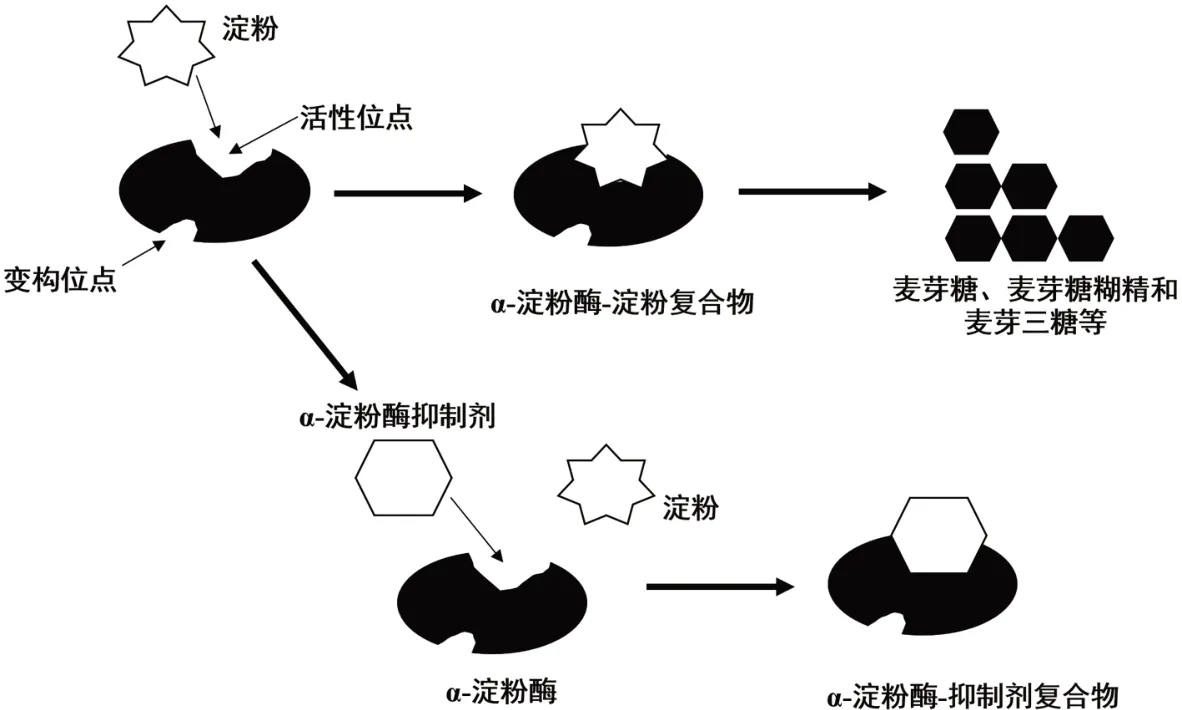
图3 α-AI对α-淀粉酶的抑制模式
在3,5-二硝基水杨酸法中,淀粉酶作用下的淀粉被转化为还原糖,其中包括一些还原性基团,如醛基。这些还原性基团与DNS 反应产生显色反应,生成红棕色产物(图2A)。因此,只要淀粉经过淀粉酶的作用形成了还原糖,就可观察到显色反应。同时,在试验中使用了合适的抑制对照组进行比较,减少样品背景的影响,以排除其他可能干扰测定结果的因素,可以确保测定α-AI活力结果的准确性和可靠性。对于碘-淀粉显色法,淀粉分子具有完整的空间结构时(由许多α-葡萄糖单元组成),其淀粉分子与碘分子通过非共价键(主要包括氢键和范德华力等)的相互作用[18],从而实现碘-淀粉复合物的形成。这种复合物可以吸收可见光,表现为蓝色(图2B)。然而,淀粉经过淀粉酶的作用后空间结构受到破坏,导致碘分子无法充分与淀粉分子相互作用,使得产生的复合物少于完整的淀粉分子时的数量,从而降低显色的程度(图4A)。在α-AI 的存在下,α-AI 通过抑制淀粉酶的活性来减少淀粉的降解。因此,在α-AI 的存在下,淀粉分子的结构可能不会被完全破坏,碘分子仍然可以与已被酶降解的淀粉分子形成复合物,产生一定程度的显色反应(图4B)。因此,淀粉的蓝色程度与淀粉的结构可能不是线性关系。在这种情况下,使用碘-淀粉显色法测定α-AI 含量可能会产生不准确的结果。

图4 完全降解淀粉或未完全降解淀粉分别与碘分子显色反应情况
3 结论与讨论
3,5-二硝基水杨酸法和碘-淀粉显色法均基于显色反应的前后变化进行测量,但具体的反应机理和检测原理不同。3,5-二硝基水杨酸法是通过红棕色产物的生成来间接测定α-AI 的活性,而碘-淀粉显色法则是通过测量淀粉与碘络合物的吸光度变化来间接测定α-AI 的活性。其中,碘-淀粉显色法使用碘作为指示剂,它与淀粉形成蓝色或紫色络合物来定性或定量分析。然而,该方法在一些情况下可能存在选择性差的问题,因为其他物质或不完全降解淀粉也可能与碘发生反应,导致误判。而在3,5-二硝基水杨酸法中,只要淀粉被淀粉酶催化产生还原糖,就可观察到显色反应,可以更好地为白芸豆提取物α-AI产品质量提供指导方向。
本研究采用3,5-二硝基水杨酸法和碘-淀粉显色法对白芸豆提取物中α-AI活力进行定量分析,并对不同检测方法的结果准确性进行综合比较。结果表明,3,5-二硝基水杨酸法测定α-AI的活力的偏差率的绝对值均低于碘-淀粉显色法,并且标注α-AI活力越高,测定α-AI活力越接近标注值。因此,3,5-二硝基水杨酸法更具有前瞻性,可为产品的生产提供指导。
