丛枝菌根真菌和解磷细菌复合接种对水稻丛枝菌根真菌侵染率和肥料利用率的影响
2024-01-30殷小冬贾艳艳李其胜徐莉焦加国李青杨文飞杜小凤顾大路
殷小冬 贾艳艳 李其胜 徐莉 焦加国 李青 杨文飞 杜小凤 顾大路

殷小冬,賈艳艳,李其胜,等. 丛枝菌根真菌和解磷细菌复合接种对水稻丛枝菌根真菌侵染率和肥料利用率的影响[J]. 江苏农业学报,2023,39(8):1680-1687.
doi:10.3969/j.issn.1000-4440.2023.08.007
收稿日期:2023-06-06
基金项目:江苏现代农业产业单项技术研发项目[CX(22)3127];淮安市农业科学研究院科研发展基金项目(HNY202130);淮安市农业科学研究院高层次引进人才科研启动发展基金项目(002201901413);淮安市农业科学研究院科研发展基金项目(HNY202028);江苏省自然科学基金项目(BK20200264)
作者简介:殷小冬(1996-),男,安徽合肥人,硕士,研究实习员,主要从事微生物肥料研发。(E-mail)1553015412@qq.com
通讯作者:顾大路,(E-mail)gudalu666@aliyun.com
摘要:为探究丛枝菌根真菌和解磷细菌复合接种对水稻肥料利用率的影响,本研究以金粳818为试验材料,以接种灭活复合菌剂为对照,分析2种丛枝菌根真菌[异形根孢囊霉(Rhizophagus irregularis,RI)和摩西管柄囊霉(Funneliformis mosseae,FM)]和3种解磷细菌[芽孢杆菌属细菌(Bacillus sp.,R1-3)、巨大芽孢杆菌(Bacillus megaterium,BM)、耐盐节杆菌(Arthrobacter pascens,AP)]单接种和两两组合接种对水稻丛枝菌根真菌侵染率和肥料利用率的影响。结果表明,与单接种丛枝菌根真菌处理相比,加入解磷细菌后大部分处理的水稻菌根侵染率降低,其中FM+BM处理的丛枝菌根真菌侵染率下降至7.54%,显著低于单接种丛枝菌根真菌处理。相较于对照和单接种丛枝菌根真菌或解磷细菌处理,复合接种处理在水稻生殖生长期末整体上提高了氮肥、钾肥利用率,其中FM+BM处理与对照相比分别提高了19.55个百分点、20.47个百分点。丛枝菌根真菌和解磷细菌复合接种有利于提高水稻生殖生长期末氮肥利用率和钾肥利用率,其中FM+BM为最优组合。
关键词:丛枝菌根真菌;解磷细菌;水稻;肥料利用率;侵染率
中图分类号:S144.1 文献标识码:A 文章编号:1000-4440(2023)08-1680-08
Effects of combined inoculation of arbuscular mycorrhizal fungi and phosphate-solubilizing bacteria on colonization rate and fertilizer use efficiency in rice
YIN Xiao-dong1 JIA Yan-yan1 LI Qi-sheng1 XU Li2 JIAO Jia-guo2 LI Qing1 YANG Wen-fei1 DU Xiao-feng1 GU Da-lu1
(1.Huaiyin Institute of Agricultural Sciences of the Xuhuai District of Jiangsu Province, Huaian 223001, China;2.College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:In order to investigate the effects of combined inoculation of arbuscular mycorrhizal fungi and phosphate-solubilizing bacteria on fertilizer use efficiency in rice, Jinjing 818 was used as experimental material in the study. The effects of two arbuscular mycorrhizal fungi (Rhizophagus irregularis, RI; Funneliformis mosseae, FM) and three phosphate-solubilizing bacteria (Racillus sp., R1-3; Bacillus megaterium, BM; Arthrobacter pascens, AP) on colonization rate and fertilizer use efficiency of rice were analyzed, and the inoculation of inactivated fungi was set as control. The results showed that the colonization rates of arbuscular mycorrhizal fungi in most treatments decreased after the addition of phosphate-solubilizing bacteria, and the colonization rate in FM+BM treatment decreased to 7.54%, which was significantly lower than that in the treatment of single inoculation of arbuscular mycorrhizal fungi. Compared with control and single inoculation of arbuscular mycorrhizal fungi or phosphate-solubilizing bacteria, combined inoculation improved the nitrogen use efficiency and potassium use efficiency overall at the end of reproductive growth period of rice. Compared with control, FM+BM treatment increased by 19.55 percentage points and 20.47 percentage points, respectively. Combined inoculation of arbuscular mycorrhizal fungi and phosphate-solubilizing bacteria was beneficial to improve the nitrogen use efficiency and potassium use efficiency at the end of reproductive growth period of rice, and FM+BM was the best combination.
Key words:arbuscular mycorrhizal fungi;phosphate-solubilizing bacteria;rice;fertilizer use efficiency;colonization rate
水稻(Oryza sativa L.)位居中国三大主粮之首。长期以来增施化肥是保证水稻高产的有效方法。然而,近年来粮食产量并没有随着化肥的过多投入表现出明显增长的趋势,氮、磷肥的生理利用率以及吸收效率急剧下降[1]。有研究结果表明,中国氮肥的农田利用率仅为30%~35%[2],磷肥利用率为10%~25%[3],钾肥利用率为25%~45%[4]。在淹水条件下,稻田土壤氮肥损失可达50%[5]。肥料的严重流失不仅造成水稻生产效益下降,还导致面源污染,严重威胁到农业可持续发展[6]。因此,研究如何提高稻田土壤肥料利用率对于减少化肥过量施用带来的不良影响具有重要意义。
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)广泛存在于农田土壤中,能够与80%陆生植物根系形成菌根共生体。植物通过光合作用将自身合成的营养物质供给AMF,AMF则通过遍布土壤的菌丝网络不断吸收土壤中的氮、磷等养分供给植物[7]。研究结果表明,接种AMF可显著提高大豆根际土壤脲酶、氮同化关键酶的活性,促进大豆对铵态氮的利用,提高大豆的磷素吸收量[8-10]。贾艳艳等[11]研究发现,在氮肥减量施用条件下接种AMF可显著提高土壤蛋白酶、脲酶及硝酸还原酶的活性,提高小麦的氮肥利用率和农学效率。
此外,有研究发现AMF和解磷细菌存在功能上的互作。解磷细菌分泌的磷酸酶和有机酸等促进植物生长的物质能够增强AMF的侵染能力[12]。例如,荧光假单胞菌(Pseudomonas fluorescens)BBc6R8产生的细胞壁降解酶能提高AMF定殖率,促进菌丝生长,进而促进植物生长[13]。在沙土中复合接种AMF和解磷细菌比单接种更能增加叶片中氮、磷含量,促进大豆对氮素和磷素的吸收,但降低了AMF的侵染率[14]。然而,也有研究结果表明在低磷土壤中,AMF和解磷细菌之间会竞争养分,抑制对方的生长[15]。解磷细菌和AMF功能互作的关系并不稳定,并且AMF和解磷细菌复合作用对水稻对氮、磷吸收利用的相关研究较少。因此,探讨不同AMF和解磷细菌菌株复合接种后对水稻对氮、磷吸收利用的影响,有助于提高水稻肥料利用率。
本研究拟以金粳818为试验材料,将2种AMF与3种解磷细菌进行两两复合接种,研究其对水稻氮素吸收相关土壤酶活性、土壤速效养分以及氮、磷、钾肥料利用率的影响,以期为提高稻田肥料利用率提供技术支撑。
1 材料与方法
1.1 供试菌株
供试AMF为异形根孢囊霉(Rhizophagus irregularis,RI)和摩西管柄囊霉(Funneliformis mosseae,FM),其中RI为本实验室保存菌种,FM购自北京市农林科学院。接种菌剂预先用三叶草盆栽繁殖,包括根系、孢子和扩繁基质,1 g菌剂含15~25个孢子。
解磷细菌芽孢杆菌属细菌(Bacillus sp.,R1-3)由江苏徐淮地区淮阴农业科学研究所土壤与肥料中心提供;巨大芽孢杆菌(Bacillus megaterium,BM)购自于中国农业微生物菌种保藏管理中心,编号为ACCC 10011;耐盐节杆菌(Arthrobacter pascens,AP)由南京农业大学土壤生态实验室提供。3种解磷细菌在试验条件下对土壤具有较好的解磷效果,能促进植物的生长发育[16-18]。接种前,将3种解磷细菌从-80 ℃冰箱中取出活化,用溶菌肉汤(LB)培养基摇至对数生长期使用。
1.2 供试水稻品种以及土壤
水稻品种为金粳818,2022年5月11日至2022年6月20日进行育苗。2022年6月21日挑选水稻苗,去除根部的土壤,用70%乙醇溶液对根部进行消毒,再用清水反复冲洗后备用。
试验所用土壤采集自江苏省植物生长调节剂工程研究中心(119°7′11″E,33°33′43″N),土壤类型为沙壤土,基本理化性质见表1。土壤风干后粉碎过2 mm筛,121 ℃下高压湿热灭菌2 h备用。
1.3 试验设计
试验于2022年6月在江苏省植物生长调节剂工程研究中心试验地进行。试验所用花盆上口径22.0 cm,下口径14.5 cm,高19.5 cm,花盆用0.1%高锰酸钾溶液浸泡1 d,清水反復冲洗后晾干备用,每盆装土5 kg。一共设计13个处理,分别是(1)不施肥处理,CK1;(2)接种RI和FM复合的灭活菌剂,CK2;(3)单接种RI真菌,A1;(4)单接种FM真菌,A2;(5)单接种R1-3,B1;(6)单接种BM,B2;(7)单接种AP,B3;(8)双接种RI+R1-3,A1B1;(9)双接种RI+BM,A1B2;(10)双接种RI+AP,A1B3;(11)双接种FM+R1-3,A2B1;(12)双接种FM+BM,A2B2;(13)双接种FM+AP,A2B3。每个处理6个重复,一共78个盆栽。其中CK1为空白组,用于计算水稻肥料利用率。RI和FM按照10 g/kg土壤进行接种,先向盆中加入土壤,平整土壤表面,上层再加入一层土壤,保证菌剂在土壤表面下5 cm处。BM和AP按照土壤质量5%接入。双接种组按照相应单接种菌量的一半接入。每盆土壤施入复合肥(N含量-P2O5含量-K2O含量:15%-15%-15%)2 g,其中氮肥的施用原则为基肥∶蘖肥∶促花肥∶保花肥=5∶1∶2∶2,蘖肥在移栽后7 d施用,促花肥和保花肥在穗分化期施用。
1.4 样品采集
在营养生长期末和生殖生长期末分别采样一次,每次随机选取3个盆栽样本。将水稻植株连根取出,用清水反复冲洗干净,待晾干后放入自封袋中。将采集的水稻植株分成地上和地下两部分,地下根系用于测定根系侵染率;地上部分测定鲜质量,然后放入105 ℃烘箱杀青30 min,再在75 ℃烘箱中烘干至恒质量。烘干结束后将植株地上部分茎鞘、叶片和籽粒分别进行称质量,粉碎,测定全氮、全磷、全钾含量。盆栽土壤按照上、中、下3层取样,混合均匀,去除石砾、植物残体等杂质,一部分土壤样品自然晾干后测定基本理化指标,另一部分保存在-20 ℃冰箱内测定土壤酶活性、铵态氮含量和硝态氮含量。
1.5 测定项目与方法
1.5.1 菌根侵染率 采用脱色-蓝色墨水染色法测定菌根侵染率,具体方法参考王幼珊等的方法[19]。根据菌丝、丛枝和泡囊的侵染情况进行计算,没有菌根结构的根段为0,只有一半长度的根段形成菌根为50,以此类推,记录各等级下的根段数。
侵染率(%)=(0×根段数+10×根段数+20×根段数+…+100×根段数)/观察根段总数
1.5.2 土壤理化指标 土壤铵态氮含量采用氯化钾浸提-双波段比色法测定,硝态氮含量采用氯化钾浸提-靓蓝比色法测定,土壤速效磷含量采用碳酸氢钠浸提-钼锑抗比色法测定,土壤速效钾含量采用醋酸铵浸提-火焰光度法测定[20],土壤脲酶活性采用茚三酮苯酚钠-次氯酸钠比色法测定,土壤蛋白酶活性采用茚三酮比色法测定[21]。
1.5.3 植株养分含量 水稻经硫酸-过氧化氢消煮后,分别测定全氮、全磷、全钾含量[20]。
1.5.4 产量 将每盆水稻全部脱粒,去除未灌浆的空粒后测定实际产量。
1.5.5 肥料利用率 氮素积累量(g)=(茎鞘干质量×茎鞘氮含量+叶片干质量×叶片氮含量+籽粒干质量×籽粒氮含量)
磷素积累量(g)=(茎鞘干质量×茎鞘磷含量+叶片干质量×叶片磷含量+籽粒干质量×籽粒磷含量)
钾素积累量(g)=(茎鞘干质量×茎鞘钾含量+叶片干质量×叶片钾含量+籽粒干质量×籽粒钾含量)
氮肥利用率(NRE)=(施肥组植株总氮素积累量-空白组植株总氮素积累量)/施氮量×100%
磷肥利用率(PRE)=(施肥组植株总磷素积累量-空白组植株总磷素积累量)/施磷量×100%
钾肥利用率(KRE)=(施肥组植株总钾素积累量-空白组植株总钾素积累量)/施钾量×100%
1.6 数据处理与分析
试验数据采用SPSS 22.0软件统计分析,5%水平下Duncan’s新复极差法检验各处理平均值之间的差异显著性,用Pearson法进行相关性分析,用OriginPro 2021软件进行绘图。
2 结果与分析
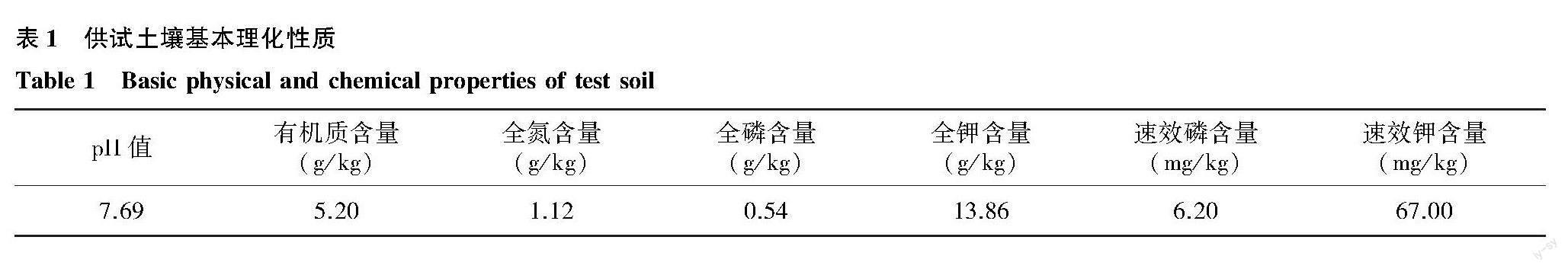
2.1 接菌对水稻根系菌根侵染率的影响
未接种AMF处理的水稻根系未检测到孢子和菌丝(图1)。A1、A2处理的水稻根系侵染率可达31.28%和29.68%,说明2种真菌均可在水稻根系定殖并且发挥作用。相较于单独接种RI真菌的A1处理,双接种的A1B1、A1B2、A1B3处理不同程度降低菌根侵染率,其中A1B3处理的菌根侵染率最低,为15.44%,但与A1处理没有显著差异(P=0.056)。相较于单独接种FM真菌的A2处理,双接种的A2B1处理下的菌根侵染率高达32.85%(P=0.684),而A2B2处理下的菌根侵染率显著下降,达到7.54%(P=0.011)。
2.2 接菌对土壤理化性质的影响
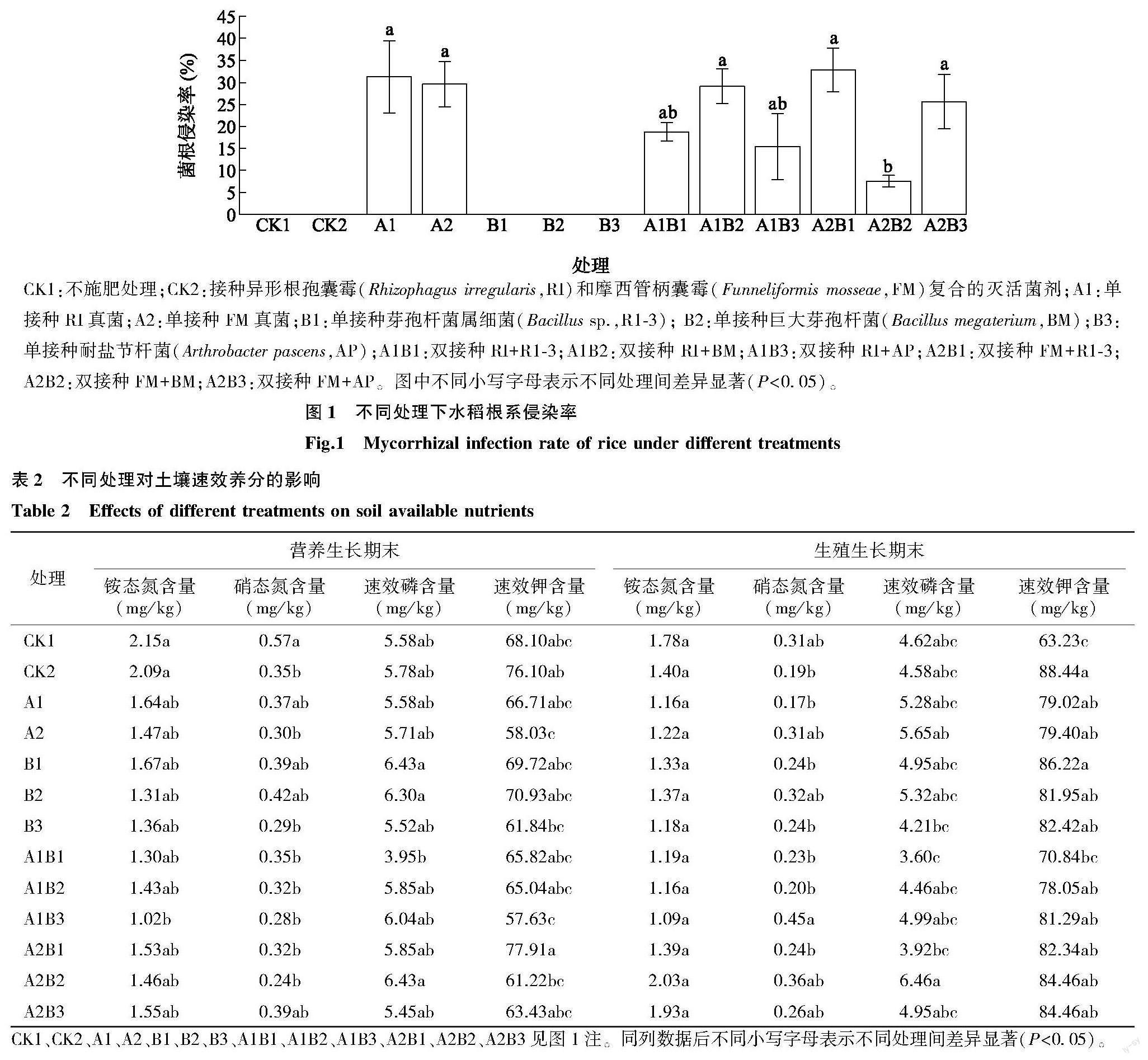
表2显示,在水稻营养生长期末,土壤养分维持较低的水平且各试验组之间差异较小,CK1中土壤铵态氮、硝态氮含量最高;速效磷含量最高的为B1处理和A2B2处理,与A1B1处理相比具有显著差异;速效钾含量最高的为A2B1处理,显著高于A2、B3、A1B3处理。在水稻生殖生长期末,不同菌种组合处理的土壤养分含量存在差异;A1B3处理的硝态氮含量最高,显著高于CK2、A1、B1、B3、A1B1、A1B2、A2B1;A2B2处理的速效磷含量最高,与B3、A1B1、A2B1处理相比具有显著差异性;CK2的速效钾含量最高,显著高于A1B1处理。
CK1、CK2、A1、A2、B1、B2、B3、A1B1、A1B2、A1B3、A2B1、A2B2、A2B3见图1注。同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
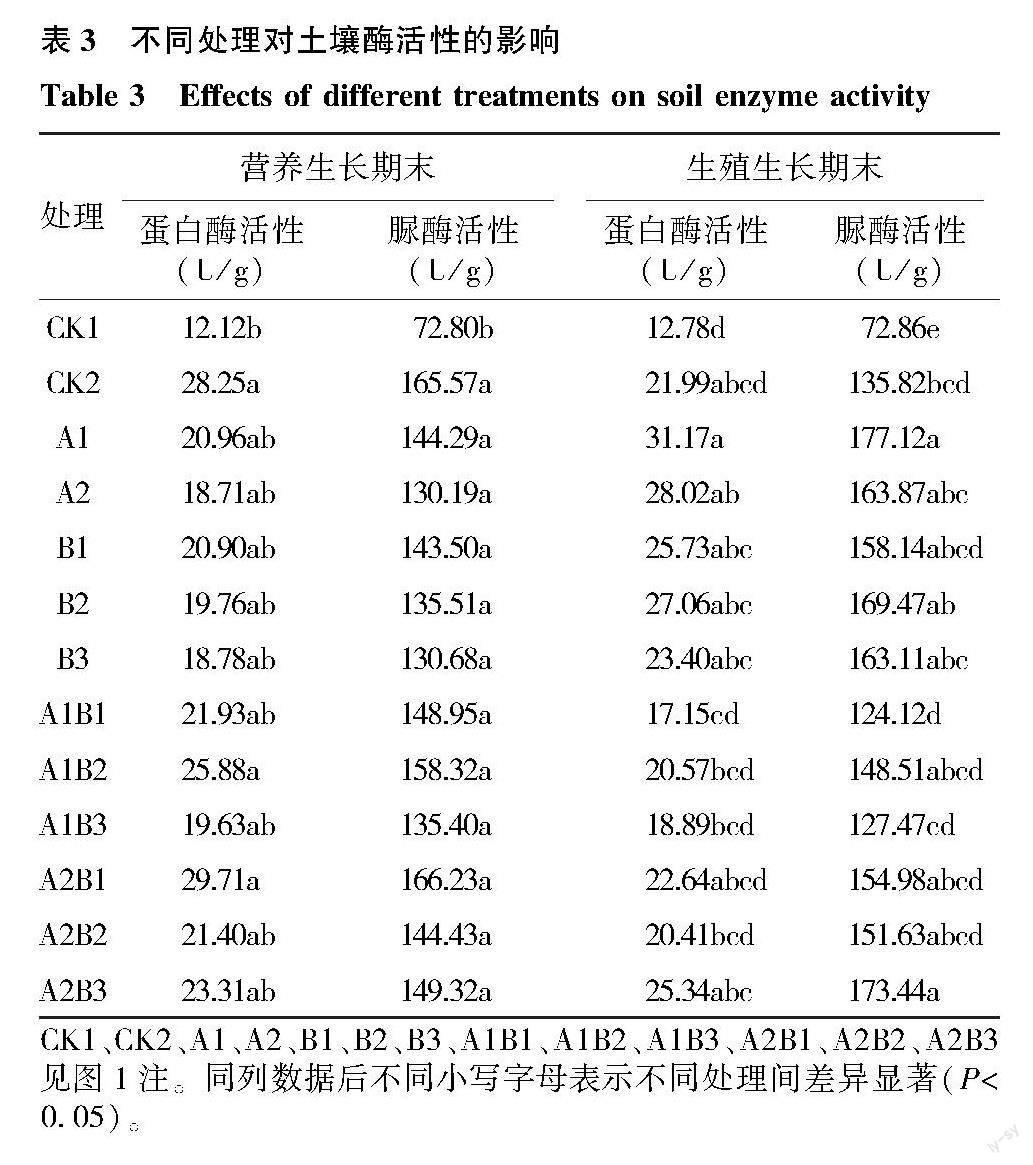
表3显示,与CK1相比,CK2和接菌处理不同程度地提高了蛋白酶和脲酶的活性。在水稻营养生长期末,A2B1处理的土壤蛋白酶、脲酶活性最高,显著高于CK1;复合接种处理组的蛋白酶、脲酶活性整体高于单接种处理组。在水稻生殖生长期末,与CK1相比,单接菌处理以及双接种处理中的A2B1和A2B3均提高了蛋白酶活性,A1处理下蛋白酶活性最强;除A1B1和A1B3处理外,其余接菌处理较CK1均不同程度地提高了脲酶活性,其中A1处理的脲酶活性最高,A2B3处理次之,均显著高于CK2(P<0.05)。
2.3 接菌对水稻养分积累的影响
图2显示,在水稻营养生长期末,氮素积累量最高的为A2处理,显著高于CK1和A2B1处理;除CK1处理外,其他接菌处理磷素积累量无显著差异;接菌处理的钾素积累量均高于CK2,其中A2、A1B1、A1B2处理与CK2相比具有显著差异性。在水稻生殖生长期末,在氮素积累方面,复合接种处理整体高于单接种处理,其中A2B2处理的氮素积累量最高,并显著高于CK2和单接种处理(P<0.05);磷素积累量最高的为A2B2处理,显著高于A1、A2、B2处理;钾素积累量最高的为A2B2处理,显著高于A1、A2、B1、B3、A1B1、A2B1处理和CK2。
CK1、CK2、A1、A2、B1、B2、B3、A1B1、A1B2、A1B3、A2B1、A2B2、A2B3見图1注。同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
2.4 接菌对水稻肥料利用率的影响
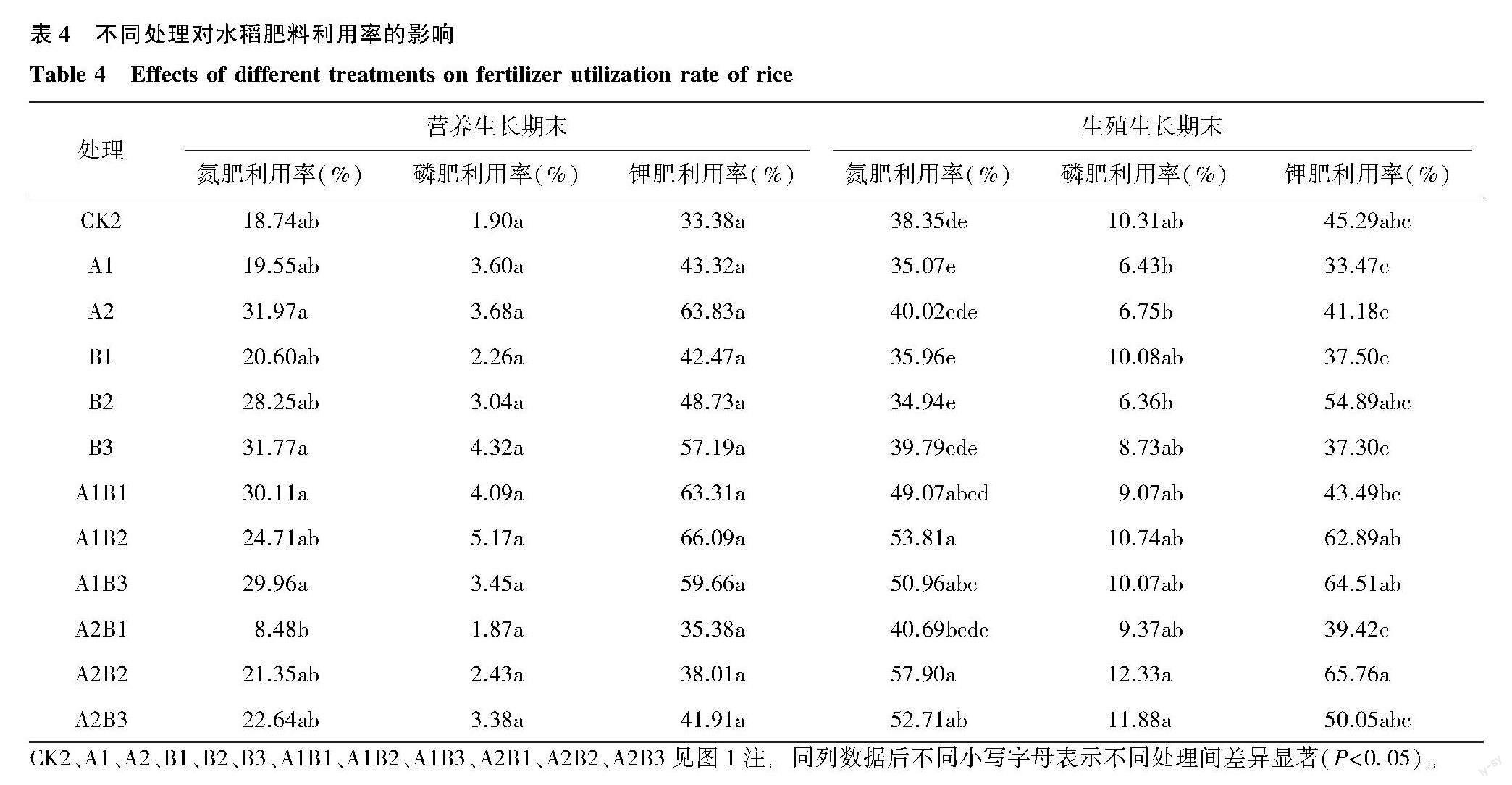
表4显示,接菌处理整体上提高了水稻的肥料利用率。在水稻营养生长期末,除A2B1处理外,其余接菌处理水稻氮肥利用率和磷肥利用率差异不显著;各处理的磷肥利用率和钾肥利用率之间及与对照的差异均不显著。在水稻生殖生长期末,A2B2处理的氮肥利用率显著高于CK2,比CK2提高了19.55个百分点;接菌处理的水稻磷肥利用率与CK2差异不显著;A2B2处理的水稻钾肥利用率最高,显著高于A1、A2、B1、B3、A1B1、A2B1处理,A2B2处理的钾肥利用率比CK2提高了20.47个百分点。
CK2、A1、A2、B1、B2、B3、A1B1、A1B2、A1B3、A2B1、A2B2、A2B3见图1注。同列数据后不同小写字母表示不同处理间差异显著(P<0.05)。
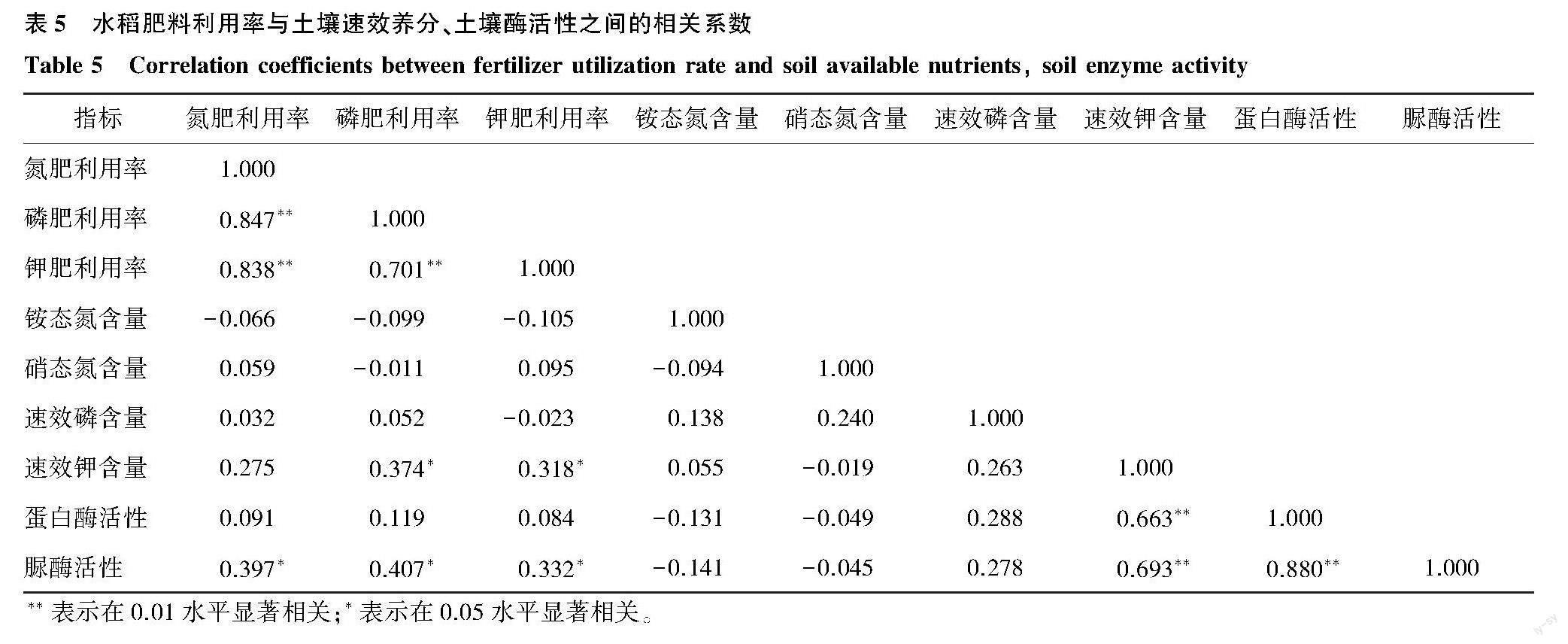
2.5 相关性分析
水稻生殖生长期末各指标之间的相关系数分析结果(表5)表明,氮肥利用率、磷肥利用率和钾肥利用率之间存在极显著正相关关系(P<0.01)。其中,水稻氮肥利用率与脲酶活性存在显著正相关关系(r=0.397)。磷肥利用率与速效钾含量、脲酶活性存在显著正相关关系(r=0.374、r=0.407)。钾肥利用率与速效钾含量、脲酶活性存在显著正相关关系(r=0.318、r=0.332)。
3 讨 论
解磷细菌与AMF的侵染率、菌丝密度等生长状况具有差异性。有学者基于真菌-细菌合作共生的理论,将假单胞菌接入被根内根孢囊霉(Rhizophagus intraradices)侵染的小麦中,发现菌根侵染率提高了2倍以上,且根外菌丝的密度显著增加[22]。而本研究中除A2B1处理外,与单接种AMF相比,接种解磷细菌后菌根侵染率明显下降,其中A2B2处理显著降低,说明加入解磷细菌反而抑制了AMF的生长,导致其定殖能力下降。在低磷土壤条件下,土壤中的磷被细菌优先吸收,以微生物磷的形式固定在细菌体内,AMF自身生长发育受到缺磷的限制[23]。根据前人研究结果,土壤微生物磷在被细菌吸收固定100 d后才能实现周转利用[24],而本试验周期约为100 d,土壤速效磷含量为6.20 mg/kg,土壤养分含量较低,解磷细菌的接入短期内为AMF孢子扩繁做出贡献的可能性大大降低。张林等[25]在菌丝室的低磷土壤中接种解磷细菌巨大芽孢杆菌后同样发现摩西球囊霉的侵染率降低。
土壤蛋白酶和脲酶参与土壤有机氮向无机氮的转化过程,其活性大小常用来反映土壤氮素供应强度[26]。AMF不能单独分泌土壤中的分解酶,但能够促进土壤微生物分泌多种酶,包括酸性磷酸酶[25]、碱性磷酸酶[25]、硝酸还原酶[27]、蛋白酶[28]和脲酶[28]等。本研究中,在水稻营养生长期末,无论是单接种AMF还是同时接种AMF和解磷细菌,土壤蛋白酶和脲酶的活性大部分低于单独接种灭活复合菌剂。AMF对水稻根系的侵染需要一个过程,在营养生长期,AMF侵染初期依赖于宿主对其养分的供应,而对宿主的养分贡献十分有限。在水稻生殖生长期末,相比单独接种灭活复合菌剂,单独接种RI真菌提高了土壤脲酶的活性;在接种AMF的同时添加解磷细菌后,土壤脲酶的活性整体高于单独接种灭活复合菌剂,但整体低于单独接种AMF的处理,这可能是由于接种解磷细菌后AMF孢子和菌丝生长受到抑制,从而减弱AMF促进土壤酶分泌的能力。
在本研究中,相比单独接种灭活复合菌剂,单接种AMF和解磷细菌处理的水稻氮肥利用率没有显著变化;在水稻生殖生长期末 双接种情况下部分处理显著提高了氮肥利用率。水稻生殖生长期末,土壤脲酶活性与氮肥利用率、磷肥利用率和钾肥利用率均呈顯著正相关。微生物的数量和活性高度依赖于土壤中的碳,而土壤中往往缺乏碳元素,因此95%以上的微生物处于休眠状态[29]。AMF从植物光合产物中获取碳元素,在生长过程中会分泌果糖、葡萄糖等低相对分子质量化合物,这些物质可直接被微生物吸收利用[30]。由于AMF分泌物的存在,根外菌丝表面碳质量浓度较高,微生物更容易被吸引,有的细菌能在根系附近形成生物膜,加强自身抗性,形成稳定的群体[31]。细菌在真菌菌丝表面定殖能力的大小受到真菌种类的影响。芽孢杆菌属细菌R1-3、巨大芽孢杆菌、耐盐节杆菌这3种菌株由于合成自身细胞的需要,对根外菌丝分泌的糖类物质表现出趋化性,不断扩繁定殖。解磷细菌发挥作用的重要前提是能在土壤中生存生长,所以单接种解磷细菌可能由于土壤中缺少有效载体和营养物质,受到土著微生物的干扰使得群体逐渐萎缩甚至消失[32]。不同细菌与真菌的组合在肥料利用率方面表现出的差异可能是由于3种细菌的生长习性不同,在菌丝上定殖能力也受到影响。AMF可以识别合作的伙伴,当真菌土壤中施入解磷细菌后,细菌也会分泌生长激素、各种酶类等物质促进土壤养分的矿化,土壤中可利用养分增多,AMF在与解磷细菌竞争养分的同时也保持着合作的可能性,宿主植物将光合作用的产物分享给土壤中的微生物,这时AMF和解磷细菌倾向于形成共生关系,共同协助土壤中的养分向宿主植物运输,形成植物-AMF-细菌三体结构[33]。在本研究中,RI和FM在3种解磷细菌的帮助下共同维护与宿主植物的关系,促进氮素和钾素向水稻地上部运输,提高其肥料利用率。
综上所述,在水稻生殖生长期末,本研究筛选出FM+BM组合可最大程度提高氮肥利用率和钾肥利用率。但该种模式是否具有普遍性?如何选择AMF的最佳合作伙伴以达到水稻肥料利用率的最佳水平仍需要进一步研究。
参考文献:
[1] 闫 湘,金继运,梁鸣早. 我国主要粮食作物化肥增产效应与肥料利用效率[J]. 土壤,2017,49(6):1067-1077.
[2]张艳红,陈志青,杨 硕,等. 增施纳米三氧化钼对水稻产量、品质和氮肥利用率的影响[J]. 扬州大学学报(农业与生命科学版),2022,43(5):27-36.
[3]钱卫飞,徐巡军,钱卫东,等. 不同土壤类型水稻测土配方施肥对肥料利用率的影响[J]. 江苏农业科学,2013,41(1):83-85.
[4]鲁艳红,廖育林,聂 军,等. 五年定位试验钾肥用量对双季稻产量和施钾效应的影响[J]. 植物营养与肥料学报,2014,20(3):598-605.
[5]蔡祖聪,颜晓元,朱兆良. 立足于解决高投入条件下的氮污染问题[J]. 植物营养与肥料学报,2014,20(1):1-6.
[6]LIU L, XU W, LU X K, et al. Exploring global changes in agricultural ammonia emissions and their contribution to nitrogen deposition since 1980[J]. Proceedings of the National Academy of Sciences of the United States of America,2022,119(14):e2121998119.
[7]WU Q S, HE J D, SRIVASTAVA A K, et al. Mycorrhiza enhances drought tolerance of citrus by altering root fatty acid compositions and their saturation levels[J]. Tree Physiology,2019,39(7):1149-1158.
[8]宋福强,程 蛟,常 伟,等. 田间施加AM菌剂对大豆生长效应的影响[J]. 中国农学通报,2013,29(6):69-74.
[9]邓 胤,申 鸿,罗文倩,等. 不同氮素形态比例条件下接种AMF对玉米氮同化关键酶的影响[J]. 植物营养与肥料学报,2009,15(6):1380-1385.
[10]刘云龙,钱浩宇,张 鑫,等. 丛枝菌根真菌对豆科作物生长和生物固氮及磷素吸收的影响[J]. 应用生态学报,2021,32(5):1761-1767.
[11]贾艳艳,杨文飞,杜小凤,等. 接种AM真菌和施氮对还田稻秆氮素释放和小麦产量的影响[J]. 江西农业学报,2020,32(3):8-13.
[12]SAXENA J, MINAXI, JHA A. Impact of a phosphate solubilizing bacterium and an arbuscular mycorrhizal fungus (Glomus etunicatum) on growth, yield and P concentration in wheat plants[J]. CLEAN-Soil, Air, Water,2014,42(9):1248-1252.
[13]DEVEAU A, PALIN B, DELARUELLE C, et al. The mycorrhiza helper Pseudomonas fluorescens BBc6R8 has a specific priming effect on the growth, morphology and gene expression of the ectomycorrhizal fungus Laccaria bicolor S238N[J]. New Phytologist,2007,175(4):743-755.
[14]畢银丽,陈书琳,孔维平,等. 接种微生物对大豆生长及其根际土壤的影响[J]. 生态科学,2014,33(1):121-126.
[15]ZHANG L, FAN J, DING X, et al. Hyphosphere interactions between an arbuscular mycorrhizal fungus and a phosphate solubilizing bacterium promote phytate mineralization in soil[J]. Soil Biology and Biochemistry,2014,74:177-183.
[16]王应兰. 解磷微生物细菌的筛选、鉴定及其制备肥料的研究[D]. 贵阳:贵州大学,2020.
[17]张 振,李辉信,陈 雄,等. 一株具有荧蒽降解能力的产吲哚乙酸菌的筛选鉴定及其特性[J]. 环境工程学报,2014,8(11):5041-5048.
[18]李 青,谢昶琰,张 苗,等. 防控甜瓜枯萎病病菌的生防菌筛选及其根际定殖[J]. 江苏农业学报,2023,39(2):336-343.
[19]王幼珊,张淑彬,张美庆. 中国丛枝菌根真菌资源与种质资源[M]. 北京:中国农业出版社,2012.
[20]鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社,2000.
[21]关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社,1986.
[22]FREY-KLETT P, GARBAYE J, TARKKA M T. Tansley review: the mycorrhiza helper bacteria revisited[J]. New Phytologist,2007,176:22-36.
[23]MARSCHNER P, CROWLEY D, RENGEL Z. Rhizosphere interactions between microorganisms and plants govern iron and phosphorus acquisition along the root axis-model and research methods[J]. Soil Biology and Biochemistry,2011,43(5):883-894.
[24]朱晓亚,李子豪,林启美,等. 模拟不同春季降雨量下典型草原土壤微生物磷周转特征[J]. 生态学报,2020,40(8):2655-2661.
[25]张 林,丁效东,王 菲,等. 菌丝室接种解磷细菌Bacillus megaterium C4对土壤有机磷矿化和植物吸收的影响[J]. 生态学报,2012,32(13):4079-4086.
[26]戴伊莎,成 欣,刘帮艳,等. 秸秆和紫云英协同覆盖对西南旱地土壤养分、酶活性及小麦产量的影响[J]. 土壤通报,2021,52(6):1339-1347.
[27]ZAREA M J, KARIMI N, GOLTAPEH E M, et al. Effect of cropping systems and arbuscular mycorrhizal fungi on soil microbial activity and root nodule nitrogenase[J]. Journal of the Saudi Society of Agricultural Sciences,2011,10:109-120.
[28]谷文超,張 杰,周 浓,等. 不同丛枝菌根真菌组合与接种时期对滇重楼幼苗根际土壤理化性质与微生物数量的影响[J]. 中国实验方剂学杂志,2020,26(22):116-130.
[29]BLAGODATSKAYA E, KUZYAKOV Y. Active microorganisms in soil: critical review of estimation criteria and approaches[J]. Soil Biology & Biochemistry,2013,67:192-211.
[30]TOLIJANDER J F, LINDAHL B D, PAUL L R, et al. Influence of arbuscular mycelial exudates on soil bacterial growth and community structure[J]. FEMS Microbiology Ecology,2007,61(2):295-304.
[31]ARTURSSON V, JANSSON J K. Use of bromodeoxyuridine immunocapture to identify active bacteria associated with arbuscular myccorhizal hyphae[J]. Applied and Environmental Microbiology,2003,69:6208-6215.
[32]吴 翔,唐 亚,甘炳成,等. 一种初步判断细菌类微生物在土壤中定殖能力的方法[J]. 中国土壤与肥料,2020(3):204-209.
[33]BONFANTE P, ANCA I A. Plants, mycorrhizal fungi, and bacteria: a network of interactions[J]. Annual Review of Microbiology,2009,63:363-383.
(责任编辑:王 妮)
