淤泥质潮滩大型底栖动物群落及其碳库:夏季温岭隘顽湾的启示
2024-01-28田素杰汤雁滨于培松刘诚刚刘清河张荣良曾江宁廖一波
田素杰,汤雁滨,于培松,刘诚刚,刘清河,张荣良,寿 鹿,曾江宁,廖一波
(自然资源部海洋生态系统动力学重点实验室,自然资源部第二海洋研究所,浙江 杭州 310012)
0 引言
2009年BlueCarbon:Theroleofhealthyoceansinbindingcarbon中系统提出了蓝碳概念[1]。区别于陆地森林固定的绿碳,蓝碳由海洋浮游生物等初级生产者主导的物质循环过程吸收固定,包括食物网传递、氧化利用、分解排出、海底沉积等过程[2-3]。海岸带作为由河口、淤泥质潮滩(也称“泥滩”)、植被潮滩、海草草甸等生境连续分布而组成的整体生态系统,相关研究结果展示了其巨大的固碳潜力,是各个国家地区为扩大蓝碳储量重点保护的区域[4-6]。目前海岸带蓝碳研究的关注热点为植被潮滩(红树林、海藻床、盐沼植物等)通过光合作用将CO2固定为有机物并埋藏的过程[6-7]。然而蓝碳研究不能仅局限于植被潮滩,植物光合作用产生的有机物一部分会被就地掩埋,一部分会被输送到邻近的泥滩中。近年来陆续开展的植被潮滩和泥滩区域碳库大小调查,证实了在海岸带蓝碳评估中考虑泥滩生境的必要性[8-9]。
由海洋生物隔离或储存在海洋生态系统中的蓝碳包括生物碳库和沉积物碳库[10]。近年来为开展生态系统和蓝碳的科学管理,进行了很多对海洋生境内整体碳库的量化研究,其中大型底栖动物碳库作为生物碳库的重要组成而受到重视[11-12]。大型底栖动物是海岸带重要的消费者,来自初级生产者的碳被它们摄食而储存在食物网中。同时大型底栖动物的挖掘、筑巢营穴等活动会有效推动泥滩沉积物中碳的转化,它们带来的生物扰动会引起沉积物生物地球化学性质的变化,影响有机物的运输和循环[13]。大型底栖动物还可以向沉积物中输送有机碳碎屑,促进沉积物固碳,在海岸带碳埋藏过程中发挥重要作用[14-15]。近年来有很多研究从不同类群的大型底栖动物角度分析其对蓝碳的贡献作用,但针对各类群底栖动物有机碳含量高低的研究较少,这对泥滩生态系统整体碳库的量化研究造成了阻碍。
在以往的泥滩碳库调查中,沉积物碳库已经初步探明,在此基础上逐步开展泥滩中大型底栖动物的生物碳库调查,对构建及完善我国海岸带蓝碳评估体系、量化生境内整体碳库的大小有重要意义。本文以夏季浙江东部沿海隘顽湾为例,系统介绍泥滩大型底栖动物群落的结构特征和功能群组成,评估生态系统健康程度,估算生物碳库大小并分析其组成,初步探究泥滩中不同类群大型底栖动物作为生物碳库的潜力,为我国蓝碳发展以及生境内整体碳库的查明提供了科学思路。
1 材料与方法
1.1 研究区域概况
隘顽湾地处浙江东部沿海,东起温岭石塘山,西至玉环市栈台山,南通披山洋,海湾沿岸呈半圆形。隘顽湾东西长约14.8 km,南北宽约14.4 km[16],基底以淤泥为主,泥滩面积约57.51 km2,是浙江省东部沿海重要的港湾型潮滩,正处于缓慢淤积过程,是研究泥滩大型底栖动物群落及其碳库的理想区域。

图1 隘顽湾大型底栖动物采样断面位置Fig.1 Location of sampling sections of macrobenthos around the Aiwan Bay
1.2 样品采集与处理
本次调查时间为2021年8月20日—21日,在隘顽湾设置了两条潮间带调查断面,即AWB1(28°17′43″N—28°18′44″N,121°32′24″E—121°32′52″E),AWB2(28°18′11″N—28°19′51″N, 121°30′13″E—121°30′31″E)。各断面设5个站位点:高潮区和低潮区各1个,中潮区3个。大潮期间在各站位点进行大型底栖动物采样,使用25 cm × 25 cm × 30 cm的定量框于每个站位点取4个样方。样方内泥质样品通过0.5 mm孔径钢筛淘洗,并按站位分装于样品袋中,-20 ℃条件下保存。采集的大型底栖动物样品在实验室进行镜检,鉴定物种并按照类群进行划分。吸干生物表面水分,用感量为0.001 g的电子天平称量湿重。潮间带生物的采样、收集、鉴定、称重等流程均按照《海洋调查规范 第6部分:海洋生物调查》(GB/T 12763.6—2007)[17]要求进行。大型底栖动物称量结束后将生物样品以65 ℃烘干至恒重,并称得干重。烘干的样品研磨粉碎后称取25.0 mg,使用元素分析仪测定大型底栖动物有机碳(organic carbon, OC)和总氮(total nitrogen, TN)含量。
1.3 数据分析
1.3.1 大型底栖动物群落结构分析
主要分析潮间带泥滩大型底栖动物群落结构以下指数[18]:
物种多样性指数(Shannon-Wiener diversity index,H′):
H′=-∑Pilog2Pi
(1)
物种丰富度指数(Margalef's species richness index,D):
D=(S-1)/log2N
(2)
物种均匀度指数(Pielou's evenness index,J):
J=H′/log2S
(3)
优势度(Y):
Y=ni/N×fi
(4)
式中:Pi为第i种个体数占总个体数的比例,S为总物种数,fi为该种出现的站位数占总站位数的百分比,N为所有物种的个体总数,ni为第i种物种的个体数。断面中Y>0.02的物种为优势种。
1.3.2 大型底栖动物功能群划分与生态系统健康评估
隘顽湾出现的大型底栖动物根据食性可划分为5个功能群:1)以小型动物、幼虫为食的肉食者(carnivorous group);2)通过过滤器官进食的浮游生物食者 (planktophagous group);3)以维管植物、绿色植物为食的植食者(phytophagous group);4)以其他生物、植物为食的杂食者 (omnivorous group);5)以有机碎屑为食的碎屑食者(detritivorous group)[19-21]。
J′FD=H′/log2n
(5)
式中:n为功能群个数,H′为物种多样性指数。J′FD高于0.8,认为生态系统状态优秀;J′FD处于0.6~0.8之间为状态良好;J′FD处于0.4~0.6之间为状态一般;J′FD低于0.4为状态不良[22-23]。
1.3.3 碳库计算
大型底栖动物的有机碳含量和总氮含量可通过元素分析仪直接获得,泥滩中大型底栖动物碳库按下式计算:
BCstock=∑BCi
(6)
BCi=Bi×OCi×A
(7)
式中:BCstock为泥滩大型底栖动物碳库量;BCi为第i个大型底栖动物类群的碳库量;Bi为第i个大型底栖动物类群的干重生物量;OCi为第i个大型底栖动物类群的有机碳含量;A为泥滩总面积。
2 结果与分析
2.1 大型底栖动物群落分析
在隘顽湾潮间带采集的大型底栖动物样品的物种名称、潮区分布、功能群组成等结果如表1所示。鉴定结果显示共有生物种类29种,其中软体动物13种,占比44.83%;甲壳类动物7种,占比24.14%;多毛类动物5种,占比17.24%;其他类动物3种(鱼类2种、纽形动物1种);棘皮动物1种。软体动物包括腹足纲和瓣鳃纲生物,与甲壳类动物构成隘顽湾大型底栖动物群落的主要组分。
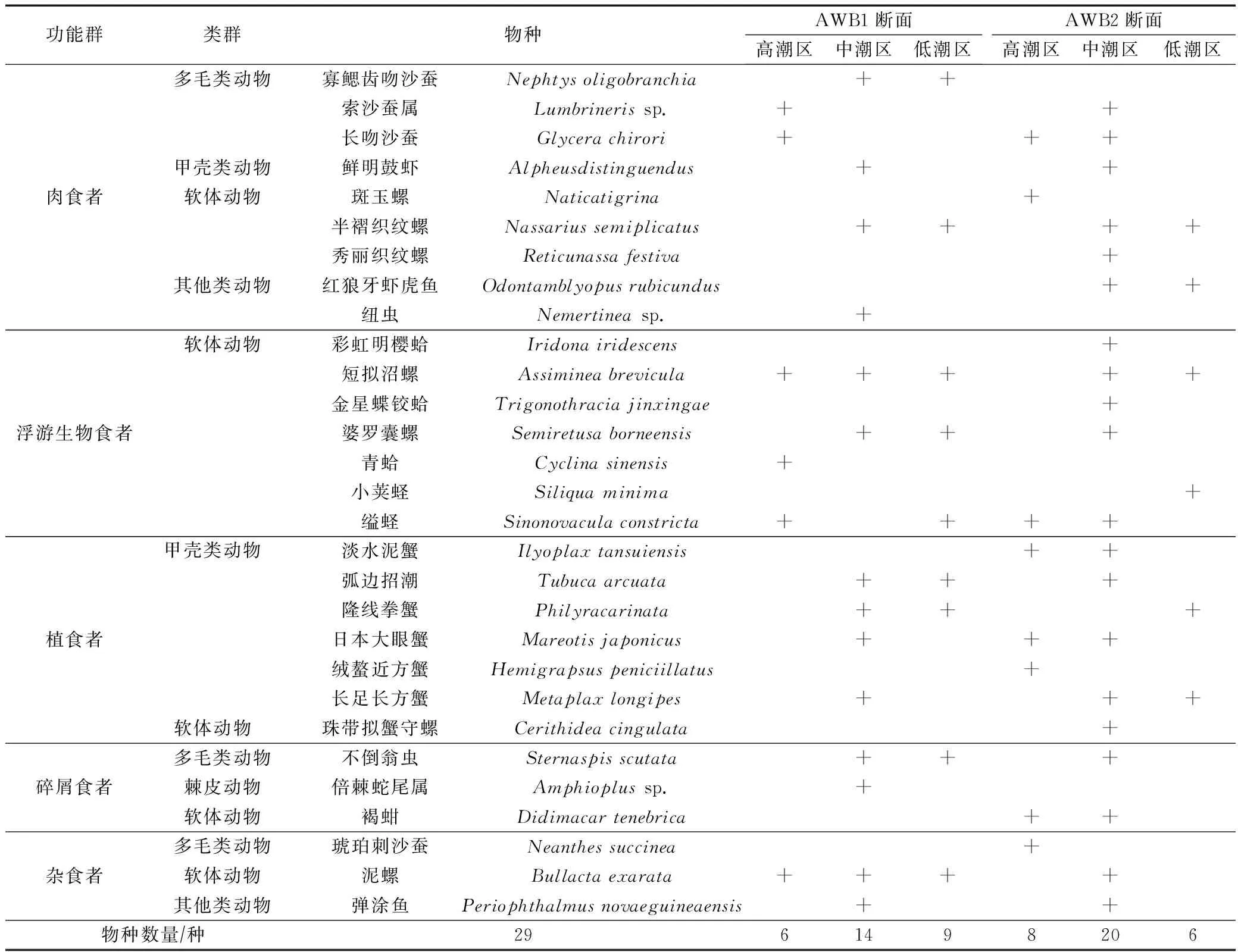
表1 隘顽湾大型底栖动物的功能群、类群和物种分布Tab.1 Distribution of functional groups, taxa and species of macrobenthos in Aiwan Bay
根据隘顽湾大型底栖动物优势度的计算,短拟沼螺Assimineabrevicula、婆罗囊螺Semiretusaborneensis、日本大眼蟹Mareotisjaponicus、半褶织纹螺Nassariussemiplicatus和缢蛏Sinonovaculaconstricta在多个潮区出现,优势度指数分别为0.168、0.099、0.059、0.039和0.030,是隘顽湾泥滩大型底栖动物优势种。
隘顽湾两个调查断面中大型底栖动物平均丰度为105.2±37.2 ind/m2,平均生物量为46.9±6.4 g/m2,多样性指数为3.11~3.25,丰富度指数为2.92~3.65,均匀度指数为0.70~0.75。对断面内不同潮区的大型底栖动物丰度和生物量进行统计学差异性检验(Kruskal-Wallis test),结果如图2所示。AWB1断面不同潮区的丰度之间无显著差异,这与中潮区采样点丰度变化较大有关;断面内不同潮区生物量差异显著,由于甲壳类动物等大型个体多集中生活在中潮区,生物量表现为中潮区>低潮区>高潮区。AWB2断面不同潮区的生物量之间无显著差异;断面内不同潮区丰度在中、低潮区之间有显著差异。从大型底栖动物类群来看,软体动物和甲壳类动物的生物量和丰度均远大于其他门类,是隘顽湾底栖动物的重要组成。
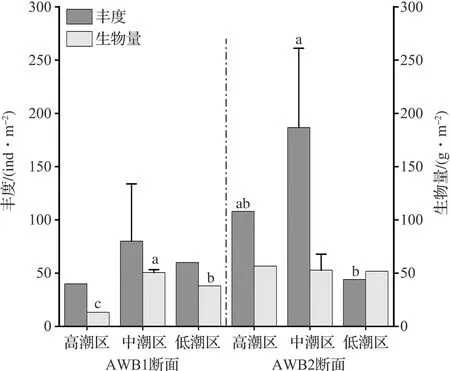
图2 隘顽湾大型底栖动物在不同采样点的平均丰度和生物量Fig.2 Average abundance and biomass of the macrobenthos at different sample stations in Aiwan Bay(a、b、c为显著性差异标志,p<0.05。)(a, b and c are significant difference markers, p<0.05.)
2.2 大型底栖动物功能群组成与生态系统健康程度
根据大型底栖动物的食性,可将隘顽湾大型底栖动物划分为5个功能群,其中肉食者种类最多,有9种;其次为浮游生物食者和植食者,均为7种;碎屑食者和杂食者最少,均为3种。不同功能群的平均生物量在两个断面的分布差异不显著,两个断面中平均生物量最大的功能群均为植食者;不同潮区分布中浮游生物食者在高潮区表现出较大优势,平均生物量高于其他功能群,中、低潮区中植食者的平均生物量较高(图3)。

图3 隘顽湾不同断面(a)和潮区(b)功能群的平均生物量Fig.3 Average biomass of functional groups in different sections(a) and tidal zones(b) in Aiwan Bay

2.3 大型底栖动物生物碳库
按照不同类群分析计算AWB1和AWB2断面内大型底栖动物的有机碳含量,结果如表2所示。其他类动物(主要为虾虎鱼科、纽虫)的有机碳含量远高于其他类群,软体动物有机碳含量偏低,棘皮动物有机碳含量略高于软体动物。
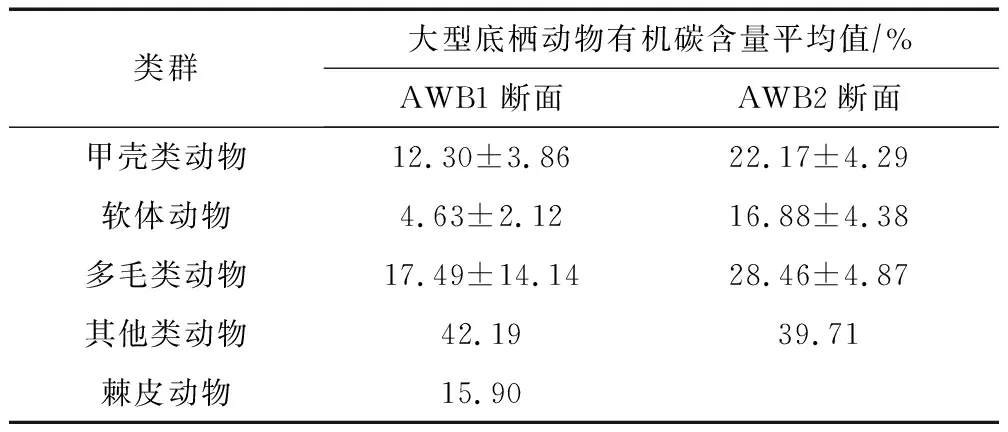
表2 隘顽湾不同类群大型底栖动物的有机碳含量Tab.2 Organic carbon content among different taxa of macrobenthos in Aiwan Bay
结合隘顽湾生物量和不同类群的有机碳含量,可计算出区域内大型底栖动物单位面积内固碳量为2.85±1.35 g·m-2,隘顽湾淤泥质潮滩面积约 57.51 km2,大型底栖动物碳库大小达到(1.64±0.78)×105kg。甲壳类动物和软体动物对隘顽湾区域生物碳库的贡献率达到95%以上。甲壳类动物是最大的贡献者,占比59.80%,其后依次为软体动物(35.72%)、其他类动物(2.61%)、多毛类动物(1.80%)和棘皮动物(0.06%)。
分析隘顽湾大型底栖动物的有机碳和总氮含量可以发现,两者之间存在很强的相关性(Spearman’s rank correlation coefficient,ρ=0.933,p=0.000),线性拟合呈正相关关系(r2=0.78,图4)。
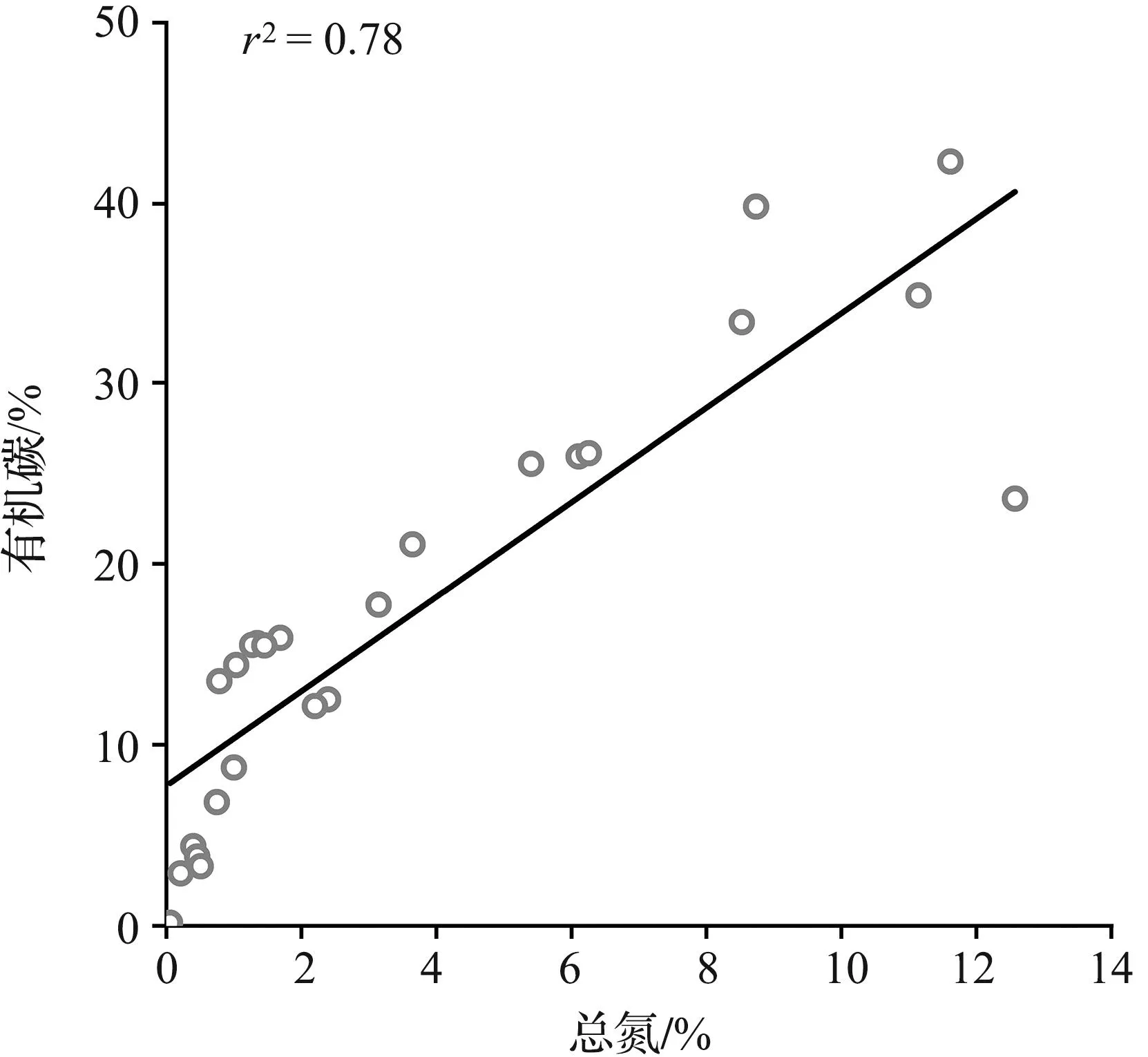
图4 隘顽湾大型底栖动物有机碳和总氮含量线性拟合Fig.4 Linear fitting of organic carbon-total nitrogen content of macrobenthos in Aiwan Bay
3 讨论
3.1 通过大型底栖动物群落结构评价淤泥质潮滩生境
我国淤泥质潮滩集中在辽东湾、渤海湾、江苏沿岸、杭州湾等区域,是众多野生候鸟和底栖生物栖息、繁衍的重要生境[24],也是人为活动中向海洋扩展利用的主要土地类型[25]。泥滩开发利用过程中,外来物种入侵、围垦等因素不断影响着大型底栖动物群落结构和泥滩的生态系统服务功能[26-28]。如外来物种互花米草在我国泥滩迅速蔓延,挤压、侵占原有泥滩空间[29],改变底栖环境,抑制软体动物等大型底栖动物的生长[30-31],降低了生物丰度[32]。由于面临严重的外在因素干扰,20世纪50年代以来,我国潮滩面积累计减少约57%[33]。
我国沿海淤泥质潮滩大型底栖动物群落结构研究结果的初步统计见表3。南麂列岛作为国家级海洋自然保护区,大型底栖动物的丰度和生物量均较高,仅部分断面受到中等程度干扰,区域群落结构稳定。崇明东滩、莱州湾、湄洲湾等区域受到外来物种入侵、陆源排污、围塘养殖等因素影响,丰度和生物量较低[34-40]。隘顽湾夏季调查结果中大型底栖动物丰度和生物量与其他区域相比并不突出,但生物多样性指数和丰富度指数较高,同时调查还发现隘顽湾区域内生态系统整体处于健康状态,这与调查区域暂无互花米草入侵、受填海围垦影响程度较低有关[41]。因此保护我国沿海淤泥质潮滩不受外来物种入侵影响,减少人为开发围垦,对开发利用和保护泥滩大型底栖动物资源有重要意义。
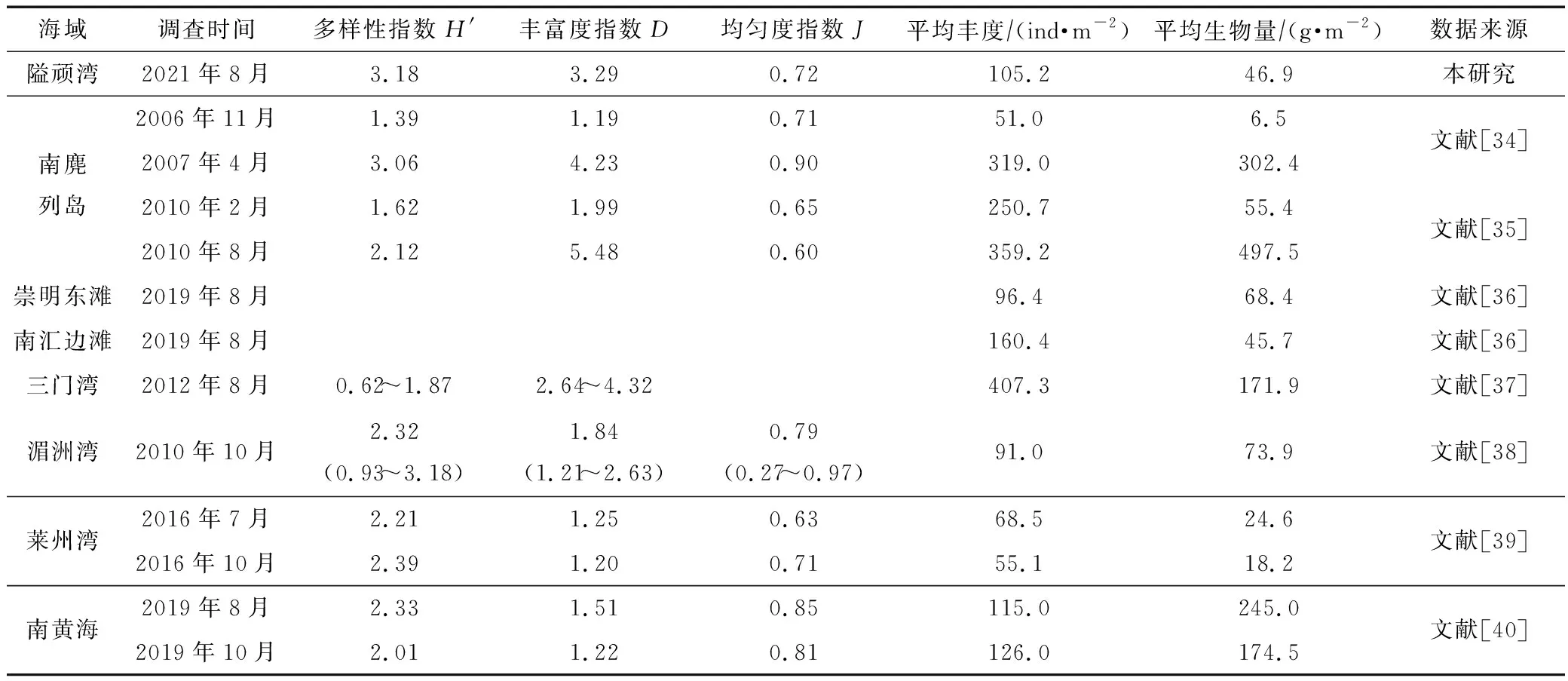
表3 我国淤泥质潮滩生境大型底栖动物群落结构、丰度、生物量统计Tab.3 Statistics of macrobenthos community structure, abundance and biomass at muddy tidal flat in China
隘顽湾调查区域共鉴定出29种大型底栖动物,其中肉食者功能群种类占比最高(31.0%),这与浙江西门岛等泥滩的情况一致[19]。肉食者是泥滩生境中最高级消费者,对植物和低营养级生物有着下行控制,其摄食过程会作用于生产者丰度和物种组成,影响着生态系统中的物质循环和有机物分解的速率[42]。因此,在泥滩保护和治理中,关注肉食者类群变化,对发挥生态系统服务功能、恢复生态系统健康状态有重要意义。
3.2 淤泥质潮滩大型底栖动物的固碳潜力
大型底栖动物群落是海岸带生境中次级生产的主要组成部分,且次级生产力高低与生物多样性呈正相关[43]。不同类群的大型底栖动物在次级生产和生命活动过程中对碳埋藏的贡献不同。甲壳类动物中的虾、蟹类动物具有极强的生物扰动(挖洞、筑巢等活动)能力,它们带来的生物扰动会向沉积物深处输送大量氧气,导致碳的暴露、氧化和损失,会使CO2排放量增加,蓝碳外流增加[44]。同时蟹类动物作为常见的植食者,可以快速利用植物中的碳、氮储备,是泥滩中的初级生产力向海洋转移的中介[45]。双壳类动物在沿海生境中以较低的营养级存在,多为消耗碎屑、颗粒物的滤食性动物,在物质循环中会隔离颗粒物中的有机碳,使其成为生物碳库的重要组成[46]。值得注意的是,双壳类动物作为碳汇的矛盾点在于养殖和产品利用过程中造成的CO2封存或排放净量,更多的需要考虑双壳类动物的养殖产量和颗粒物捕获量,并通过生命周期中的不同贡献评估双壳类动物在海洋碳平衡中的潜在作用[47]。甲壳类动物和软体动物作为常见的食物资源,为隘顽湾泥滩中生物碳库的主要贡献类群,在海岸带不同底质皆有分布,且是沿海泥滩重要的养殖类群,养殖规模在海岸带区域快速扩大。自2000年以来,我国一直保持为全球最大的海洋甲壳类动物和软体动物养殖、加工和贸易国[48-50],但生物碳库会在生物消费和利用过程中从海洋生态系统中去除,同时捕捞过程还带来CO2排放[51]。因此合理地开发利用甲壳类动物和软体动物等养殖资源并减少CO2的排放将有效提高海岸带生境内的生物碳库量。与其他门类不同的是,多毛类动物促进固碳的作用是公认的,多毛类动物个体较小,代谢率高,在产量相似的情况下,对营养物的利用非常可观[52-53]。隘顽湾调查区域内多毛类动物的有机碳含量仅次于鱼类,但多毛类动物的生物量和丰度均低于甲壳类动物和软体动物,对生境内生物碳库的贡献较低。
夏季隘顽湾大型底栖动物单位面积内生物固碳量较低,为2.85 g·m-2(0.028 5 Mg·hm-2),生境内大型底栖动物碳库大小为1.64×105kg(163.90 Mg)。由常见沿海生境的蓝碳调查结果(表4)可知,大型底栖动物的生物碳库在生境中并不占优势,但大型底栖动物可以利用泥滩中的底栖微藻、海藻等初级生产力,是沿海生境重要的能量流动载体,同时底栖动物的活动有助于沉积物中碳的储存,对泥滩土壤有机碳的埋藏有重要意义[58-59]。评估生态系统整体碳库量需要沉积物、植物以及底栖动物等碳库数据,本次调查结果可为隘顽湾淤泥质潮滩生境碳库的量化研究提供科学数据,也为我国海岸带生境整体碳库的查明提供调查思路。
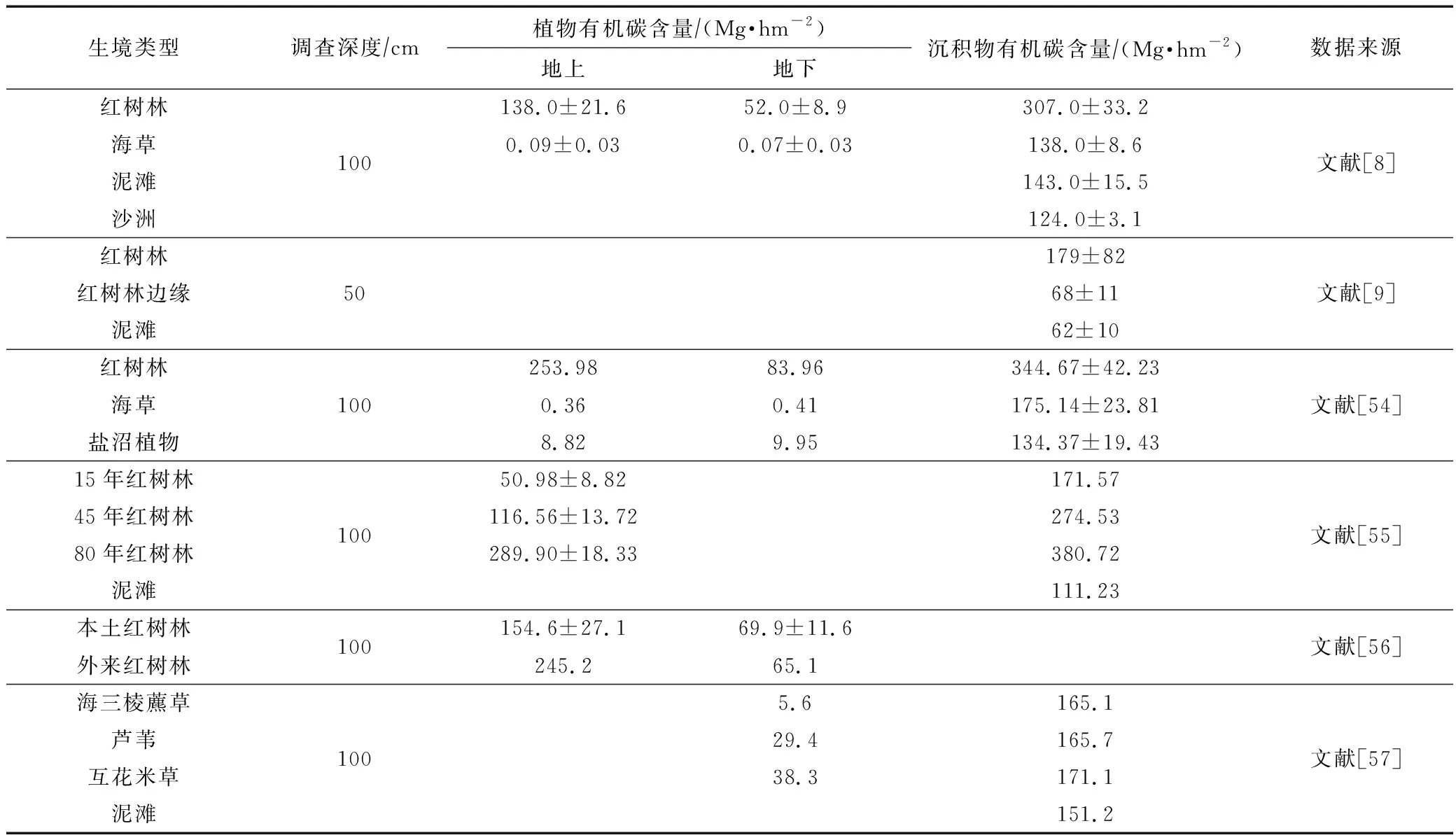
表4 常见沿海生境中的有机碳含量Tab.4 Organic carbon content in common coastal habitats
淤泥质潮滩大型底栖动物的固碳潜力大小与生物有机碳含量高低直接相关,ALLGEIER等[60]曾对部分无脊椎动物的C-N含量相关性进行研究,但未涉及泥滩大型底栖动物。本次调查发现隘顽湾不同类群大型底栖动物的有机碳和总氮含量之间有较强的正相关性,可以互相作为指示指标。
4 结论
我国淤泥质潮滩现状并不乐观,作为人类活动向海洋推进时的主要土地利用类型和重要后备土地资源,面临巨大的开发压力;另外,自1963年起米草属植物被陆续引入促淤造滩,其凭借强大的适应能力大量侵占潮滩空间。隘顽湾是浙江沿海典型的淤泥质潮滩,与其他海域对比,其生物多样性指数较高,且生态系统健康程度整体处于优秀水平,这与调查区域内无互花米草外来物种入侵、围垦填海活动较少有关。
大型底栖动物碳库是海岸带生物碳库的重要组成。本次对夏季隘顽湾淤泥质潮滩的调查发现,大型底栖动物中其他类(包括鱼类、纽虫)动物有机碳含量最高(40.95%),其后依次为多毛类动物(22.98%)、甲壳类动物(17.24%)、棘皮动物(15.90%)和软体动物(10.76%)。结合隘顽湾面积和生物量探明区域内大型底栖动物碳库大小为163.90 Mg。不同类群大型底栖动物有机碳含量存在差异,同时生物活动对促进蓝碳埋藏的贡献也不同,多毛类动物有机碳含量高、对营养物的利用非常可观,是潜在的生物固碳类群;甲壳类动物和软体动物为隘顽湾大型底栖动物生物碳库的主要贡献者,同时作为我国主要的海洋养殖类群、潮滩生境的主要类群,生物碳库潜力巨大,其中的双壳贝类已经列入海洋行业碳汇核算标准。值得注意的是大型底栖动物作为碳汇更多的要考虑其生命周期内封存或排放的CO2净量。其它类群动物能否成为海岸带碳汇仍需在生物固碳机理方面进行进一步的科学讨论。
