LSD1和PIEZO1在口腔癌中的表达及其与预后转归关系研究
2024-01-27罗昕骁邱妮赵殊艺何武书肖晨亮徐路肖玉鸿
罗昕骁,邱妮,赵殊艺,何武书,肖晨亮,徐路,肖玉鸿
口腔癌是头颈部最常见的恶性肿瘤之一,中国2022年口腔癌新发病例和死亡病例分别为31 733例、15 745例[1]。目前口腔癌患者病死率仍然较高[2],早期评估口腔癌预后转归很有必要。研究表明,DNA甲基化和生物力学信号改变在口腔癌发生发展中扮演重要角色[3-4]。赖氨酸特异性去甲基化酶1(lysine specific demethylase 1,LSD1)是首个发现的组蛋白去甲基化酶,能通过去甲基化作用启动或抑制基因转录以参与肿瘤过程[5]。压电型机械敏感离子通道组件1(piezo-type mechanosensitive ion channel component 1,PIEZO1)是一种感应力学信号蛋白,能通过改变生物力学信号改变细胞形态、结构参与肿瘤发生发展[6]。有实验报道,LSD1和PIEZO1在口腔癌细胞中异常表达[7-8]。现分析口腔癌组织中LSD1、PIEZO1表达与患者病理特征和预后转归关系,旨在为口腔癌预后评估提供参考,报道如下。
1 资料与方法
1.1 临床资料 回顾性选取2013年1月—2018年3月联勤保障部队第九二〇医院口腔外科收治的口腔癌患者113例,男73例, 女40例;年龄27~72 (60.68±8.63)岁,≥60岁79例、<60岁34例;病理类型:鳞状细胞癌105例,其他类型8例;肿瘤大小:>3 cm 61例,≤3 cm 52例;分化程度:低分化51例,中高分化62例;浸润深度:>5 mm 41例,≤5 mm 72例;TNM分期[9]:Ⅰ~Ⅱ期75例,Ⅲ期38例;淋巴结转移:有淋巴结转移31例,无淋巴结转移82例。
1.2 病例选择标准 (1) 纳入标准:①年龄≥18岁;②接受根治或姑息性切除;③经术后病理诊断为口腔癌。(2)排除标准:①合并口腔扁平苔藓、牙周炎等其他口腔疾病;②入院前已接受放化疗等抗肿瘤治疗;③自身免疫疾病或合并其他部位恶性肿瘤;④急慢性感染或合并严重心、肝、肾等重要脏器损害;⑤精神疾病;⑥拒绝随访;⑦病历资料不完整。
1.3 观测指标与方法
1.3.1 LSD1、PIEZO1检测:收集术中部分口腔癌组织和癌旁组织(距离癌组织边缘>3 cm),常规固定、脱水、透明、切片、脱蜡后。磷酸缓冲盐溶液修复,抗原加入一抗LSD1(1∶150)、PIEZO1(1∶100)和磷酸缓冲盐溶液(对照),4℃孵育过夜,后将对应二抗滴入载玻片孵育60 min。切片显色、染色,滴加盐酸酒精溶液分化组织切片,返蓝后用梯度酒精、二甲苯干燥透明,最后用中性树脂封闭切片。使用奥林巴斯生物倒置显微镜(型号 APX100)观察LSD1、PIEZO1表达情况。
1.3.2 口腔癌组织和癌旁组织免疫组织化学评分、阳性细胞比评价:无阳性细胞(0分)、阳性细胞比<10%(1分)、阳性细胞比10%~<51%(2分)、阳性细胞比51%~80%(3分)、阳性细胞比>80%(4分);细胞染色强度:无着色(0分)、淡黄色(1分)、棕黄色(2分)、棕褐色(3分)。二者乘积0~2分为阴性,>2分为阳性[10]。
1.3.3 随访预后转归:患者术后通过门诊复诊、电话、互联网等方法随访,统计患者生存情况,随访截至2023年3月。根据口腔癌组织LSD1、PIEZO1表达情况分为LSD1阳性表达组、LSD1阴性表达组,PIEZO1阳性表达组、PIEZO1阴性表达组。
1.4 统计学方法 选用SPSS 28.0统计学软件处理数据。计数资料以频数或率(%)表示,比较采用χ2检验;Kaplan-Meier法绘制口腔癌患者生存曲线,组间生存率比较采用Log-rank检验;多因素Cox回归分析影响口腔癌患者预后的相关因素。P<0.05为差异有统计学意义。
2 结 果
2.1 口腔癌组织与癌旁组织LSD1、PIEZO1表达比较 免疫组织化学结果显示,LSD1、PIEZO1阳性染色主要位于细胞质。口腔癌组织LSD1、PIEZO1阳性表达率高于癌旁组织(P<0.01),见表1和图1。
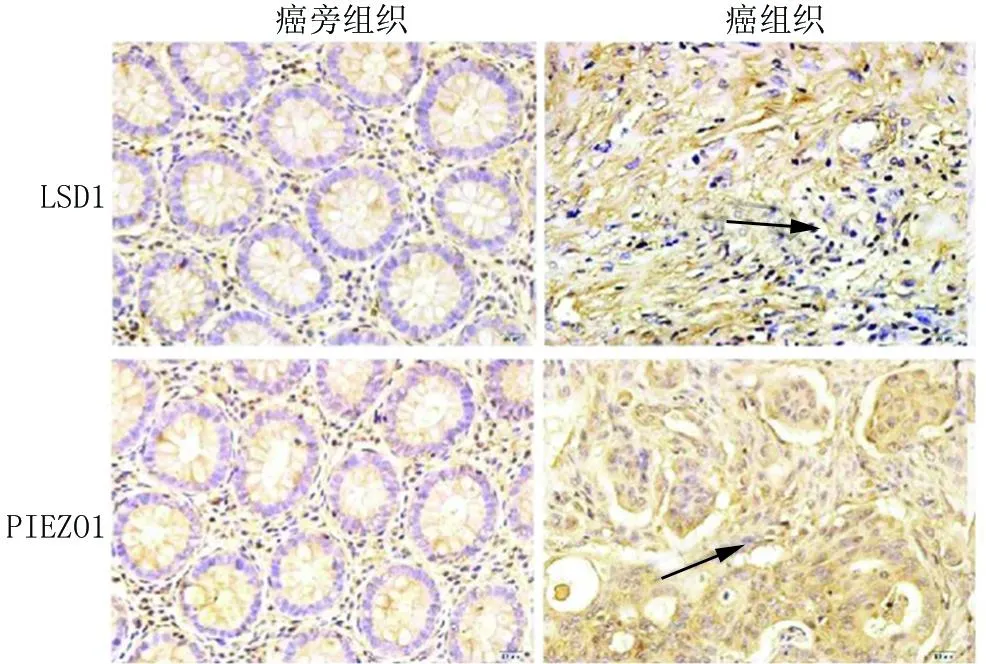
图1 口腔癌组织与癌旁组织LSD1、PIEZO1免疫组化染色(×200)Fig.1 Immunohistochemical staining of LSD1 and PIEZO1 in oral cancer tissue and adjacent tissues

表1 口腔癌组织与癌旁组织LSD1、PIEZO1阳性表达比较 [例(%)]Tab.1 Comparison of LSD1 and PIEZO1 Positive Expressions in Oral Cancer and Paracancerous Tissues
2.2 口腔癌组织LSD1、PIEZO1表达在不同临床/病理特征中差异比较 LSD1、PIEZO1在分化程度低、浸润深度>5 mm、TNM分期Ⅲ期、有淋巴结转移患者中阳性表达率升高(P<0.05),而在不同性别、年龄、病理类型、肿瘤大小的口腔癌患者中阳性表达率比较,差异无统计学意义(P>0.05),见表2。
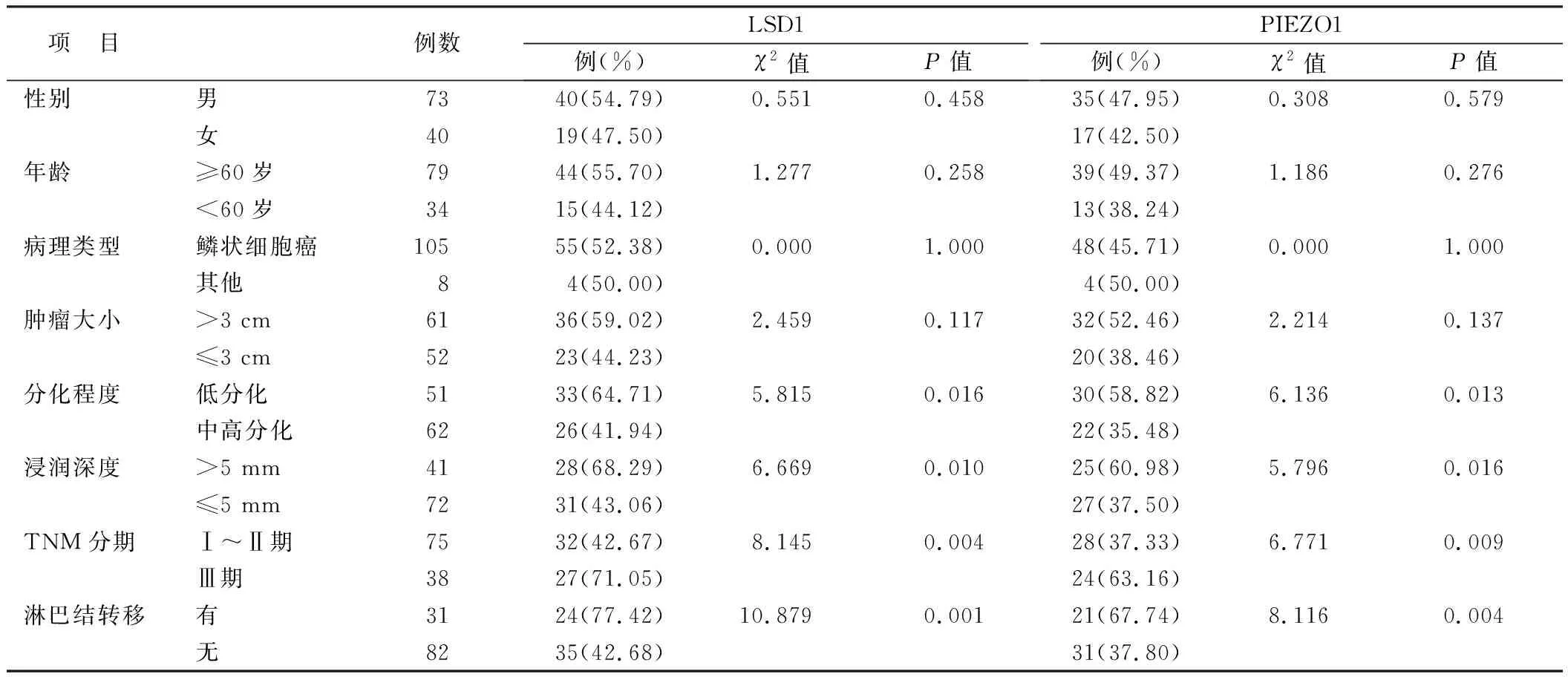
表2 不同临床病理特征患者口腔癌组织LSD1、PIEZO1阳性表达比较Tab.2 Comparison of LSD1 and PIEZO1 positive expression in oral cancer tissues of patients with different pathological characteristics
2.3 口腔癌组织LSD1、PIEZO1表达与生存率的关系 随访5年,113例口腔癌患者失访5例,死亡49例,5年总生存率为56.64%(64/113)。Kaplan-Meier生存曲线分析显示,LSD1阳性表达组(59例)、PIEZO1阳性表达组(52例)5年总生存率为42.37%(25/59)、42.31%(22/52),分别低于LSD1阴性表达组(54例)72.22%(39/54)、PIEZO1阴性表达组(61例)68.85%(42/61),差异均有统计学意义(Log-rankχ2=12.097、9.795,P=0.001、0.002),见图2。
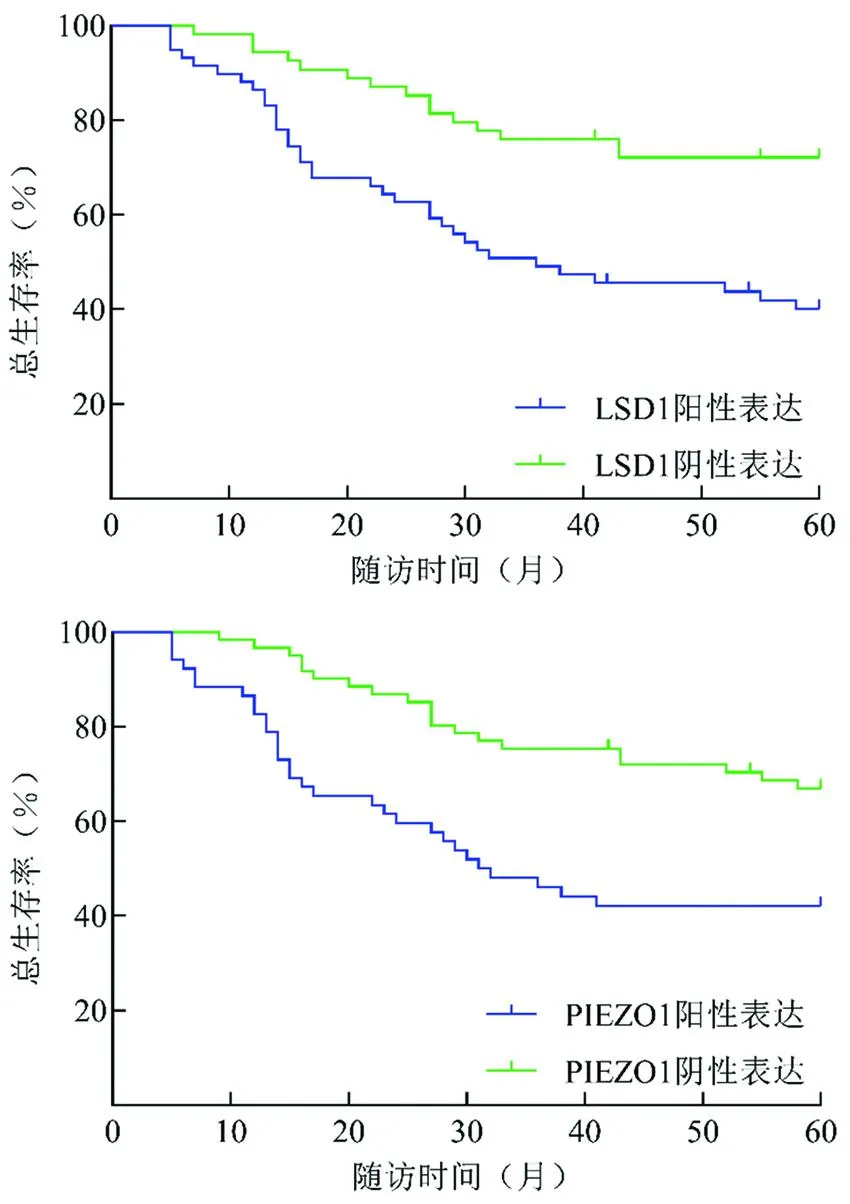
图2 LSD1、PIEZO1阳性/阴性表达口腔癌患者Kaplan-Meier生存曲线Fig.2 Kaplan Meier survival curve of oral cancer patients with positive/negative expression of LSD1 and PIEZO1
2.4 影响口腔癌患者预后转归的Cox回归分析 以影响口腔癌患者预后转归为因变量(赋值:是为“1”;否为“0”),以上述结果中P<0.05项目为自变量进行多因素Cox回归分析,结果显示:低分化、浸润深度>5 mm、TNM分期Ⅲ期、有淋巴结转移和LSD1、PIEZO1阳性表达为影响口腔癌患者预后转归的独立危险因素(P<0.05),见表3。
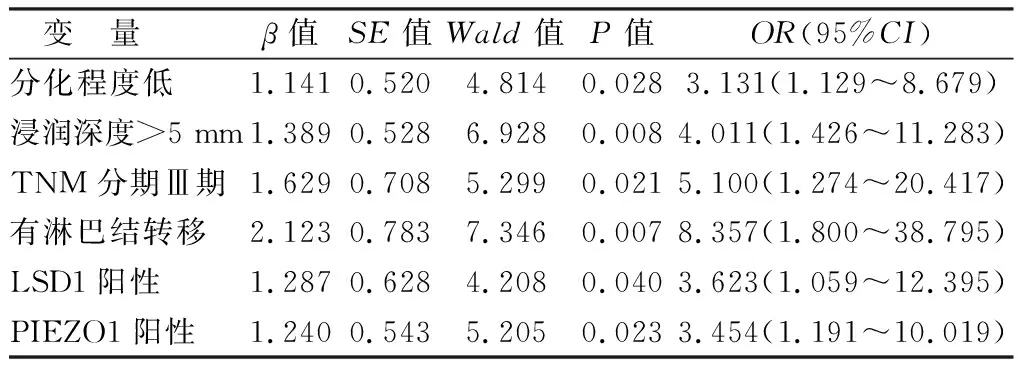
表3 影响口腔癌患者预后转归的Cox回归分析Tab.3 Cox regression analysis on the prognostic outcomes of oral cancer patients
3 讨 论
口腔癌是起源于口腔黏膜上皮的恶性肿瘤,临床中90%以上为鳞状细胞癌,其发病可能与口腔卫生差、病毒感染、吸烟、饮酒、口腔黏膜相关病变、环境等因素有关[11]。截至目前,根治性切除手术仍然是早期口腔癌最有效的治疗方法,尽管近年来其早期诊断率有所提升,但临床中仍有超过60%的口腔癌患者为初诊晚期,失去最佳治疗时机,5年生存率仅40%~50%[12]。虽然近年来部分免疫、靶向药物被用于口腔癌治疗,但由于口腔癌具有高度异质性、侵袭性和转移性,仍有部分患者难以获得较好临床效益[13-14]。因此,有必要确定更多口腔癌预后转归生物标志物,以指导临床干预和改善患者预后。
口腔癌的发生发展是多因素和多机制共同作用的过程,表观遗传改变在其中发挥重要作用[15]。DNA甲基化是哺乳动物调控基因表达的主要表观遗传学形式,能通过阻碍转录因子与调控序列结合、阻碍甲基CpG结合蛋白结合到甲基化CpG位点、阻碍转录因子结合等方式抑制基因表达,进而参与口腔癌发生发展[3]。LSD1是一种转录调节剂,又称BHC110、AOF2、KDM1A,能通过其高度保守结构域中黄素腺嘌呤二核苷氧化作用,特异性催化组蛋白第三亚基4/9号赖氨酸的单甲基化和二甲基的去甲基化,直接或间接调节蛋白质活性和稳定性,其异常表达与癌基因或抑癌基因异常表达密切相关[16]。近年来多项研究报道了LSD1与恶性肿瘤的关系,如LSD1在乳腺癌中高表达,能促进转录因子Slug诱导的上皮—间充质转化,促进乳腺癌细胞生长、侵袭和转移[17];LSD1在甲状腺癌中高表达,能通过上调缺氧诱导因子-1α促进Wnt/β-连环蛋白信号通路激活,进而促进甲状腺癌细胞恶性进展[18]。已有学者报道,LSD1在口腔癌中高表达,并影响口腔癌细胞恶性进展[7],同时有学者指出,LSD1高表达与卵巢癌、胃癌患者预后不良有关[19-20],因此推测LSD1可能影响口腔癌患者预后转归。本研究结果显示,口腔癌组织LSD1阳性表达率升高,与上述研究报道结果相符[7]。结果还显示,LSD1在分化程度低、浸润深度>5 mm、TNM分期Ⅲ期、有淋巴结转移患者癌组织中阳性表达率升高,提示LSD1参与口腔癌发生发展。分析原因LSD1升高能上调核转运蛋白亚基α2表达,激活磷脂酰肌醇3-激酶/蛋白激酶B信号通路,加速肿瘤新生血管生成、抑制肿瘤细胞凋亡、增强肿瘤细胞侵袭转移能力等作用,促进口腔癌发生发展[21]。此外LSD1还能抑制免疫细胞浸润,以阻碍宿主免疫对口腔癌细胞的清除能力,并促进口腔癌细胞免疫逃逸,导致口腔癌发生发展[16,22]。
生物力学信号传导是指流体剪切力、牵拉力、挤压力、基质硬度等力学刺激改变细胞生物学功能,将机械信号转化为电信号或生物信号的过程,异常的生物力学信号会改变细胞形态、结构等促进肿瘤发生发展[4]。机械敏感性离子通道是细胞表面将机械刺激转化为生物力学信号的机械感受器,PIEZO1是组成机械敏感性离子通道的成孔状亚基单位,受力学刺激激活后可开放离子通道,让带正电的钙离子进入细胞内,以产生相应的生化反应[23]。基于PIEZO1对生物力学信号的重要作用,近年来多项研究也报道了其与恶性肿瘤的关系,如PIEZO1在卵巢癌中高表达,能激活河马/yes相关蛋白(yes-associated protein,YAP)促进卵巢癌细胞生长和转移[24]。PIEZO1在前列腺癌中高表达,能激活原癌基因Src/YAP轴促进前列腺癌细胞生长和转移[25]。有学者报道,抑制PIEZO1能抑制口腔癌细胞增殖、迁移和侵袭[8]。同时有学者指出,PIEZO1高表达与肝细胞癌患者预后不良有关[26]。然而关于PIEZO1与口腔癌患者预后转归的关系尚未可知。本研究结果显示,口腔癌组织PIEZO1阳性表达率升高,符合上述研究报道结果[8]。结果还显示,PIEZO1在分化程度低、浸润深度>5 mm、TNM分期Ⅲ期、有淋巴结转移患者癌组织中阳性表达率更高,提示PIEZO1参与口腔癌的发生发展。分析其原因可能与PIEZO1高表达激活了YAP信号有关。YAP是应力刺激的转录共激活因子,也是介导肿瘤发生发展的重要致癌基因,应力刺激下YAP激活能放大机械信号以进一步激活自身,进而激活促癌信号通路和增强癌细胞生长、转移、侵袭等能力促进肿瘤的发生发展[4]。PIEZO1高表达能传导生物力学信号激活YAP信号,进而促进口腔癌细胞恶性进展[27]。
本研究通过随访分析发现,LSD1阳性表达组、PIEZO1阳性表达组5年总生存率低于LSD1阴性表达组、PIEZO1阴性表达组,且LSD1阳性表达、PIEZO1阳性表达为影响口腔癌患者预后转归的独立危险因素。说明口腔癌组织LSD1、PIEZO1表达还与口腔癌患者预后转归密切相关。
综上所述,LSD1、PIEZO1在口腔癌组织中高表达,与分化程度、浸润深度、TNM分期和淋巴结转移有关,是口腔癌患者预后转归不良的独立危险因素,可能成为口腔癌患者预后转归评估的生物标志物。但本研究结果还需多中心研究进一步验证。
利益冲突:所有作者声明无利益冲突
作者贡献声明
罗昕骁、何武书:设计研究方案,实施研究过程,论文撰写,研究构思,进行统计学分析;邱妮、赵殊艺:提出研究思路,课题设计,分析试验数据,论文审核;肖晨亮、徐路、肖玉鸿:实施研究过程,资料搜集整理,论文修改,论文撰写
