Serratia sp.对铜绿微囊藻、斜生栅藻的溶藻效果
2024-01-26洪桂云马少雄
洪桂云,汪 涛,朱 慧,马少雄
(安徽建筑大学环境与能源工程学院/水污染控制与废水资源化安徽省重点实验室,安徽 合肥 230601)
大量的氮、磷等物质排入水体,导致水体富营养化,使藻类迅速生长繁殖,引起蓝藻水华暴发,严重影响水生态系统健康,威胁饮用水安全[1-2]。蓝藻水华发生范围广,持续时间长,生物量高,已成为世界性的生态环境问题[3-4],探索抑制藻类水华暴发的有效途径极为迫切。目前,控制藻类的方法主要有物理法、化学法和生物法。常用的物理法有黏土除藻、气浮除藻及超声波控藻等手段。化学法是通过投加除藻剂来达到抑制藻类生长的目的。物理法和化学法对藻类有很强的灭杀作用,但存在治理成本高、选择性差、易对环境造成二次污染等缺点[5-7]。微生物控藻技术因有经济、高效、环境友好的优势[8-9]而广受关注。控藻微生物研究主要围绕溶藻菌分离[10]、溶藻机理[11]以及对藻类的抑制效果[12-14]展开,而对实验体系中溶藻产物的分析研究较少。
铜绿微囊藻是引起水体藻华的主要藻种之一,通过产生微囊藻毒素和蓝藻毒素威胁环境生态和人类健康[15]。斜生栅藻是淡水中极为常见的浮游绿藻,对污染物的耐性较强且繁殖快,常作为淡水水体生态常用指示物种,是淡水水体污染指示种之一,在水生生态系统中占有重要地位[16]。洪桂云等[17]从富营养化水体中分离到溶藻菌S6(Serratiasp.),并对该菌株溶藻机理进行了研究。本研究将菌株S6 分别加入铜绿微囊藻(Microcystis aeruginosa)、斜生栅藻(Scenedesmus obliquus)以及2 种藻混合藻液中,以藻种生物量、叶绿素a、氨氮、总磷(TP)浓度的变化趋势为指标研究S6 对水华中2 种常见藻的溶藻效果,以及对水质的影响,并利用光谱技术分析溶藻产物,为生物控藻研究提供理论基础。
1 材料与方法
1.1 供试藻种
铜绿微囊藻(FACHB-1326)和斜生栅藻(FACHB-1810)均购于武汉中科院水生生物研究所淡水藻种库,于恒温光照培养箱中静置培养,培养条件:温度(25±1)℃,照度2 000 lx,光暗周期12 h∶12 h。
1.2 菌种活化
实验菌株S6(Serratiasp.)为本课题组从富营养化水体中筛选的高效溶藻菌,置于低温冰箱保藏。将菌种S6接入牛肉膏蛋白胨液体培养基,以30 ℃、150 r/min条件恒温振荡培养24 h,备用。
1.3 溶藻菌S6溶藻实验
将溶藻菌S6 培养至对数生长期(2×109mL-1),依次稀释至原菌液的10-1、10-2、10-3、10-4、10-5,取各稀释菌液20 mL,分别加入180 mL 预培养1 周的铜绿微囊藻、斜生栅藻以及两者按体积比1∶1混合(下称“混合藻”)的藻液中,以加入20 mL BG11 培养基为空白对照。每组设置3 个平行样,用封口膜封口后放入恒温光照培养箱中进行溶藻实验。培养条件:温度(25±1)℃,光暗周期12 h∶12 h[17]。
1.4 藻细胞浓度、叶绿素a浓度测定
采用血细胞板计数法[18]和热乙醇法[19]分别测各溶藻体系中的藻细胞数目和叶绿素a 浓度,计算溶藻率(%):
式中:ρ(Chl-a)c为对照组的叶绿素a 质量浓度,ρ(Chl-a)t为处理组的叶绿素a质量浓度。
1.5 氨氮和总磷测定
将共培养的菌藻混合液定期取样10 mL,经0.45 μm微孔滤膜过滤,测定滤液中氨氮及磷质量浓度,氨氮测定采用纳氏试剂比色法,TP 测定采用钼酸铵分光光度法,计算去除率(%)。
式中:ρ(NH3-N)c和ρ(TP)c为对照组的氨氮和总磷质量浓度,ρ(NH3-N)t和ρ(TP)t为处理组的氨氮和总磷质量浓度。
1.6 溶藻产物特性分析
紫外光谱测定。取铜绿微囊藻、斜生栅藻和混合藻的空白对照组以及经不同浓度菌液溶藻14 d后的处理组藻液3 mL,分别采用TU-1950 型普析紫外分光光度计测定350~750 nm的光密度(OD)。
红外光谱测定。分别取空白对照组和经不同浓度菌液溶藻14 d 后的铜绿微囊藻、斜生栅藻以及混合藻35 mL,于4 ℃、5 000 r/min 条件下离心5 min,离心后的沉淀用去离子水洗涤3 次,冷冻干燥,干燥粉经KBr 固定后于FTIR-7600 型红外光谱分析仪上进行光谱扫描。
三维荧光光谱分析。将空白对照、原菌液和10-1倍菌液处理14 d 后的铜绿微囊藻、斜生栅藻和混合藻的9 个样品混匀、离心,各取3 mL 上清液过0.45 μm 滤膜,得到胞外溶解性有机物溶液,采用F-7000 型荧光光度计(HITACHI,日本)进行激发波长(λEx)为200~450 nm 和发射波长(λEm)为250~550 nm的检测,扫描间隔均为5 nm。
1.7 数据处理
采用IBM SPSS Statistics 24 软件对数据进行统计分析。所有数据均用单因素方差分析(One-way ANOVA)方法,利用Origin 2022软件绘图。
2 结果与分析
2.1 溶藻菌S6对不同藻类生长情况的影响
由图1 可知,铜绿微囊藻、斜生栅藻、混合藻的空白对照组中藻细胞浓度均呈上升趋势。加入溶藻菌S6 后,各处理组的藻细胞浓度与菌液浓度呈负相关。叶绿素a 浓度变化同藻细胞浓度,3 组对照组中叶绿素a 质量浓度分别从(274.65±18.53)、(260.54±13.54)、(444.49±27.68)μg/L升至(688.25±21.31)、(775.32±23.18)、(945.15±43.57)μg/L;而原菌液处理组中叶绿素a 质量浓度分别从(237.65±12.21)、(243.44±21.58)、(432.78±30.28)μg/L 降至(25.11±5.7)、(48.63±3.88)、(92.83±13.68)μg/L,各组的溶藻率见图2。由图2可知,溶藻率最高的为原菌液处理组,最低的为105倍稀释组,铜绿微囊藻、斜生栅藻、混合藻的原菌液溶藻率分别为89.4%、80.0%和78.6%,S6 105倍稀释液溶藻率分别为33.6%、22.2%和38.4%。因此,溶藻菌S6 可使两种纯藻及其混合藻的藻密度和叶绿素a 浓度均降低,且随着菌液浓度升高,溶藻率也呈现上升趋势。
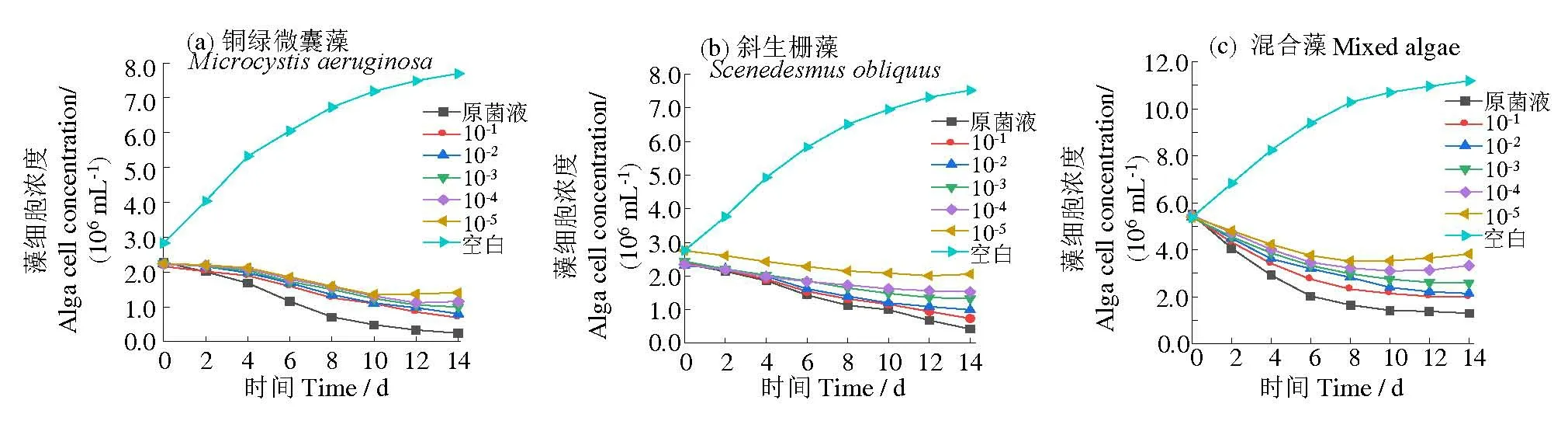
图1 S6菌对不同藻类藻密度的影响Fig.1 Effect of algicidal bacterium S6 on the algal density of different algal species

图2 S6菌对不同藻类溶藻率Fig.2 Alga dissiolution rate of different alga solutions treatmented with algicidal bacterium S6
2.2 溶藻菌S6对氨氮和总磷的去除能力
图3表明,铜绿微囊藻、斜生栅藻和混合藻藻液对照组中氨氮浓度在前6~8 d 内下降,之后呈平稳趋势,14 d 内3 组藻对照组中去除率分别为58%、68%和43%,可能是由前期藻类自身繁殖需要消耗水中的氮源,后期生长趋于稳定导致。各处理组氨氮浓度变化趋势同对照组,S6 原菌液及其10、102、103、104、105倍的稀释菌液对铜绿微囊藻中氨氮去除率分别为79%、73%、71%、69%、69%和64%,对斜生栅藻中氨氮去除率分别为77%、74%、74%、73%、72%和71%,对混合藻中氨氮去除率分别为55%、49%、48%、47%、47%和46%,各处理组氨氮去除率平均值略高于各对照组(图4)。由图3可知,原菌液和10倍稀释的处理组起始氨氮含量明显偏高,可能是由于这两组菌液中含有一定量的牛肉膏蛋白胨培养基。在原菌液加入铜绿微囊藻和斜生栅藻12 d、加入混合藻10 d左右时,由于藻类死亡数量上升,藻细胞大量破裂,导致水中氨氮浓度有一定回升。

图3 S6菌对不同藻液NH3-N的影响Fig.3 Effect of algicidal bacterium S6 on NH3-N concentrations in different algal solutions
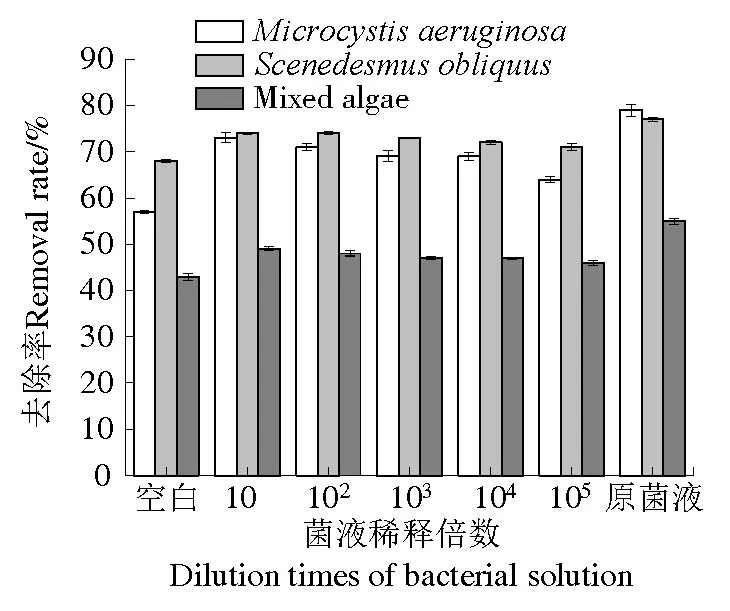
图4 S6菌对不同藻液氨氮去除率Fig.4 Removal rates of NH3-N from different algal solutions treatmented with algicidal bacterium S6
由图5 可知,三组空白对照组中TP 浓度也由于藻类自身繁殖需要呈现下降趋势,14 d 内铜绿微囊藻、斜生栅藻和混合藻藻液对照组除磷率分别为31%、34%和52%。加入不同浓度菌液后,S6原菌液及其10、102、103、104、105倍的稀释菌液对铜绿微囊藻中TP去除率分别为28%、29%、24%、29%、31%和31%,对斜生栅藻中TP 去除率分别为36%、36%、34%、35%、36%和39%,对混合藻中TP 去除率分别为56%、54%、51%、51%、53%和46%,各处理组除磷率和对照组相差不大(图6)。
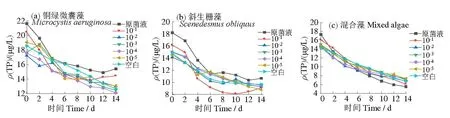
图5 S6菌对不同藻液中TP浓度的影响Fig.5 Effect of algicidal bacterium S6 on TP concentrations in different algal solutions
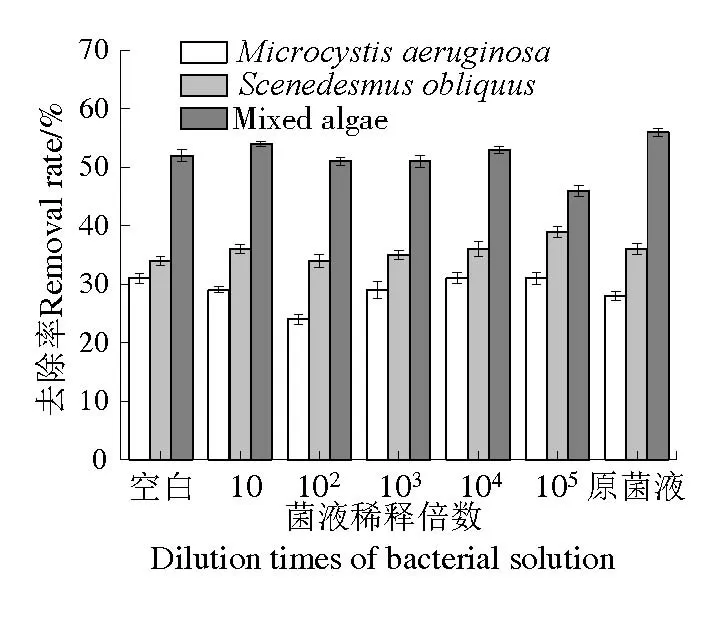
图6 S6菌对不同藻液TP去除率Fig.6 Removal rates of TP from solutions of different algae treatmented with algicidal bacterium S6
2.3 溶藻产物的紫外光谱分析
由图7可知,铜绿微囊藻、斜生栅藻和混合藻对照组和经不同浓度菌液溶藻14 d 后,各处理组的紫外吸收光谱变化趋势较为相近,总体上,不同处理组吸收峰峰值均随菌液浓度升高而降低,原菌液组处理组的峰值最低。铜绿微囊藻对照组在425~465、500~520、600~630、650~675 nm 处出现4 个吸收峰,峰值分别为2.325、2.008、1.958、1.889,各处理组的吸收峰位置与对照组相似,但峰值低于对照组。斜生栅藻的对照组在400~450 nm 处峰值为1.907,475~500 nm 处峰值为1.862、670~695 nm处峰值为1.926,各处理组在670~690 nm 之间出现与对照组相似但峰值低于对照组的吸收峰。混合藻对照组在450~460、640~680 nm 处吸收峰峰值分别为1.319、1.139,各处理组在640~690 nm 处也出现与对照组相似但峰值较低的吸收峰。

图7 S6菌对不同藻类的溶藻产物紫外吸收光谱Fig.7 UV-absorption spectra of algae-lysing products of different algae dissolved by algicidal bacterium S6
2.4 溶藻产物的傅里叶红外光谱分析
由图8 可知,各处理组与对照组的红外光谱主要吸收峰位置基本一致,峰形十分相似,但因菌液浓度不同,各吸收峰相对强度会有差异。铜绿微囊藻溶藻前后的红外光谱均在3 400、2 875、1 660、1 550、1 410、1 070、700 cm-1处出现7 个吸收峰。从峰归属看,3 400 cm-1处吸收峰为酰胺Ⅱ峰,是N—H伸缩振动区域;2 300 cm-1处是CO2反对称伸缩振动区域;1 660 cm-1处是C—O 伸缩振动区域;1 550 cm-1处是硝基—NO2伸缩振动区域;1 410 cm-1处是饱和烃基C—H 弯曲振动区域,表明蛋白质中的C—H 键可能被破坏;1 070 cm-1处是伯醇C—O伸缩振动区域;700 cm-1处是硬脂酸CH2面内摇摆振动区域。可见,铜绿微囊藻藻细胞结构中N—H、CO2、C—O、—NO2、C—H、CH2等键断裂。斜生栅藻在3 400、2 875、2 300、1 660、1 550、1 410、1 250、1 070、700 cm-1处出现9个吸收峰,其中铜绿微囊藻中未出现的2 875 cm-1和1 250 cm-1处分别是CH2对称伸缩振动和C—N伸缩振动区域,表明斜生栅藻藻细胞结构中N—H、CO2、C—O、—NO2、C—H、CH2、C—N 等键断裂。混合藻分别在3 400、2 875、1 660、1 550、1 410、1 250、1 070、700 cm-1处出现8 个吸收峰,表明混合藻藻细胞结构中也有类似的化学键键遭到破坏。由上可知,三种溶藻体系中的几种化学键大致相同,说明溶藻产物中均存在某种或多种含有这些化学键的多糖、氨基酸或蛋白质。

图8 S6菌对不同藻类的溶藻产物的红外光谱Fig.8 Infrared spectra of algae-lysing products of different algae dissolved by algicidal bacterium S6
2.5 溶藻产物溶解性有机物(DOM)的三维荧光分析
由图9(a-c)可知:铜绿微囊藻对照组光谱中λEx、λEm中心位置为270、340 nm 和200、380 nm 的类色氨酸峰和类富里酸荧光峰;原菌液和10倍稀释处理组的DOM 中除检测到类色氨酸峰和类富里酸荧光峰,还出现λEx、λEm为350、450 nm 的类腐殖酸荧光峰。由图9(d-f)可知:斜生栅藻对照组光谱中出现λEx、λEm为280、340 nm 的色氨酸峰;原菌液和10倍稀释处理组除色氨酸峰外,还检测到λEx、λEm为350、450 nm 的类腐殖酸荧光峰。由图9(g-i)可知:混合藻对照组光谱中出现λEx、λEm为270、330 nm 的类色氨酸峰;原菌液和10 倍稀释处理组除类色氨酸峰外,也检测到λEx、λEm为200、380 nm 的类富里酸峰和λEx、λEm为340、430 nm 的类腐殖酸荧光峰。类色氨酸物质可能是藻细胞的代谢产物,类富里酸、类腐殖酸物质是微生物对大分子有机物或藻细胞的降解产物,且这类物质不能被溶藻菌作为营养物质吸收[20]。随着溶藻菌S6 浓度的上升,溶藻产物DOM中类色氨酸、类富里酸和腐殖酸物质荧光峰强度呈增大趋势。
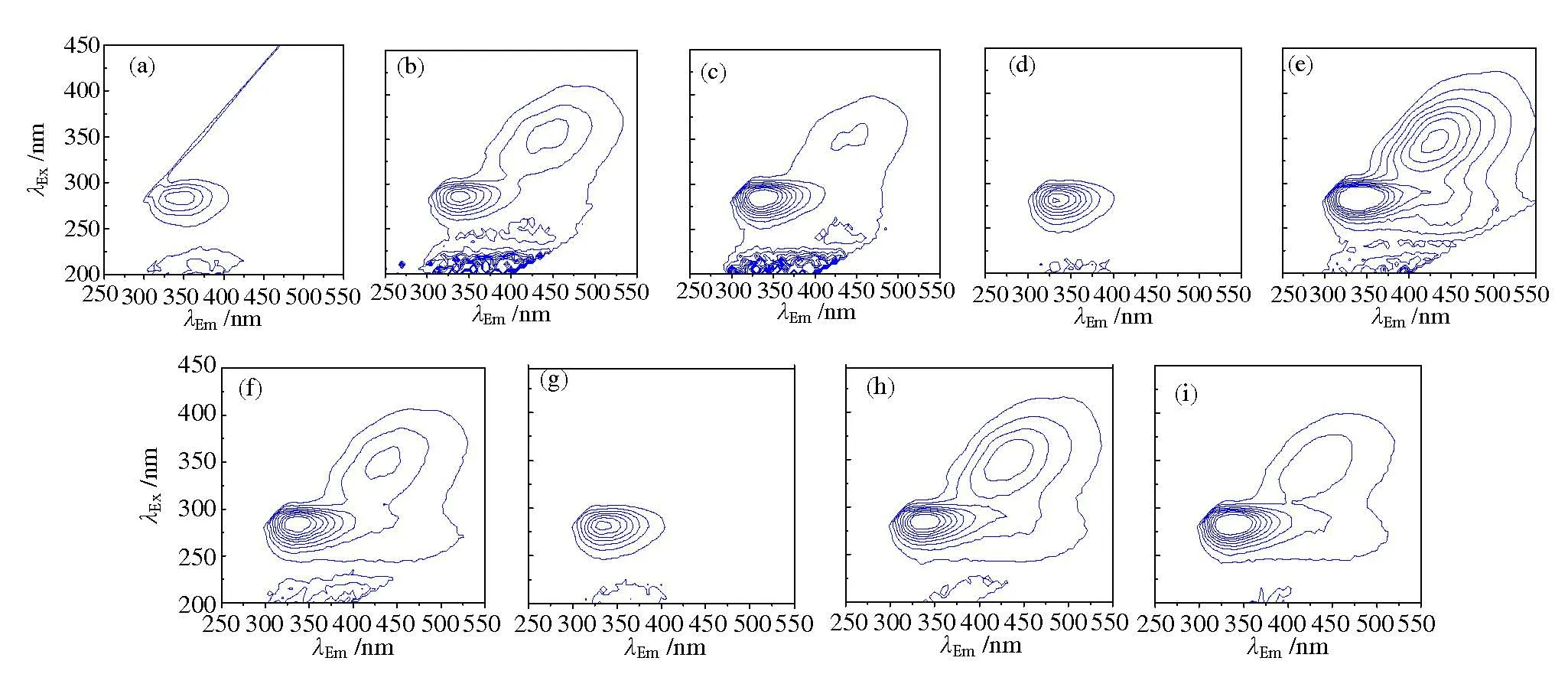
图9 S6菌对不同藻类溶藻产物的三维荧光谱Fig.9 Three-dimensional fluorescence spectra of algae-lysing products of different algae dissolved by algicidal bacterium S6
3 讨论
本研究以本课题组筛选到的高效溶藻菌S6 为研究对象,以铜绿微囊藻和斜生栅藻为供试藻种,以各溶藻体系中的藻细胞浓度、叶绿素a 浓度、氨氮、总磷为指标,监测不同浓度的溶藻菌S6 对不同藻类的溶藻过程。当两种藻分别与不同浓度溶藻菌S6单独培养时,各实验组中的藻细胞浓度与叶绿素a含量呈下降趋势;混合藻分别与不同浓度溶藻菌S6混合培养时,各处理组中藻细胞浓度和叶绿素a含量均下降,而空白对照组中藻细胞浓度和叶绿素a含量均上升。可见,S6对两种藻的溶藻效果较佳,并可初步判断溶藻菌S6对混合藻也有一定抑藻效果。许蓝心等[21]研究表明,铜绿微囊藻和斜生栅藻共培养相互会产生抑制效应,本研究中溶藻效果是混合藻之间的抑制作用还是溶藻作用,下一步实验将根据混合藻实验体系中两种藻细胞的具体占比来探究。陈东等[22]发现,侧孢短芽孢杆菌(Brevibacillus laterosporus)对铜绿微囊藻的去除率可达到89.55%;金黎[23]探究4 株从富营养化水体中筛选出的高效溶藻菌株G3 (Aeromonas)、B2 (Cellulomonas)、P1 (Micrococcus cohn)、P2 (Flavobacterium bergey)对不同藻种的溶藻性能和影响因素时,发现菌液投加量会影响溶藻效果;Su 等[24]研究溶藻菌的溶藻率与菌液浓度的关系,结果也与本研究一致。
氮磷是反映水体富营养化程度重要指标之一。本研究中,经不同浓度菌液溶藻14 d 后,各处理组的NH3-N 浓度整体上呈下降趋势,氨氮去除率与菌液浓度成正比,且混合藻中去除率低于两种纯藻,这可能与藻类间竞争有关,具体原因有待进一步探究。TP 浓度变化趋势同NH3-N,但去除率与菌液浓度无直接关系,低浓度菌液处理组中TP浓度下降可能与藻类自身繁殖需要有关,高浓度菌液组TP浓度下降可能受溶藻菌S6 影响。因此,溶藻菌S6 对NH3-N 和TP 有一定的去除效果。刘萍等[25]利用溶藻菌生物膜中动态膜生物反应器自身的脱氮除磷优势降低水体中氨氮含量时发现,溶藻菌对氨氮去除率最高为73.84%,与本研究结果(氨氮最高去除率为79%)相比略低,这可能是由于反应器内微生物系统对氨氮的利用能力已趋于饱和,但其TP去除率高达86.79%,比本研究约高30%。徐晨岚[26]发现Shigellasp.H3 和Alcaligenessp.H5 两株细菌也有脱氮和溶藻双重作用。马民[27]发现在贫营养好氧反硝化培养基中活化3 d 后的菌液对氨氮的去除率可达86.98%。与文献[25-27]的菌株相比,本研究的溶藻菌S6 对NH3-N 去除效果较高,而除磷效果较低,本课题组将进一步优化溶藻菌S6培养条件,以利于提高溶藻菌S6除磷效果。
随着微生物控藻研究的深入,在溶藻细菌筛选鉴定的基础上,将光谱分析技术应用于藻类有机物(包括胞外有机物和胞内有机物)分析[28-29]。曾滟[30]在研究菌藻共生培养时用紫外分光光度法测定藻类680 nm处光密度,用以表征藻密度及藻的生长情况。孔赟等[31]发现,铜绿微囊藻经溶藻菌株Streptomycessp.HJC-D1 溶藻前后的红外光谱峰形也十分相似。溶藻菌S6分别与铜绿微囊藻、斜生栅藻以及两者混合藻共培养时,不同处理组藻液的紫外光谱图呈相似的下降趋势,表明各藻液中叶绿素a 等物质浓度均下降,且存在类似的溶藻有机物,处理组藻液的紫外吸收峰峰值比对照组小,并随着菌液浓度的降低,各组间的差异逐渐减小。当3 种实验体系的溶藻产物经红外光谱扫描后,藻细胞结构中N—H、CH2、C—O、—NO2、C—H、C—N 等键断裂,可知在溶藻过程中,藻细胞内多糖、氨基酸、蛋白质类物质结构可能被溶藻产物破坏,藻细胞破裂,细胞质被吸收,溶藻产物被释放出来。对比不同浓度菌液的红外吸收曲线,原菌液吸收峰的透过率最低,光密度最强,说明原菌液的溶藻产物浓度最高,溶藻效果最强。由各溶藻体系的三维荧光图谱可知,溶藻菌S6 作用于铜绿微囊藻的DOM 中含类色氨酸、类富里酸物质,斜生栅藻的DOM 中含有类色氨酸和类腐殖酸物质,其中类富里酸和类腐殖酸物质仅在处理组被检测出,且原菌液的荧光强度大于其10倍稀释液。由上可知,溶藻菌S6破坏了铜绿微囊藻和斜生栅藻细胞,并释放了藻细胞胞内有机物,铜绿微囊藻溶解产物初步推断为类色氨酸、类富里酸和类腐殖酸物质,斜生栅藻溶解产物为类色氨酸和类腐殖酸物质,且菌液投加量越高,藻细胞破坏和降解程度越严重。董小娜等[32]运用三维荧光图谱结合平行因子模型分析溶藻菌R1(Lysinibacillus macrolides)溶藻产物时发现,主要溶藻产物为长波类色氨酸物质。卢露等[33]应用三维荧光技术研究溶藻菌EA-1(Enterobacter)对铜绿微囊藻溶藻产物胞外溶解性有机物组成变化时结果也与本研究一致。
4 结论
1)不同浓度溶藻菌S6对铜绿微囊藻、斜生栅藻以及混合藻均有溶藻效果,且菌液浓度越高,溶藻效果越好。
2)高浓度的溶藻菌S6 对氨氮和总磷具有一定去除能力,但除磷效果不如脱氮。
3)不同处理组溶藻产物的DOM 光谱学特征研究表明,铜绿微囊藻的DOM 以类色氨酸、类富里酸和类腐殖酸为主,斜生栅藻的DOM 以类色氨酸和类腐殖酸物质为主,随着溶藻菌液浓度的上升,类色氨酸、类富里酸和类腐殖酸物质的强度呈增加趋势。
