湖南省不同品种公猪精液品质及运动性能的研究
2024-01-26刘海林朱立军张翠永阳享元肖斌华陈方志李瑾林朱建军
刘海林,朱立军,张翠永,阳享元,肖斌华,陈方志,李瑾林,朱建军
1.湖南光大牧业科技有限公司,长沙 410131;2.湖南省畜牧兽医研究所,长沙 410131;3.湖南省绥宁县动物疫病预防控制中心,湖南绥宁 422600;4.湖南省宁乡市动物疫病预防控制中心,湖南宁乡 410600
俗话说:“母猪好,好一窝;公猪好,好一坡”,这形象地体现了公猪在整个猪场中的地位和价值。公猪精液品质是人工授精中最重要的因素之一,直接影响母猪受胎率和产仔率等[1],故每次采精稀释后要进行质量检测,为精液稀释、保存和利用等提供依据。本试验从影响受精力相关程度较大的指标,如精子活力、精子畸形率以及精子运动轨迹等参数来分析不同品种的猪精液品质,为猪场的精液检测和公猪饲养管理提供参考。
1 材料与方法
1.1 数据来源
本试验数据来源于湖南省32 个生猪良补县的公猪站,在2021 年4 月—2022 年11 月,共采集51 批次247头成年公猪(长白猪73头、大白猪75头、杜洛克猪99 头)的鲜精。每个公猪站提供3~5 头不同品种(长白、大白和杜洛克)公猪精液稀释后的产品,每头2 份,装入17 ℃恒温保存箱,严格按照运输要求送至湖南光大牧业科技有限公司精液检测实验室进行检测。
1.2 检测设备
精子质量分析系统(AndroVision Minitube/德国)、相差显微镜(蔡司)、电子天平、恒温保存箱、恒温水浴锅、恒温预热板、血球计数板、载玻片、盖玻片和移液枪等。
1.3 检测指标与方法
1)精液体积:用电子天平称量精液质量,按照1 g:1 mL的比例换算成精液体积。
2)精子活力和运动轨迹参数。采用精子质量分析系统(CASA)测定精子活力和运动轨迹参数。先将17 ℃精液样品轻轻摇动均匀,用移液器分别吸取3 个液层中的精液各10 μL 置于载玻片上并加盖玻片,在37 ℃条件下预热1~2 min,用CASA获取视野中的精子活力和运动轨迹参数,取平均值。其他精子运动轨迹参数的计算方式与精子活力相同。
精子活力计算公式如下:
M=(n1+n2+n3)/3
式中:M为活力,单位为%;n1,n2,n3为3 个液层中的活力值。
3)精子密度。采用血细胞计数法测定精子密度。①制样:吸取3.95 mL 3.0%氯化钠溶液于5 mL EP 管中,取50 μL 待测精液样品与3.95 mL 3.0%氯化钠溶液充分混合均匀,制成试样。②点样:用盖玻片将血球计数板计数室盖好。吸取10 μL试样置于血球计数板一端计数室的边缘,让试样自行流入,使其充满计数室,计数室内不应有气泡。用同样方法在血球计数板另一端计数室点样后,静置约5 min。③观察:将点好样品的血球计数板置于载物台上,在100 倍的条件下观察。④计数:采用边观察、边计数的方法,用计数器清点计数室的精子个数。每个计数室观察5 个中方格,5 个中方格分别为计数室的左上角、右上角、正中间、左下角和右下角。精子计数均以精子头部所处的位置为准,每个中方格内的精子均为计数范围,方格压线的精子计数遵循“数上不数下,数左不数右”的原则。分别记录2 个计数室5 个中方格的总精子数,并取其平均值,记为Ti。
精子密度计算公式:
D=Ti×80×5×104
式中:D为精子密度,单位为个/mL;Ti为2 个计数室中5个中方格总精子数的平均值,单位为个;80为精液稀释倍数;5 为5 个中方格精子数转换成25个中方格的倍数;104为25 个中方格中精液体积为0.1 mm3转换成1 mL的倍数。计算结果保留至小数点后2位,若2个计数室中5个中方格总精子数之间的绝对差值大于5个,则应重检。
4)精子畸形率。精子畸形率采用姬姆萨染色法(即仲裁法)。①吸取10 μL 样品滴于载玻片一端,用另一边缘光滑的载玻片与有样品的载玻片呈约35°夹角,先浸润与样品接触的边缘向另一侧缓慢推动,将样品均匀地涂抹在载玻片上,自然风干(约 5 min),每个样品制作2 个抹片;②将风干后的抹片浸没于放有姬姆萨染液的染缸中,染色15~30 min 后用水冲去染液,晾干制成染片,待检;③将染片置于400倍下观察,观察顺序为从左到右、从上到下。根据观察到的精子形态,按表1 要求判定正常精子和畸形精子,且一边观察,一边用计数器计数,累计观察约200 个精子,分别记录精子总数和畸形精子总数,拍照保存该样品的图片。

表1 精子形态判定
精子畸形率计算公式:
式中:Ai为畸形率,单位为%;A0为观察精子总数,单位为个;A为观察畸形精子总数,单位为个。计算结果保留至小数点后1 位,用2 个平行样的平均值表述样品检测结果。若2个平行样计算结果之间的绝对差值大于6.0%,则应重检。
5)有效精子数。有效精子数(个/剂)=精液体积(mL)×精子密度(个/mL)×精子活力(%)×(1-精子畸形率)(%)。
1.4 数据统计
数据统计采用Excel 2021 处理,分析采用SPSS 18.0软件,检测数据以“平均值±标准差”表示。
2 结果与分析
2.1 不同品种公猪间的常规精液品质比较
由表2可知,不同品种公猪间的精子活力有一定的差异,但差异不显著,顺序为大白猪>长白猪>杜洛克猪;不同品种间的畸形率和剂量均无明显差异;每剂中长白猪的前向运动精子数要高于杜洛克猪和大白猪。
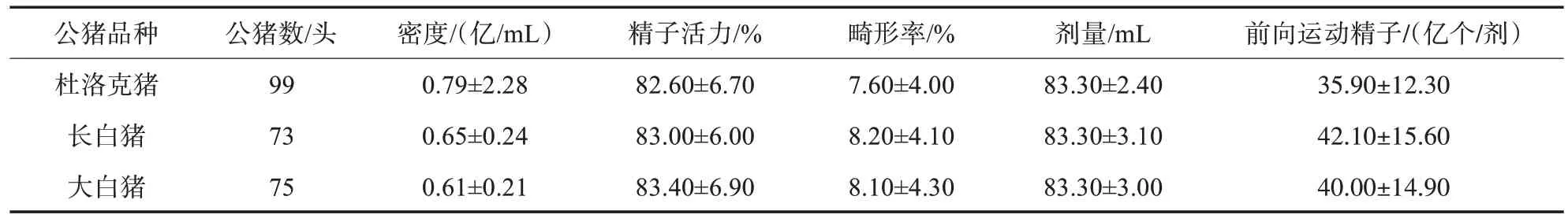
表2 不同品种公猪间的常规精液品质
2.2 不同品种公猪间的精子运动性能比较
由表3可知,不同品种公猪的精液中,长白猪精子的缓慢比例显著高于杜洛克猪和大白猪,长白猪精子的直线加速比例低于杜洛克猪和大白猪,差异不显著;长白猪精子的局部比例高于杜洛克猪和大白猪,差异不显著;长白猪精子的转圈比例显著低于杜洛克猪和大白猪;长白猪的不动比例低于杜洛克猪和大白猪,差异不显著。
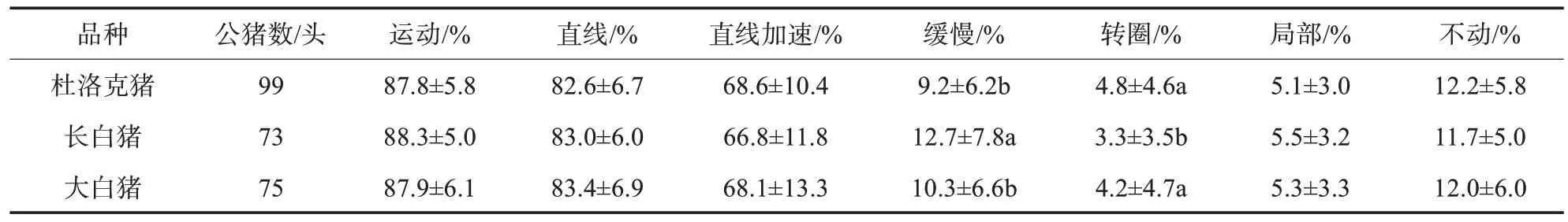
表3 不同品种公猪间的精子运动性能比较
3 讨论
近年来,随着生猪人工受精技术的日趋成熟和生猪养殖技术的提升,对精液品质的要求也相应提高,国家也更新了相应的标准:《猪常温精液》GB 23238—2021 和《猪常温精液生产与保存技术规范》GB/T 25172—2020。这些标准涉及到公猪精液采集、稀释、保存以及成品的质量要求等细节。GB 23238—2021 中明确规定公猪精液经稀释后的成品质量要求为:剂量≥80 mL,精子活力≥60%,精子畸形率≤20%,前向运动精子数≥18×108个(受体为引入品种或培育品种,常规输精)。按照GB 23238—2021 的要求,本研究检测了湖南省杜、长、大3 个引入品种公猪精液质量中的常规指标,结果表明,不同品种公猪精液的活力和畸形率均无显著差异。
畸形精子通常是指形态和结构异常的精子,分为头部畸形、颈部畸形、中段畸形和主段畸形等,其产生原因分为原发性、继发性畸形以及三级异常3种情况。一般优良品质的公猪精液中畸形率不超过14%~18%;如果精子畸形率超过20%(GB 23238—2021),则会影响精子的受精能力,必须废弃[2-3]。本试验发现,部分公猪精液在保质期内的精子畸形率偏高(接近20%)。通常情况下,随时间推移,精子畸形率会继续提高;在人工受精时,这部分公猪精液的品质达不到国家标准,从而导致母猪无法受孕。本研究发现,精子畸形主要表现为尾部的远端原生质滴数量偏多,其次为折尾和断尾。原生质滴是精子成熟过程中原生质的残留物,精子在成熟移行过程中原生质滴从精子颈部移动至中部,射出的精液中成熟精子已脱掉原生质滴。尾部远端原生质滴的发生为继发性异常,通常出现在附睾尾中;精子的卷尾和断尾为三级异常。这些畸形的发生可能是在精液处理过程中,精子受挤压等因素的刺激而形成。有研究[2-4]表明,一些原发性因素引起的精子畸形对受胎率的影响弱于继发性和三级异常。
精子质量分析系统(CASA)是1 种对显微摄像的计算机运动图像进行自动分析的技术,可快速客观测定精子密度、活率和形态等指标,还能提供一系列精子运动参数的量化数据。精子运动参数是精子运动能力的体现,可以直接反映精子质量;精子迁移率高,意味着精子通过雌性生殖道到达受精部位的时间相对而言要快。有研究认为,精子运动能力与受胎率具有一定的相关性[5]。在本试验中,长白猪精子的缓慢比例显著高于杜洛克猪和大白猪,同时长白猪精子的直线加速比例低于杜洛克猪和大白猪,但差异不显著,这说明长白猪精子的迁移速率低于杜洛克猪和大白猪。长白猪精子的转圈比例显著低于杜洛克猪和大白猪,同时长白猪精子的不动比例低于杜洛克猪和大白猪,但差异不显著,这表明长白猪的前向运动精子数的比例高于杜洛克猪和大白猪,这与表2 中每剂长白猪的前向运动精子数高于杜洛克猪和大白猪的结果一致。
在实践生产中,公猪的遗传基因、营养与管理、年龄与采精频率到精液采集、稀释、保存和运输等环节均能影响精液品质。因此,建议从以下几个方面进行改进:①品种方面,引进有系谱档案的合格公猪;选留时及时剔除有遗传缺陷的血统,并淘汰性能差的老龄公猪(4岁以上)和无法正常采精的公猪。②营养与管理方面,保证猪舍环境温度(17~25 ℃)和充足的运动场所;合理调节公猪体膘,保证公猪体况健康;保持5 d/次的采精频率。③人员管理方面,对相关人员进行有效的培训、沟通和监管,以确保采精、稀释、保存以及运输等环节落实到位,从而提高每批次精液合格率[1,6-8]。
