隆突性皮肤纤维肉瘤的影像表现及临床病理特征
2024-01-25熊瑶尚柳彤李文华段红莉周中华李天然
熊瑶,尚柳彤,李文华,段红莉,周中华,李天然
隆突性皮肤纤维肉瘤(dermatofibrosarcoma protuberans,DFSP)是一种起源于真皮和皮下组织的低度恶性肿瘤,约占软组织肉瘤的1.8%~6.0%,具有生长缓慢但局部侵袭性强、术后易复发但较少远处转移的特点[1-2]。DFSP多表现为突出于皮肤的质韧结节或肿块,表面多呈紫红色或肤色[3],部分可伴有溃疡或邻近皮肤色素沉着,首次就诊时多被误诊为良性肿瘤而行单纯肿物切除,忽略其无包膜及向周围组织侵袭的生物特点,导致术后复发率约24%~60%[4]。本研究回顾性分析35例DFSP的CT、MRI影像表现及病理特征,以提高对其精准定性及浸润范围评估的能力,有助于临床制定合适的治疗方案,进而降低术后复发率。
材料与方法
1.病例资料
搜集2012年1月至2021年5月间中国人民解放军总医院第四医学中心经手术病理证实的35例DFSP患者,回顾性分析其临床及CT、MRI影像学资料。35例患者中9例(9个病灶)为原发性DFSP(全部单发),26例(31个病灶)为复发性DFSP(22例单发,4例多发);男22例,女13例,年龄18~56岁,中位年龄36岁。临床上均以皮肤结节或肿块就诊,病程3个月~40年,9例病变颜色加深呈暗红色或紫红色,8例有轻度压痛,2例病变表面有破溃伴瘙痒,16例病灶近期略增大或明显增大。其中1例复发型DFSP发生双肺及盆腔远处转移。
2.检查方法
35例患者中,11例行CT检查,其中5例行增强检查;31例行MRI检查,其中16例行增强检查,1例行动态增强检查,18例同时行DWI检查。
CT检查采用Philips Brilliance 128排256层iCT,管电压120 kV,管电流160 mAs,层厚及层间距5 mm,重建层厚及层间距1.25 mm,增强扫描采用双筒高压注射器注入对比剂碘佛醇(剂量1.5~2.0 mL/kg),注射流率4.0 mL/s,延迟30 s、60~70 s后分别采集动脉期及静脉期图像。
MRI检查采用Siemens 3.0T Skyra超导磁共振扫描仪,根据不同部位选择不同线圈,行T1WI、T2WI-FS、T1WI增强及DWI序列扫描,b值取0、800 s/mm2,增强扫描采用对比剂Gd-DTPA,剂量0.2 mmol/kg,采用高压注射器以1.5 mL/s流率经肘静脉团注,再以生理盐水20 mL冲管。
3.图像分析
研究表明,不同国家、不同时期的胰腺炎病因谱存在一定的差异。在我国胰腺炎的主要病因为胆道系统疾病,而在欧美及西方发达国家则以饮酒和暴饮暴食为主要病因。鉴于此,本研究应用时间序列分析方法探讨改革开放30年来尤其是近20年山东聊城市人民医院收治的急性胰腺炎(AP)患者的病因,为该地区胰腺炎的预防和治疗提供决策支持。
所有图像由两位分别具有7年和10年诊断经验的影像科医师共同阅片分析,意见不一致时经协商达成一致。主要评估指标包括病变位置、数目、大小(以病灶长径为准)、形态(类圆形、梭形、不规则形)、边界(清楚、不清楚)、内部密度或信号(以邻近肌肉作为参考标准)、双低信号征(T1WI及T2WI病灶内可见条带状低信号区域)、强化特点、瘤周浸润及远处转移情况(“皮肤尾征”、“脂肪尾征”及“筋膜尾征”为病灶呈鼠尾状向邻近皮肤、皮下脂肪层及筋膜层浸润)。
4.手术及病理学检查
机遇与挑战并存,困难和希望同在。虽说我国氮肥工业面临着挑战,但同时也面临着新的发展机遇。党的十九大提出“生态文明”“绿色发展”“坚持人与自然和谐共生”等新的发展理念和发展原则,将给氮肥行业的发展带来深远影响。“氮肥行业拥有煤炭清洁高效利用技术,在协同处理有机废物方面作出了有益探索。抓好氮肥的绿色发展、节能环保工作,不仅有助于行业本身的可持续发展,也将对其他行业的废弃物处理和提高全社会的资源利用率做出贡献。”顾宗勤欣慰地说。
CT表现:11例DFSP患者行CT平扫,9例密度较均匀,与邻近肌肉相比呈等或稍低密度(图1~2),平扫CT值为27~56 HU,1例病灶体积大并内部出现囊变、坏死区域(图2),1例病灶内可见钙化。5例行CT增强检查,1例病灶体积较小,增强呈轻中度均匀强化,4例动脉期呈轻中度不均匀强化,静脉期呈持续性强化,较大病灶内部囊变、坏死区不强化,瘤内和/或瘤周多发迂曲血管显示(图2)。病灶多边界欠清,并可见向周围侵袭征象,其中9例见“皮肤尾征”(图1a),8例见“脂肪尾征”(图1b、2a),7例见“筋膜尾征”。本组病例中1例复发DFSP发生双肺及盆腔多发转移(图4),肺部转移灶CT平扫表现为双肺内多发结节及肿块,边界清楚,较小病灶呈类圆形,较大病灶呈浅分叶状改变,密度较均匀,CT值约45 HU。
DFSP好发于20~50岁中青年,男性发病率略高于女性[5]。本组病例诊断时中位年龄为36岁,男女比例为1.7:1,与文献报道相符。该病可发生于全身任何部位,但以躯干、四肢居多,偶尔可发生于头面部及乳腺[6]。本组病例发生于躯干21例,四肢10例,头面部4例,与文献报道相符。肿瘤生长缓慢,病程可长达数月至数十年不等,但肿瘤可沿真皮及皮下组织浸润性生长,邻近筋膜、肌肉组织及骨骼可受侵。手术切除是DFSP首选治疗方案,但单纯的肿物切除后复发率较高,本组病例中26例复发,因此临床更需重视术前影像诊断及浸润范围评估,采取广泛扩大切除术(切缘距离病灶边缘≥3 cm)及术后辅助放疗可有效降低复发率[7]。Martin等[8]报道莫氏显微外科手术(Mohn micrographic surgery,MMS)可最大限度保留正常组织且显著降低术后复发率。
结 果
1.病灶位置、数目、形态、大小
35例患者中,31例(88.6%)单发,3例有2个病灶,1例有3个病灶,共40个病灶;34例(97.1%)病灶位于皮肤或皮下脂肪层,1例位于浅筋膜下层;发生于头面部4例(头部3例,面颊部1例,占11.4%),躯干21例(腹部7例,背部9例,肩部1例,锁骨上区1例,胸壁1例,腹股沟区1例,臀部1例,占60%),四肢10例(上臂3例,前臂2例,大腿1例,小腿2例,踝部2例 ,占28.6%)。2个病灶呈类圆形,11个病灶呈梭形,27个病灶呈不规则形,其中14个病灶表面可见一个或多个结节状突起,表现为“子结节外突征”,23个病灶合并多结节融合改变,表现为“多结节征”,5个病灶悬吊于皮肤外,表现为“悬吊征”。病灶长径1.3~18.6 cm,平均5.1 cm。40个病灶中12个直径<3 cm,12个直径3~5 cm,16个直径>5 cm(表1)。
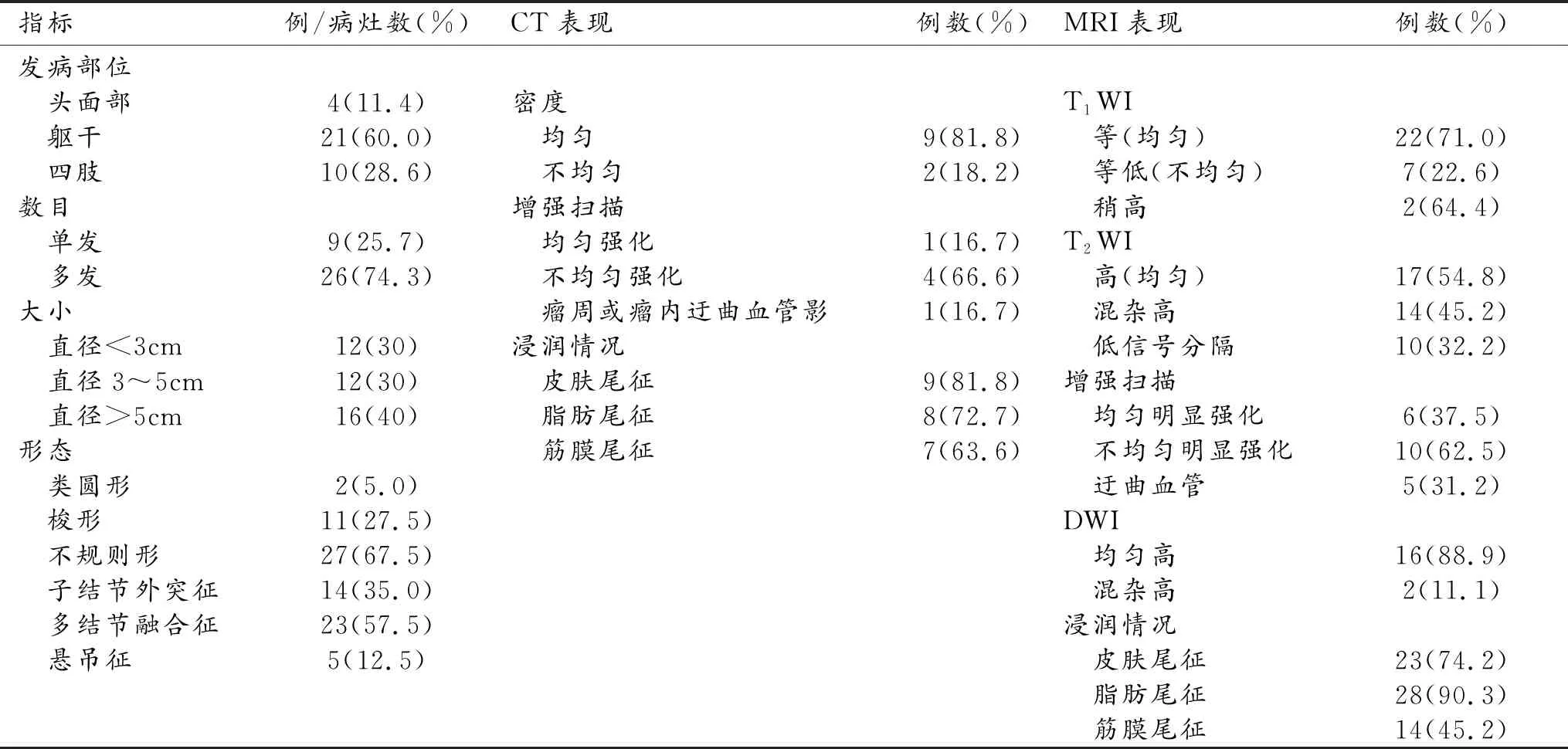
表1 35例DFSP (40个病灶)的影像学特征
2.影像学表现
例如:在《正方形、长方形面积的计算》一课的课堂教学过程中,我就是以小组合作教学的方式展开数学课堂教学活动的。
据介绍,每一个合作的农户或种植基地,农拓者都会安排专业人员对土壤进行分析,收集历年作物生长、天气变化等大量数据,在大数据的基础上量身打造出覆盖种、肥、药和田间管理等多方面的全程种植解决方案,并在种植过程中进行监督化的跟踪管理。在这种模式下,农民的种植水平得以提升,避免了肥药的浪费和无效施用,精准的病虫害解决方案保障了作物健康,促进了农民增产增收,交出了辣椒亩产增幅30%、番茄亩产增幅40%、其他作物均有不同比例增产的答卷。

图1 右前下腹壁经典型DFSP患者,女,38岁。a) CT平扫示右前下腹壁不规则软组织密度肿块,边界较清,大小约9.9 cm×5.4 cm×11.1 cm,CT值约35 HU,邻近皮肤略增厚(箭);b) CT平扫冠状面重建图像,肿块呈多结节融合状改变,病灶沿邻近脂肪层浸润,呈“脂肪尾征”(箭);c) T1WI示肿块呈等信号,形态不规则呈多结节融合状改变; d) T2WI示肿块呈不均匀高信号,其内可见低信号分隔影(箭头),并可见病灶沿邻近脂肪层及浅筋膜浸润,呈“脂肪尾征”(长箭)、“筋膜尾征”(短箭);e) T1WI增强扫描示肿块呈不均匀明显强化,邻近皮肤略增厚并强化(箭); f) MRI动态增强扫描曲线呈上升型;g) DWI示肿块呈高信号; h) ADC图示病灶信号减低,ADC值约为1.072×10-3mm2/s;i) 镜下可见长梭形密集排列的肿瘤细胞,局部排列呈“车辐状”,瘤细胞包裹脂肪细胞(×200,HE)。
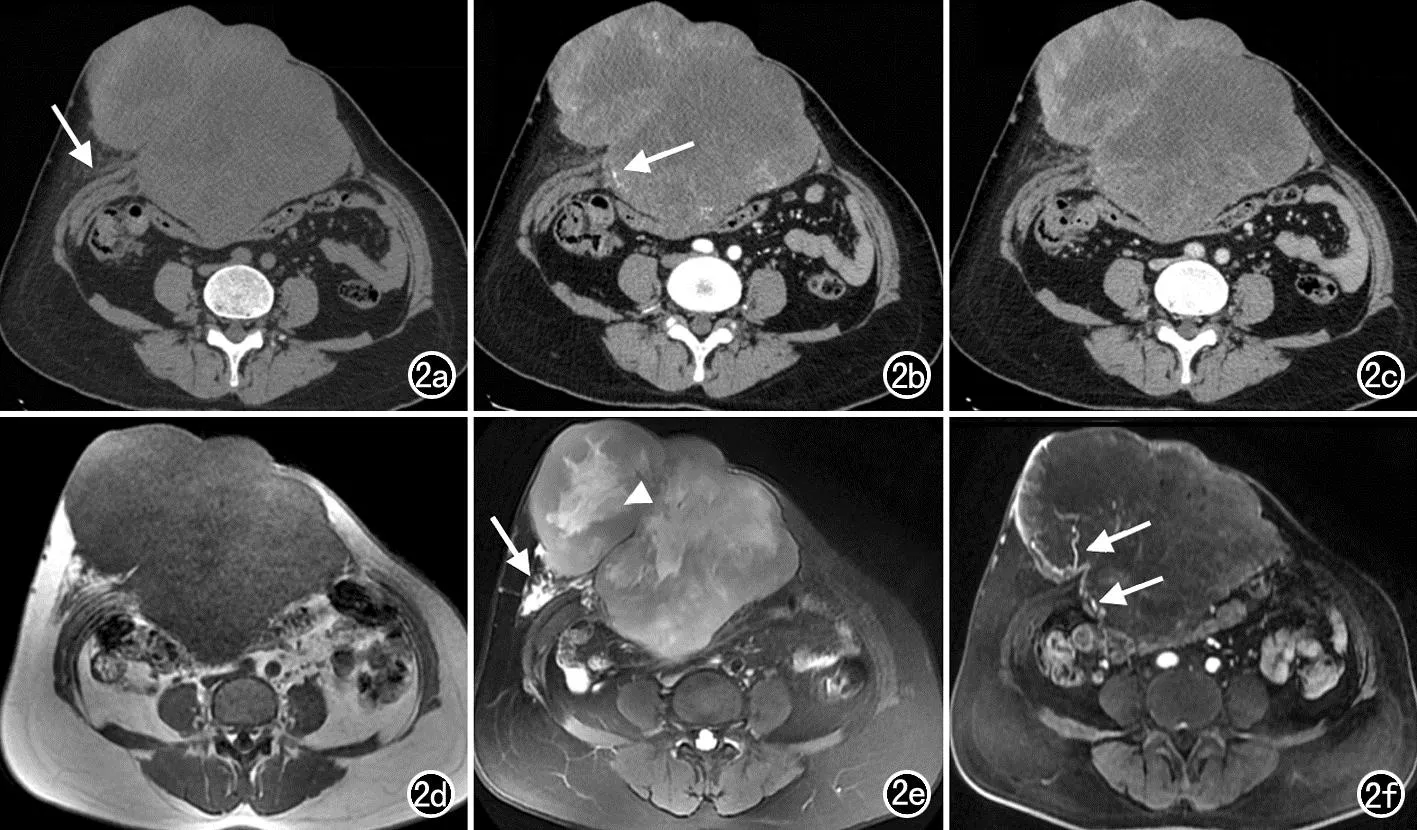
图2 前下腹壁纤维肉瘤型DFSP患者,女,53岁。a) CT平扫示前下腹壁分叶状巨大软组织密度肿块,边界较清,病灶侵犯腹壁肌肉并局部突入腹腔,中心大片状低密度囊变/坏死区,病灶右侧局部可见“脂肪尾征”(箭); b) CT增强扫描动脉期图像,病灶边缘实性成分中度强化并多发小血管显影(箭),病灶中心囊变/坏死区未见强化; c) CT增强扫描静脉期图像,病灶呈渐进性强化方式; d) T1WI示病灶呈等、略低信号;e) T2WI示病灶信号混杂,边缘实性成分呈中等高信号,中心囊变/坏死区呈高信号,其内局部可见低信号分隔影(箭头),并可见“脂肪尾征”(箭);f) T1WI增强扫描示病灶边缘局部明显不均匀强化,瘤周及内部多发迂曲小血管影(箭)。
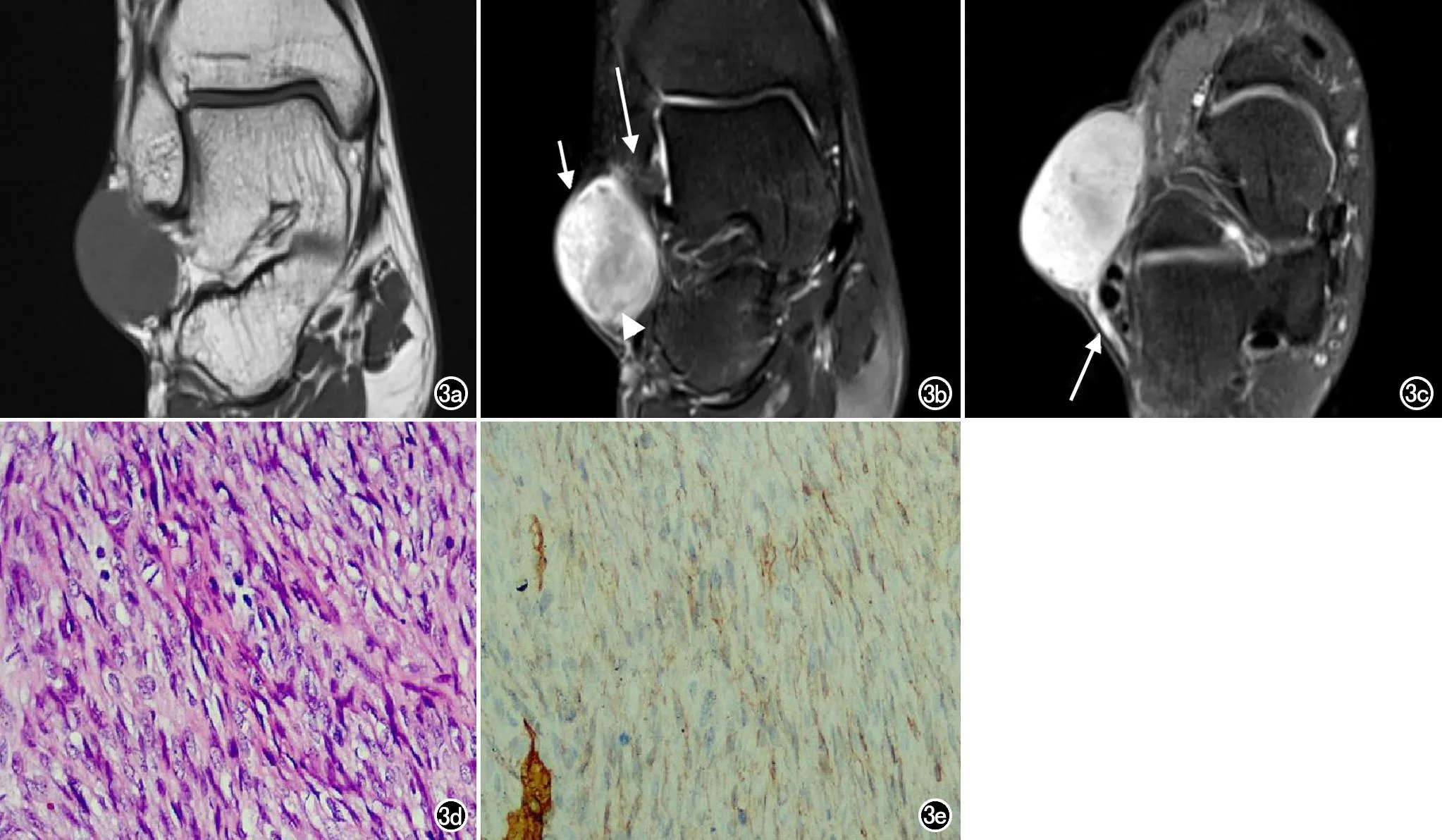
图3 右侧外踝纤维肉瘤型DFSP患者,男,35岁。a)冠状面T1WI示右侧外踝皮下梭形等信号肿块,大小约4.0 cm×2.1 cm×3.3 cm,内部信号较均匀,边界较清楚;b)冠状面T2WI示病灶呈不均匀高信号,内部可见低信号分隔影(箭头),并可见病灶沿邻近皮肤及脂肪层侵犯,呈“皮肤尾征”(短箭)、“脂肪尾征”(长箭);c)轴面T2WI示病灶局部沿邻近筋膜层侵犯,呈“筋膜尾征”(箭);d)镜下示梭形肿瘤细胞呈“席纹状”密集排列,细胞异型性明显(×200,HE);e)免疫组化CD34染色,瘤细胞阳性表达(×200)。
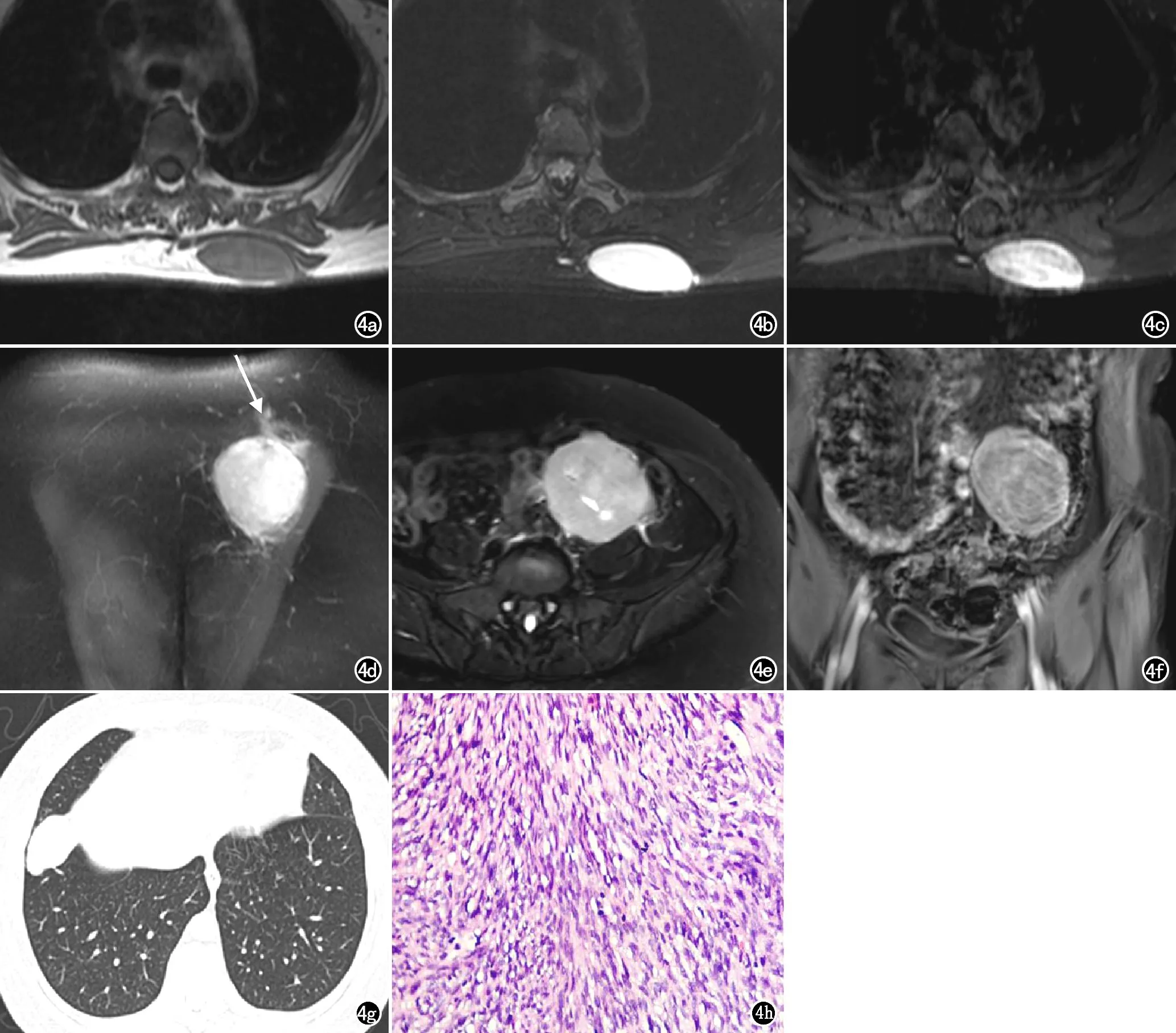
图4 左胸背部皮下经典型DFSP患者,女,51岁。a)T1WI示左胸背部皮下脂肪层梭形等信号肿块,边界清楚,信号较均匀,大小约5.2 cm×2.1 cm×5.2 cm;b)T2WI示病灶呈高信号,信号均匀;c)T1WI增强扫描示病灶呈明显不均匀强化;d)冠状面T1WI增强扫描示病灶强化程度进一步增加,并可见病灶浸润邻近脂肪层,呈“脂肪尾征”(箭);e)轴面T2WI图像,患者术后4年发生盆腔转移,病灶呈混杂高信号,中心可见小斑片状囊变区;f)T1WI增强扫描示病灶呈不均匀轻中度强化;g)CT平扫图像,患者术后4年亦发生双肺多发转移,右肺下叶近斜裂处肿块,边界清楚,呈浅分叶状,密度均匀;h)镜下示密集排列的梭形肿瘤细胞(×200,HE)。
大体表现为肿物常起源于真皮层及皮下,呈多结节状或不规则形,质中,无包膜,切面呈灰红色或灰白色,部分病灶伴局灶出血、坏死,并可见肿瘤细胞呈蜂窝状侵犯皮下脂肪层。本组28例诊断为经典型DFSP,镜下典型表现为弥漫分布的单一梭形肿瘤细胞围绕胶原纤维或间质血管呈“轮辐状”排列,细胞无明显异型性,核分裂像少见(图1i、4h)。6例为纤维肉瘤型DFSP,肿瘤细胞异型性较明显(图3d),核分裂像多见,排列方式呈“鱼骨样”,部分可见囊变坏死区。1例为黏液型DFSP,肿瘤细胞排列稀疏,伴大量黏液成分聚集在细胞外间质。免疫组化:除2例纤维肉瘤型DFSP病理标本CD34染色呈阴性外,其余33例CD34染色阳性,Vimentin染色阳性率为74.3%,S-100蛋白、CK染色阴性率分别为91.4%、77.1%。
3.病理结果
MRI表现:31例DFSP行MRI检查,22例T1WI呈较均匀等信号,7例呈等、稍低信号(图1~4),2例呈略高信号,其中3例病灶体积较大,中心可见小片状高信号;T2WI-FS序列上,17例呈均匀高信号,14例呈混杂高信号(图1~4),其中10例病灶内可见条形低信号分隔(图1d、2e、3b),该区域在T1WI序列上有时亦呈低信号,呈“双低信号征”。16例行增强扫描,6例瘤体较小,增强呈较均匀明显强化,10例呈不均匀明显强化(图1~2),其中3例复发病灶体积较大,病灶中心可见斑片状无强化囊变、坏死区,5例病灶内部和/或周边可见增粗流空血管影(图2)。本组有1例经典型DFSP病例行动态增强扫描(图1),增强呈渐进性不均匀强化,其动态增强扫描曲线呈上升型(图1f)。16例DWI(b=800 s/mm2)呈较均匀高信号(图1g),2例肿瘤体积较大,病灶边缘实性成分呈高信号,中心坏死囊变区呈低信号,ADC图上10例呈均匀低信号,8例呈不均匀低信号(图1h),ADC值范围为0.798×10-3~1.393×10-3mm2/s。T2WI-FS序列可较清楚显示病灶向周围浸润情况,其中23例可见“皮肤尾征”(图3b),28例见“脂肪尾征”(图2e、3b),14例见“筋膜尾征”(图3c)。1例发生于左肩部的复发型DFSP,病灶体积较大,可见邻近肩峰骨质受侵,于T2WI-FS序列上呈斑片状高信号。
所有患者均行手术切除,标本经10%中性福尔马林固定,石蜡包埋,切片后HE染色,并在高、低倍镜下观察。免疫组化染色主要抗体包括CD34、CD68、Vimentin、S-100蛋白、EMA、CK、Ki-67。
讨 论
1.临床及病理特点
舟曲泥石流发生的原因是多方面的、复杂的,但是不可否认,生态环境的破坏是重要原因之一。舟曲县农民通过大规模开垦坡地来增加土地面积,40°以下的坡地已被开垦完毕,山体植被遭到严重破坏,大量树木被砍伐,水源涵养能力差,都加剧了泥石流灾害程度。
DFSP是一种发生于皮肤或真皮层的低级别局部侵袭性软组织肉瘤。在2013年WHO软组织及骨肿瘤分类中,DFSP被归入成纤维细胞/成肌纤维母细胞肿瘤,病理上分为经典型、纤维肉瘤型、黏液型、色素型等多种亚型,以经典型居多[9]。本组病例中28例为经典型,7例为纤维肉瘤型,1例为黏液型。经典型镜下可见大量梭形肿瘤细胞围绕血管呈“轮辐状”排列,细胞异型性不明显,核分裂象少见。纤维肉瘤型肿瘤细胞异型性显著,核分裂像亦多见,因而术后易复发且侵袭性较强。DFSP免疫组化具有一定特异性,90%以上的DFSP患者 CD34和Vimentin表达阳性,S-100蛋白、CK表达阴性[10]。细胞遗传学上,90%以上DFSP患者存在t(17;22)(q11;q13)染色体异位,甲磺酸伊马替尼可作为DFSP的分子靶向治疗药物[4,11,12]。
2.影像征象
形态特征:DFSP病灶多位于皮肤或皮下脂肪层内,呈单发或多个结节融合状生长形成不规则肿块,部分子结节突出于皮肤表面,呈“多结节征”及“子结节外突征”,推测该征象可能与病灶为局部皮肤多中心起源、病灶边缘肿瘤细胞增殖速率差异及病程进展的不同阶段有关,纤维肉瘤型DFSP更易出现此征象[12];本组5例病灶因位置表浅及重力作用悬吊于皮肤外,呈“悬吊征”,此三种征象均为DFSP颇具特征性的形态学改变。
密度/信号特征:CT平扫DFSP瘤体密度多较均匀,且与邻近肌肉相似,少部分病灶呈略低密度,但密度仍较均匀,部分复发型病例瘤体较大,可呈分叶状巨大肿块突出体表,其内部可有不同程度囊变、坏死区,但钙化罕见。MRI更有利于显示病灶影像特点,能更准确评估肿瘤的大小和范围,以及与邻近神经肌肉、骨骼的关系[13],因而MRI多被推荐用于术前定性、手术计划和复发随访。MRI平扫中T1WI病灶多呈等、稍低信号,部分呈稍高信号,代表病灶内局部微出血;T2WI-FS多呈均匀或混杂高信号,混杂信号反映病灶内不同组织成分,稍高信号代表肿瘤细胞密集区,高信号对应囊变坏死区,低信号反映肿瘤间质内丰富的纤维基质成分或致密结缔组织[14],本组10例病灶内部可见条片状T1WI、T2WI序列均呈低信号区域,呈“双低信号征”,亦作为DFSP另一特征性表现。DWI序列上病灶多呈明显高信号,ACD图多呈低信号,其反映了病灶内细胞排列较密集、富含间质血管及胶原纤维的特点。瘤体CT及MRI强化方式取决于肿瘤细胞密度与纤维基质比例,细胞密度大且血管丰富、纤维基质稀疏,强化多明显,且MRI强化程度多较CT明显,可能与对比剂进入瘤体内速度较慢有关[15]。Mallett等[16]报道复发DFSP恶性程度增加、分化程度更差,瘤体体积更大,内部更易出现囊变、坏死及黏液变性,因而其密度及信号更混杂,强化更不均匀。
瘤周浸润及远处转移情况:DFSP病灶边界欠清楚,并沿周围皮肤、皮下脂肪及筋膜层呈尾状浸润性生长,其密度、信号与肿瘤类似,DWI呈高信号,增强呈鼠尾状强化,分别称“皮肤尾征”、“脂肪尾征”及“筋膜尾征”。本组病例中26例(9例CT,23例MRI)见“皮肤尾征”,32例(8例CT,28例MRI)见“脂肪尾征”,16例(7例CT,14例MRI)见“筋膜尾征”,上述三种征象均为DFSP较为特征性的影像表现[16,17],其病理基础为肿瘤细胞常包裹脂肪细胞及皮肤附属器,并沿着脂肪间隔呈“树根状”生长。有文献报道,复发DFSP较原发DFSP局部侵袭能力更强,更易出现上述三种尾征[17]。本组病例中有1例复发病灶体积较大,内部信号不均,瘤周伴有水肿,且均见上述三种尾征,增强不均匀强化且瘤周多发增粗迂曲血管,病理证实为纤维肉瘤型DFSP,因此临床更需重视术前定性诊断及扩大切除范围的评估。血行转移是DFSP的主要转移方式,常见转移部位为肺、肝及骨骼[18]。本组病例中仅1例胸背部复发DFSP手术切除3次,于首次术后4年发生双肺及盆腔多发转移,盆腔转移灶信号及强化方式不同于原发灶,可能与病灶体积较大,其内部囊变并富含小毛细血管有关,随访过程中均未见淋巴结转移。
3.鉴别诊断
DFSP需与其他皮下浅表部位的软组织肿瘤相鉴别:①皮脂腺囊肿,病变密度较低且无血液供应,增强扫描多数不强化,但合并感染时可呈环形强化。②皮肤纤维瘤,多发生于四肢,躯干部较少见,其形态扁平,局部皮肤常增厚,增强扫描呈轻度强化。③韧带样纤维瘤病,女性好发,常表现为类圆形或不规则形深部软组织肿块,体积多较大,局部可呈触角样向周围组织延伸,亦可见“筋膜尾征”。④神经鞘瘤,边界清楚,在肌间隙内沿神经纵行生长,更易发生变性,可见“神经出入征”及“靶征”[19]。⑤结节性筋膜炎,生长快速,好发于四肢,多位于皮下筋膜层向内或外生长,瘤周可伴有炎性渗出。
综上所述,DFSP多表现为发生于躯干及四肢皮肤或皮下肿瘤,瘤体颜色加深多呈暗红色或紫红色,多突出于体表并缓慢浸润性生长,多伴有子结节外突征、多结节征、悬吊征等特征性肿瘤形态;CT、MRI提示病灶与皮肤分界不清,多伴有皮肤尾征、脂肪尾征及筋膜尾征等瘤周浸润征象,T2WI显示“双低信号”征,血供较丰富,增强呈不均匀渐进性强化。综合分析上述临床资料、影像特点、病理及免疫组化,有助于该病准确诊断、临床手术方案制定及术后复发监测。