三个猪种PPARγ2基因的多态性分析
2024-01-25孙奴奴王美如
孙奴奴,王美如
(运城学院 生命科学系,山西 运城 044000)
杜长大三元杂猪种是以杜洛克猪作为终端父本、长白猪和大约克猪作为终端母本培育而成的商品型猪种,具有生长速度快、适应性好、增重快、饲料报酬高、胴体性能好、瘦肉率高、肉色好等特点,近几年占据着我国90%以上的商品猪市场[1]。晋汾白猪是一种以马身猪、太湖猪(二花脸类群)等国内猪种与长白猪等国外猪种作为亲本[2],经过杂交培育出优良猪种作为终端母本和以大白猪为父本培育出的国家级新型瘦肉型品种猪,具有产仔多、生长快、肉质品质好等优点,已经正式通过了国家畜禽遗传资源委员会的审定,成为山西省首个国家级的猪新品种。新山西黑猪,亦称山西瘦肉型猪新品系(SD-Ⅱ系),是在山西黑猪的基础上,利用基因导入技术引入外国猪种血缘,经过10年的不断选育而形成的新型山西地方猪种,具有生长速度快、产仔性能好、抗病力强、适应性广、抗逆性强、瘦肉率高、肉质鲜美、经济价值高等品种优势,得到了行业和社会的广泛关注和认可,具有良好的商业发展前景[3]。
过氧化物酶体增殖物激活受体(Peroxisome proliferators-activated receptors,PPARs)是一类基因转录子,属于核激素受体超家族,1990年Issemann[4]等首先发现该受体并进行了命名。PPARs基因分PPARα、PPARβ/δ、PPARγ三种亚型,编码产物分别有468、441、479个氨基酸残基。PPARs包含6个区域,从氨基端到羧基端依次为A/B、C、D,以及E/F,其中A/B区为调节区,通过MAPK介导一丝氨酸残基磷酸化提高PPARα的受体-配体亲和力,同时降低PPARγ的活性;C区是DNA结合域(DBD),PPAR通过此结构与DNA上的过氧化物酶体增殖物激活受体反应元件(PPRE)结合从而调节靶基因转录;D区是转录活性调节结构域,许多核内因子与此结构域结合后可影响PPARs的活性;E/F区是配体结合结构域(LBD),该结构域在转录激活过程中起关键作用。PPARα基因在心、肝、肾等代谢活跃器官表达量较高,在脂肪和软骨中表达量较低;PPARβ/δ基因广泛表达于多种器官和组织;而PPARγ基因主要表达于脂肪、血管内皮细胞和平滑肌细胞[5]。
人的PPARγ2基因编码产物具有多种生物学功能,PPARγ2基因与糖尿病患者肥胖[6]、脂肪细胞分化和脂质代谢[7]、胰岛素抵抗和糖尿病[8]等相关,有时对肿瘤有双重作用[9]。近年来,在猪PPARγ2基因方面的研究也有了一定的进展。2012年,梁家充[10]等研究广西巴马小型猪PPARγ2基因第2外显子与2型糖尿病易感性的关系,结果显示PPARγ2基因第2外显子19813A/G突变与广西巴马小型猪血清胰岛素水平和糖耐受性降低有关,19813AG基因型个体T2DM易感性明显高于19813AA基因型个体。2009年,王桂英[11]等采用PCR-SSCP方法对PPARγ2基因的部分序列进行多态性位点检测,结果显示,在5′调控区219 bp处和323 bp处以及exon6的147 bp处各发现1个A→G突变,且与猪产仔数相关。2013年,朱云[12]等利用PCR-RFLP方法对猪PPARγ2基因第一启动子Bsrl位点进行多态性分析,结果显示该位点出现A/G突变,形成b、Bb和B型三种基因型,且与肉质性状相关联。2016年,王顺利[13]等利用PCR-SSCP方法检测大河乌猪PPARγ2基因第2外显子区的多态性,结果显示该位点基因型均为纯合AA型,并未发现多态性。
本研究以这三种猪为研究对象,采用PCR-RFLP方法对PPARγ2基因第一启动子Bsr1位点多态性进行检测与分析,为研究PPARγ2基因及其Bsr1位点多态性对脂肪相关性状的影响提供基础材料,对猪场养殖及优良的猪种选育等提供参考依据。
1 材料与方法
1.1 实验动物
本实验采用由运城新龙丰畜牧有限公司提供的33头杜长大三元杂猪、23头晋汾白猪及33头新山西黑猪的耳组织作为实验材料,分别放入1.5 mL灭菌后的离心管中,然后向放有组织的离心管中加入75%的无水乙醇,使耳组织被完全浸没。将离心管进行标号,然后放入冰盒中带回实验室,放于-20℃冰箱中保存备用。
1.2 主要试剂与仪器设备
基因组DNA提取试剂盒、2×Taq PCRmix、琼脂糖、过硫酸铵、甘油、TEMED、甲醛等(购自北京华越洋生物工程有限公司);引物合成(上海生工生物工程技术服务有限公司);PCR扩增仪(Thermal cycler-2720)(上海宾智生物科技公司);数码凝胶成像分析系统(Tanon-1600)(武汉爱斯佩科学仪器公司);DYCZ-28D双板夹芯式垂直电泳仪,DYY-6C恒温恒压电泳仪(北京六一生物科技有限公司);TGL-16M高速台式冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.3 试验方法
1.3.1 基因组DNA提取及引物合成
使用基因组DNA提取试剂盒提取猪基因组DNA;引物参考朱云[12]的实验进行设计(登录号:AJ006757),并由上海生工生物工程技术服务有限公司合成。
1.3.2 PCR及SSCP
以DNA为模板进行PCR扩增,10μL反应体系为:DNA(0.5μL),上游引物(0.2μL),下游引物(0.2μL),2×Taq PCR Master Mix(5μL),双蒸水(4.1μL);PCR反应程序为:预变性95℃,5 min,94℃变性30 s,52.6℃退火30 s,72℃延伸30 s,35个循环,72℃后延伸5 min;用限制性核酸内切酶(Bsr 1)酶切经1.5%的琼脂糖凝胶电泳检测扩增成功的PCR产物,酶切反应体系总体积为15μL,其中PCR产物10μL,10×Buffer R1.5μL,双蒸水3.5μL,Bsr 1酶0.1μL,将酶切反应体系混匀,于37℃下放置消化4 h,然后利用3%的琼脂糖凝胶检测,最后利用凝胶成像系统拍照并判别基因型。
1.3.3 数据的统计处理
基因型结果利用PopGen 32软件进行群体遗传学分析,并利用SAS 8.1统计软件进行卡方检验。
2 结果与分析
2.1 PCR扩增产物检测结果
2.1.1 杜长大三元杂猪PPARγ2基因PCR扩增产物检测结果
以杜长大三元杂猪的DNA为模板,PCR扩增PPARγ2目的基因,取2μL的PCR扩增产物,用1.5%的琼脂糖凝胶进行电泳,结果如图1所示:

M为BM2000+DNA maker;1—10为扩增结果。图1 杜长大三元杂猪PPARγ2基因PCR扩增产物检测结果
如图1所示,1—10泳道为扩增得到的杜长大三元杂猪PPARγ2基因目的条带。可以看出DNA条带位于250 bp与500 bp之间且靠近250 bp,符合预计的284 bp长度,目的基因扩增成功,DNA条带明亮,未出现杂带,可用于后续操作。
2.1.2 晋汾白猪PPARγ2基因PCR扩增产物检测结果
以晋汾白猪的DNA为模板,PCR扩增PPARγ2目的基因,取2μL的PCR扩增产物,用1.5%的琼脂糖凝胶进行电泳,结果如图2所示:

M为BM2000+DNA maker;1—10为扩增结果。图2 晋汾白猪PPARγ2基因PCR扩增产物检测结果
如图2所示,1—10泳道为扩增得到的晋汾白猪PPARγ2基因目的条带,可以看出DNA条带位于250 bp与500 bp之间且靠近250 bp,符合预计的284 bp长度,目的基因扩增成功,DNA条带明亮,未出现杂带,可用于后续操作。
2.1.3 新山西黑猪PPARγ2基因PCR扩增产物检测结果
以新山西黑猪的DNA为模板,PCR扩增PPARγ2目的基因,取2μL的PCR扩增产物,用1.5%的琼脂糖凝胶进行电泳,结果如图3所示:

M为BM2000+DNA maker;1—10为扩增结果。图3 新山西黑猪PPARγ2基因PCR扩增产物检测结果
如图3所示,1—10泳道为扩增得到的新山西黑猪PPARγ2基因目的条带,可以看出DNA条带位于250 bp与500 bp之间且靠近250bp,符合预计的284 bp长度,目的基因扩增成功,DNA条带明亮,未出现杂带,可用于后续操作。
2.2 酶切产物检测结果
2.2.1 杜长大三元杂猪PPARγ2基因酶切产物检测结果
用限制性核酸内切酶(Bsr1)对杜长大三元杂猪PPARγ2基因扩增产物进行酶切,酶切检测结果如图4所示:
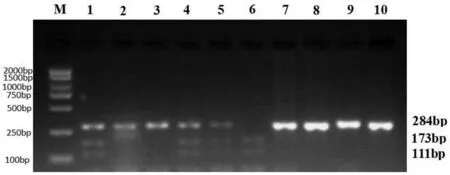
M为BM 2000+DNA Marker;1、4、5为Bb型;2、3、7—10为BB型;6为bb型。图4 杜长大三元杂猪PPARγ2基因Bsr1位点酶切产物检测结果
从图4可知,在杜长大三元杂猪中检测到BB、bb、Bb三种基因型,表明PPARγ2基因Bsr1位点在杜长大三元杂猪中存在多态性。
2.2.2 晋汾白猪PPARγ2基因酶切产物检测结果
用限制性核酸内切酶(Bsr1)对晋汾白猪PPARγ2基因扩增产物进行酶切,酶切检测结果如图5所示:
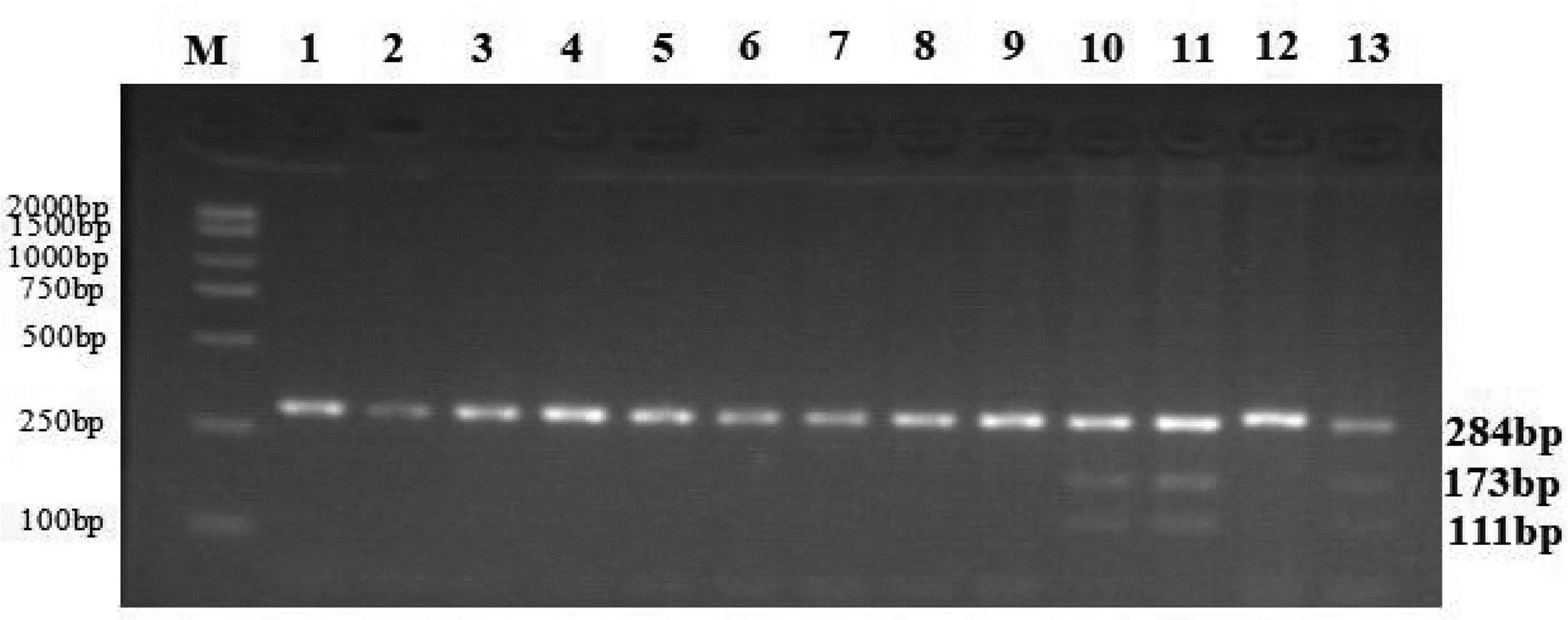
M为BM 2000+DNA Marker;1—9、12为BB型;10—11、13为Bb型。图5 晋汾白猪PPARγ2基因Bsr1位点酶切产物检测结果
从图5中可知,在晋汾白猪中检测到BB、Bb两种基因型,表明PPARγ2基因第一启动子Bsr1位点在杜长大三元杂猪中存在多态性。
2.2.3 新山西黑猪PPARγ2基因酶切产物检测结果
用限制性核酸内切酶(Bsr1)对新山西黑猪PPARγ2基因扩增产物进行酶切,酶切检测结果如图6所示:
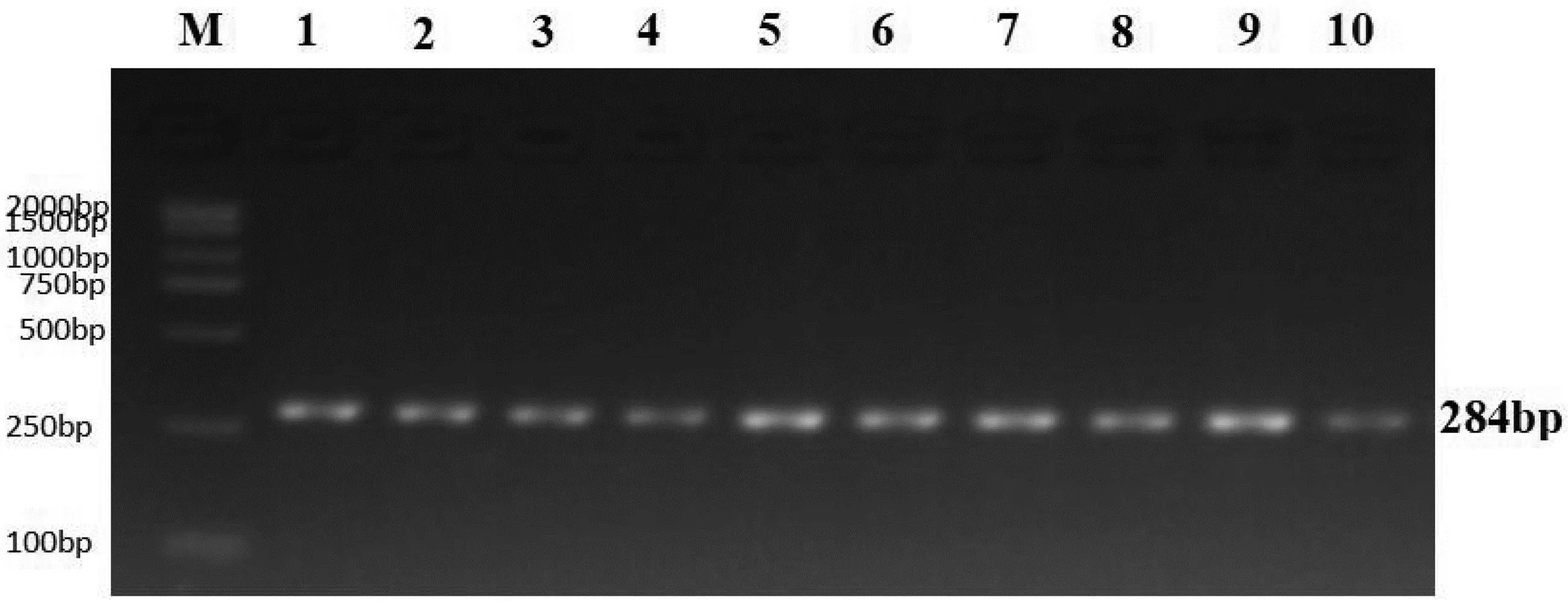
M为BM 2000+DNA Marker;1—10均为BB型。图6 新山西黑猪PPARγ2基因Bsr1位点酶切产物检测结果
从图6中可以看出,在新山西黑猪中只检测到一种基因型:BB,表明PPARγ2基因第一启动子Bsr1位点在新山西黑猪中不存在多态性。
2.3 统计学分析
2.3.1 基因型和等位基因频率分析
采用软件PopGen32对杜长大三元杂猪、晋汾白猪、新山西黑猪的PPARγ2基因Bsr1位点的酶切分型结果进行统计分析,得出表1所示结果:

表1 三种猪PPARγ2基因Bsr1位点基因型与等位基因频率分析结果
由表1可知,杜长大三元杂猪中出现了BB、Bb、bb三种基因型,其中BB基因型频率为0.6061,Bb基因型频率为0.3636,bb基因型频率为0.0303;晋汾白猪中出现了BB、Bb两种基因型,其中BB基因型频率为0.7826,Bb基因型频率为0.2174;新山西黑猪中只出现了BB一种基因型,其基因型频率为1.0000。结果显示,三猪种的优势基因型均为BB基因型,优势等位基因均为B。
2.3.2 纯合度、杂合度和香农指数分析
利用软件PopGen32对杜长大三元杂猪、晋汾白猪、新山西黑猪三种猪进行群体遗传学分析,得出表2所示结果:

表2 三种猪的群体遗传学分析结果
由表2可知,杜长大三元杂猪、晋汾白猪、新山西黑猪的纯合度分别为0.6364、0.7826、1.0000,新山西黑猪的纯合度高于杜长大三元杂猪、晋汾白猪,说明新山西黑猪的遗传性能相较于晋汾白猪、杜长大三元杂猪更稳定。香农指数越高,表明多态性越丰富,杜长大三元杂猪的香农指数(0.5168)高于晋汾白猪的香农指数(0.3438),说明杜长大三元杂猪的遗传多态性更丰富。杜长大三元杂猪和晋汾白猪的P值均大于0.05(P=0.672000>0.05,P=0.604479>0.05),说明PPARγ2基因Bsr1多态性位点在两猪种中均符合Hardy-Weinberg平衡。
2.3.3PPARγ2基因Bsr1位点基因型分布差异性分析
利用软件SAS 8.1检测PPARγ2基因Bsr1位点的基因型分布在杜长大三元杂猪、晋汾白猪、新山西黑猪三个猪种群体中是否有差异。结果如表3所示:

表3 PPARγ2基因Bsr1位点基因型分布差异性分析
由表3可知,P值为0.0025,P<0.01,表明PPARγ2基因Bsr1位点在杜长大三元杂猪、晋汾白猪、新山西黑猪三个猪种群体中基因型分布差异极显著。
3 讨论与结论
根据朱云[12]等的研究可知,PPARγ2基因经PCR扩增得到的产物大小为284 bp,在第一启动子区有1个Bsr1酶切位点,可产生173 bp和111 bp两个片段。本实验以33头杜长大三元杂猪,23头晋汾白猪,33头新山西黑猪为研究对象,采用PCR-RFLP方法对PPARγ2基因第一启动子Bsr1位点的多态性进行研究。结果显示,PPARγ2基因Bsr1位点酶切后在杜长大三元杂猪中能检测到三种基因型(BB、bb、Bb),在晋汾白猪中能检测到两种基因型(BB、Bb),在新山西黑猪中只能检测到一种基因型(BB)。三猪种的优势基因型均为BB基因型,优势基因均为B等位基因。
应用PopGen32软件对三猪种进行遗传学分析,结果显示,杜长大三元杂猪和晋汾白猪的P值均大于0.05,说明PPARγ2基因的第一启动子Bsr1多态性位点在两猪种中均符合Hardy-Weinberg平衡。应用SAS8.1软件对三猪种进行卡方检验,结果显示,PPARγ2基因Bsr1多态性位点的不同基因型在杜长大三元杂猪、晋汾白猪、新山西黑猪三个猪种群体中分布差异极显著(P=0.0025<0.01)。朱云等[12]对山猪的研究结果表明,PPARγ2基因Bsr1位点出现突变,存在b、Bb、b三种基因型,且在不同猪种中此位点的基因型频率不同,与本实验结果基本一致。晋汾白猪、新山西黑猪中个别基因型不出现的原因可能有以下两点:一是样本数量太少,晋汾白猪23头,不满足统计分析样本数量最低要求,可扩大样本数量。新山西黑猪33头,虽然已经满足统计分析样本数量最低要求,但样本数量仍偏低;二是由于环境等原因使得PPARγ2基因在不同猪种中的遗传稳定性存在差异。
