长链非编码RNA ZIM2-AS1在肝细胞癌中的表达及其临床意义
2024-01-24孙晋李英楠石梦姣田红卫慕艳华李君李宗芳
孙晋 李英楠 石梦姣 田红卫 慕艳华 李君 李宗芳
(西安交通大学第二附属医院生物诊断治疗国家地方联合工程研究中心,西安 710004)
肝细胞癌(hepatocellular carcinoma,HCC)作为肝脏最常见的原发性恶性肿瘤,是世界范围内第六大癌症,也是癌症相关死亡的第三大原因,其发病率在全球范围内持续升高[1]。对于早期HCC患者,手术切除、肝移植和射频消融术是最有效的临床治疗方法,但由于HCC起病隐匿、进展迅速、早期诊断困难,大多数HCC患者首次确诊即已进入中晚期,治疗手段有限,预后差且极易复发[2]。目前,尽管以分子靶向药物(如索拉非尼、仑伐替尼)和免疫检查点抑制剂(如阿替利珠单抗、信迪利单抗)为主的系统性治疗在中晚期HCC的治疗中取得了一定效果,但因HCC异质性强、易耐药、肿瘤免疫微环境特殊,导致总体治疗效果并不理想[3]。因此,急需开发有效的HCC早期诊断、预后判断生物标志物以及分子和免疫治疗靶点。
长链非编码RNA(long non-coding RNA,lnc-RNA)是一类长度超过200个核苷酸,缺乏蛋白质编码能力的RNA分子。大多数lncRNA由RNA聚合酶Ⅱ转录,其结构与mRNA相似,具有5'-帽子和3'-多聚腺苷酸(polyA)尾巴[4]。LncRNA可通过顺式(cis)和反式作用(trans)方式在表观遗传、转录和转录后水平调控基因表达,进而参与各种生物学过程,与生物个体发育和疾病的发生发展密切相关[5]。大量研究已证实lncRNA是肿瘤发生和发展的关键调控分子。目前已有一大批lncRNAs被鉴定出在HCC中异常表达,其可通过影响细胞增殖、凋亡、迁移、侵袭、血管生成、耐药及肿瘤微环境免疫细胞功能进而参与肿瘤发生发展,且具有作为HCC早期诊断和预后判断生物标志物的潜力[6-7]。
ZIM2-AS1(ZIM2 antisense RNA 1)是一条转录于人类染色体19q13.43区域的lncRNA,长度为2 092 bp。到目前为止,ZIM2-AS1在肿瘤中的相关研究仍比较匮乏。最近的一项研究发现ZIM2-AS1作为自噬相关lncRNA与食管鳞状细胞癌患者的总生存期呈正相关,是影响预后的保护因素,提示ZIM2-AS1可能参与肿瘤发生发展[8]。而ZIM2-AS1在HCC中的表达是否异常以及与HCC进展具有怎样的关系尚不清楚。因此,本研究拟基于TCGA数据通过生物信息学手段探讨ZIM2-AS1在HCC组织中的表达情况及其临床意义,以期为ZIM2-AS1用于HCC早期诊断、预后判断等基础及临床转化研究提供依据。
1 资料与方法
1.1 数据的获取及处理 自TCGA数据库(https://portal.gdc.cancer.gov/)下载374例HCC组织样本和50例癌旁组织样本的RNA-seq数据和临床资料数据。RNA-seq数据通过edge R软件包进行过滤和标准化处理获得TPM(Transcripts per Million mapped reads)数据,经log2转换后用于后续分析。
1.2 ZIM2-AS1在HCC组织中的表达及其与临床特征的相关性分析 采用EdgeR软件包分别分析374例HCC组织和50例癌旁组织,以及50例配对HCC和癌旁组织中ZIM2-AS1的表达情况;按照表达量的中位数分为高表达组和低表达组,采用Logistic回归模型分析ZIM2-AS1表达与性别、年龄、T/N/M分期、病理分期、肿瘤状态、血清AFP水平、Child-Pugh分级、血管浸润、肝纤维化Ishak评分等临床特征的相关性。
1.3 ZIM2-AS1与HCC患者预后相关性分析 基于TCGA下载的HCC RNA-seq数据和临床随访数据,利用R语言survminer程序包确定最佳cut-off值并据此将患者分为高表达组和低表达组,进一步采用Kaplan-Meier法对总生存期(overall survival,OS)和疾病相关生存期(disease specific survival,DSS)进行分析;运用Cox比例风险回归模型分析影响预后的危险因素,其中单因素分析结果P值<0.1的临床指标进一步纳入多因素分析;并根据影响预后的危险因素采用R语言rms程序包进一步构建Nomogram预测模型用于预测HCC患者1年、3年和5年总体生存概率。
1.4 ZIM2-AS1与HCC免疫细胞浸润相关性分析利用R语言GSVA程序包基于ssGSEA算法分析基因表达水平与免疫细胞浸润程度的相关性,并进行Spearman相关性检验。
1.5 ZIM2-AS1对HCC的诊断价值分析 利用R语言pROC程序包制作受试者工作特征(receiver operating characteristic,ROC)曲线,通过曲线下面积(area under the curve,AUC)评价指标诊断效能。
1.6 通过qRT-PCR检测ZIM2-AS1在人正常肝细胞和HCC细胞系中的表达情况 人正常肝细胞系L-O2以及5种HCC细胞系(Bel-7402、Bel-7404、HepG2、Hep3B和Huh7)均采用DMEM培养液(含10%胎牛血清)于恒温培养箱(37 ℃和5%CO2)中培养。采用Trizol法提取细胞总RNA并使用Vazyme公司的HiScript Ⅲ 1st Strand cDNA Synthesis Kit 进行反转录;利用TaKaRa公司的TB Green®Premix Ex TaqTMⅡ试剂对ZIM2-AS1的表达水平进行检测,并通过β-actin作为内参基因进行相对定量分析。ZIM2-AS1引物为F:5'-ACCATGCAGCCATAAAAAGG-3',R:5'-CCACCATGTGTCCATGTGTT-3';β-actin引物为F:5'-TGGCACCCAGCACAATGAA-3',R:5'-CTAAGTCATAGTCCGCCTAGAAGCA-3'。
1.7 统计学处理 采用SPSS20软件进行统计分析,结果以表示。采用独立样本t检验评估ZIM2-AS1在非配对HCC组织和细胞系中的表达差异;采用配对样本t检验评估ZIM2-AS1在配对HCC组织中的表达差异;采用log-Rank检验评估生存差异;通过Cox比例风险回归模型分析评估预后的危险因素。P<0.05被认为差异具有统计学意义。
2 结果
2.1 ZIM2-AS1在HCC组织和癌旁组织中的表达情况 通过比较374例HCC组织和50例癌旁组织中ZIM2-AS1的表达水平,发现ZIM2-AS1在HCC组织中的表达水平显著高于癌旁组织(P<0.01,图1A);进一步比较50例配对HCC组织的表达水平,结果显示ZIM2-AS1在肿瘤组织中的表达水平同样高于癌旁组织(P<0.01,图1B)。以上结果提示,lncRNA ZIM2-AS1在HCC组织中表达上调。
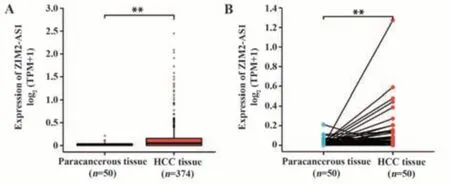
图1 基于TCGA数据分析ZIM2-AS1在HCC组织中的表达情况Fig.1 Expression status of ZIM2-AS1 in HCC tissues based on TCGA data
2.2 ZIM2-AS1表达与HCC患者临床特征相关性分析 通过构建单因素Logistics回归模型分析HCC患者ZIM2-AS1表达水平与临床病理参数的相关性,结果如表1所示,高表达ZIM2-AS1与年龄(OR=0.351,P=0.004)、性别(OR=0.543,P=0.037)、N分期(OR=4.552,P=0.008)、组织学分级(OR=2.027,P=0.019)和血清AFP水平(OR=21.569,P<0.001)显著相关,而与病理分期、荷瘤状态、T分期、M分期、Child-Pugh分级、血管浸润、残瘤、肝旁组织炎症和Ishak纤维化评分无显著相关性。
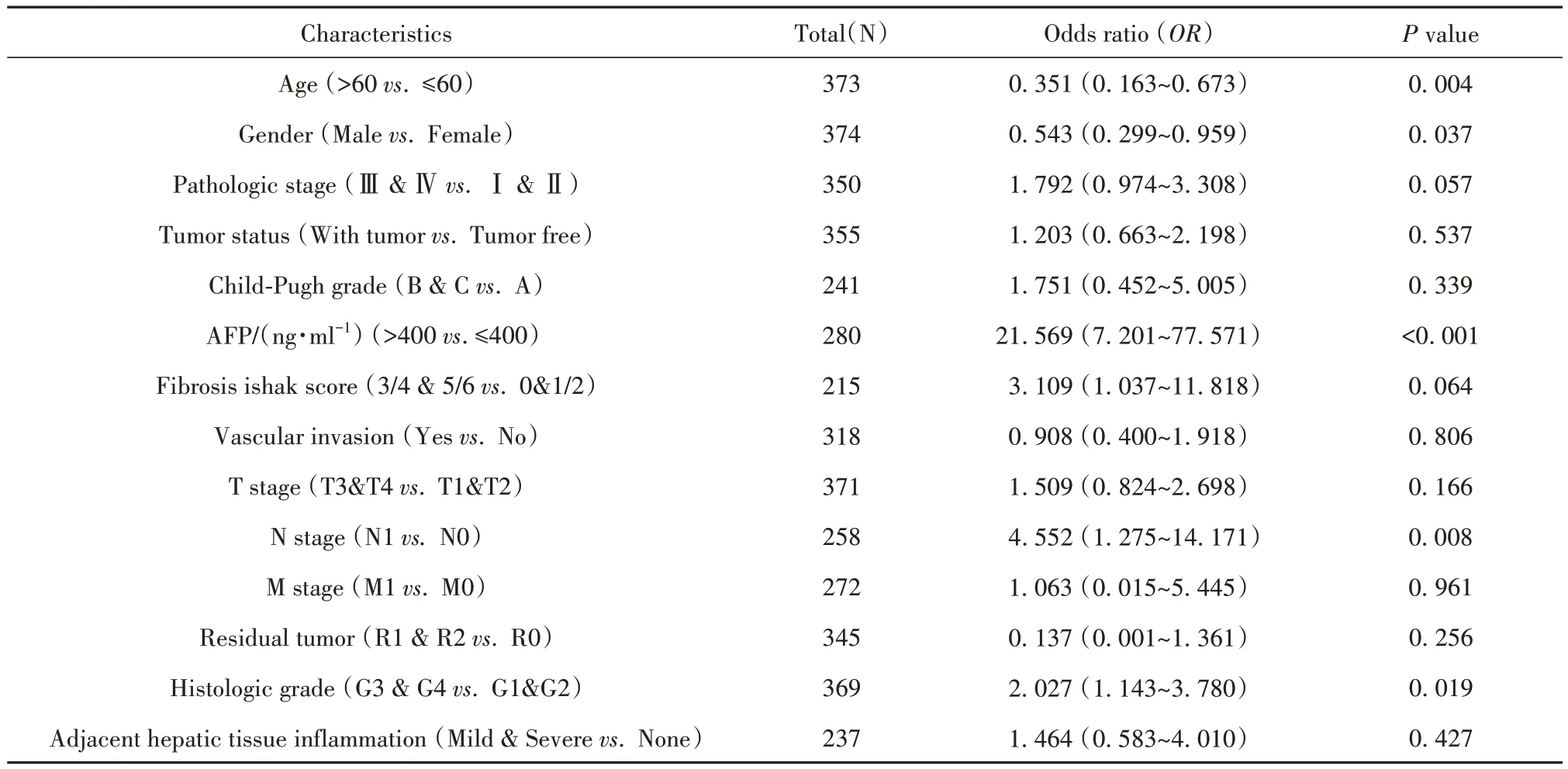
表1 ZIM2-AS1表达水平与HCC患者临床病理指标的关系(Logistic回归)Tab.1 Logistic analysis of association between ZIM2-AS1 expression and clinical characteristics
2.3 ZIM2-AS1表达与HCC患者预后相关性分析 为明确ZIM2-AS1表达与HCC患者预后的相关性,根据ZIM2-AS1的表达量,按最佳cut-off值将患者分为高表达组和低表达组,采用Kaplan-Meier法对OS和DSS进行分析,结果显示ZIM2-AS1高表达患者的OS和DSS均显著低于低表达患者(P均<0.05,图2),提示ZIM2-AS1高表达在HCC中是一项不良预后因素。

图2 ZIM2-AS1表达与HCC患者预后的关系Fig.2 Relationship between ZIM2-AS1 expression and prognosis of HCC patients
单因素Cox回归分析结果提示,ZIM2-AS1表达水平(HR=1.446,P=0.037)、T分期(HR=2.598,P<0.001)、M分期(HR=4.077,P=0.017)、病理分期(HR=2.504,P<0.001)及荷瘤状态(HR=2.317,P<0.001)与HCC患者OS具有显著相关性;进一步多因素Cox回归分析显示,ZIM2-AS1高表达水平(HR=1.866,P=0.007)和荷瘤状态(HR=2.076,P=0.002)是影响HCC患者OS的独立危险因素(表2)。

表2 影响HCC患者OS的单因素和多因素Cox分析Tab.2 Univariate and multivariate Cox analysis of OS in HCC patients
此外,综合ZIM2-AS1表达水平、T分期、M分期、病理分期以及荷瘤状态等影响预后的危险因素进一步构建了Nomogram预测模型,用于预测HCC患者1年、3年和5年总生存率(图3),从图中可以看出,ZIM2-AS1表达水平对预测HCC患者总生存概率贡献较大。

图3 预测HCC患者1年、3年和5年总生存率的Nomogram模型Fig.3 Nomogram for predicting probability of 1-,3- and 5-year OS for HCC patients
2.4 ZIM2-AS1表达与HCC免疫细胞浸润的关系通过对HCC组织ZIM2-AS1表达与19种免疫细胞浸润的相关性分析发现,ZIM2-AS1表达与HCC肿瘤微环境中5种免疫细胞的浸润水平存在显著相关性(|Spearman'sr|>0.1,P<0.05),其中与Th2细胞、滤泡辅助性T细胞(Tfh)和CD56brightNK细胞浸润呈正相关,而与中性粒细胞和浆细胞样树突状细胞(pDC)浸润呈负相关(图4)。
2.5 ZIM2-AS1对HCC的诊断价值分析 ROC曲线结果如图5A~C所示,ZIM2-AS1表达水平对于评估HCC(AUC=0.659)、N0期(AUC=0.662)、组织学分级G1&G2期(AUC=0.644)均具有一定的诊断价值(AUC均>0.50)。此外,如图4D、E显示,ZIM2-AS1表达水平对于评估1年、3年及5年OS(AUC分别为0.607、0.570和0.600)和DSS(AUC分别为0.621、0.560和0.564)同样具有诊断价值(AUC均>0.50)。
2.6 ZIM2-AS1在人正常肝细胞和HCC细胞系中的表达情况 利用qRT-PCR检测ZIM2-AS1在人正常肝细胞L-O2和5种HCC细胞系中的表达情况,结果如图6所示,ZIM2-AS1在被检测的5种HCC细胞系(Bel-7402、Bel-7404、HepG2、Hep3B和Huh7)中的表达水平均显著高于人正常肝细胞系L-O2(P均<0.05)。

图6 ZIM2-AS1在人正常肝细胞系和HCC细胞系中的表达情况Fig.6 Expression of ZIM2-AS1 in human normal liver cells and HCC cell lines
3 讨论
HCC作为常见的恶性肿瘤之一,其致病因素较多且发病机制复杂,涉及多阶段、多步骤的生物学过程及错综复杂的分子调控网络[9]。越来越多的研究表明,lncRNA作为重要调控分子可与DNA、各类RNA(如mRNA和miRNA)以及蛋白发生互作,通过构成复杂的调控网络参与肿瘤发生发展,已成为肿瘤生物标志物和治疗靶点研发的重要分子类型[10]。近年来,HCC相关lncRNA研究进展迅猛,一批参与HCC发生发展的lncRNAs得到鉴定,展现出了作为HCC生物标志物和治疗靶点的潜力[11]。因lncRNA数量庞大,迫切需要发现和鉴定更多的HCC相关lncRNA,为HCC的早期诊断、预后判断和靶向治疗提供全新分子。
LncRNA ZIM2-AS1转录于人类染色体的19q13.43区域,在肿瘤发生发展中的生物学作用目前并不清楚。DU等[12]通过全基因组关联分析(GWAS)对乌干达男性前列腺癌相关风险位点进行鉴定,发现位于ZIM2-AS1内含子区域的rs7258285位点为非洲和非洲后裔男性前列腺癌的易感位点。而最近一项关于食管鳞状细胞癌的生物信息学研究发现ZIM2-AS1与自噬相关基因呈现共表达模式且与食管鳞状细胞癌患者的OS密切相关,是影响预后的保护因素,提示ZIM2-AS1可能参与肿瘤发生发展[8]。目前,ZIM2-AS1在HCC中的表达情况以及其与HCC进展的关系尚未见报道。
本研究利用TCGA数据库中HCC RNA-seq数据及其临床资料进行生物信息学分析,对ZIM2-AS1在HCC中的表达情况及临床意义进行探究,发现ZIM2-AS1在配对和非配对HCC组织中的表达水平均呈现上升趋势,其高表达与年龄、性别、肿瘤N分期、组织学分级及血清AFP水平呈显著正相关,而与患者的OS和DSS均呈负相关,是影响HCC患者OS的独立危险因素,且从构建的Nomogram预测模型可以看出,ZIM2-AS1表达水平对预测HCC患者总生存概率贡献较大。进一步通过ROC曲线分析发现ZIM2-AS表达水平对于评估HCC、N0分期、组织学G1和G2期、OS和DSS均具有良好的预测效果,以上结果表明ZIM2-AS1具有可作为HCC早期诊断和预后判断新型分子标志物的潜力。此外本研究发现,ZIM2-AS1的高表达与HCC组织中多种免疫细胞的浸润密切相关。例如,具有肿瘤免疫抑制功能的Th2细胞和CD56brightNK细胞的浸润与ZIM2-AS1表达水平呈正相关,而具有抗肿瘤活性的中性粒细胞和pDC在HCC组织中的浸润丰度则与ZIM2-AS1表达水平呈负相关。研究表明肿瘤浸润的Th2细胞可通过分泌IL-4和IL-10介导免疫抑制进而促进肿瘤生长或转移[13-14]。而最新研究发现浸润于肿瘤组织的CD56brightNK细胞,分泌干扰素-γ和肿瘤坏死因子-α的能力显著减弱,提示其抗肿瘤功能受到抑制[15]。在肿瘤微环境中,中性粒细胞分为具有抗肿瘤效应的N1型和促肿瘤效应的N2型两个亚群,其中N1型中性粒细胞可通过分泌Ⅰ型干扰素和活性氧物质以及激活多种先天性和适应性免疫细胞(如T、B、NK和DC等)抑制肿瘤生长和转移[16]。pDC作为一类树突状细胞亚群,具有分泌Ⅰ型干扰素的功能,近年来研究发现pDCs可通过表达肿瘤坏死因子相关凋亡诱导配体和分泌颗粒酶B直接杀伤肿瘤并可有效增强NK和T细胞的抗肿瘤活性[17]。因此,ZIM2-AS1高表达可能与HCC免疫抑制型肿瘤微环境的形成密切相关,在HCC肿瘤微环境的调控中发挥重要作用,同时提示ZIM2-AS1可作为潜在的HCC免疫治疗靶点。最后,通过qRT-PCR验证了ZIM2-AS1在HCC细胞中的高表达趋势,其结果与TCGA数据一致。
综上所述,本研究主要基于TCGA数据通过生物信息学手段揭示了lncRNA ZIM2-AS1在HCC中异常高表达及其具有作为HCC诊断、预后判断生物标志物及免疫治疗靶点的潜在应用价值,同时为进一步针对ZIM2-AS1开展相关基础与临床转化研究提供理论依据。本研究仅在细胞系中对ZIM2-AS1的表达进行了验证,后续拟通过收集肿瘤组织、血清和血浆等临床样本开展进一步验证工作。