基于JAK2/STAT3信号通路探究利咽糖浆对慢性咽炎大鼠咽喉组织损伤及咽黏膜修复的影响
2024-01-24李勇沈文明王文茜武汉市中医医院耳鼻咽喉科武汉430014
李勇 沈文明 王文茜 (武汉市中医医院耳鼻咽喉科,武汉 430014)
慢性咽炎是耳鼻喉科常见疾病,可造成咽部干痒疼痛、有异物感、咳嗽、吞咽困难等症状,给患者工作生活造成很大不便[1-2]。现代医学研究认为,活性氧(reactive oxygen species,ROS)、自由基等炎症介质和炎症细胞因子引发咽部黏膜组织炎症从而造成慢性咽炎,抗炎与抗氧化治疗是改善慢性咽炎症状的有力手段[3-4]。Janus激酶2(Janus kinase 2,JAK2)/信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)是机体组织重要的炎症调控信号,抑制其信号途径激活传导可明显减轻缺血再灌注引发的炎症和氧化应激,从而减轻肺损伤,治疗急、慢性咽炎等炎症相关疾病的冬青属植物根和茎水提取物可通过下调JAK2/STAT3信号发挥抗炎作用,由此可知JAK2/STAT3能成为有前景的慢性咽炎治疗靶点[5-6]。慢性咽炎在中医学中属“慢喉痹”,病机多为肺阴虚导致的虚火上炎、气血瘀滞、咽部失养,滋阴润肺、清热解毒是其治疗策略[7-8]。武汉市中医医院自制的利咽糖浆主要由玄参、菊花、牛蒡子等组成,根据药典中各药功效,并遵循“药有个性之特长,方有合群之妙用”的配伍原则配制成的糖浆制剂,具有清热解毒、润肺利咽之功效,推测可用于治疗慢性咽炎。本文以此药灌胃慢性咽炎大鼠,基于JAK2/STAT3信号探讨其对慢性咽炎大鼠咽喉组织损伤及咽黏膜修复的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD大鼠,体质量200~240 g,SPF级,购自四川海思科制药有限公司,大鼠许可证号:SYXK(川)2018-182。大鼠遵照《中华人民共和国实验动物管理条例》适应性饲养在本院动物房中1周,具体条件:湿度55%~65%,温度22.0~25.5 ℃,明暗各12 h交替轮换。本研究经武汉贝赛模式生物中心实验动物福利与伦理管理委员会批准,批号:BSMS动(福)第2022-03-28A号。
1.1.2 试剂与仪器 利咽糖浆为武汉市中医医院自制药;RO8191(货号:HY-W063968,纯度:98.53%)购自美国MCE公司;10%氨水(货号:CAS 1336-21-6)购自南京化学试剂股份有限公司;PE Anti-rat CD4抗体(货号:B203412)购自BIOLEGEND(北京)生物科技有限公司;FITC Anti-rat CD8抗体(货号:ab95527)、大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(货号:ab100785)、IL-6 ELISA试剂盒(货号:ab100772)、大鼠IL-10 ELISA试剂盒(货号:ab214566)、兔源Anti-rat JAK抗体(货号:ab39636)、兔源Anti-rat p-JAK抗体(货号:ab32101)、兔源Anti-rat p-STAT3抗体(货号:ab76315)、兔源Anti-rat STAT3抗体(货号:ab68153)购自美国Abcam公司;兔源Anti-rat β-actin抗体(货号:AF5003)、辣根过氧化物酶标记山羊抗兔二抗(货号:A0208)、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒(ABTS快速法)(货号:S0121)、ROS检测试剂盒(货号:S0033M)、钠盐(bicinchoninic acid,BCA)蛋白定量试剂盒(货号:P0012S)、丙二醛(malondialdehyde,MDA)检测试剂盒(货号:S0131S)、RIPA裂解液(货号:P0013K)购自上海碧云天生物技术有限公司。全自动脱水机(型号:ASP200S)、石蜡轮转切片机(型号:RM2035)、加热石蜡包埋系统(型号:G1150H)、生物光学显微镜(型号:DM3000)均购自德国Leica公司;酶标分析仪(型号:DNM-9606)购自北京普朗新技术有限公司;流式细胞仪(型号:CytoFLEX)购自美国贝克曼库尔特公司;蛋白制胶、电泳与转膜系统(4胶/4膜)(型号:MiniProGelTM)购自上海碧云天生物技术有限公司。
1.2 方法
1.2.1 慢性咽炎大鼠模型制备及分组给药 制备慢性咽炎大鼠模型参照文献[9]:将10%氨水置于喷雾器中,取SD大鼠51只,向其咽部喷2揿,每天喷3次,间隔8 h,持续21 d后,观察大鼠一般情况,当出现皮毛粗糙、暗淡,口腔分泌物及饮水量增加,有侧头蹭垫料、搔抓口唇两侧动作,额戴反光镜观察大鼠咽部发现其组织充血、肿胀,有很多分泌物附着,则判断模型建立成功,共造模成功48只,随机分为模型组、利咽糖浆组、RO8191组、利咽糖浆+RO8191组,每组12只,另取12只SD大鼠咽部注射等剂量生理盐水,作为对照组。
利咽糖浆为武汉市中医医院自制药:将玄参、菊花、牛蒡子、丹皮、赤芍、板蓝根、麦冬、桔梗以相同比例浸泡、煎煮、过滤、浓缩后得到生药含量为0.8 g/ml的药液,然后加入适量蔗糖溶解混匀,得到每瓶200 ml的糖浆制剂,将JAK2/STAT3激活剂RO8191分别加入上述糖浆制剂及生理盐水中,得到2.3 mg/ml的RO8191与利咽糖浆混合药液、2.3 mg/ml的RO8191药液,利咽糖浆组大鼠灌胃9 ml/kg的利咽糖浆制剂,药物终剂量为7.2 g/kg;RO8191组大鼠灌胃9 ml/kg的RO8191药液,RO8191终剂量为20.7 mg/kg[10];利咽糖浆+RO8191组大鼠灌胃9 ml/kg的RO8191和利咽糖浆混合药液,RO8191和利咽糖浆终剂量分别为20.7 mg/kg、7.2 g/kg;对照组和模型组大鼠灌胃9 ml/kg的生理盐水,各组大鼠均每天灌胃1次,持续灌胃21 d。
1.2.2 检测大鼠一般情况及咽部表观状态 给药全部完成后24 h观察大鼠皮毛、饮水量、口腔分泌物、行为动作等一般情况,并额戴反光镜观察大鼠咽部,根据文献[11]标准进行评分:大鼠咽部表面湿润有光泽,无充血、肿胀等病理症状且呈浅红色,无分泌物附着,计0分;大鼠咽部表面光泽不良,有少量急性充血且附着少量分泌物,计1分;大鼠咽部表面色泽差且颜色暗红,有急性、轻度肿胀等病理现象,附着分泌物,计2分;大鼠咽部呈暗红色和暗色,急性充血、肿胀等病理现象明显并附着大量分泌物,计3分。
1.2.3 大鼠外周血中T淋巴细胞亚群检测及标本采集 大鼠一般情况及咽部表观状态检测结束后取颈动脉血,于4 ℃下以300 g 离心15 min,将上清储存在-80 ℃下备用;再次取颈动脉血1 ml加入适量红细胞裂解液,冰水浴中静置30 min,于4 ℃下以300 g 离心20 min,得到外周血T淋巴细胞,加入适量PBS混匀洗涤后再次以同样条件离心,将细胞沉淀以PBS重悬后计数,然后取约含5×106个细胞的细胞悬液以同样条件离心,依次加入FITC Anti-rat CD8、PE Anti-rat CD4抗体、PBS后混匀,避光孵育30 min,以同样条件离心后使用PBS洗涤细胞沉淀,加入500 μl PBS小心吹打混匀后上机检测,通过FCSalyzer v0.9.22软件分析流式细胞仪所得数据,获得T淋巴细胞亚群CD4+T、CD8+T,并计算CD4+T/CD8+T。
以异氟醚麻醉大鼠后处死,剪下咽部组织,取0.6 g加入蛋白裂解液,冰水浴中上下研磨,4 ℃下离心(1 000 g,20 min),采用BCA试剂盒检测上清中总蛋白浓度,然后储存在-80 ℃下备用。
1.2.4 大鼠咽部病理形态变化检测 将1.2.3中剩余的大鼠咽部组织以仪器脱水后置于二甲苯中透明,以融化的石蜡包埋成块后切片,选出无破损且厚薄均匀的切片置于二甲苯中脱蜡,水化后采用HE试剂盒进行染色,脱水、透明、封片后光学显微镜下观察大鼠咽部病理形态变化。
1.2.5 大鼠血清TNF-α、IL-6、IL-10、MDA、ROS、TAOC水平检测 取1.2.3中冻存于-80 ℃的血清提前缓慢解冻,以各自试剂盒并遵循其说明指导测定其中TNF-α、IL-6、IL-10、MDA、ROS、T-AOC水平。
1.2.6 大鼠咽部组织JAK2/STAT3通路相关蛋白表达检测 取1.2.3中冻存于-80 ℃的咽部组织蛋白样品液提前缓慢解冻,取出18 μg蛋白,以100 ℃沸水变性5 min,以120 V电压跑电泳70 min,以40 mA电流湿转75 min,以3%牛血清白蛋白封闭蛋白非特异位点2 h,将目的蛋白JAK、p-JAK、STAT3、p-STAT3、β-actin自硝酸纤维膜上截下,分别以稀释1 000倍的相对应兔源一抗孵育9 h,洗膜后以稀释2 000倍的辣根过氧化物酶标记的山羊抗兔二抗孵育2 h,经增强化学发光法显色、曝光、扫描后,将图片输入Image Lab软件分析,定量各蛋白灰度后算出其与内参β-actin的比值,进行统计后得出各蛋白相对表达。
1.3 统计学分析 采用SPSS24.0软件对所得实验数据进行统计分析,计量资料采用表示,对照组与模型组间采用t检验进行差异比较;模型组与给药组间采用单因素方差分析进行差异比较,两两之间采用LSD-t检验进行进一步比较,P<0.05表示差异有统计学意义。
2 结果
2.1 利咽糖浆对大鼠一般情况及咽部表观状态的影响 对照组大鼠一般情况及咽部表观状态正常,咽部黏膜及肌层组织结构清晰完好。与对照组相比,模型组大鼠皮毛粗糙、暗淡,口腔分泌物量及饮水量增加,有侧头蹭垫料、搔抓口唇两侧动作,咽部红肿充血,呈现暗红色,喉中鸣响呈间断性喘鸣声,咽部黏膜上皮组织增生,呈钉状或乳突状,组织有充血情况,附有较多黏液,大量炎症细胞浸润黏膜下层,并部分深入肌层组织,咽部组织出现明显病理形态损伤,咽部表观状态评分显著升高(P<0.05)。与模型组、利咽糖浆+RO8191组相比,利咽糖浆组大鼠上述一般情况及咽部表观及病理损伤症状均有所改善,咽部表观状态评分均降低(P<0.05);RO8191组大鼠上述一般情况、咽部表观及病理损伤症状均进一步加重,咽部表观状态评分升高(P<0.05)。见图1、表1。
表1 各组大鼠咽部表观状态评分(,n=12)Tab.1 apparent state score of pharynx of rats in each group (,n=12)
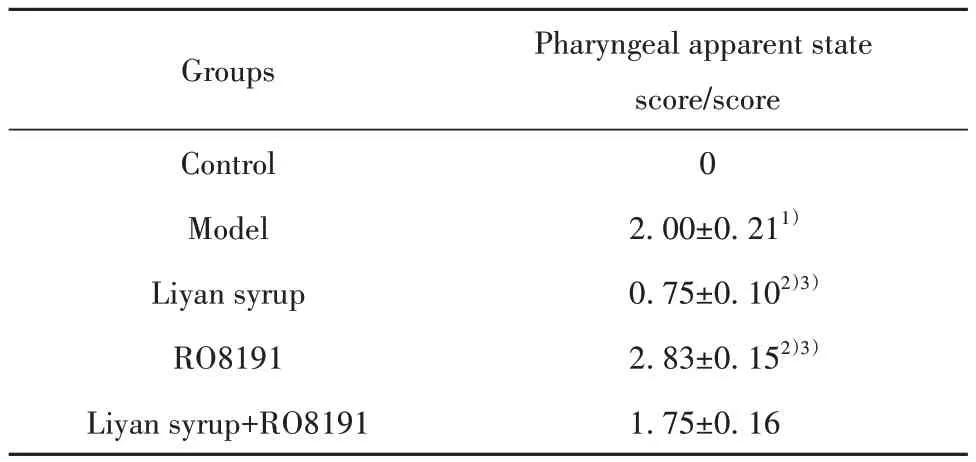
表1 各组大鼠咽部表观状态评分(,n=12)Tab.1 apparent state score of pharynx of rats in each group (,n=12)
Note:Compared with control group, 1)P<0.05; compared with model group, 2)P<0.05; compared with Liyan syrup+RO8191 group, 3)P<0.05.
Pharyngeal apparent state score/score 0 2.00±0.211)0.75±0.102)3)2.83±0.152)3)1.75±0.16 Groups Control Model Liyan syrup RO8191 Liyan syrup+RO8191

图1 HE染色检测各组大鼠咽部病理形态变化(×200)Fig.1 Pathological changes of pharynx of rats in each group were detected by HE staining (×200)
2.2 利咽糖浆对大鼠外周血T淋巴细胞亚群的影响 与对照组比较,模型组大鼠外周血CD4+T比例、CD4+T/CD8+T降低(P<0.05),CD8+T比例升高(P<0.05);与模型组、利咽糖浆+RO8191组相比,利咽糖浆组大鼠外周血CD4+T比例、CD4+T/CD8+T均升高(P<0.05),CD8+T比例均降低(P<0.05);RO8191组大鼠外周血CD4+T比例、CD4+T/CD8+T比值均降低(P<0.05),CD8+T比例均升高(P<0.05)。见图2、表2。
表2 各组大鼠外周血T淋巴细胞亚群比例(,n=12)Tab.2 Proportion of T lymphocyte subsets in peripheral blood of rats in each group (,n=12)

表2 各组大鼠外周血T淋巴细胞亚群比例(,n=12)Tab.2 Proportion of T lymphocyte subsets in peripheral blood of rats in each group (,n=12)
Note:Compared with control group, 1)P<0.05; compared with model group,2) P<0.05; compared with Liyan syrup+RO8191 group,3)P<0.05.
CD4+T/CD8+T 2.08±0.13 1.36±0.091)1.93±0.142)3)1.09±0.052)3)1.42±0.10 Groups Control Model Liyan syrup RO8191 Liyan syrup+RO8191 CD4+T/%58.49±3.51 46.10±1.831)57.37±3.242)3)40.34±1.122)3)47.25±1.03 CD8+T/%28.14±1.35 33.82±1.421)29.76±1.142)3)36.94±0.932)3)33.15±1.06

图2 流式细胞术检测各组大鼠外周血T淋巴细胞亚群Fig.2 Detection of T lymphocyte subsets in peripheral blood of rats in each group by flow cytometry
2.3 利咽糖浆对大鼠血清炎症及氧化应激相关因子水平的影响 与对照组比较,模型组大鼠血清IL-6、TNF-α、MDA、ROS水平升高(P<0.05),IL-10、T-AOC水平降低(P<0.05);与模型组、利咽糖浆+RO8191组相比,利咽糖浆组大鼠血清IL-6、TNF-α、MDA、ROS水平均降低(P<0.05),IL-10、T-AOC水平均升高(P<0.05);RO8191组大鼠血清IL-6、TNF-α、MDA、ROS水平均升高(P<0.05),IL-10、T-AOC水平均降低(P<0.05)。见表3。
表3 各组大鼠血清IL-6、TNF-α、IL-10、MDA、ROS、T-AOC水平(,n=12)Tab.3 Serum IL-6, TNF-α, IL-10,MDA,ROS and T-AOC of rats in each group level (,n=12)
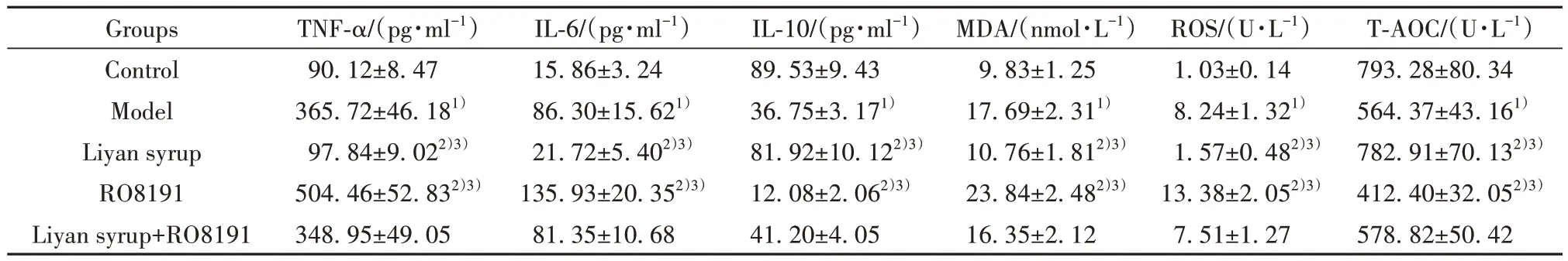
表3 各组大鼠血清IL-6、TNF-α、IL-10、MDA、ROS、T-AOC水平(,n=12)Tab.3 Serum IL-6, TNF-α, IL-10,MDA,ROS and T-AOC of rats in each group level (,n=12)
Note:Compared with control group, 1)P<0.05; compared with model group,2) P<0.05; compared with Liyan syrup+RO8191 group, 3)P<0.05.
T-AOC/(U·L-1)793.28±80.34 564.37±43.161)782.91±70.132)3)412.40±32.052)3)578.82±50.42 Groups Control Model Liyan syrup RO8191 Liyan syrup+RO8191 TNF-α/(pg·ml-1)90.12±8.47 365.72±46.181)97.84±9.022)3)504.46±52.832)3)348.95±49.05 IL-6/(pg·ml-1)15.86±3.24 86.30±15.621)21.72±5.402)3)135.93±20.352)3)81.35±10.68 IL-10/(pg·ml-1)89.53±9.43 36.75±3.171)81.92±10.122)3)12.08±2.062)3)41.20±4.05 MDA/(nmol·L-1)9.83±1.25 17.69±2.311)10.76±1.812)3)23.84±2.482)3)16.35±2.12 ROS/(U·L-1)1.03±0.14 8.24±1.321)1.57±0.482)3)13.38±2.052)3)7.51±1.27
2.4 利咽糖浆对大鼠咽部组织JAK2/STAT3通路相关蛋白表达的影响 与对照组比较,模型组大鼠咽部组织p-JAK2/JAK2、p-STAT3/STAT3水平升高(P<0.05);与模型组、利咽糖浆+RO8191组相比,利咽糖浆组大鼠咽部组织p-JAK2/JAK2、p-STAT3/STAT3均降低(P<0.05);RO8191组大鼠咽部组织p-JAK2/JAK2、p-STAT3/STAT3均升高(P<0.05)。见图3、表4。
表4 各组大鼠咽部组织JAK2/STAT3通路相关蛋白相对表达(,n=12)Tab.4 Relative expressions of JAK2/STAT3 pathway related proteins in pharyngeal tissue of rats in each group (,n=12)
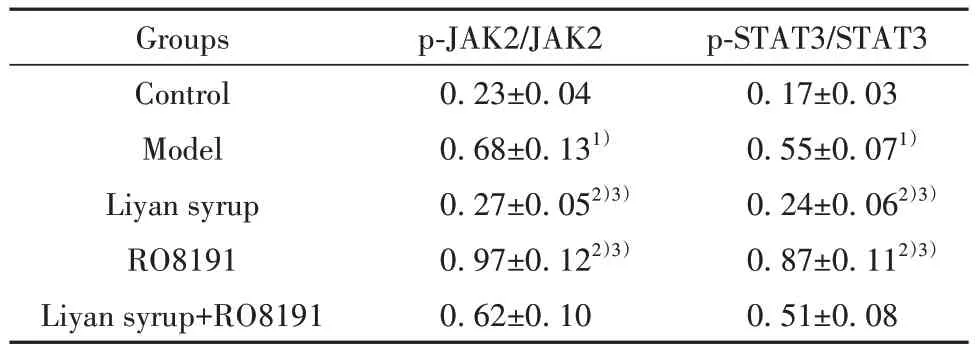
表4 各组大鼠咽部组织JAK2/STAT3通路相关蛋白相对表达(,n=12)Tab.4 Relative expressions of JAK2/STAT3 pathway related proteins in pharyngeal tissue of rats in each group (,n=12)
Note:Compared with control group, 1)P<0.05; compared with model group,2) P<0.05; compared with Liyan syrup+RO8191 group,3)P<0.05.
p-STAT3/STAT3 0.17±0.03 0.55±0.071)0.24±0.062)3)0.87±0.112)3)0.51±0.08 Groups Control Model Liyan syrup RO8191 Liyan syrup+RO8191 p-JAK2/JAK2 0.23±0.04 0.68±0.131)0.27±0.052)3)0.97±0.122)3)0.62±0.10
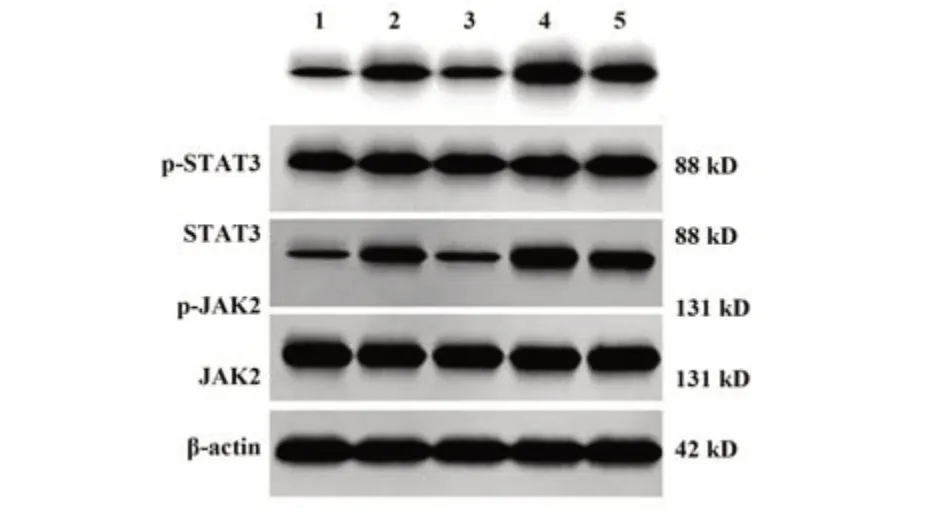
图3 免疫印迹检测各组大鼠咽部组织JAK2/STAT3通路相关蛋白表达Fig.3 Western blot was used to detect expressions of JAK2/STAT3 pathway related proteins in pharyngeal tissues of rats in each group
3 讨论
慢性咽炎作为咽部的一种慢性炎症性疾病,可造成黏膜增生、腺体膨大、血管扩张、黏液分泌增多等病理现象,ROS、TNF-α、IL-6等炎症介质及淋巴细胞、白细胞等炎症细胞参与调控其复杂的病理反应过程[3,12-13]。本实验以10%氨水刺激大鼠咽部构建慢性咽炎模型,结果显示氨水刺激可诱导炎症介质ROS、TNF-α、IL-6大量产生,降低抗炎因子IL-10水平,外周血淋巴细胞CD4+T亚群比例降低,CD8+T亚群比例升高,引发咽部炎症及氧化应激损伤,导致大鼠咽部红肿充血,呈现暗红色,喉中鸣响呈间断性喘鸣声,出现皮毛粗糙、暗淡,口腔分泌物及饮水量增加,并出现侧头蹭垫料、搔抓口唇两侧等症状,表明大鼠模型建立成功。
西医治疗慢性咽炎的首选药为青霉素类抗生素,但由于耐药、过敏等问题,寻求更好的治疗药物十分重要,中药因其毒副作用小的优点在慢性咽炎的治疗中得到了很大发展。本文将玄参、菊花、牛蒡子、丹皮、赤芍、板蓝根、麦冬、桔梗浸泡煎煮、过滤浓缩后,加入蔗糖溶解制成利咽糖浆,其中玄参、菊花、牛蒡子为君药,具有清热解毒、泻火利咽功效,丹皮、赤芍为成药,具有清热凉血、消肿祛瘀功效,板蓝根、麦冬为佐药,具有降燥解毒、润肺养阴功效,桔梗为使药,可解毒排脓、宣泄肺气,具有带动诸药上行的功效,上述药物合用共奏清热解毒、润肺利咽之功[7-8,14-16]。本实验以此利咽糖浆制剂干预处理慢性咽炎大鼠,可减少炎症介质ROS、TNF-α、IL-6产生,提升抗炎因子IL-10水平,调控外周血淋巴细胞亚群分化,提高CD4+T比例与CD4+T/CD8+T比值,从而减轻炎症,增加抗氧化酶T-AOC生成,降低氧化应激水平,减轻大鼠黏膜上皮组织增生、充血红肿、黏液大量附着等咽部组织病理形态损伤,降低咽部表观状态评分,改善大鼠皮毛暗淡、口腔分泌物量及饮水量增加等一般情况,最终缓解慢性咽炎症状,揭示了利咽糖浆对慢性咽炎具有很好的治疗作用。
研究表明抗炎治疗是治疗咽炎、缓解咽喉痒痛的有效策略,JAK2/STAT3信号可调控炎症细胞分化浸润、炎症因子表达等炎症反应过程,抑制JAK2/STAT3通路激活可显著减轻炎症反应,减轻肺损伤,并可改善类风湿关节炎症状,由此推测通过下调JAK2/STAT3通路抑制炎症可能是利咽糖浆治疗慢性咽炎的药理机制[3-4,17-19]。本研究结果显示,慢性咽炎大鼠相比于对照组大鼠,其咽部组织p-JAK2/JAK2与p-STAT3/STAT3水平显著升高,利咽糖浆可逆转其变化,且以JAK2激活剂RO8191干预处理慢性咽炎大鼠,可加重大鼠咽部组织炎症损伤及咽炎症状,表明JAK2/STAT3信号参与调控利咽糖浆对慢性咽炎的治疗过程[20];当利咽糖浆和RO8191联合干预处理慢性咽炎大鼠时,RO8191可减弱利咽糖浆的抗炎及抗氧化应激功能,抵抗其对大鼠咽部组织炎症损伤及咽炎症状的改善作用,最终逆转利咽糖浆的慢性咽炎治疗功效,揭示利咽糖浆可通过抑制JAK2/STAT3信号激活而起到治疗慢性咽炎的作用。
综上可知,利咽糖浆能降低JAK2与STAT3蛋白的磷酸化水平,抑制ROS及炎症因子表达生成,减弱氧化应激,抵抗炎症发生及进展,缓解慢性咽炎大鼠咽黏膜损伤,改善咽炎症状,抑制JAK2/STAT3信号激活是其药理机制之一。本实验制备了一种新的咽炎治疗药物,并证实了其疗效,为急慢性咽炎的临床治疗做出了一定贡献。