氨氮和重金属Cu2+对放逸短沟蜷的急性毒性及氧化胁迫效应
2024-01-24秦媛林业宏侯颖怡王伟瑜张凯郑善坚
秦媛,林业宏,侯颖怡,王伟瑜,张凯,郑善坚*
(1.浙江师范大学化学与生命科学学院,浙江 金华 321004;2.浙江省野生动物生物技术与保护利用重点实验室,浙江 金华 321004)
放逸短沟蜷(Semisulcospira libertine),又称青蛳,为软体动物门、腹足纲、前鳃亚纲、新进腹足超目、短沟蜷科、短沟蜷属[1]的淡水螺类。放逸短沟蜷肉质鲜嫩可口、风味独特、营养丰富,生活于水体清澈、水温较低的山区溪流中,喜附着于水中石块上,以刮食藻类为生。其对水质要求较高,是良好的环境监测指示物种。
铜离子(Cu2+)是生物必需微量元素之一,适量的Cu2+可与蛋白质中的巯基结合,从而干扰巯基酶活性[2],杀灭病原体,可以保持水生动物体内环境稳定;而过量的Cu2+会导致水生动物的机体结构和生理功能发生异常,导致其产生各种病变和疾病[3]。分子态氨具有脂溶性和不带电的性质,可以很容易地通过细胞膜,扩散到生物血液和组织中,从而会形成血氨中毒[4]。氨对水生螺的毒性大于亚硝酸盐氮和硝酸盐氮,且相对于部分虾类、水蚤类、甲壳类等水生无脊椎动物而言,螺类对氨更具有耐受性[5]。
为了解水体中氨氮和Cu2+胁迫对放逸短沟蜷的影响,现开展2 种环境因子对放逸短沟蜷的急性毒性试验以及在氨氮和Cu2+胁迫下生理指标测定,评估放逸短沟蜷的毒性响应,以期为今后放逸短沟蜷的人工养殖提供技术支撑,为水环境氨氮和重金属Cu2+污染的生态风险评价提供科学依据。
1 材料与方法
1.1 时间与地点
2021 年7 月。试验地位于浙江师范大学浙江省野生动物生物技术与保护利用重点实验室。
1.2 样本
放逸短沟蜷采集自浙江开化,平均壳长为(18.20±2.03)cm,平均壳宽为(9.53±1.71)cm,于水槽(38 cm×28 cm×15 cm)内暂养,水温(25±1)℃,pH 值为(7.5±0.1)。
1.3 急性毒性试验
根据预试验结果确定药物质量浓度范围,按照等比数列间距,设置药物的质量浓度梯度。每种药物设置5 个浓度梯度,ρ(Cu2+)为0,0.25,0.50,1.00和2.00 mg/L;ρ(氨氮)为0,16,32,64 和128 mg/L,0 为对照组,其他浓度为处理组。每个浓度梯度的养殖槽,放入20 只经暂养健康的放逸短沟蜷。每个浓度设置3 个平行组。
试验药物分别为硫酸铜(国药集团化学试剂有限公司,AR)和氯化铵(国药集团化学试剂有限公司,AR)配成的1,10 g/L 母液溶液。
将放逸短沟蜷暂养48 h 后,在38 cm×28 cm×15 cm 的养殖槽中进行试验。试验用水为经沉淀、砂滤、曝气后的自来水,水温(25±1)℃,pH 值为(7.5±0.1),维持自然光照。试验周期为48 h,每12 h 更换试验药物溶液1 次。试验期间不投喂。试验开始后分别于6,12,24,30,36 和48 h 记录死亡数量,清除死亡个体并计算死亡率。
1.4 超氧化物歧化酶、过氧化氢酶和丙二醛活性的测定
根据急性毒性试验结果,分别设置Cu2+浓度依次为0(对照组),0.25(低浓度组)和1.00 mg/L(高浓度组)。氨氮浓度依次为0(对照组),32(低浓度组)和128 mg/L(高浓度组);每个浓度梯度设置3 个平行,每个浓度的养殖槽中放置20 只放逸短沟蜷。试验期间,水温(25±1)℃,pH 值为(7.5±0.1)。每12 h更换对应药物浓度的溶液。
在试验开始后的12,24,36 和48 h,分别从每组中随机取3 只放逸短沟蜷,敲破螺壳,取出放逸短沟蜷的肝脏,按1∶9 的比例,加入匀浆介质0.9%的生理盐水,于4 000 r/min 离心10 min,取上清液用于各项酶活性及含量的测定。超氧化物歧化酶(SOD)和过氧化物酶(CAT)的活性,以及丙二醛(MDA)含量的测定,均使用南京建成生物工程研究所生产的相应试剂盒进行。
1.5 数据分析
试验数据用Microsoft Excel 2021 分析处理后,使用SPSS 26.0 计算半致死浓度(LC50)、绝对致死浓度(LC100)和95%置信区间。安全浓度(SC)的计算公式采用96 h LC50计算[6]:
水体中分子氨对放逸短沟蜷的胁迫有着重要的作用,其含量用下式表示[7]:
式中:pKa——离解常数;
pH——pH 值。
式中:T——热力学温度,K;T=273+t;
t——试验水温,℃。
试验数据的统计分析使用SPSS 26.0。先对数据进行单因素方差分析(ANOVA),处理间若有显著差异,再用Duncan 法比较均值间的差异显著性(P<0.05)。
2 结果与分析
2.1 氨氮对放逸短沟蜷的急性毒性效应
本试验发现,在氨氮胁迫下,随着药物浓度的增加或胁迫时间的延长,放逸短沟蜷的摄食量减少,爬壁行为减少,逐渐翻背,最后死亡。氨氮对放逸短沟蜷的致死效应见表1。由表1 可见,ρ(氨氮)较低且在短时间内胁迫时,各组放逸短沟蜷并未出现死亡。但随着ρ(氨氮)增加和胁迫时间的延长,放逸短沟蜷的死亡率也逐渐增加。说明当水体中含有一定浓度的氨氮时,会对放逸短沟蜷产生一定的致死作用。经统计分析可得,氨氮胁迫对短沟蜷48 h LC50为35.51 mg/L,SC 为3.51 mg/L。
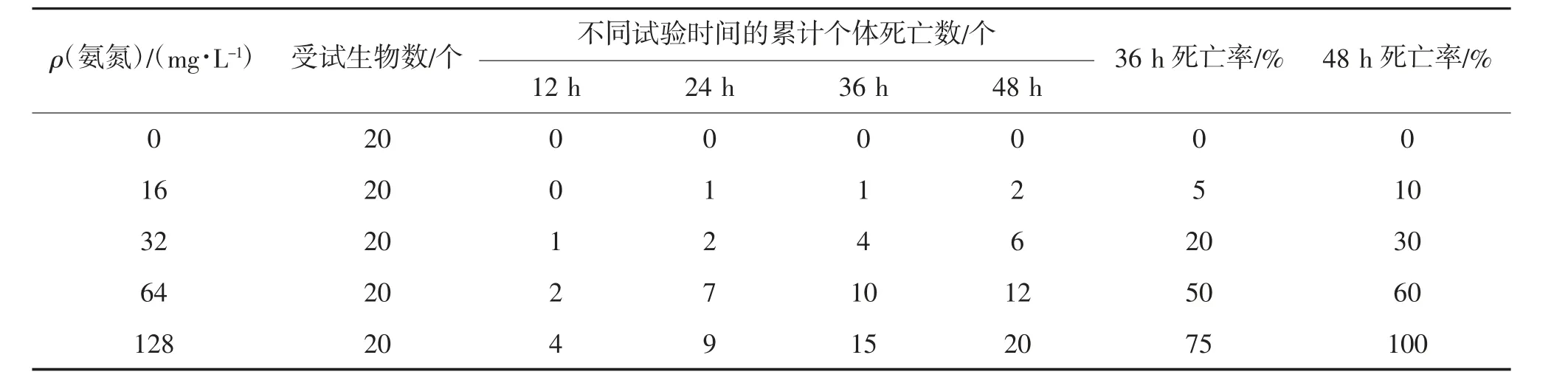
表1 氨氮对放逸短沟蜷的致死效应
2.2 Cu2+对放逸短沟蜷的急性毒性效应
本试验中,与一些软体动物类似,在Cu2+胁迫下,放逸短沟蜷先是“假死”状态,然后缓慢移动,随着药物浓度增加或时间的延长,对外界刺激反应迟钝,沉于水底,身体僵硬,最后死亡。Cu2+对放逸短沟蜷的致死效应见表2。由表2 可见,低浓度的Cu2+胁迫的时间较短时,各组放逸短沟蜷未出现死亡。但随着ρ(Cu2+)的增加,且高浓度的Cu2+作用的时间延长时,放逸短沟蜷的死亡率也逐渐上升。说明Cu2+对放逸短沟蜷的致死作用与药物的浓度和药物胁迫时间长短有关。

表2 Cu2+对放逸短沟蜷的致死效应
经统计分析可得,Cu2+对放逸短沟蜷48 h LC50为0.835 mg/L,SC 为0.083 5 mg/L。
2.3 Cu2+、氨氮对放逸短沟蜷肝脏CAT 活性
Cu2+、氨氮对放逸短沟蜷肝脏CAT 活性见图1(a)(b),由图1 可见,在Cu2+胁迫下,各Cu2+处理组放逸短沟蜷肝脏的CAT 活性均比对照组低,且随着胁迫时间的延长,CAT 活性呈现先降低后升高又降低的波浪式变化。各时间低、高浓度组的CAT 活性均显著低于对照组(P<0.05)。当0.25 mg/L Cu2+处理组和1 mg/L Cu2+处理组胁迫到36 h 时,CAT 活性略有回升,但仍低于对照组。在氨氮胁迫下,氨氮处理组放逸短沟蜷肝脏的CAT 活性均显著低于对照组(P<0.05),在氨氮的处理浓度分别为32 和128 mg/L 时,随时间的增加,放逸短沟蜷肝脏的CAT 活性均呈现了先降低后升高的趋势。当放逸短沟蜷分别在Cu2+和氨氮处理后,其肝脏的CAT 活性均低于对照组,说明在一定程度上2 种药物对放逸短沟蜷肝脏的CAT 活性产生了抑制作用。
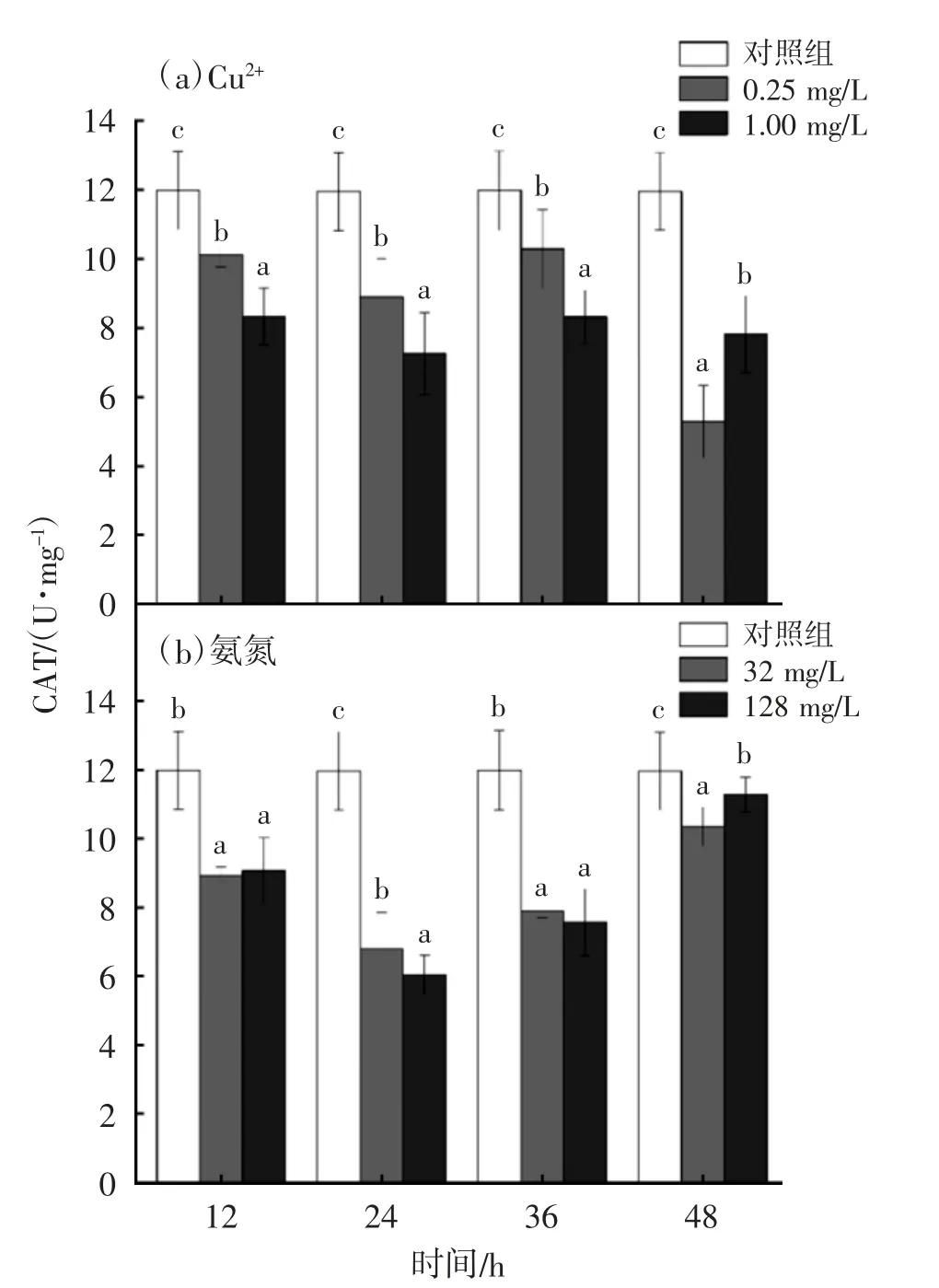
图1 Cu2+、氨氮对放逸短沟蜷肝脏CAT 活性
2.4 Cu2+、氨氮对放逸短沟蜷肝脏SOD 活性
Cu2+、氨氮对放逸短沟蜷肝脏SOD 活性的影响见图2(a)(b)。由图2 可见,各Cu2+处理组放逸短沟蜷肝脏的SOD 活性,均显著低于对照组(P<0.05)。ρ(Cu2+)为0.25 mg/L、12~24 h 时,放逸短沟蜷肝脏的SOD 活性升高,随着时间的延长,SOD 活性呈先降低后升高的趋势,说明一定浓度的Cu2+对SOD的活性存在促进作用。ρ(Cu2+)为1.00 mg/L 的处理组中,放逸短沟蜷肝脏的SOD 活性整体呈先降低后升高的趋势。ρ(氨氮)为32 和128 mg/L 时,放逸短沟蜷肝脏的SOD 活性均呈现先降低后升高的趋势,且各处理组SOD 活性显著低于对照组(P<0.05)。在处理后48 h 时,ρ(氨氮)为128 mg/L 的处理组放逸短沟蜷肝脏的SOD 活性低于对照组,对SOD 活性具有抑制作用。

图2 Cu2+、氨氮对放逸短沟蜷肝脏SOD 活性的影响
2.5 Cu2+、氨氮对放逸短沟蜷肝脏MDA 含量
Cu2+、氨氮对放逸短沟蜷肝脏MDA 含量的影响见图3(a)(b)。由图3 可见,在Cu2+胁迫下,ρ(Cu2+)为0.25 和1.00 mg/L 处理组中,放逸短沟蜷肝脏的MDA 含量均显著高于对照组(P<0.05);随着处理时间的增加,处理组放逸短沟蜷肝脏的MDA 含量均增加。在氨氮胁迫下,处理组放逸短沟蜷肝脏MDA的活性均显著高于对照组(P<0.05),氨氮质量浓度为32 和128 mg/L 的处理组中,随着时间的增加,放逸短沟蜷肝脏的MDA 含量逐渐上升。当放逸短沟蜷在Cu2+和氨氮的胁迫下,其肝脏的MDA 含量会随时间的增加而累积。

图3 Cu2+、氨氮对放逸短沟蜷肝脏MDA 含量的影响
3 讨论
3.1 氨氮和Cu2+对放逸短沟蜷的急性致毒效应特征
在氨氮和Cu2+胁迫下,生物体内产生的活性氧自由基会导致脂质过氧化[8],MDA 是其主要代谢产物。MDA 是一种细胞膜被氧化破坏的指示物,很大程度上可反映出生物受胁迫的程度[9]。MDA 与抗氧化酶可反映出放逸短沟蜷的机体受损程度。放逸短沟蜷肝脏产生的MDA 使脱氧核糖核酸、膜蛋白和酶产生交联反应,增加了膜的通透性,从而改变细胞膜结构,影响膜的功能和代谢,损伤细胞[10]。本试验中,由于过剩的活性氧自由基会攻击不饱和脂肪酸双键,使肝脏膜磷脂中的脂质发生过氧化反应,从而MDA 的含量上升[11]。
在抵御氧化性损伤中,SOD 是一种金属酶[8],具有抗氧化防御的功能,能够催化超氧阴离子自由基歧化,使其生成氧和过氧化氢,在机体氧化与抗氧化平衡中有着重要的作用。SOD 可以增强吞噬细胞的防御功能以及机体的免疫功能[12]。CAT 是生物体内重要的保护酶之一,可以催化H2O2分解为水和氧,保护生物体组织免受毒害[13]。因此SOD 和CAT的活性变化会作为指示污染胁迫的重要标志物[14]。
3.2 Cu2+对放逸短沟蜷急性毒性的效应
在本试验中,随着Cu2+浓度的逐渐提高,放逸短沟蜷的死亡率随之上升。在高浓度Cu2+的胁迫下,放逸短沟蜷肝脏的CAT 和SOD 活性要显著低于对照组,抑制了CAT 和SOD 的活性,且其肝脏的MDA 含量也较对照组高。重金属Cu2+是属于剧毒型的金属,容易被生物体吸收,并且对环境有持久性影响,从而影响水生动物的生理和行为。硫酸铜常被用在水产养殖中[15],当硫酸铜在动物体内富集到一定程度时,就会对生物体有毒害作用,导致水生动物Cu2+中毒,已经成为重金属污染物[16]。2014年,有研究发现,在Cu2+胁迫下,方形环棱螺移动缓慢,随着时间的延长,大多数螺会厣紧缩且不再移动,继而死亡[17]。
3.3 氨氮对放逸短沟蜷急性毒性的效应
本试验中,放逸短沟蜷肝脏的CAT 和SOD 活性受到抑制,其肝脏MDA 含量大量增加。氨氮浓度越高,其毒性越强,放逸短沟蜷死亡率越高。因此,在养殖过程中要尽量降低养殖水体中氨氮的浓度。当鱼受到轻度的环境胁迫时,会诱导SOD 活性,当受到重度环境胁迫时,SOD 活性会被抑制[18]。氨氮由2 种不同的化学物质组成,即离子态铵和游离的分子态氨[19],其中离子态铵是水体中的主要营养盐类,对放逸短沟蜷的影响小,游离的分子态氨则是水产养殖水体中的有毒有害物质,其平衡受pH 值、水温、盐度、CO2等因子的影响[20]。由于分子态氨为亲脂性分子,半径较小,容易穿透生物膜的疏水性微孔进入生物肝脏,对鱼贝类的生长繁殖带来危害[4,21-22],同时也使其抵抗力和免疫力降低[23-24]。分子态氨可以降低鱼类的能量代谢,对其鳃、肝等组织造成损伤[25],使其呼吸困难,最后出现器官衰竭等生理毒性反应[26]。
4 结语
本试验表明,放逸短沟蜷对高浓度的重金属Cu2+和氨氮较为敏感。因此,在进行放逸短沟蜷人工育苗时,应要注意对水质的监测,将水体重金属Cu2+和氨氮的含量控制在安全浓度范围内,防止水体中有高浓度的重金属Cu2+和较高含量的氨氮,对放逸短沟蜷造成胁迫,甚至产生中毒现象,从而降低其成活率,导致育苗失败。
