扫频源OCTA对系统性红斑狼疮患者黄斑区脉络膜厚度及微循环改变的评估
2024-01-24毕萌樊芳夏会卡梁福珍季彤张风肖贾志旸
毕萌 樊芳 夏会卡 梁福珍季彤 张风肖贾志旸
1华北理工大学研究生院,唐山063210;2河北省人民医院眼科,石家庄050057;3河北医科大学研究生院,石家庄050000;4河北省人民医院风湿免疫科,石家庄050057
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种全身性、慢性自身免疫性结缔组织病,损伤可累及多种器官,约1/3患者眼部受累[1]。SLE常见的眼部临床表现包括干燥性角结膜炎、视网膜及脉络膜血管炎、视神经损害等,其中视网膜及脉络膜血管炎的发病率约为10%,是导致患者视力严重损害的主要原因[2-3]。SLE患者眼部血管受累时可引发眼底微血管病变,狼疮性视网膜病变(lupus retinopathy,LR)为其主要表现之一,脉络膜也会受到不同程度影响[4-5]。研究表明,脉络膜视网膜病变是SLE处于疾病活动期的敏感指标,其存在往往表明患者可能同时合并狼疮性肾病,且SLE患者的脉络膜厚度改变还与其中枢神经系统受累相关[6-7]。因此,对SLE患者视网膜及脉络膜微观结构与微循环变化进行评估,一定程度上有助于SLE疾病进展的早期监测和及时干预,为患者的预后评估提供一定参考。光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA)技术具有无创、快速、高分辨率、可定量测量眼底微血管等优点,广泛应用于眼底血管疾病及影响眼部血管的全身血管性疾病研究[8-10]。以往研究中多侧重于应用OCTA观察SLE患者的视网膜微循环变化[11-13],而对脉络膜微循环变化研究较少;但脉络膜受免疫系统、全身血管异常及各种炎症的影响较大,因此有必要对SLE患者脉络膜厚度及血流变化等观察指标进行检测。在SLE患者脉络膜微循环相关研究中,多采用脉络膜血管指数及脉络膜毛细血管丛(choriocapillaris,CC)血流密度等指标,目前尚无对SLE患者脉络膜毛细血管流空(flow deficits,FDs)的研究。FDs的概念最初由Spaide[14]提出以评估脉络膜血流的变化情况,并广泛应用于正常人、年龄相关性黄斑变性(age-related macular degeneration,AMD)及中心性浆液性脉络膜视网膜病中[15-17]。本研究采用OCTA检测并比较无明显眼部症状的亚临床LR患者与健康对照人群黄斑区平均脉络膜厚度、视网膜浅层毛细血管丛(superficial capillary plexus,SCP)及视网膜深层毛细血管丛(deep capillary plexus,DCP)血流密度、CC血流密度、脉络膜毛细血管FDs平均面积(flow deficits area,FDa)和FDs百分比(percentage of flow deficits,FD%)的差异,从而探讨SLE患者黄斑区早期脉络膜微血管的变化特征,为SLE早期眼科检查和随访监测提供参考依据。
1 资料与方法
1.1 一般资料
采用横断面研究方法,纳入2022年1-7月就诊于河北省人民医院风湿免疫科门诊的SLE患者37例作为SLE组,病程3.17(1.04,6.36)年,同期纳入体检中心的健康受试者35名作为对照组,所有入组受试者均任意随机选取一眼纳入统计分析。SLE组纳入标准:(1)符合SLE诊断标准[18];(2)不合并其他自身免疫性疾病;(3)无明显眼部症状,如视物模糊、变形等,能配合眼科检查。SLE组排除标准:(1)等效球镜度>+2.00 D或<-6.00 D,眼轴长度>26 mm;(2)屈光间质严重混浊影响成像质量者,如患有白内障、大量眼底出血等;(3)患有基础性疾病者,如高血压、糖尿病;(4)有其他眼底疾病史者,如视网膜静脉阻塞、AMD等;(5)有眼外伤或眼内手术史者;(6)诊断为LR或氯喹/羟氯喹相关性视网膜脉络膜病变者;(7)图像质量差(图片信号强度指数<55或存在明显伪影)者。对照组纳入标准:(1)与病例组年龄及性别相匹配;(2)经检查无眼部疾病。对照组排除标准:(1)患有或既往合并风湿免疫性疾病者;(2)患有高血压、糖尿病等全身基础性疾病者;(3)无法配合眼科检查者。2个组最佳矫正视力、年龄、眼轴长度、眼压比较,差异均无统计学意义(表1)。本研究方案遵循《赫尔辛基宣言》,经河北省人民医院医学伦理委员会审批(批文号:202310),并获得所有受检者的知情同意。
1.2 方法
1.2.1眼部检查 采用标准对数视力表(XK100-02型,温州星康医学科技有限公司)进行插片验光以检查受试者最佳矫正视力;采用非接触式眼压计(CT-80A型,日本Topcon公司)测量受试者眼压;采用IOLMaster 500(德国ZEISS公司)测量受试者眼轴长度;采用裂隙灯显微镜(SL-2G,日本Topcon公司)检查受试者双眼眼前节情况,排除不符合相应标准的受试者;复方托吡卡胺滴眼液(规格:10 ml含复方托吡卡胺50 mg、盐酸去氧肾上腺素50 mg)点眼扩瞳后,采用眼底照相机(VISUCAM 200,德国ZEISS公司)检查受试者双眼黄斑、视盘、后极部及周边视网膜等情况,排除有眼底异常改变的受试者;采用Humphrey Field Analyzer全自动视野计(德国ZEISS公司)检查病例组受试者视野情况,排除视野结果异常的受试者。因眼轴长度及脉络膜厚度受生理节律影响,所有检查均在北京时间8:00-12:00完成。
1.2.2OCTA检查受试者脉络膜厚度 由同一经验丰富的医师采用DRI-OCT Triton(日本Topcon公司)的Radial模式拍摄受试者黄斑区9 mm×9 mm范围的图片,重复拍摄3次,取图像质量较高的图片进行分析。采用仪器内置软件(版本1.28)对所采集的图像进行自动分层(若不准确则进行手动矫正),并参照ETDRS分区(图1)标准将测量范围分为黄斑中心1 mm的圆形区域(中心凹下)、1~3 mm的环形区域(旁中心凹)和3~6 mm的环形区域(中心凹周围),分别计算每个区域平均脉络膜厚度。
1.2.3OCTA检查受试者FDs面积及百分比 由同一位经验丰富的医师采用DRI-OCT Triton(日本Topcon公司)的Angio模式拍摄黄斑区3 mm×3 mm范围内眼底血流图片,重复拍摄3次,将图像质量较高的CC层(Bruch膜下边界至下方10.4 μm)血流图像(图2A)导入ImageJ软件(版本2.0.0),再按照Rochepeau等[19]的步骤计算FDa及FD%。具体步骤为:(1)将CC层图像转化为8-bit格式,使用Phansalkar法对图像进行二值化处理(窗口半径选择15像素),图像被转换成黑白像素图(图2B),其中白色像素区域被视为流空区域;(2)使用Set scale功能将每个像素值转化为mm2;(3)使用Analyze Particles tool功能对二值化后的图像进行计算,FDa被定义为白色阈值面积的总和,FD%被定义为白色阈值面积占总面积的百分比。

图2 脉络膜毛细血管图像处理 A:脉络膜毛细血管层血流图像 B:Phansalkar法(窗口半径=15像素)二值化处理后的脉络膜毛细血管层血流图像 白色像素代表脉络膜毛细血管流空区域 C:黄色选中区域代表脉络膜毛细血管流空区域
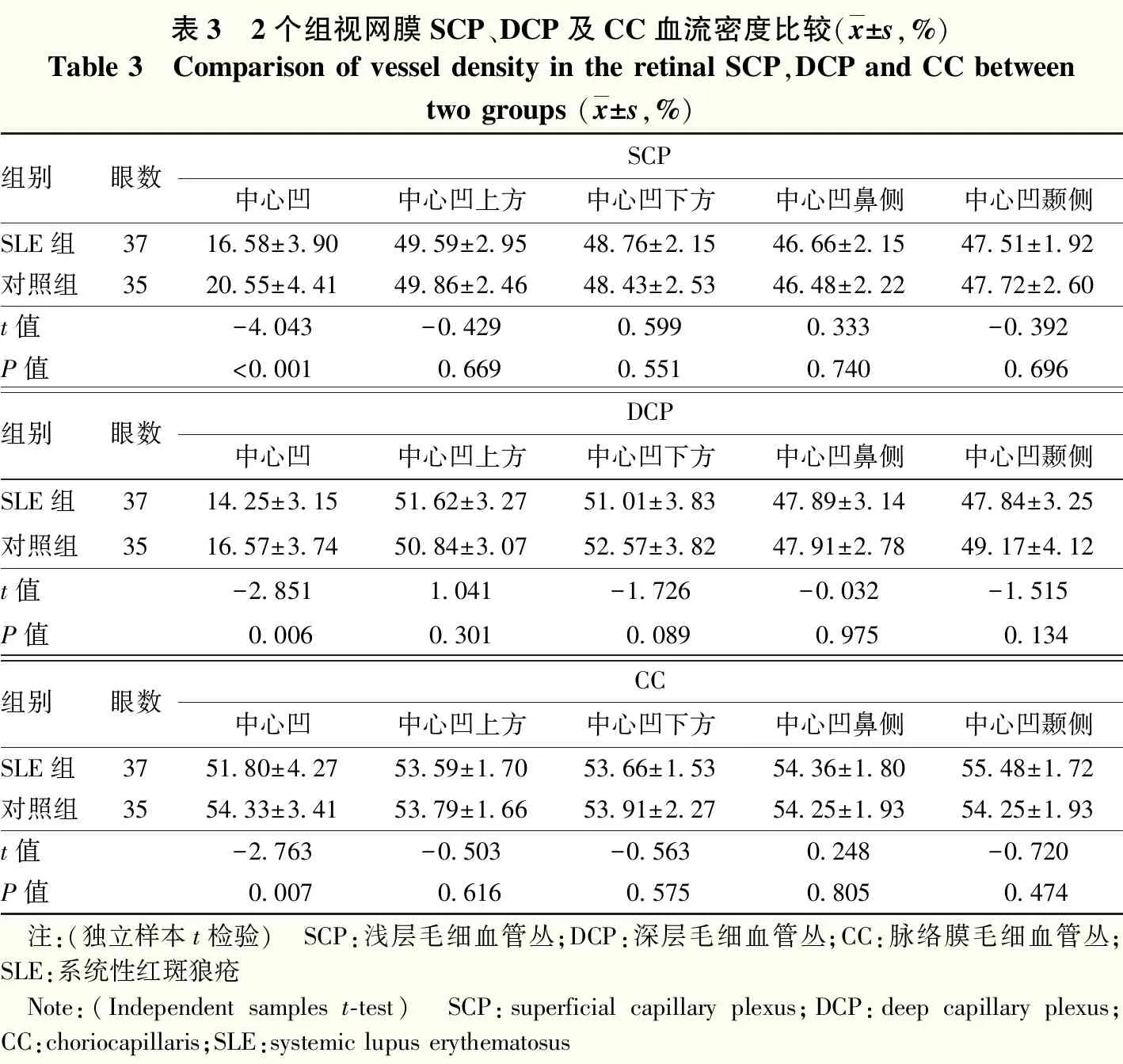
表3 2个组视网膜SCP、DCP及CC血流密度比较(x±s,%)Table 3 Comparison of vessel density in the retinal SCP,DCP and CC betweentwo groups (x±s,%)组别眼数SCP中心凹中心凹上方中心凹下方中心凹鼻侧中心凹颞侧SLE组3716.58±3.9049.59±2.9548.76±2.1546.66±2.1547.51±1.92对照组3520.55±4.4149.86±2.4648.43±2.5346.48±2.2247.72±2.60t值-4.043-0.4290.5990.333-0.392P值<0.0010.6690.5510.7400.696组别眼数DCP中心凹中心凹上方中心凹下方中心凹鼻侧中心凹颞侧SLE组3714.25±3.1551.62±3.2751.01±3.8347.89±3.1447.84±3.25对照组3516.57±3.7450.84±3.0752.57±3.8247.91±2.7849.17±4.12t值-2.8511.041-1.726-0.032-1.515P值0.0060.3010.0890.9750.134组别眼数CC中心凹中心凹上方中心凹下方中心凹鼻侧中心凹颞侧SLE组3751.80±4.2753.59±1.7053.66±1.5354.36±1.8055.48±1.72对照组3554.33±3.4153.79±1.6653.91±2.2754.25±1.9354.25±1.93t值-2.763-0.503-0.5630.248-0.720P值0.0070.6160.5750.8050.474 注:(独立样本t检验) SCP:浅层毛细血管丛;DCP:深层毛细血管丛;CC:脉络膜毛细血管丛;SLE:系统性红斑狼疮 Note:(Independent samples t-test) SCP:superficial capillary plexus;DCP:deep capillary plexus;CC:choriocapillaris;SLE:systemic lupus erythematosus
1.2.4OCTA检查受试者黄斑区各层血流密度 由同一经验丰富的医师采用DRI-OCT Triton(日本Topcon公司)的Angio模式拍摄黄斑区3 mm×3 mm范围内眼底血流图片,重复拍摄3次,取图像质量较高的图片进行分析。采用仪器内置软件对所采集的图像自动分层(若不准确则进行手动矫正),并自动分析各个层面及各个区域的血流密度值(血流密度值=血管占据区域面积/拍摄区域总面积)。
1.3 统计学方法
2 结果
2.1 2个组脉络膜厚度比较
SLE组黄斑中心凹区域平均脉络膜厚度较对照组明显增厚,差异有统计学意义(t=2.170,P=0.033)。SLE组旁中心凹及中心凹周围区域平均脉络膜厚度厚于对照组,但差异均无统计学意义(t=1.834、1.319,均P>0.05)(表2)。
2.2 2个组黄斑区各层不同区域血流密度比较
SLE组中心凹区域SCP、DCP及CC血流密度较对照组下降,差异均有统计学意义(t=-4.043,P<0.001;t=-2.851,P=0.006;t=-2.763,P=0.007),2个组间其余区域SCP、DCP及CC血流密度比较差异均无统计学意义(均P>0.05)(表3)。
2.3 2个组FDa及FD%比较
与对照组相比,SLE组FDa及FD%明显增大,差异均有统计学意义(Z=-3.470、-3.476;均P=0.001)(表4)。
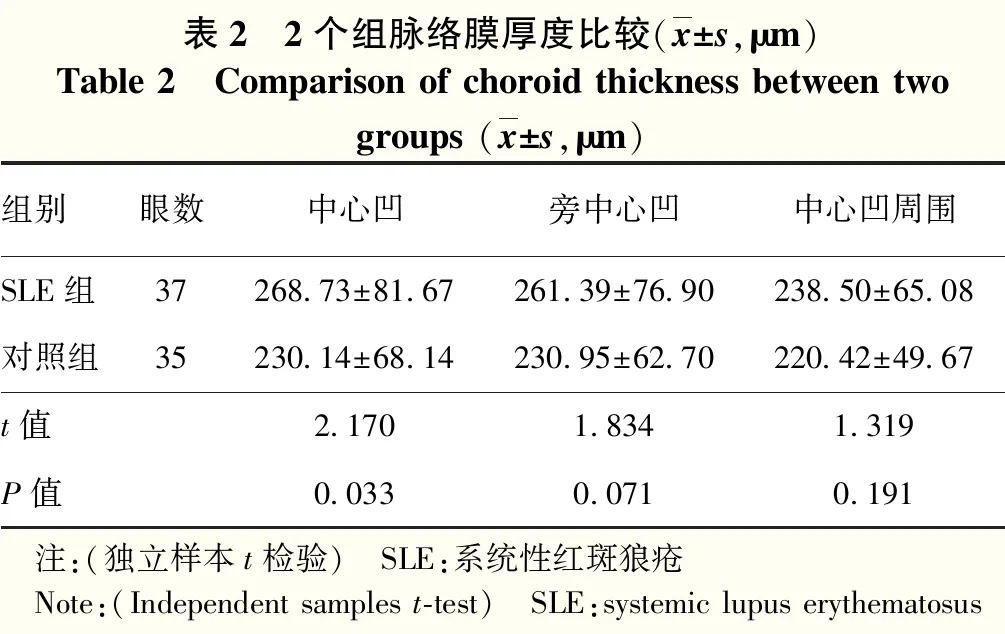
表2 2个组脉络膜厚度比较(x±s,μm)Table 2 Comparison of choroid thickness between twogroups (x±s,μm)组别眼数中心凹旁中心凹中心凹周围SLE组37268.73±81.67261.39±76.90238.50±65.08对照组35230.14±68.14230.95±62.70220.42±49.67t值2.1701.8341.319P值0.0330.0710.191 注:(独立样本t检验) SLE:系统性红斑狼疮 Note:(Independent samples t-test) SLE:systemic lupus erythematosus
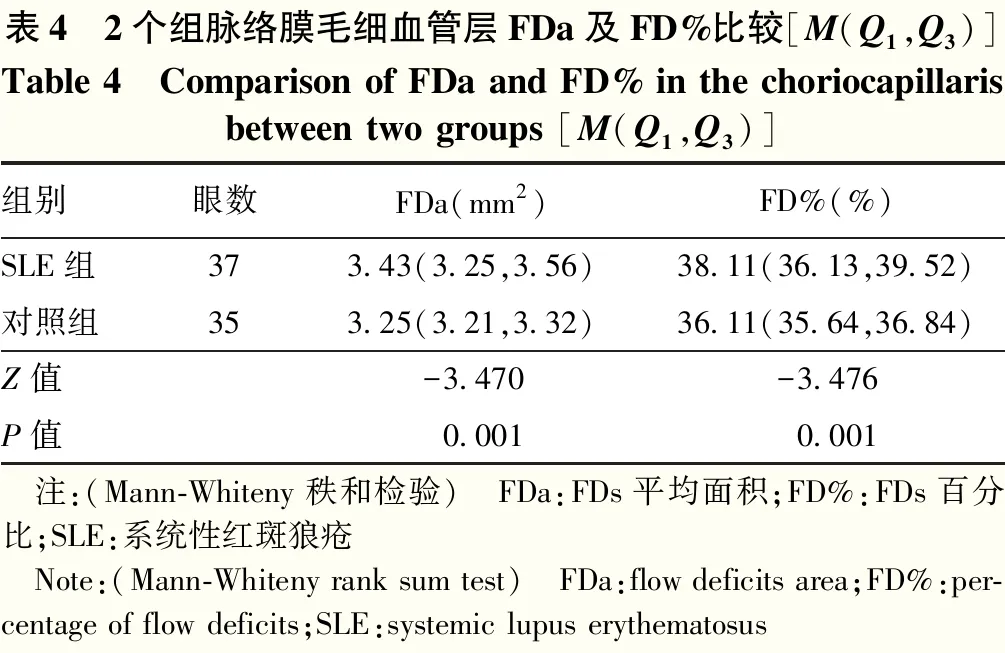
表4 2个组脉络膜毛细血管层FDa及FD%比较[M(Q1,Q3)]Table 4 Comparison of FDa and FD% in the choriocapillarisbetween two groups [M(Q1,Q3)]组别眼数FDa(mm2)FD%(%)SLE组373.43(3.25,3.56)38.11(36.13,39.52)对照组353.25(3.21,3.32)36.11(35.64,36.84)Z值-3.470-3.476P值0.0010.001 注:(Mann-Whiteny秩和检验) FDa:FDs平均面积;FD%:FDs百分比;SLE:系统性红斑狼疮 Note:(Mann-Whiteny rank sum test) FDa:flow deficits area;FD%:per-centage of flow deficits;SLE:systemic lupus erythematosus
3 讨论
与其他自身免疫性疾病类似,SLE可以诱发血管炎或干扰正常血管调节机制,从而间接影响全身血管系统[20-21]。当眼部视网膜及脉络膜血管受累时,免疫复合物介导的微血管病变可导致脉络膜毛细血管管壁免疫复合物沉积,从而影响脉络膜厚度变化。有研究表明,脉络膜厚度是提示SLE患者疾病严重程度的指标,是反映疾病活动度的敏感标志物[22-23]。此外,流行病学研究显示,脉络膜可能与SLE疾病活动度或SLE的发病率相关[24]。因此,对SLE患者脉络膜的相关研究具有一定的诊断、监测及预后评估价值。本研究采用OCTA对SLE患者黄斑区脉络膜厚度及脉络膜血流进行定量分析,发现尚无眼部临床表现的SLE患者黄斑区脉络膜厚度增厚、CC层微循环发生改变的特征,这些特征为SLE患者眼底微血管变化的早期诊断提供了依据,为SLE患者眼底损害的早期干预提供一定参考价值。
本研究中,SLE组黄斑中心凹区域的视网膜SCP、DCP血流密度均较对照组显著降低,其余区域SCP、DCP血流密度与对照组相比差异均无统计学意义。以往研究显示,SLE患者各个区域的SCP、DCP血流密度与对照组相比均不同程度降低,且SCP降低可能是SLE活动和不良预后的标志[34-37]。有研究表明,在接受羟氯喹治疗超过5年的SLE患者中可观察到SCP及DCP的降低[38],而在接受羟氯喹治疗少于5年时,HCQ对视网膜微血管血流密度的降低有一定的保护作用[39]。An等[36]的研究中排除了使用过氯喹/羟氯喹药物的患者,而本研究中纳入的大部分患者使用HCQ治疗不超过5年,可能是导致本研究除中心凹以外区域结果差异不显著的原因之一。Bao等[35]的研究中也纳入了使用羟氯喹的患者,其中大部分患者处于SLE急性活动期,而本研究纳入的SLE患者均处于缓解期,2项研究纳入对象的疾病活动程度不同。有研究指出,SLE疾病的活动度与SCP及DCP血流密度呈明显负相关[40]。本研究推测,中心凹以外区域的SCP及DCP血流密度降低不显著的原因可能与研究对象所处的疾病活动度相对稳定有关。
本研究还发现,SLE组中心凹下CC层血流密度值显著降低,而FDa及FD%较对照组显著增加。Forte等[38]也发现了SLE患者CC层血流密度的异常降低,CC层血管变得稀疏,且这种血管异常与接受羟氯喹治疗的时间及累积剂量相关。相关研究指出,SLE患者的脉络膜血管内皮受到抗体攻击后,通过干扰抗血栓因子合成、增加内皮细胞与单核细胞之间的相互作用、激活补体依赖性内皮细胞、产生促炎因子等方式,持续损害脉络膜血管内皮细胞[41]。因此,推测CC层血流密度下降可能与SLE疾病对脉络膜血管的损害有关。然而,由于羟氯喹具有眼部毒性作用,尚不能排除药物本身可能对脉络膜血管产生的损伤作用。在以往中心性浆液性脉络膜视网膜病、AMD及糖尿病视网膜病变等的研究中,均发现了FDa及FD%明显扩大,且证实其对应扩大区域存在脉络膜毛细血管损伤[9,16-17]。本研究也发现了SLE组的FDa及FD%较对照组显著增加,可能与SLE患者脉络膜毛细血管也存在一定损伤导致血流灌注缺陷有关;这也与本研究中SLE组CC层血流密度下降的结果相符,但尚需相关实验室研究证据的支持。
本研究存在一定的局限性:(1)本研究纳入的样本量较小且未对患者进行随访,未来仍需更大样本量、随访时间更长的纵向研究来观察SLE患者脉络膜微血管随疾病进展的变化特征。(2)本研究未详细记录SLE组使用羟氯喹的具体情况以及疾病活动情况。羟氯喹对视网膜具有一定的毒性作用,但最新研究认为HCQ对视网膜的毒性作用并不通过血管介导[42],本研究中纳入的SLE患者中使用羟氯喹治疗不超过5年者约占70%,且本研究排除了诊断为氯喹/羟氯喹视网膜病变的患者,故推测HCQ对本研究结果的影响较小。(3)本研究对CC血流密度研究的范围较小(3 mm×3 mm),未来应关注更大范围成像区域内CC的变化特征,以更全面地了解SLE患者脉络膜微血管的变化情况。
综上所述,本研究发现与正常人相比,无眼部临床症状的SLE患者黄斑中心凹区域的脉络膜厚度增加,黄斑中心凹区域的视网膜浅层、深层毛细血管丛血流密度及CC层密度降低,且脉络膜的FDa及FD%扩大。OCTA对SLE患者黄斑区脉络膜微循环的定量检测有助于评估患者早期眼底病变,从而及早进行干预以期改善患者的视功能预后。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明毕萌:直接参与选题、酝酿和设计试验、采集数据、分析/解释数据、起草文章、文章修改;樊芳、夏会卡:参与文章修改、数据分析;梁福珍、季彤、张风肖:参与采集数据;贾志旸:设计试验、对文章的知识性内容做批评性审阅及定稿
