废铁屑制备三草酸合铁酸钾虚实结合的综合化学实验设计
2024-01-23庞海丽崔斌王建坤张荣兰周利君朱黎霞
庞海丽,崔斌,王建坤,张荣兰,周利君,朱黎霞
1西安电子科技大学先进材料与纳米科技学院,西安 710126
2西北大学化学与材料科学学院,西安 710127
综合化学实验是化学专业本科生实践教学的重要课程,是学生在完成基础理论课和基础实验课学习后向毕业设计过度的重要教学环节。随着高校创新型人才培养理念的发展,理工科学生的培养注重在夯实专业知识的基础上进一步提高分析和解决实际问题的能力,实现知识、能力和素质的协同发展。因此,开设综合型化学实验无疑是实现化学专业人才培养目标的有效途径[1,2],是提高教学质量和实现实践教学改革目标的重要手段[3]。“化学专业综合设计性实验”是我校应用化学专业学生必修的一门专业实验课,其将无机化学、分析化学、物理化学、有机化学等学科及其他相关学科的实验教学内容有机融合,注重培养学生的专业综合素质。通过该课程的学习,可以进一步巩固学生的基础理论、基本技能和专业知识,使之系统化和综合化,同时提高学生分析和解决问题的能力及科学创新能力。
三草酸合铁酸钾是一种经典的光敏剂,常用作化学光量计,是制备负载型活性铁催化剂的主要原料,同时也是一些有机反应的催化剂,因而具有工业应用价值。其合成路线一般有两种,一种是以硫酸亚铁铵为原料,加草酸制得草酸亚铁后经氧化配位得到三草酸合铁酸钾;另一种是以硫酸铁或三氯化铁与草酸钾为原料直接合成三草酸合铁酸钾。目前我国很多高校开设该实验[4,5],一般都是以硫酸亚铁铵为原料,因为其制备过程涉及称量、热控、干燥、倾析、过滤、蒸发浓缩、晶体培养等一系列化学基本操作,以及沉淀溶解、氧化还原、配位、除杂、提高产率和绿色化学教育等化学基本原理的应用,是一个综合培养学生动手能力、观察能力、独立分析和解决问题能力的实验项目。
本文立足“化学专业综合设计性实验”课程的培养目标,将无机化学中硫酸亚铁铵的制备、三草酸合铁酸钾的制备和分析化学中组成测定实验综合到一起,同时利用红外光谱仪(IR)和X射线衍射仪(XRD)对产品进行表征,开发了一个化学综合设计实验项目,可列入“化学专业综合设计实验”项目中。该实验传统且经典,但以往教材上的制备方法存在试剂使用量大、操作步骤较笼统、易产生副产物等问题,导致很多学生最终得不到晶体或者产率太低,因而无法完成组成测定;同时实验产生的有毒气体和产品洗涤使用的丙酮会对人体产生危害且严重污染环境。本文在传统教材和前人研究成果[6-8]的基础上,对该实验进行了设计性、探究性和绿色化改进(图1),同时融入了思政教育。主要表现在:采用密封装置制备硫酸亚铁以防止水分蒸发,同时尾气用碳酸钠溶液吸收,提高学生环保意识,践行绿色化学理念;增加了自制硫酸盐亚铁铵作为实验原料的纯度分析实验,增强学生的实验责任心;自主设计三草酸合铁酸钾溶液的析晶方式,培养学生的创新精神;增加线上虚拟仿真实验操作,提高学生的实验成功率和积极性;产品分析环节增加了配合物内外界判断和结构表征实验,培养学生科学严谨的方法论和探索精神;实验中涉及多个颜色变化和晶体培养,鼓励学生仔细观察并实时拍摄,从而感受化学之美,明白“化学变化是化学美之源”,以美育人,提高学生对化学学科的兴趣。
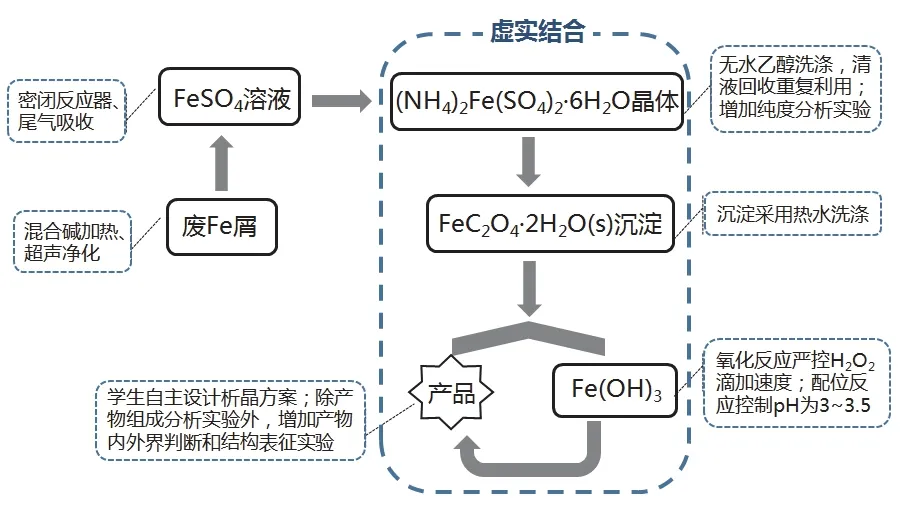
图1 实验设计框架图
1 实验目的
(1) 掌握利用铁屑制备三草酸合铁酸钾的原理和方法。
(2) 加深对Fe(II)和Fe(III)化合物的了解。
(3) 掌握确定配合物内外界和化学式的基本原理及方法。
(4) 巩固溶解、沉淀、减压过滤、蒸发浓缩、结晶和滴定等基本操作。
(5) 通过综合设计性实验的训练,培养学生创新能力及分析解决复杂问题的能力。
2 实验原理
(1) 硫酸亚铁铵的制备及其纯度测定。
硫酸亚铁铵是一种浅绿色单斜晶体,在空气中不易被氧化,溶于水但不溶于乙醇。像所有复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每个组分都小(表1)。因此,等物质的量硫酸亚铁和硫酸铵在水溶液中相互作用,得到的硫酸亚铁铵很容易在溶液中结晶析出。本实验以铁屑、硫酸和硫酸铵为原料,首先过量铁屑和硫酸反应制备硫酸亚铁溶液,再往该溶液中加入硫酸铵,混合均匀后加热浓缩、冷却结晶后得到硫酸亚铁铵。
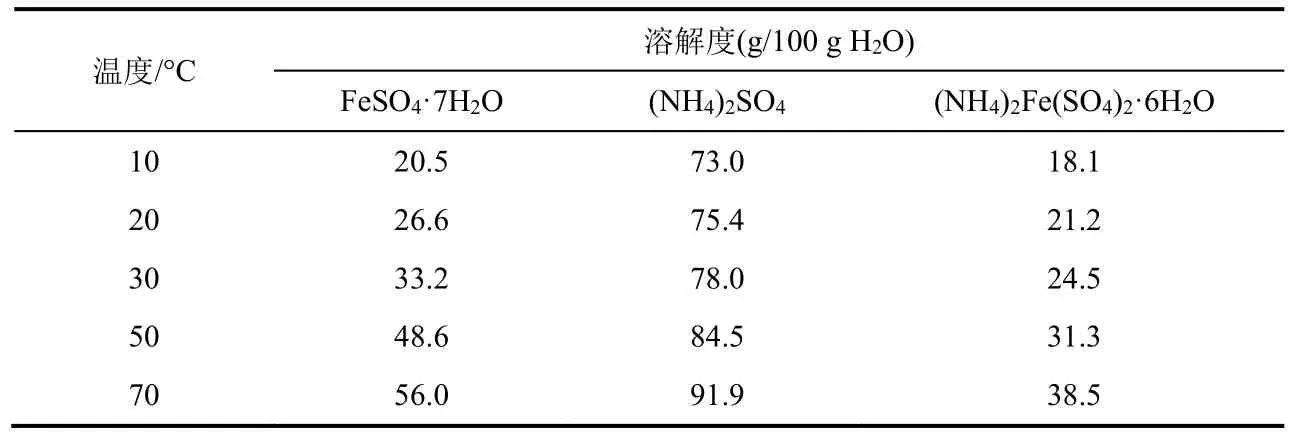
表1 (NH4)2Fe(SO4)2·6H2O及其组分的溶解度
采用高锰酸钾标准溶液滴定析晶产物中Fe(II)的含量。
Fe(II)的含量的计算公式如下:
式中:CKMnO4为高锰酸钾标准溶液的浓度(mol·L-1);VKMnO4为滴定所消耗高锰酸钾标准溶液的体积(mL);MFe为Fe的摩尔质量;m为所称取的样品质量(g)。然后根据Fe在FeSO4·(NH4)2SO4·6H2O中理论占比计算产物纯度。
(2) 三草酸合铁酸钾的制备。
三草酸合铁酸钾是一种翠绿色的单斜晶体,受光照易分解,溶于水而不溶于乙醇。以自制硫酸亚铁铵为原料,与草酸反应制备出草酸亚铁,草酸亚铁在草酸钾和草酸的存在下,被过氧化氢氧化为草酸高铁配合物,配合物溶液结晶后得到三草酸合铁酸钾晶体。反应式如下:
(3) 产物化学式的测定。
配合物中处于外界的离子以离子键和中心离子相联系,在溶液中可电离,内界离子以配位键与中心离子键连,在溶液中不电离。为了确定产物的内外界,可根据以下离子反应现象来判断:
若有沉淀生成或变色反应,说明所测离子处于配合物外界,若无现象则说明所测离子处于配合物内界。
K3[Fe(C2O4)3]·3H2O会在110 °C失去结晶水。若其起始质量为m,加热后完全失去结晶水后的质量为mt,则结晶水含量的计算公式如下:
3 实验仪器及试剂
仪器:台秤、电子天平、电炉、超声清洗机、烧杯、玻璃棒、pH试纸、量筒、布氏漏斗、滤纸、吸滤瓶、循环水泵、蒸发皿、泥三角、恒温磁力搅拌水浴锅、搅拌子、棉线、容量瓶、锥形瓶、酸碱滴定管、称量瓶、干燥器、鼓风干燥箱。X射线衍射仪(DX-2700BH,丹东浩元仪器有限公司),傅里叶红外光谱仪(FTIR-4100,日本分光株式会社)。
试剂:废铁屑、碳酸钠溶液(10%)、氢氧化钠溶液(1 mol·L-1)、硫酸溶液(3 mol·L-1)、硫酸铵、饱和草酸、饱和草酸钾、过氧化氢溶液(6%)、4A型分子筛、硝酸钾、无水乙醇、冰块、饱和酒石酸氢钠、硫氰化钾溶液(1 mol·L-1)、氯化钙溶液(0.5 mol·L-1)、草酸钠、硫磷混酸、高锰酸钾标准溶液(0.025 mol·L-1)、锌粉和溴化钾。所有试剂除废铁屑外均为分析纯。
4 实验步骤
4.1 (NH4)2Fe(SO4)2·6H2O的制备
(1) Fe屑净化:向3 g废铁屑中分别加6 mL 10% Na2CO3溶液和6 mL 1mol·L-1NaOH溶液,超声3-5 min,加热煮沸后冷却。倾析法弃除碱液,超声水洗至中性。
(2) FeSO4溶液制备:向净化后的Fe屑中加入15 mL 3 mol·L-1H2SO4溶液,水浴(75 °C)加热直至不再产生气泡(整个反应都在带冷凝和尾气吸收装置的反应器中进行),趁热抽滤,收集滤液至蒸发皿中,滴加H2SO4溶液调节pH为1-2。同时称量剩余铁屑质量,计算参加反应Fe的量。
(3) (NH4)2Fe(SO4)2·6H2O晶体制备:根据消耗Fe质量的85%计算需要加入的(NH4)2SO4质量,按量称取(NH4)2SO4固体配成饱和溶液加入到FeSO4母液中,水浴加热(90 °C)蒸发至表面出现一层晶膜,冷却至室温,过滤,用无水乙醇清洗2次,再用滤纸反复吸干晶体,称重后放入棕色干燥器中待用。
4.2 (NH4)2Fe(SO4)2·6H2O纯度的测定
(1) KMnO4标准溶液的标定:准确称取3份0.2-0.3 g干燥过的Na2C2O4,分别置于3个锥形瓶中,加30 mL水溶解,再加10 mL 3 mol·L-1H2SO4溶液,水浴(75 °C)加热至有热气,趁热用KMnO4标准溶液滴定,滴定至终点产生粉红色且30 s不褪色,记录消耗的溶液体积,平行测三次。
(2) Fe(II)含量测定:准确称取0.2-0.3 g产品3份置于3个锥形瓶中,加30 mL水溶解,再加10 mL H2SO4-H3PO4混酸,水浴(75 °C)加热至有热气,趁热用KMnO4标准溶液滴定,滴定至终点产生粉红色且30 s不褪色,记录消耗的溶液体积,平行测三次。
(3) 产品纯度计算:根据所测Fe(II)真实含量及(NH4)2Fe(SO4)2·6H2O中Fe的理论含量,计算产品的纯度。
4.3 K3[Fe(C2O4)3]·3H2O的制备
4.3.1 线上虚拟仿真实验操作
学生通过统一认证方式登录(http://hxxf.xidian.edu.cn)西安电子科技大学应用化学虚拟仿真实验平台,首先点击“我的实验”模块中的“应用化学三维虚拟仿真系统”,然后在右侧资源列表中点击“三草酸合铁(III)酸钾的制备”,接下来根据系统提示完成整套实验操作,熟悉整个制备流程和实验现象(图2)。

图2 三草酸合铁酸钾制备虚拟实验
4.3.2 线下实验室操作
(1) FeC2O4·2H2O的制备:称6 g自制(NH4)2Fe(SO4)2·6H2O晶体于250 mL烧杯中,加入18 mL水,用3 mol·L-1H2SO4溶液调节pH为1-2,加热溶解后再加30 mL饱和H2C2O4溶液,加热搅拌至沸后维持2 min,静置冷却。黄色沉淀用倾析法弃去上清液,加入15 mL热水清洗2-3次。
(2) K3[Fe(C2O4)3]·3H2O溶液制备:在上述沉淀中加入12 mL饱和K2C2O4溶液,水浴(40 °C)加热并搅拌,缓慢滴加(1滴/s)12 mL 6% H2O2溶液,加完后加热至微沸状态持续1 min,有红棕色沉淀生成。冷却至室温后边搅拌边缓慢加入饱和H2C2O4溶液,最终调节pH为3-3.5,便可以得到翠绿色K3[Fe(C2O4)3]·3H2O透明溶液。
(3) K3[Fe(C2O4)3]·3H2O晶体析出:准备了恒温水浴锅、电炉、干燥器、分子筛、棉线、硝酸钾、无水乙醇和冰块,学生需要通过查阅文献资料并结合所学理论知识自主设计实验方案,宗旨是析晶效率高、纯度高且绿色环保。晶体完全析出后抽滤,用无水乙醇清洗2次,放入鼓风干燥箱中60 °C干燥1 h,称重后放入干燥器。
4.4 K3[Fe(C2O4)3]·3H2O化学式的确定
(1) 产物内外界确定:取3份0.2-0.3 g产品置于3个锥形瓶中,加30 mL水溶解,分别加入1 mL饱和NaHC4H4O6、1滴1 mol·L-1KSCN和2滴0.5 mol·L-1CaCl2,仔细观察并记录反应现象。
(4) 结晶水含量测定:取3个称量瓶,115 °C烘干60 min,置于干燥器中冷却至室温,准确称量记录质量m0;在3个恒重称量瓶中分别称取0.25-0.5 g产品,准确称量记录质量m1;在115 °C烘干60 min,置于干燥器中冷却至室温,准确称量记录质量m2;再反复在115 °C烘干30 min,置于干燥器中冷却至室温,两次称量结果如果相差在0.001 g以内,记录最终质量mt,平行测三次。
(5) 产物化学式确定:根据所测三种组分含量计算产物中剩余K+含量,然后根据各组分含量与其摩尔量的比值计算产物中K+、Fe(III)、和结晶水的配比。
4.5 K3[Fe(C2O4)3]·3H2O结构表征
将所制备的翠绿色晶体磨细,用X射线衍射仪和红外光谱仪对其进行表征,进一步验证产品是否为K3[Fe(C2O4)3]·3H2O配合物。XRD结果如图3所示,产物在2θ= 27.18°、18.14°、12.78°和42.83°处出现4个强峰,与氯化铁出现在2θ= 33.41°、43.47°和52.55°处(JCPDS 18-0107)和草酸钾出现在2θ= 30.89°、38.89°和40.27°处(JCPDS 34-1447)的3个强峰完全不同,表明配合物形成。IR结果如图4所示,产物在3431 cm-1出现了强而宽的O—H的伸缩振动吸收峰,表明该配合物中存在结晶水。1682和1645 cm-1为COO-的反对称伸缩振动吸收峰,而1391 cm-1处为COO-的对称伸缩振动吸收峰,1273 cm-1为COO-的弯曲振动吸收峰,891和801 cm-1分别为O—H和COO-的变形振动吸收峰,在532和502 cm-1处则分别出现K—O和Fe—O的伸缩振动吸收峰。
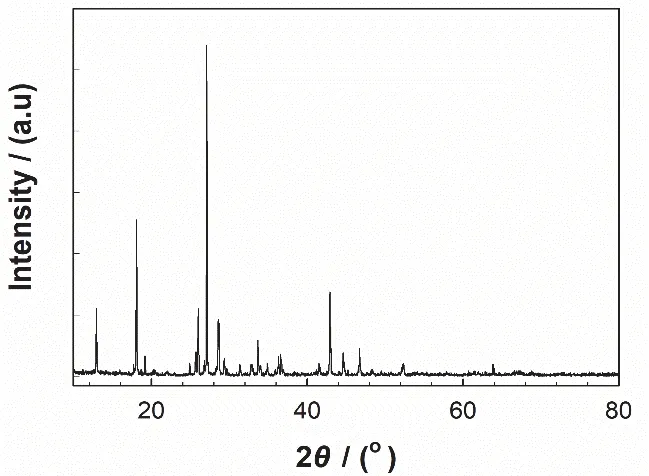
图3 三草酸合铁酸钾的XRD图
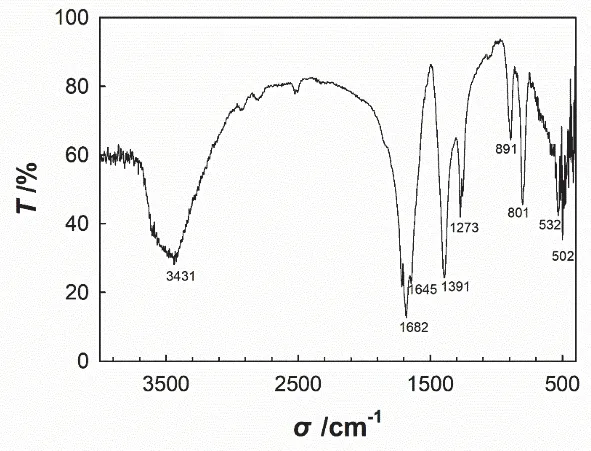
图4 三草酸合铁酸钾的IR图
5 实验注意事项
(1) Fe屑要过量,净化要彻底并用蒸馏水清洗至中性。
(2) 硫酸亚铁铵溶液水浴蒸发浓缩时需仔细观察,混合溶液表面一旦出现晶膜层立即停止加热。
(3) 严控草酸亚铁氧化反应的温度、过氧化氢滴速及剩余过氧化氢加热驱除时间,防止氢氧化铁颗粒长大影响酸溶配位反应;严控氢氧化铁沉淀酸溶配位反应过程中草酸的滴加量和滴速,实时观察反应体系的颜色变化并检测pH。
(4) 析出的晶体在抽滤过程中,勿用水冲洗。
(5) 用KMnO4标准溶液滴定分析产物组成时,反应液必须先水浴加热,然后趁热滴定;Fe(III)含量测定实验中,Zn粉还原反应后收集滤液时要保证滤液中没有Zn粉残渣。
6 思考题
(1) 在制备硫酸亚铁过程中,为什么需要Fe过量?计算硫酸亚铁铵的产率时是根据Fe的用量还是硫酸铵的用量?
(2) 在三草酸合铁酸钾制备过程中,过氧化氢为什么要过量?未反应的过氧化氢要如何驱除?
(3) 本实验有哪些主要因素影响产品的产量?影响产品纯度的因素有哪些?
(4) 根据三草酸合铁酸钾的性质,应如何保存该化合物?
(5) 判断三草酸合铁酸钾配合物内外界离子的实验原理是什么?
7 实验组织及教学建议
(1) 该综合设计性实验为选做实验项目,在实施时要求2-3个学生为一组完成。实验前期要求学生先查阅有关三草酸合铁酸钾制备的相关文献,并与实验教师讨论确定具体的析晶方案和其中的难点和重点,实验课前要求学生完成线上虚拟仿真实验操作。
(2) 本实验分三个阶段进行(约12课时):第一阶段硫酸亚铁铵的制备和纯度检测(4学时);第二阶段为三草酸合铁酸钾制备和结构分析(4学时);第三阶段为三草酸合铁酸钾中各组分含量的化学分析(4学时)。
(3) 合理安排XRD和IR的测试时间。
8 结语
本实验将硫酸亚铁铵的制备、三草酸合铁酸钾的制备及其组成分析实验综合到一起,利用IR和XRD对产品进行表征,开发了一个综合化学实验项目。为了提高实验成功率并增加学生的实验兴趣,该实验不仅对以往教材的操作进行了改进,还在制备部分增加了虚拟操作和自主设计环节,分析部分增加了内外界判断和结构表征实验,同时在整个教学过程中融入了思政元素。本实验蕴含了丰富的化学反应原理,综合了多种化学实验基础操作,同时引入了大型仪器,对于学生综合运用知识的能力、动手能力和分析解决问题能力的培养及创新设计思维的提升具有积极的意义。
