比色法测碘酸铜溶度积常数实验的改进
2024-01-23丁子都雷英杰梁云李襄宏王炎英黄涛
丁子都,雷英杰,梁云,李襄宏,*,王炎英,黄涛
1 中南民族大学化学与材料科学学院,武汉 430073
2 中南民族大学实验教学与工程训练中心,武汉 430073
难溶强电解质的沉淀溶解平衡是四大化学平衡之一,其平衡常数又称溶度积常数,反映了难溶强电解质的溶解能力。在无机化学实验中,溶度积常数测定实验是无机化学基础实验中非常重要的实验之一,不仅可以让学生在实践中理解溶度积原理、学习难溶盐及其饱和溶液的制备方法,还能够训练和培养学生对数据的分析和处理能力。碘酸铜则是本实验中所使用的难溶强电解质,目前测定其溶度积常数的实验方法有比色法[1–6]、碘量法[7,8]、催化动力学法[9]和电导法[10]。尽管方法多样,在无机化学基础实验室中,考虑仪器设备以及不同基础的一年级学生对实验的可操作性,比色法是最为常用的方法。比色法中,测定Cu2+浓度时用到的显色剂为氨水,用量较大[1–6]。众所周知,氨水易挥发氨气,具有强烈刺鼻气味且有一定的腐蚀作用,在实验过程中造成一定程度的环境污染,后处理也比较麻烦。本实验中,以甘氨酸作为显色剂,进而测定饱和碘酸铜溶液中Cu2+浓度,并计算溶度积常数。该法简单易行,通过多次实验,测得的Cu(IO3)2溶度积数值与用氨水做显色剂所获数值接近,且符合文献值范围。整个实验过程中无刺激性气味,实验完成后可浓缩回收得到甘氨酸合铜[11]。相比于氨水,以甘氨酸做显色剂具有环境友好性,在大面积人数众多的基础实验教学中更为适用。
1 实验部分
1.1 主要实验仪器和药品
封闭式电炉、电子天平、722E型分光光度计、上海美析紫外可见-分光光度计、烧杯(100 mL 3个)、玻璃棒(2支)、量筒(50 mL 1个、10 mL 1个)、吸量管(1 mL、2 mL和5 mL各1支)、洗耳球、试管(2只)、比色管(10 mL 6只)、滤纸、普通漏斗、药勺、滴管。CuSO4∙5H2O(s)、KIO3(s)、CuSO4(0.100 mol∙dm-3)、甘氨酸(2 mol∙dm-3)、BaCl2(1 mol∙dm-3)。
1.2 实验内容
1.2.1 Cu(IO3)2固体的制备
取0.8 g KIO3晶体和0.5 g CuSO4∙5H2O晶体,按《无机化学实验》教材方法[12],制备并洗涤Cu(IO3)2固体。
1.2.2 Cu(IO3)2饱和溶液的制备
将湿的Cu(IO3)2固体转移至普通漏斗过滤,取滤纸上黄豆粒大小的固体加入到100 mL近沸的蒸馏水中,保温搅拌5 min后取下,冷却至室温,再采用普通过滤,得到Cu(IO3)2的饱和溶液。
1.2.3 Cu2+标准曲线绘制
分别用吸量管取0.10、0.20、0.30、0.40和0.50 mL 的0.100 mol∙dm-3CuSO4溶液于5个10 mL比色皿中,各加2 mL 2 mol∙dm-3甘氨酸溶液,加水定容。测定640 nm处的吸光度值,记录数据,以A值为纵坐标,C(Cu2+)为横坐标,绘制标准曲线。
1.2.4 测定Cu(IO3)2饱和溶液中的C(Cu2+)
取5.00 mL Cu(IO3)2饱和溶液于10 mL比色管中,加2 mL 2 mol∙dm-3甘氨酸溶液,加水定容至10 mL,测试其吸光度A值。
2 实验结果与讨论
2.1 甘氨酸与Cu2+反应时间研究
将甘氨酸与Cu2+混合后,溶液立刻显示蓝色,表明甘氨酸已与铜离子发生配位反应,在紫外-可见吸收光谱仪上测定其吸收光谱,如图1所示,其最大吸收峰位于640 nm。Cu(NH3)42+溶液的最大吸收峰位在600 nm。
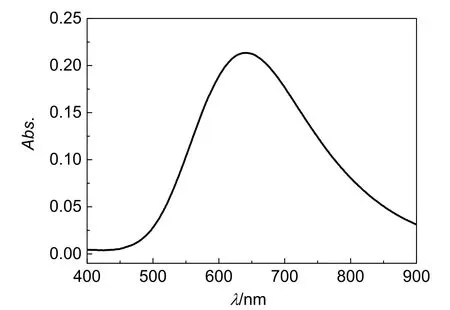
图1 甘氨酸合铜(II)的可见吸收光谱
考虑到在基础实验中,不同学生在配制溶液过程中操作时间不同,导致反应程度不同,进而影响吸光度值。因此,研究了甘氨酸与Cu2+混合后,溶液的吸光度随时间变化关系,并以此确定二者充分反应达到平衡的时间。本实验中取0.10 mL 0.100 mol∙dm-3CuSO4溶液于比色皿中,1.65 mL蒸馏水混匀后,移取0.25 mL 2 mol∙dm-3甘氨酸,快速加入比色皿中,不搅拌,即刻测定640 nm处吸光度。此时,Cu2+与甘氨酸的浓度比为1:50。A640nm值与时间关系曲线如图2所示。由图2可见,初始的吸光度已达到0.18以上,表明二者反应非常快。在给定时间6 min内,随着时间的延长,吸光度从0.186仅增加至0.202。随后,随时间延长,吸光度变化极其微小,反应基本已经达到平衡。由此可见,在实际操作中,时间对吸光度数值影响不大,用甘氨酸作为显色剂替代氨水进行该实验是可行的。
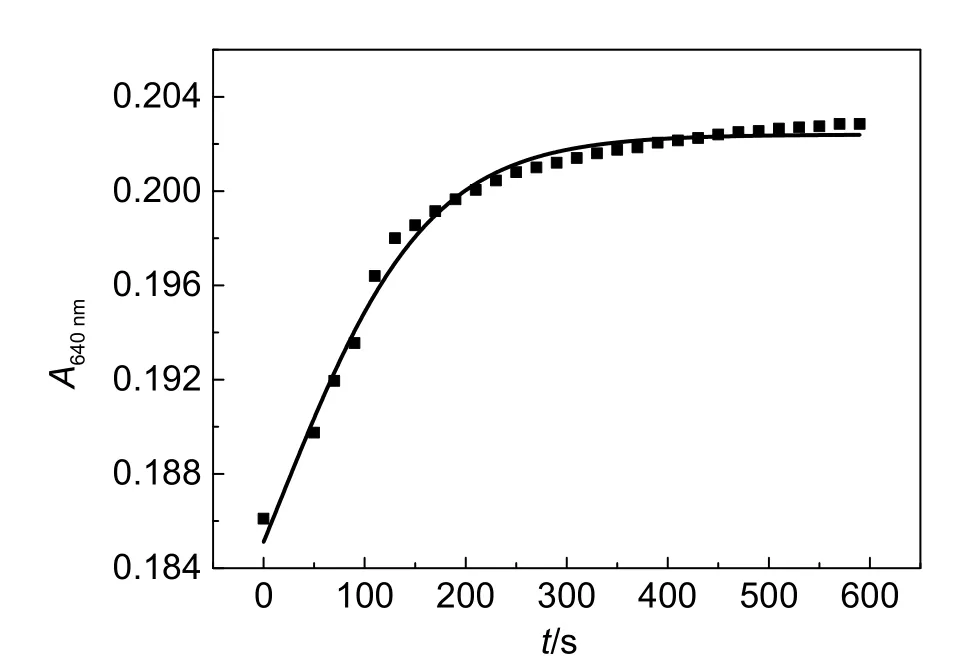
图2 Cu2+与甘氨酸的反应时间
2.2 甘氨酸加入的最佳体积
在制作标准曲线时,设计标准溶液浓度分别为1.0×10-3、2.0×10-3、3.0×10-3、4.0×10-3、5.0×10-3mol∙dm-3。重点考察Cu2+溶液最大浓度为5.0×10-3mol∙dm-3,其需要2 mol∙dm-3甘氨酸的用量。取0.50 mL 0.100 mol∙dm-3Cu2+溶液与不同体积2 mol∙dm-3甘氨酸混匀稀释并定容至10.0 mL,放置10 min后测试其在640 nm处的吸光度。如图3所示,当甘氨酸体积为0.20 mL,Cu2+与甘氨酸的浓度比为1:8时,溶液吸光度为0.011。继续增加甘氨酸的体积至1 mL,Cu2+与甘氨酸的浓度比为1:40,溶液吸光度为0.180。由此可见,甘氨酸体积0–1 mL时,溶液的吸光度随甘氨酸用量的增加而快速增加。当甘氨酸体积为1.6 mL时,溶液吸光度达到0.206。然而,甘氨酸体积在1.6–4.0 mL范围内,溶液吸光度基本稳定在0.20–0.21范围内。综合考虑,选择甘氨酸(2 mol∙dm-3)体积用量为2 mL来制备甘氨酸合铜(II)溶液。
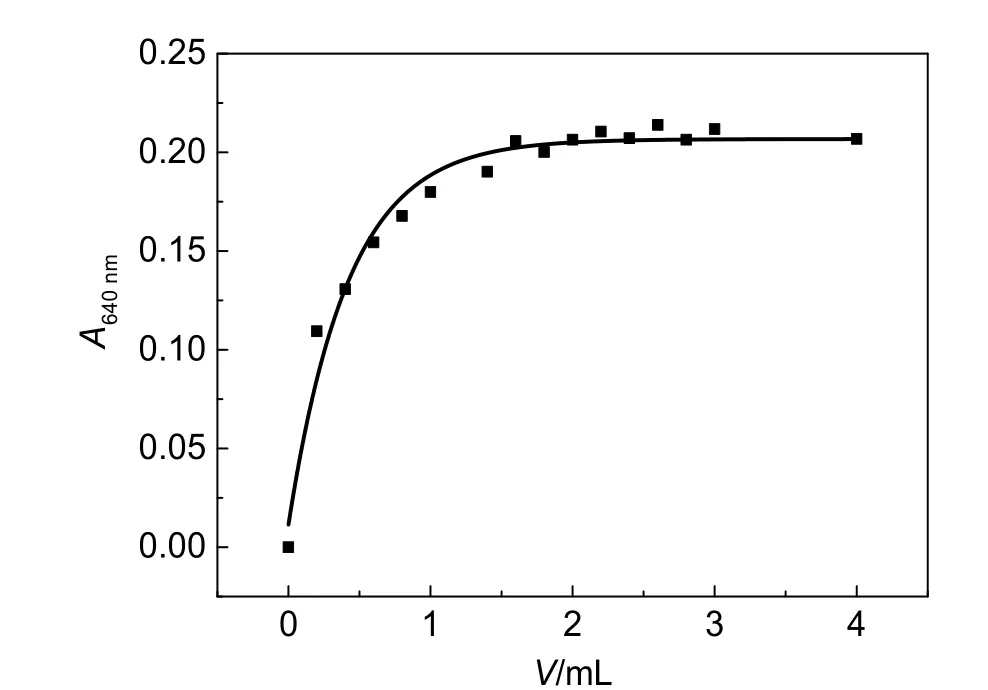
图3 Cu2+与甘氨酸反应所需甘氨酸体积与溶液吸光度变化曲线
2.3 标准曲线的制作与溶度积的计算
根据上述实验结果,分别用吸量管取0.10、0.20、0.30、0.40和0.50 mL的0.100 mol∙dm-3CuSO4溶液于5个10.0 mL比色管中,各加2 mL 2 mol∙dm-3甘氨酸溶液,加水定容,放置10 min后测定640 nm处的吸光度值,记录数据。以A值为纵坐标,C(Cu2+)为横坐标,绘制标准曲线,如图4a所示。与此同时,以氨水为显色剂,配制不同浓度的Cu(NH3)42+,测定其在600 nm处的吸光度值,记录数据。以A值为纵坐标,C(Cu2+)为横坐标,绘制标准曲线,如图4b所示。
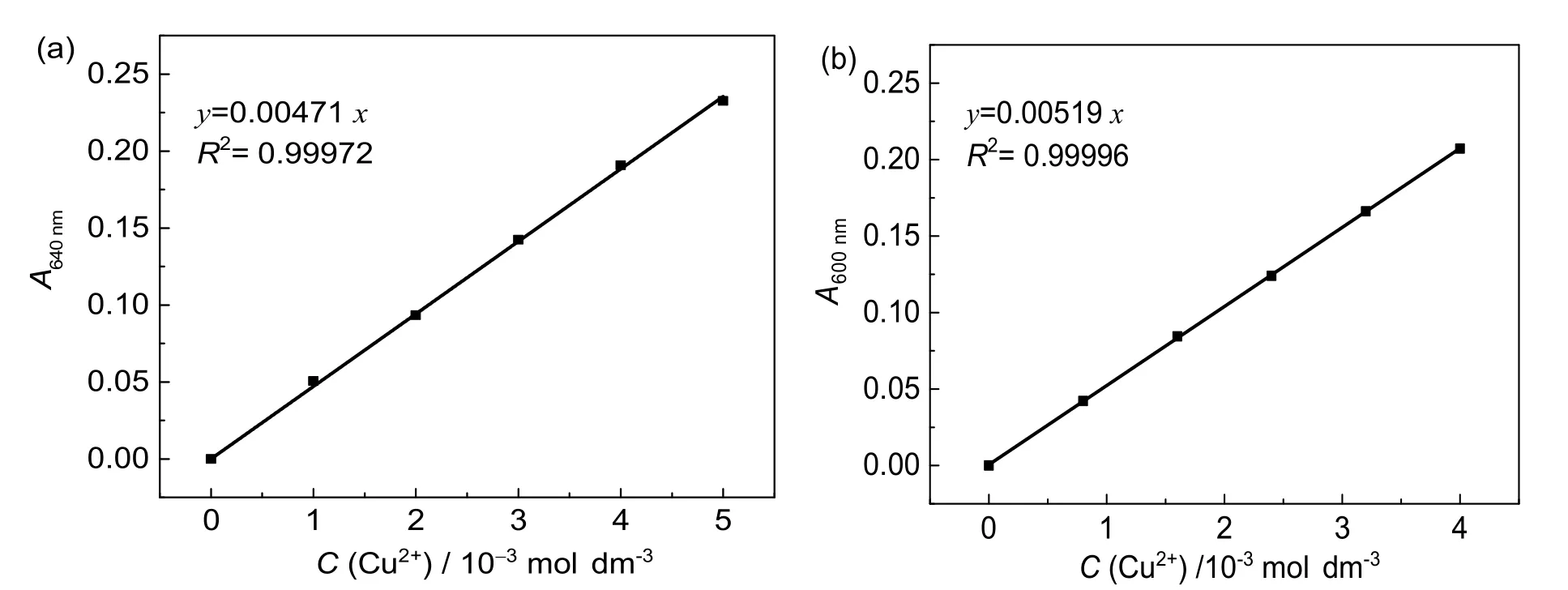
图4 甘氨酸合铜(II)中铜离子浓度与640 nm吸光度的曲线关系图(a)以及四氨酸合铜(II)中铜离子浓度与600 nm吸光度的曲线关系图(b)
这里随机抽取6位学生所制备的Cu(IO3)2饱和溶液,将这些饱和溶液各移取5.00 mL至比色管中,加2 mol∙dm-3甘氨酸溶液并加水定容至10.0 mL。放置10 min后测定其吸光度值A,根据图4a标准曲线可得这6份溶液中的Cu2+浓度C(Cu2+)。根据Ksp=[Cu2+][IO-3]2=32C3计算溶度积常数(文献值Kθsp=1.4×10-7– 6.94×10-8)[9,12,13]。同时,以氨水做显色剂配制一组对照溶液并测定其吸光度,根据图4b标准曲线得到对应各饱和溶液浓度,按相同方法计算Cu(IO3)2溶度积常数。相关数据如表1所示。
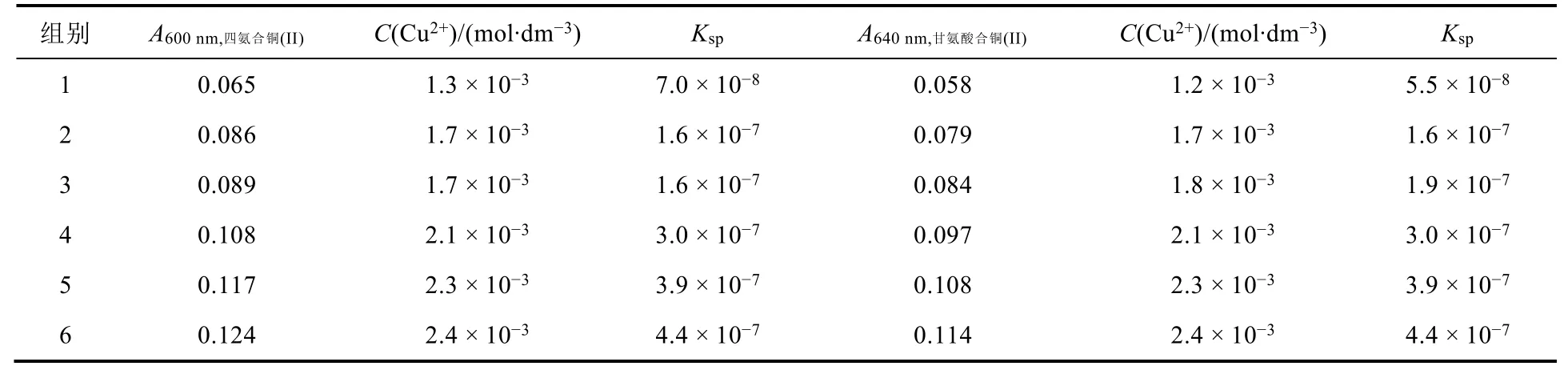
表1 以甘氨酸和氨水分别为显色剂测定Cu(IO3)2溶度积的数据列表(20 °C)
从表1中数据可见,所得溶度积常数的数量级与文献值一致,大小符合文献值的范围。以甘氨酸做显色剂和以氨水做显色剂测定的铜离子浓度十分接近。因而,二者所得溶度积数值也十分接近。这表明,以甘氨酸代替氨水作为该比色法测定Cu(IO3)2溶度积是合适的。更重要的是,甘氨酸为固体药品,与铜离子反应后,便于加热浓缩回收处理得到甘氨酸合铜(II),从而减少了环境污染。
此外,本实验将甘氨酸与铜离子的混合溶液控制在10 mL,也在一定程度上节约了药品。
3 结语
以甘氨酸代替氨水作为显色剂,所得甘氨酸合铜(II)能被有效回收,且所测定碘酸铜溶度积数据与理论值接近,表明该法可行。
