Ag2SO3/AgBr复合材料的制备及对亚甲基蓝的光降解
——推荐一个高等师范院校化学创新实验
2024-01-23夏悦卢艺波黄炜
夏悦,卢艺波,黄炜
1 湖南师范大学化学化工学院,长沙 410081
2 重庆中医药学院中药学院,重庆 402760
3 汝阳县第一高级中学,河南 汝阳 471200
1 实验设计背景
高等师范院校承担着培养具有专业知识和教育技能的中学教师、为我国基础教育储备教学人才的重任。化学实验教学是化学课程教学的重要组成部分,是学生创新能力培养的重要阵地,化学师范生的实验创新素养也决定了其未来的教师专业化发展水平。大学物理化学实验多在无机化学实验、分析化学实验和有机化学实验后的大学三年级开设,是基础化学实验向实际科研应用的过渡,其教学效果直接关系到学生创新思维能力和创新应用能力的培养。因此,针对不同专业的学生要特别注意将物理化学实验相关知识和技术与其专业领域的应用联系,使学生认识到化学领域知识和研究方法对其专业研究学习的重要性[1]。相对于化学专业理论课程,在化学实验课程中学生具有更强的主体性、参与性和体验性,更易激发创新思维。2019年教育部发布的《关于加强和改进中小学实验教学的意见》中明确提出“提高教师实验教学能力”[2]。江家发等[3]提出改进实验的能力有助于中学化学教师创新精神的培养。笔者认为在高年级开设的物理化学实验课程教学中,若能将物理化学实验项目内容与中学化学知识点紧密联系,充分发挥实验项目内容对中学创新实验教学的启发性,必能使其深刻体会化学实验对基础化学教育的价值,自觉提高化学实验技能并建立大学化学与基础化学教育的有效衔接,最终实现引领基础教育达成化学课程教学目标[4,5]。
基于半导体的光催化技术已被广泛应用于新能源、环境净化和癌症治疗等前沿领域。光催化具有光化学反应与催化反应的双重特征,与化学动力学密切相关。光催化实验是化学、材料、能源、环境等学科的交叉,内容前沿,适合开发成综合和创新性实验,符合创新型人才培养的需求[6]。目前已有一些高校将光催化科研前沿知识应用于大学化学实验教学,设计开发了基于不同半导体材料的各种综合性光催化实验[7–10],这些实验通过让学生学习学科前沿知识、化学研究方法和掌握现代实验技术在科研中的应用,来锻炼学生的综合操作能力,培养学生的创新意识,但大部分报道的实验较少能直接体现学生创新能力的应用情况,更鲜有专门针对化学师范生、凸显大学化学与基础教育密切关联性的实验设计。高中化学中沉淀和转化这一知识点涉及到银盐,同时银盐也在光催化研究领域广泛应用[11–14]。本文在笔者对Ag2SO3这一新型光催化剂研究的科研实验基础上[15,16],设计了一个综合化学基础知识和学科前沿知识的创新实验,用于培养高师化学师范生的创新应用能力。该实验的优势和特色体现在以下方面:一、实验中光催化材料的选用具有开放性的特点,并非完全拘泥于Ag2SO3这一非常规银盐,同时光催化材料的制备与中学化学沉淀溶解平衡知识点有着密切联系而有所拔高。例如,中学生熟悉通过沉淀反应生成AgBr,对高师生则鼓励学生查阅银盐光催化剂的相关资料,采用沉淀反应这一简单而又熟悉的制备方法制备Ag2SO3、Ag2CO3等银盐,大胆进行实验探索。Ag2SO3/AgBr复合物的制备还涉及沉淀的转化这一学生较少注意到的知识点。二、通过本实验培养师范生学会从不同维度对主题实验进行改进创新和自主设计中学化学开放创新实验,体现了实验创新应用能力的落实。三、以亚甲基蓝为光催化降解对象,使本实验还可作为对本科物理化学实验“溶液吸附法测固体比表面积”中亚甲基蓝废液进行后续处理的配套拓展实验。此外,本实验项目内容也适用于其他化学相关专业学生的实验教学。
2 实验目的
通过本实验的学习,培养师范生具备如下能力:
(1)了解光催化的基本原理和相关仪器的测试原理,知道光催化材料形貌和结构表征的一般方法;
(2)掌握光催化降解有机染料的实验方法和光催化反应动力学的研究方法;
(3)能独立改进实验,设计适用中学化学教学的开放创新实验;
(4)具备自学能力和实验创新精神,树立环保意识和绿色发展的观念。
3 光催化原理
光照条件下,半导体材料吸收足够能量的光子,价带(VB)中的电子被激发跃迁到导带(CB),留下空穴在价带,产生光生电子-空穴对。光生电子(e–)具有较强的还原能力,光生空穴(h+)具有较强的氧化能力,它们可进一步与在催化剂表面吸附的物种或溶液中的物种发生氧化还原反应,产生强氧化性的自由基物种如•O2–、•OH等,进而氧化分解溶液中的有机物[17,18],如图1所示。
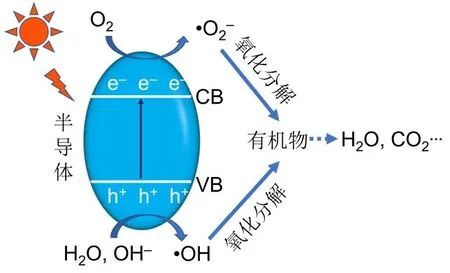
图1 光催化降解有机物机理示意图
4 试剂和仪器
试剂:硝酸银(AgNO3)、亚甲基蓝(MB)、亚硫酸钠(Na2SO3)、溴化钾(KBr)。以上试剂均为分析纯。
实验仪器:电子分析天平(ME104E,梅特勒-托利多仪器(上海)有限公司)、电热鼓风干燥箱(DHG-9030A,上海一恒科学仪器有限公司)、氙灯光源(CEL-HXF300,北京中教金源科技有限公司)、强光光功率计(CEL-NP2000,北京中教金源科技有限公司)、X射线衍射仪(XRD,D/max 2550 VB/PC,日本理学公司)、扫描电子显微镜(SEM,JEOL,JSM-6360)、紫外-可见漫反射光谱仪(UV-Vis DRS,Hitachi,U-3310)、紫外-可见分光光度计(UV-4802H型,尤尼柯(上海)仪器有限公司)及常规玻璃仪器等。
5 实验步骤
5.1 制备Ag2SO3/AgBr
在磁力搅拌下,将10 mL Na2SO3溶液(0.1 mol∙L-1)逐滴缓慢滴入10 mL AgNO3溶液(0.2 mol∙L-1)中,得到白色Ag2SO3沉淀。继续向反应体系中逐滴加入3 mL KBr溶液(0.15 mol∙L-1),观察到沉淀颜色变为淡黄色。过滤,用去离子水洗涤至滤液为中性,收集淡黄色沉淀放入45 °C烘箱中避光干燥,即获得Ag2SO3/AgBr。
为进行对比,用同样的方法分别制备Ag2SO3和AgBr:
(1)在磁力搅拌下,将10 mL Na2SO3溶液(0.1 mol∙L-1)逐滴缓慢滴入10 mL AgNO3溶液(0.2 mol∙L-1)中,得到白色Ag2SO3沉淀。
(2)在磁力搅拌下,将14 mL KBr溶液(0.15 mol∙L-1)逐滴缓慢滴入10 mL AgNO3溶液(0.2 mol∙L-1)中,得到浅黄色AgBr沉淀。
5.2 材料表征
用X射线衍射仪对所得样品进行物相表征,用扫描电子显微镜对所得样品进行形貌表征,用紫外-可见漫反射光谱仪测量样品对光的吸收情况。
5.3 可见光催化降解实验
可见光光源为配备滤光片(λ≥420 nm)的300 W氙灯。量取40 mL 20 mg∙L-1的MB溶液于夹套水冷烧杯中,称取25 mg所制材料,加入到MB溶液中,避光搅拌30 min以确保达到吸附-脱附平衡,然后置于氙灯光源下方进行可见光降解,平均光照强度为100 mW∙cm-2(图2)。在搅拌条件下,每隔一定时间取约1.5 mL溶液于离心管中,离心分离,取上层清液,用紫外-可见分光光度计测其吸收光谱。实验过程控制温度为25 °C。MB的降解效率通过其在663 nm处(MB水溶液的最大吸收峰)峰高的变化确定,计算公式为η=(1 -At/A0)×100%,其中η为降解率,A0和At分别为MB溶液的起始吸光度和t时刻的吸光度。

图2 光催化降解实验装置图
6 实验结果
6.1 形貌和结构表征
图3A、B分别为Ag2SO3和Ag2SO3/AgBr的SEM图。前者为表面较光滑的颗粒,后者是粒径大小不同的两种颗粒的复合,说明通过原位化学沉积法在Ag2SO3表面形成了AgBr。图3C为Ag2SO3和Ag2SO3/AgBr的XRD谱,后者包含了Ag2SO3(JCPDS 70-1910)和AgBr(JCPDS 79-0149)的特征峰,表明Ag2SO3/AgBr复合材料的成功制备。

图3 Ag2SO3(A)和Ag2SO3/AgBr(B)的SEM图及相应的XRD谱(C)
6.2 DRS表征
图4为Ag2SO3、AgBr和Ag2SO3/AgBr的UV-Vis DRS光谱。从图中可见Ag2SO3的吸收带边约为350 nm,仅能吸收紫外光;AgBr的吸收带边为520 nm,对可见光的吸收较强。与Ag2SO3比,Ag2SO3/AgBr的吸收带边红移到450 nm,说明在Ag2SO3上修饰适量的AgBr可以增加对可见光的吸收利用。

图4 Ag2SO3、AgBr和Ag2SO3/AgBr的UV-Vis DRS谱
6.3 光催化降解性能测试
图5为存在Ag2SO3/AgBr时,MB在暗态和可见光照条件下的紫外-可见吸收光谱。无光照时(图5A),30 min时测得的MB的吸收峰与5 min时测得的吸收峰基本重合,说明Ag2SO3/AgBr对MB很快能达到吸附-脱附平衡。在可见光照下(图5B),MB的主峰强度降低,且紫外区产生了新峰,新峰的吸收强度随时间的增加而降低。在光照降解15 min时,MB在665 nm处的峰几乎消失,说明在光照条件下Ag2SO3/AgBr可催化降解MB。
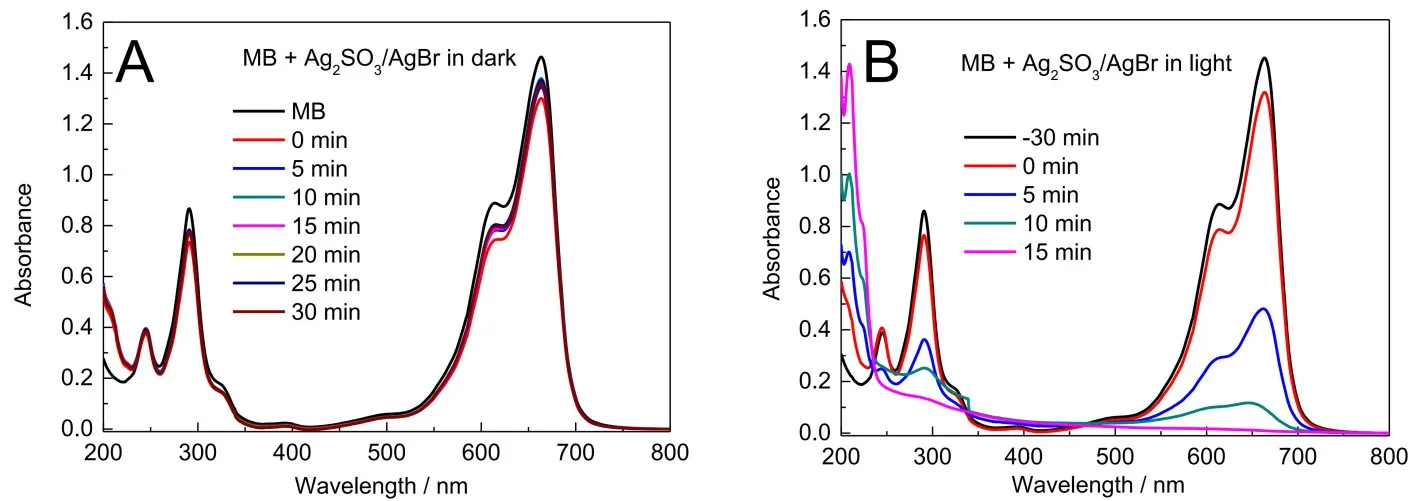
图5 存在Ag2SO3/AgBr时,MB在暗态(A)和可见光照(B)条件下的紫外-可见吸收光谱随时间的变化
MB的降解率受催化剂种类和光照的影响。如图6A所示,无催化剂存在时,MB在暗态下几乎无降解,在可见光照射下,30 min的降解率约为11.78%。单独存在Ag2SO3或AgBr时,MB经30 min的可见光照后的降解率分别约为32.11%和89.55%。而Ag2SO3/AgBr复合物在可见光照仅15 min对MB的降解率可高达99.35%。图6B表明,随着MB浓度的增大,Ag2SO3/AgBr对MB的降解(η>99%)时间延长。按准一级反应动力学方程可得如图6C所示的线性拟合图,计算得Ag2SO3/AgBr对20、30、40 mg∙L-1MB的一级反应速率常数分别为0.3312、0.1876、0.1455 min-1,Ag2SO3和AgBr对20 mg∙L-1MB的一级反应速率常数分别为0.0124、0.0288 min-1(图6D)。

图6 不同催化剂存在时,MB(20 mg∙L-1)的相对吸光度(At/A0)随时间的变化(A);在Ag2SO3/AgBr存在时,不同浓度MB的相对吸光度(At/A0)随时间的变化(B)和对应的一级反应动力学拟合曲线(C)及反应速率常数(D)
7 设计中学开放创新实验,落实对化学师范生创新应用能力的培养
本实验中,银盐的制备与高中化学中沉淀溶解平衡章节知识点联系紧密,通过观察和讨论白色沉淀(Ag2SO3)的生成和向浅黄色沉淀(Ag2SO3/AgBr)的转化,可加深学生对沉淀的生成及转化的理解。该实验除了用氙灯作为光源外,还可以直接以太阳光为光源让学生自行进行探究。例如,将25 mg Ag2SO3/AgBr复合材料加入40 mL 20 mg∙L-1MB溶液中,置于太阳光下(实验温度为30–35 °C,太阳光平均光照强度为70–80 mW∙cm-2),每隔10 min取一次样,观察到溶液的颜色变化如图7所示。经约50 min太阳光照,蓝色溶液的颜色几乎消失,说明MB发生了降解。

图7 (A)加入Ag2SO3/AgBr的原始MB溶液(20 mg∙L-1);(B)经60 min太阳光照射后MB的溶液;(C)每经10 min照射后取样的MB溶液的照片
总体而言,该实验现象显著易观察,所用药品常见易得,无需昂贵设备,操作简单易上手。无论是了解染料废水的危害及常用的处理方法,半导体光催化剂降解染料废水的机理,还是沉淀反应制备光催化剂及对亚甲基蓝废液的光降解,都是基于中学生已有知识基础,易于为中学生接受,适合拓展为中学化学开放创新实验。因此,本实验要求师范生结合中学化学教学知识点,从实验药品、仪器、方案等不同方面对该主题实验进行创新改进,设计中学化学开放创新实验,促使师范生自发思考大学化学教学与基础化学教育的密切联系,培养师范生的创新应用能力。
8 教学建议和说明
实验前,学生可以小组为单位,在教师或助教指导下查找文献资料,总结用于光催化反应的各种银盐催化剂的制备方法、种类和特点。根据学生的查阅内容,要求学生设计一些对比实验方案,从光催化材料、光源、光降解对象等不同维度进行实验改进,例如改变光催化剂的种类,将Ag2SO3替换为Ag2CO3、Ag3PO4等,将AgBr替换为AgCl、AgI、Ag2S等,或者采用不同的光源进行光催化降解,或者降解不同的化学物质等,可鼓励学生根据不同设计的实验方案进行分组对比和进一步的实验探讨。
值得说明的是,可利用X射线光电子能谱仪(XPS)对上述材料进行光催化反应前后的表征以分析催化剂表面元素价态变化。在实验条件不够的情况,可用思考题的方式引导学生查阅相关资料(如参考文献[15]等)进行分析。
9 结语
本实验通过简单的沉淀-原位化学沉积法制备Ag2SO3/AgBr复合材料,促进学生对沉淀反应及沉淀转化的理解;通过对材料的物相和形貌表征、亚甲基蓝溶液吸光度的测定加深学生对代表性仪器分析技术的直观认识;通过对光催化降解实验动力学的数据处理加强学生对物理化学基本概念的掌握;通过对中学化学开放创新实验的设计,提升化学师范生对化学原理和理论的理解,也促使学生关注化学前沿知识,体会其与中学化学的联系,探讨两者融合的教学策略。将大学化学实验与基础教育有机融合将为培养创新型未来中学卓越化学教师起到推动作用。
