乙二醇选择性电氧化用于涤纶树脂的回收利用
2024-01-23杨笑马一鸣季增锐公彦美房忠雪
杨笑,马一鸣,季增锐,公彦美,房忠雪
盐城师范学院化学与环境工程学院,江苏 盐城 224007
1 引言
塑料制品广泛应用于日常生活,已经成为人类社会的重要组成部分[1]。其中聚对苯二甲酸乙二醇酯(涤纶树脂,简称PET)具有热塑性塑料中最大的韧性、无毒、电绝缘性能好、抗化学药品腐蚀等优点,通常用于制造电气插座、金属镀膜、矿泉水瓶等。但是每年PET产品只有约30%被回收。传统的填埋和焚烧处理方法不仅浪费大量资源,而且会造成愈加严重的二次污染,例如处理不当的塑料制品会逐渐转化为微塑料和纳米塑料[2,3],由于其尺寸较小,更容易在土壤、水和空气中扩散传播难以处理[4,5]。
塑料制品的回收主要分为机械回收和化学回收。目前机械回收应用最为广泛,该方法首先将PET制品粉碎、清洗,再进行分选、干燥、造粒,然后注塑、拉伸、吹塑制得塑料产品[6]。但是随着循环使用次数增加,其理化性质与机械强度下降,不符合原有使用要求,只能降级使用。与之相比,化学法可以使PET结构中的酯基发生水解,生成对苯二甲酸和乙二醇[7–9],随后通过缩聚即可得到完全再生的PET。但化学法由于水解产物乙二醇的水溶液分离提纯困难,并未广泛应用。基于该问题,以可再生能源为驱动力,利用对乙二醇的选择性电氧化,最终得到易于沉淀分离的草酸钠。既避免能源大量消耗,又提高经济效益。
基于上述实验构想,我们设计了乙二醇电氧化应用于涤纶树脂降解的新创实验,将电催化与PET回收转化相结合,可以高选择性制备对苯二甲酸和草酸钠。本实验包含聚合物水解、减压抽滤、电催化物质转化等一系列化学教学内容,并且具有安全、易操作、重复性好、产率高等优点,可应用于大学基础化学实验[10]。为加深基础教学与日常生活、科技前沿的联系,方便后续开展课外拓展实验,本实验以生活中常见的PET塑料瓶作为原料,成功将其降解为对苯二甲酸。并且通过控制电解时长,使乙二醇选择性转化为附加值更高的乙醇酸(可生产聚乙醇酸,用于可溶解的医用缝合线、人造骨骼等)。
将本新创实验引入到本科实验教学,可以提高学生的知识水平和拓展学生的知识面,培养创造性思维,帮助学生用科学的眼光发现问题、分析问题、解决问题。同时加深学生对于化学的认同感,为本科毕业后从事科学研究和服务社会打下坚实的基础。
2 实验部分
2.1 实验原理
聚对苯二甲酸乙二醇酯结构中含有酯基官能团,在氢氧化钠溶液中可进行碱性水解,生成对苯二甲酸钠和乙二醇(图1)。对苯二甲酸钠在酸性条件下,生成对苯二甲酸(图2)。以泡沫镍作为工作电极与对电极,对PET水解所得乙二醇-氢氧化钠溶液进行电解。乙二醇失去电子依次被氧化生成乙醇醛、乙醇酸钠,并最终转化为草酸钠(图3)。
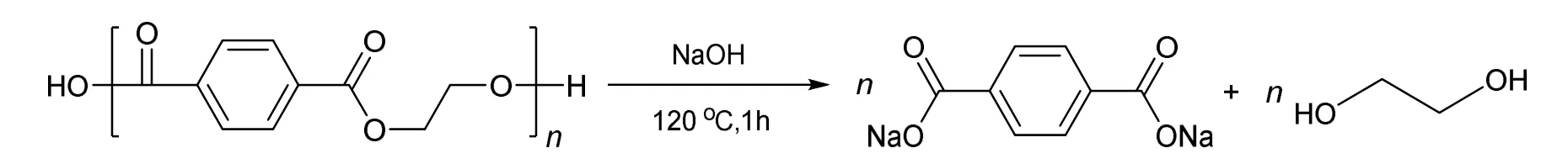
图1 PET的水解
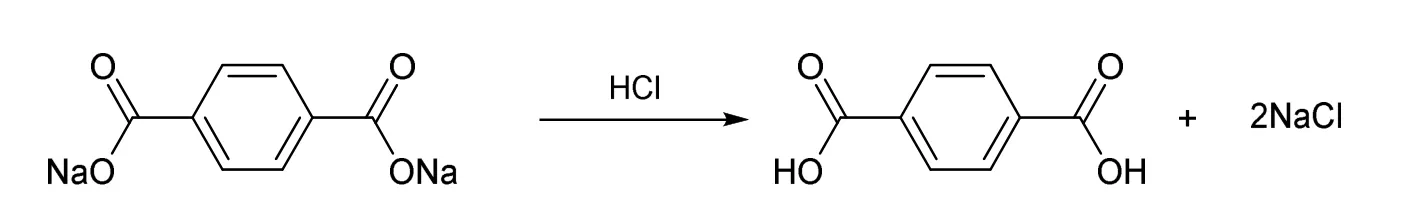
图2 对苯二甲酸钠的酸化
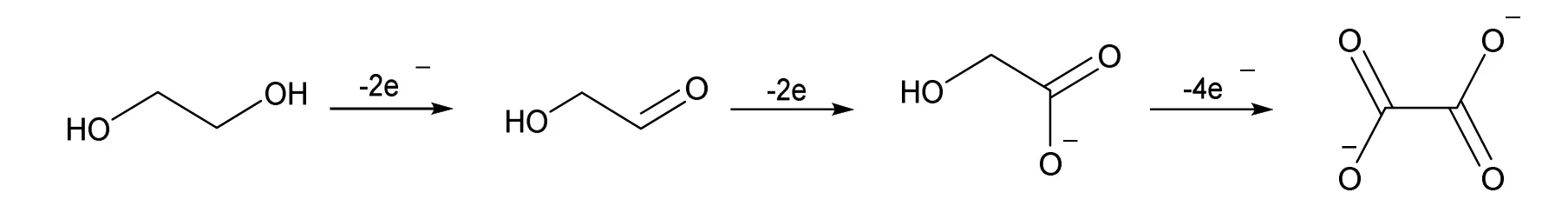
图3 乙二醇的电解
2.2 试剂及材料
试剂及材料见表1。
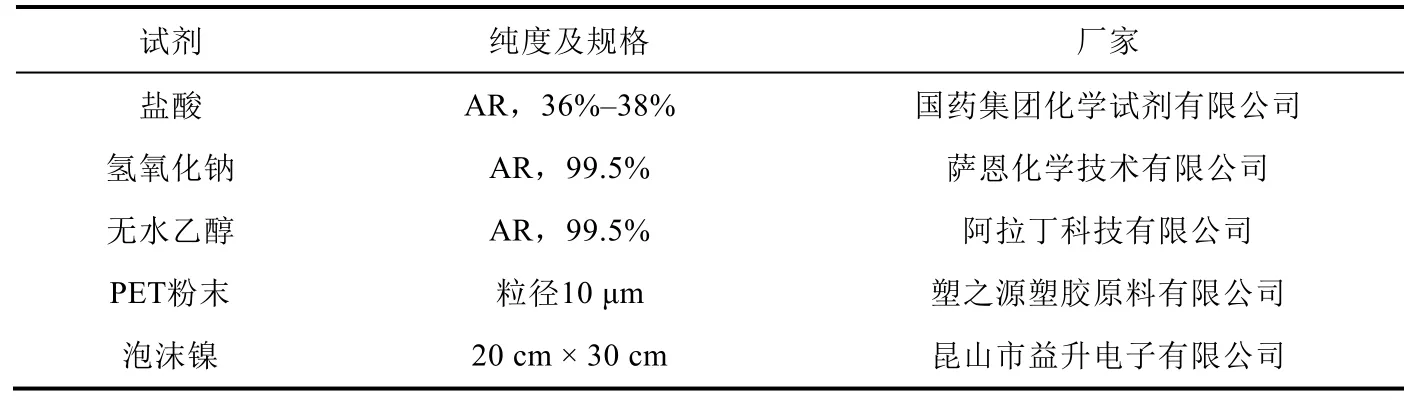
表1 实验试剂与材料
2.3 仪器
H型电解池(天津艾达恒晟科技发展有限公司),0.5 L气袋(宁波鸿谱仪器科技有限公司),分析天平(ES-J220,天津市德安特传感技术有限公司),加热型磁力搅拌器(MS-H380-Pro,大龙兴创实验仪器),恒温加热磁力搅拌器(DF-101S,河南予华仪器有限公司),直流稳压电源(MS-303D,麦盛能源科技有限公司),真空干燥箱(DZF-6020,上海森信实验仪器有限公司),核磁共振波谱仪(AVANCEⅡ400MHz,德国Bruker公司),气相色谱仪(GC-2014C,日本岛津公司)。
2.4 实验步骤
2.4.1 PET的水解
在50 mL圆底烧瓶中,依次加入0.4800 g PET粉末,20 mL 10 mol∙L-1氢氧化钠溶液,放入磁力搅拌子。将反应瓶转移至油浴锅内,安装回流冷凝管,通冷凝水,开启搅拌。加热到120 °C,反应1 h。反应结束后,反应液变为淡黄色。将其冷却至室温。圆底烧瓶内有固体沉淀。
2.4.2 对苯二甲酸的分离
搭建抽滤装置,使用玻璃纤维滤纸进行抽滤。滤饼使用少量10 mol∙L-1氢氧化钠溶液洗涤。将滤液转移到100 mL烧杯中保存,用于乙二醇的电解。将抽滤所得固体转移到100 mL烧杯中,加入70 mL热水,搅拌,使对苯二甲酸钠充分溶解,趁热抽滤,除去不溶性杂质。将滤液转移到100 mL烧杯中。逐滴加入1 mol∙L-1的盐酸酸化至溶液为酸性(pH=3–4)。此时有大量白色固体析出,抽滤,使用少量冰水洗涤,重复三次。转移产品并烘干至恒重,称量,对苯二甲酸的质量为0.3558 g。对苯二甲酸核磁共振氢谱、碳谱谱图见补充材料中图S1和图S2。
2.4.3 乙二醇的电解
剪裁2片直径为4 cm的泡沫镍作为工作电极与对电极。将PET水解抽滤所得滤液倒入左侧电解槽。量取20 mL 10 mol∙L-1氢氧化钠溶液,倒入右侧电解槽。搭建H型电解池装置。左侧电解槽安装工作电极,右侧电解槽安装对电极,右侧电解槽连接气袋,收集气体。连接直流稳压电源,工作电极连接电源正极,对电极连接电源负极。
将H型电解槽加热到100 °C,调整电流为0.20 A,恒流电解3 h。电解初期,阳极未有明显现象,但随着反应的进行逐渐析出白色固体。电解结束,冷却至室温,使固体完全析出。将反应液转移到100 mL烧杯。搭建抽滤装置,抽滤。用少量乙醇洗涤,重复三次。烘干至恒重。称量,草酸钠的质量为0.2730 g。其中草酸钠核磁共振碳谱谱图、所得气体气相色谱谱图见补充材料图S3和图S4。
2.4.4 实验拓展
收集生活中常见的PET塑料瓶,洗净,粉碎。在50 mL圆底烧瓶中,依次加入0.5000 g粉碎的PET粉末,20 mL 5 mol∙L-1氢氧化钠溶液进行水解,放入磁力搅拌子,转移至油浴锅内。安装回流冷凝管,通冷凝水,加热到120 °C,回流反应5 h。反应结束后,停止加热,将反应液冷却至室温。圆底烧瓶内有固体沉淀。
搭建抽滤装置,使用玻璃纤维滤纸进行抽滤。滤饼使用少量5 mol∙L-1氢氧化钠溶液洗涤。将上述滤液转移到100 mL烧杯中保存。抽滤所得固体转移到100 mL烧杯中,加入70 mL热水,搅拌,使对苯二甲酸钠充分溶解,趁热抽滤,除去不溶性杂质。将上述滤液转移到100 mL烧杯中。逐滴加入1 mol∙L-1盐酸酸化至溶液为酸性(pH=3–4)。出现大量白色固体,抽滤。滤饼使用冰水洗涤,重复三次。转移产品并烘干至恒重,称量。
剪裁2片直径为4 cm的泡沫镍作为工作电极与对电极。在左侧阳极电解槽加入水解抽滤所得滤液;在右侧阴极电解槽中加入20 mL 5 mol∙L-1氢氧化钠溶液。搭建H型电解池装置。左侧安装工作电极,右侧安装对电极,右侧阴极连接气袋收集气体。调节温度至100 °C,打开加热。调整电流为0.2 A,恒流电解1.5 h。电解过程中,阳极未有明显现象。电解结束,将电解液转移到茄形烧瓶,通过减压蒸馏除去水分,使固体完全析出。加入盐酸酸化至溶液为酸性(pH=3–4),分离提纯。利用上述实验,得到对苯二甲酸产率为81%、乙醇酸产率为63%。所得产品在生活中均有广泛应用。拓展了该实验的实用性。乙醇酸核磁共振氢谱、碳谱谱图见附件中图S5和图S6。
3 结果与讨论
3.1 PET水解条件优化
PET水解条件优化如表2所示。首先,考察NaOH溶液浓度对水解反应的影响。当使用1 mol∙L-1NaOH溶液作为反应液,室温条件下(25 °C)反应1 h,PET只能水解17%。随着NaOH溶液浓度增大,PET的水解比例不断提高。以5 mol∙L-1NaOH溶液作为反应液,室温反应1 h(25 °C)时,水解比例为32%。以10 mol∙L-1NaOH溶液作为反应液,室温反应1 h(25 °C)时,可以水解47%。为进一步增加水解比例,提高水解过程反应温度。选择10 mol∙L-1NaOH溶液作为反应液,60 °C时水解比例72%,温度升高至100 °C,水解比例提高至88%。当加热至120 °C,反应1 h时,PET水解比例达到95%。若再进一步提高反应温度,溶液将发生沸腾,影响反应效果,当进一步提高氢氧化钠浓度时,水解比例未有明显增加,综上所述,以10 mol∙L-1NaOH溶液为反应液,120 °C加热回流反应1 h为最优条件。
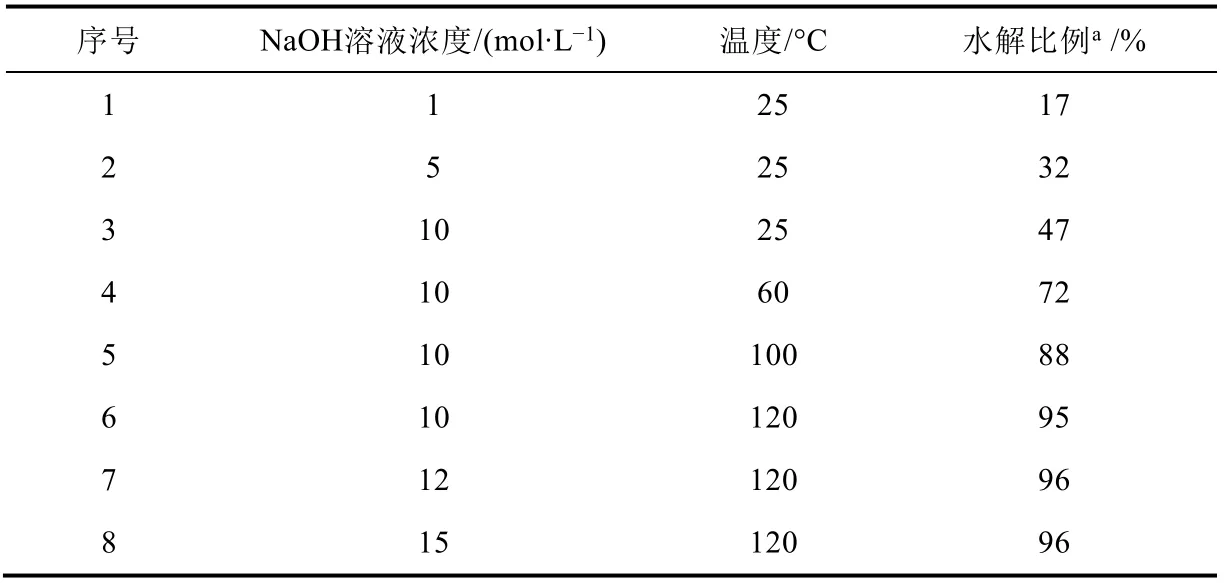
表2 PET水解条件的优化
3.2 乙二醇电解条件优化
3.2.1 工作电极筛选
电极材料作为乙二醇电解的催化剂,其催化性能对于电解过程至关重要。因此我们首先对电极材料进行筛选。基于实验成本与原料易得的考虑,我们选择铁、镍和铜三种金属泡沫作为电解催化剂进行性能测试。实验结果表明,当以铜泡沫与铁泡沫作为工作电极施加正电压时,金属泡沫会发生溶解,溶液变为蓝色(图4A)和黄色(图4B),表明溶液中生成了铜离子和铁离子。两种金属泡沫的稳定性不适宜用于电催化乙二醇氧化实验,并且产生的金属盐会对目标产物草酸钠造成污染。与之对比,当以镍泡沫作为工作电极施加正电压时,溶液保持无色(图4C)。并且随电解时间延长,析出白色固体,生成草酸钠未被金属镍污染。综上所示,本新创实验使用镍泡沫为乙二醇电解的最佳电极材料。

图4 不同金属作为工作电极
3.2.2 电解条件优化
在恒电流电解过程中,随施加电流的增大(>0.50 A),乙二醇氧化为草酸钠的理论电解时长逐渐缩短,但是过大的电流容易导致水氧化副反应发生,不利于乙二醇电氧化。通过减小电流可以有效抑制副反应发生,但电流过小(<0.05 A),理论电解时长增加,不适合本科实验教学(>10 h)。综合考虑电解效率与反应时长,将电流设定为0.20 A,电解时长约为3 h。
3.3 产物杂质去除方法
3.3.1 对苯二甲酸分离提纯
通过提高水解溶液中钠离子浓度,利用溶度积常数(Ksp),使水解产物的溶解度降低,析出对苯二甲酸钠沉淀。随后,抽滤除去水溶性的乙二醇。再通过热水溶解对苯二甲酸钠,抽滤,除去不溶性杂质和未反应的PET固体。由于对苯二甲酸在水中溶解度低,最后通过盐酸酸化使其析出,抽滤,分离得到对苯二甲酸固体,用少量冰水洗涤,除去产物残留的少量盐酸。
3.3.2 草酸钠分离提纯
通过提高电解液中钠离子浓度,利用溶度积常数(Ksp),使电解产物的溶解度降低,析出草酸钠沉淀。抽滤,将草酸钠和电解液分离,再用乙醇清洗草酸钠沉淀,除去残留的氢氧化钠。
3.4 实验的安全性和可行性
3.4.1 实验的安全性
本新创实验涉及氢氧化钠、PET粉末、盐酸等药品,均为本科生实验常用化学试剂,因此本实验原料易得。其中,要注意盐酸为无色透明的液体,有强烈的刺激性气味,具有较高的腐蚀性,在配制溶液时要在通风橱中操作。氢氧化钠性状为白色不透明固体,易潮解。属于碱性腐蚀品,注意不要触碰到皮肤上。若触碰皮肤,须及时使用大量冷水进行冲洗。PET粉末颗粒较小,使用时须佩戴防尘口罩。实验过程中产生的气体,用气袋进行收集并密封,防止泄露。
3.4.2 废液的处理
本实验过程中,产生的废液主要为氢氧化钠水溶液,因此用盐酸对溶液进行中和,调节pH为中性,再倒入指定废液桶中。
3.4.3 实验的可行性
为进一步验证PET回收利用的可行性,在课余时间组织20名学生进行开放实验(图5)。学生实验得到的产品收率略低于本次改进实验,教学效果良好,验证了本实验具有良好的重复性(实验具体数据见补充材料表S1)。此外,本新创实验需要教学时长约6 h,符合综合化学实验教学时长要求。

图5 多组学生进行开放性实验
PET水解、分离实验,总时长需要2 h,可设计为有机化学实验。乙二醇电解实验,总时长4 h,可设计为物理化学中电化学实验,可以根据教学要求灵活安排。实验拓展部分,通过控制电解时长,可以制备乙醇酸,总时长约8 h,适合作为学生的课外拓展与开放实验。
3.4.4 成本核算
本新创实验以废旧PET为原料,在水解与电氧化过程中氢氧化钠、电能不断消耗,最终得到对苯二甲酸、草酸钠等产物。通过市场调研,进行成本核算,收益可观,有一定的研究与应用前景(表3)。

表3 成本核算
4 创新性
(1)以塑料回收为切入点,培养学生发现、分析、解决问题的能力。
(2)符合本科实验教学,实现多学科交叉,提高学生综合素养。
(3)帮助学生理解绿色化学与可持续发展理念,聚焦科研热点问题。
5 结语
本新创实验以PET塑料为原料,通过将电催化与传统碱性水解相结合,制备对苯二甲酸、乙醇酸和草酸钠等产物。融合了有机化学、物理化学、高分子化学等学科,包含聚合物水解、减压抽滤、电催化物质转化等一系列化学教学内容。通过将实验内容和日常生活紧密联系,以废旧PET回收利用为切入点,有助于学生理解绿色化学与可持续发展理念,拓展专业视野,激发科学探索兴趣。补充材料:可通过链接https://www.dxhx.pku.edu.cn免费下载。
