浅谈创新药物研究案例在有机化学教学中的应用
2024-01-23闵真立王婷陈亚军杨曦亮
闵真立,王婷,陈亚军,杨曦亮
武汉科技大学医学院药学系,武汉 430081
有机化学是研究有机化合物的结构、组成、物理化学性质、反应机理、合成方法以及应用的科学,是药学专业的四大基础化学课之一。有机化学也是药学专业学生学好药物化学、天然药物化学、药物分析等专业课程的基础。有机化学因其理论晦涩难懂、内容繁杂等原因,通常也是药学专业基础化学教学的难点和痛点,学生普遍认为有机化学难记、难学、难用,因此学生学习兴趣不高。另外,学生对有机化学与药学的关系认识不足,对其学习轻视,也影响了学习效果。在有机化学教学中,如何使抽象枯燥的内容变得生动有趣,使难于记忆理解的知识变得易于接受和掌握,提高教学质量,是教师需要思考和解决的问题。
案例教学是一种重要的教学方法,具有形象、直观的特点,在大学课堂被广泛使用[1,2]。由于有机化学跟药物研究之间联系紧密,在教学过程中引入一些新药物研发的案例,应用于有机化学课堂教学中,既能丰富教材内容,也使课堂教学更加形象、生动,或许是解决上述问题的方法之一。运用恰当,能让学生感受有机化学在医药中的实际应用价值,理解生命物质、生命现象与有机化学的关系,激发学生学习热情,收到很好的教学效果。
当然,有机化学内容庞杂,与新药研究有关系的还包括药物的合成、分离、鉴定等,本文仅就小分子创新药物设计案例与有机化学相关内容教学做一些初步的探讨。
1 有机化学与药学的关系
药学是一门基于化学和生命科学的发展而产生的交叉学科。化学阐明药物作用的物质基础,生命科学理论解释药物作用的机制。四大基础化学,即有机化学、分析化学、无机化学和物理化学,是药学专业学生学习的基础课程,其中有机化学课程对药学专业学生尤为重要。药物的化学成分绝大部分都是有机物,从先导物的发现和结构优化,到后续的吸收、分布、代谢和起效等研究都跟有机化学有关。这些研究内容涉及药学专业课程包括药物化学、药物分析、药剂学、药物代谢动力学、药理学等。有机化学基础的强弱会直接影响多门药学专业课的学习效果[3–5]。
这些药学专业课中,尤以药物化学与有机化学的关系最为密切。药物化学是新药创制的龙头学科[6],而有机化学是学习药物化学重要的前置课程。有机化学教学是基础,药物化学教学是其拓展与应用[7],能加深对有机化学的认识。有机化学与药物化学的教学过程有相通之处:大部分化学药物本质上是有机化合物,结构明确,有特定的官能团。药物的酸碱性、稳定性、吸收、分布、代谢等药学性质都跟化学结构特别是官能团有关系,至于药物的制备方法,则更是与药物官能团的转换有关系。而官能团的结构和性质是有机化学学习的重点。药物的生物活性则与药物的理化性质以及药物的特定结构有关,这些也与有机化学相关。
2 有机化学与创新药物设计的部分知识结合点
现代创新药物设计理论认为,药物分子与机体的酶或受体等重要蛋白质的特定部位结合,将酶的活性催化中心封闭,或使得受体介导的信号被传导到下游或被阻断,进而纠正机体的病理生理状态,发挥药效。这种药物分子通过与重要功能靶蛋白结合而起效的机制又被形象地比喻为“钥匙和锁孔”的关系,小分子化学药物是“钥匙”,酶或受体是“锁孔”,药物与靶标之间通过形成化学键以及分子间作用力,发挥“钥匙”上沟槽以及锯齿作用,作用于“锁孔”,产生药效。
药物分子与生物靶标之间的作用主要通过形成化学键以及分子间作用力等形式来实现,而这两者是有机化学重要的教学内容。除此之外,还有一些内容也有很强的相关性,本文初步归纳如表1所示。

表1 有机化学部分知识点在创新药物设计中的应用[8,9]
相关知识点在有机化学教学、药物化学教学以及创新药物实践中都有关联。这些知识点在有机化学教学过程中是抽象难懂的内容,但是,如果联系到它们与新药研究的关系,在进行相关内容教学时,适时引入例子则能使相关章节知识教学更具体、生动,易于学生掌握,能强化教学效果[10]。
立体效应是有机化学中很重要的一个概念,在官能团的反应活性差异比较、SN1和SN2反应机理等内容的教学中经常用到。这一概念在药物创制过程中也有应用,经典的例子如肾上腺受体激动剂(图1),其结构中的取代基R随着立体结构变大,位阻增大,生物活性从激动活性变成拮抗活性,1a是肾上腺受体激动剂,而1b则是α-肾上腺受体拮抗剂。电子效应包括诱导效应和共轭效应,又都可以分成供电子效应和吸电子效应,最终体现为官能团或有机化合物的电子云密度大小。在有机化学的教学中,它们涉及有机化合物官能团的反应活性,在药物研究领域,基于电子效应以及结构的相似性衍生出了电子等排体、生物电子等排体等概念。这些概念、原理被广泛地应用于新药设计中,经典的例子比如组胺H2受体拮抗剂西咪替丁、雷尼替丁等的发现。
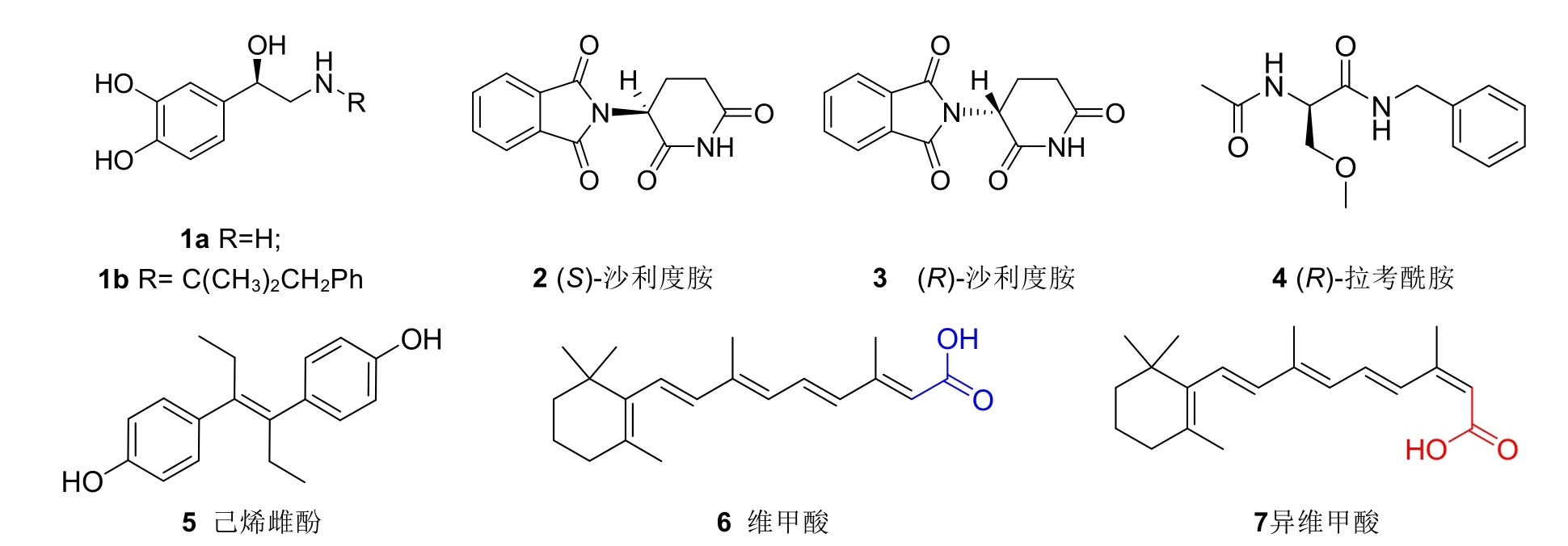
图1 化合物1–7的结构
光学异构、手性是有机化学中很重要的一部分内容,在有机化学课程中涉及一些基本概念和规则的教学。化合物的手性也对其生物活性存在着巨大影响,最著名的例子就是“反应停”事件。“反应停”是药物的商品名,其通用名为沙利度胺(图1),由于其化学结构中含有一个手性碳,所以有两个异构体,(R)-沙利度胺3是一个镇静止吐良药,但是(S)-沙利度胺2具有抑制血管生成的致畸作用。最初“反应停”以外消旋体上市,用于治疗孕妇的妊娠呕吐,结果造成了数以万计的新生儿肢体畸形的灾难事件。“反应停”事件极大地促进了人们对有机化合物手性的认识和手性药物的研究以及监管,此后上市的药物,很少再出现这种生物学效应呈现极端差异的情况,更多是一个对应异构体无效或弱效,另一个对映异构体强效,比如近年上市的(R)-拉考酰胺4(图1)是很好的抗癫痫药物[11],其S异构体几乎无效。双键的顺反异构对于化合物发挥药理活性也有重要的影响。比如反式己烯雌酚5(图1)能起天然雌激素样作用,其顺式异构体无生物活性。反式维甲酸6(图1)是治疗某一亚型白血病的药物,而13-顺式异构体7(图1)则是治疗严重痤疮的药物。
与时俱进的案例可能更容易引起共鸣,激发学生的兴趣。2019年末爆发的新冠疫情在世界范围内对人类造成了极大危害,数百万人死亡。在这场与病毒搏斗的过程中,小分子化学药物成为人类有力的武器之一,其中效果较好的有帕罗韦德(Paxlovid)。帕罗韦德是由奈玛特韦[12](图2A,nirmatrelvir)和利托那韦构成的复方制剂,其中奈玛特韦为主要作用成分,是新冠病毒特异性蛋白酶Mpro(Main protease,也称3-Chymotrypsin like protease,3CLpro)的抑制剂,利托那韦则有助于减缓奈玛特韦代谢或分解,使其在体内维持较长的有效作用时间[13]。奈玛特韦分子结构中有6个手性碳,光学异构体复杂,它们决定了与之相连的叔丁基、四氢吡咯骈合环丙烷以及丁内酰胺这些空间位阻较大的基团的伸展方向。研究表明新冠病毒蛋白酶Mpro活性催化中心有4个孔洞(P1–P4,图2B),正好能跟这三个具有立体效应的基团嵌合,另外一个嵌入的基团是三氟甲基。同时,奈玛特韦的酰胺键能与该蛋白酶形成若干氢键,最关键的是蛋白酶Mpro的145位半胱氨酸Cys145的巯基能与奈玛特韦的腈基发生加成反应,形成共价键[12,14]。正是因为小分子药物与蛋白酶有多种作用,使得奈玛特韦有较强的抑制病毒复制的作用。这个例子综合体现了表1的多个知识点。在课程思政的教学改革背景下,对于有机化学或药物化学的课程思政建设,抗新冠病毒药物研究蕴含了值得深入挖掘的思政元素。
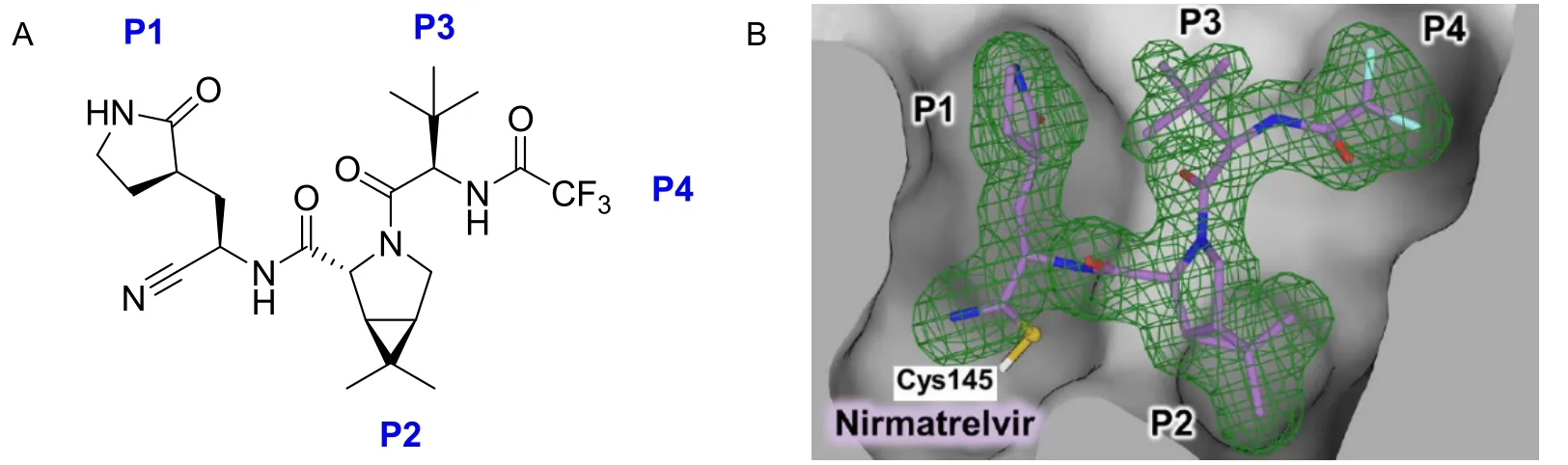
图2 (A)奈玛特韦化学结构及与靶酶结合方位;(B)奈玛特韦靶与靶酶结合示意图[12]
总之,在有机化学相关概念、知识点的教学过程中,引入这些例子,可以使相关概念具体化,也可使学生对这些知识点认识更深刻,引起其兴趣。
3 结合相关软件的创新药物案例在教学中的应用
近年来,随着计算机科学及基因组学、蛋白质组学等学科的快速发展,创新药物研究的面貌正在发生深刻变化。计算机辅助药物设计、人工智能辅助药物开发等在新药设计中的比重越来越大。相关软件既是药物开发的工具,也使得药物与靶点的结合变得可视化,有机化学以及药物化学等课程教学可以变得更丰富与生动。相关教师应该熟练掌握这些软件,比如AutoDock、Discovery Studio(DS)、ChemOffice、LigPlus和PyMOL等,借助这些软件工具可以将药物–受体的作用方式通过计算机更为直观生动地呈现出来,不仅能提高学生对有机化学、药物化学的兴趣,还能让学生更好地理解氢键、疏水作用、离子键、π–π作用等[15,16]。就此思考,笔者谨举一例。
案例:靶向抗肿瘤药物蛋白酪氨酸激酶抑制剂伊马替尼和尼洛替尼的开发[17]。
在细胞信号转导过程中,蛋白激酶能催化三磷酸腺苷ATP的γ-磷酸基转移到底物蛋白的丝氨酸、苏氨酸或酪氨酸残基的羟基上,将其磷酸化,从而引起底物蛋白构象的改变,启动下游生化反应,将信号传导下去,调控细胞的分化、增殖等过程。酪氨酸激酶是研究最充分的一种激酶,很多细胞的细胞膜上存在酪氨酸激酶受体,其活性过高是很多肿瘤发生的根本原因,抑制其活性能起到靶向抗肿瘤的作用。
如图3所示,药物研究人员首先发现2-苯氨基-4-(吡啶-3-基)嘧啶8具有酪氨酸激酶抑制活性。在苯氨基的3位引入苯甲酰胺所得化合物9能与酪氨酸激酶的Glu286和Asp381形成氢键,增加激酶抑制活性。进一步的结构优化发现,在二氨基苯基的苯环上引入6-甲基,由于位阻增加,化合物10的吡啶基嘧啶的构象改变,不能抑制蛋白激酶C(PKC)的活性,保留了对酪氨酸激酶的抑制活性,因此提高了选择性。但是,化合物10的水溶性较差,药代动力学性质不佳,在苯甲酰胺基上引入了亲水性的N-甲基哌嗪,提高了化合物的溶解度和生物利用度,最终发现了伊马替尼11。
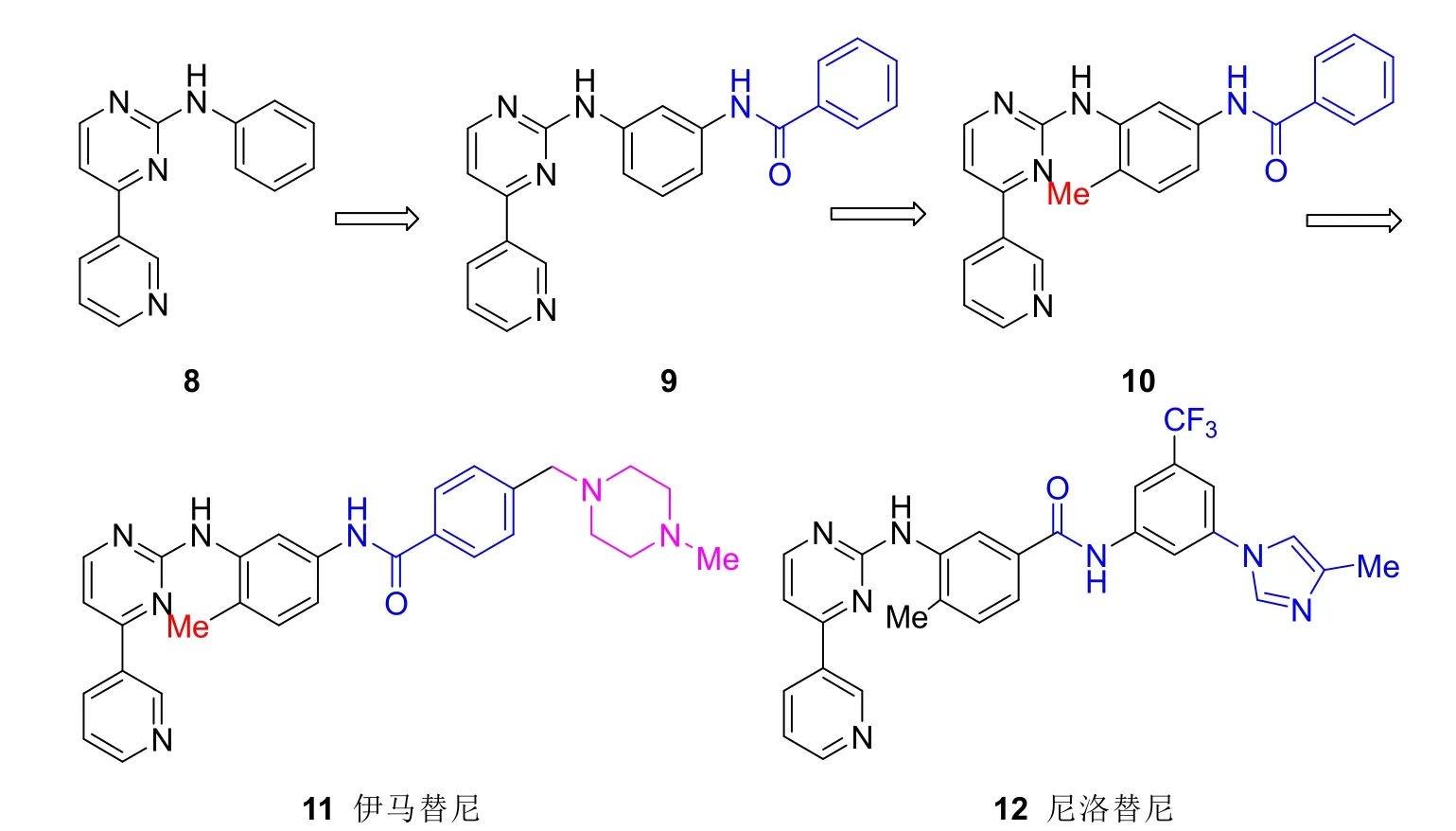
图3 伊马替尼及尼洛替尼化学结构演变过程
伊马替尼长时间使用后,大部分患者产生了耐药问题,根本原因是患者的酪氨酸激酶域产生了点突变,与伊马替尼的结合力减弱。为了克服耐药问题,研究人员对伊马替尼和Abl激酶结合的X射线晶体结构进行分析,结果发现伊马替尼的吡啶和嘧啶占据了酶活性中心的深裂缝,这个区域本应为ATP所占据。伊马替尼的吡啶与该区域的Met318形成一个氢键,酰胺基跟Glu286、Lys271、Asp381以及两个水分子之间共同构成的氢键网络稳定了伊马替尼与酶的结合,发挥了很好的酶抑制活性。但是,耐药者Abl激酶的Tyr253发生突变,影响了这些氢键网络的稳定性,导致伊马替尼的活性减弱。由此,药物研究人员设想,尽管伊马替尼的N-甲基哌嗪如预期地延伸到溶剂区,增加了水溶性,改善了药代动力学性质,但是N-甲基哌嗪的周围是一个疏水的口袋,排列着Val289、Met290、Val299和Ala380等亲脂性氨基酸残基。如果将亲水的N-甲基哌嗪换成疏水性的结构,增加和周围疏水残基的结合力,可能增加化合物对激酶的抑制作用,克服耐药问题。同时,对伊马替尼结构中的甲酰胺基进行了一个电子等排替换,改善与变异后的受体氢键结合情况。在此思路的指导下,最后优化结构,在酰胺苯环上引入了亲脂性较强的三氟甲基和较大极性的咪唑基,与酶的结合力大幅增强,活性增加,同时具有伊马替尼一样极佳的药代动力学性质,于是得到了尼洛替尼12。
通过Discovery Studio作图软件显示,伊马替尼完全嵌入受体活性中心的疏水口袋中(图4A),从而发挥抑制磷酸化作用。伊马替尼的N-甲基哌嗪基团从口袋中伸出,与水接触。由于哌嗪结构具有较大极性,较好的水溶性,N-甲基哌嗪局部结构改变了整个分子的水溶性,具有较优的脂水分配系数,使得伊马替尼有很好的药代动力学性质,最终开发成功。伊马替尼与受体作用的2D图(图4B)则清晰地揭示了伊马替尼起效的化学基础:范德华力、氢键、电荷转移复合物以及疏水作用等将小分子化合物伊马替尼与受体蛋白结合在一起,从而引起受体构象改变,启动下游生化反应,抑制磷酸化。

图4 DS显示伊马替尼与受体(PDB code:1IEP)作用图(Discovery Studio v17.2.0.16349)
在伊马替尼和尼洛替尼发现的案例中,表1所列的化学键、分子间作用力、立体效应、电子效应以及水溶性等概念都得到了体现,特别是借助Discovery Studio软件,更加形象直观地表现出来。这对于有机化学或者药物化学相关知识点的教学无疑是有帮助的。
4 结语
有机化学是药学专业的重要基础课程,特别是对于药物化学的学习,而药物化学则与药物创新紧密相关。有机化学内容庞杂,价键理论等内容更是抽象深奥,在有机化学教学过程中适时引入创新药物研究的案例,特别是结合一些软件使用,能让学生对这些内容有一个形象直观的认识,易于理解掌握,同时,也可以加深学生对有机化学作用的认识,激发学习兴趣,提升教学效果。通过近年的教学实践以及和学生的访谈分析,笔者发现学生学习兴趣不断加强,相关章节的知识点掌握更为扎实。进入专业课学习后,学生对自身作为药学人的使命感增强,学习的参与程度和主动积极性大大增加。
