18F-FDG PET/CT影像组学对肺腺癌KRAS突变的预测价值
2024-01-23朱璇璇
于 丽 朱璇璇 魏 宁
1.徐州医科大学医学影像学院(江苏 徐州 221000)
2.徐州睢宁县人民医院影像科(江苏 徐州 221000)
3.徐州医科大学附属医院介入科(江苏 徐州 221000)
肺癌按照组织形态可划分为小细胞癌和非小细胞癌[1],其中非小细胞癌约占肺癌总数的85%以上,肺腺癌属于非小细胞癌亚型的其中一种,约占所有肺癌患者40%[2]。突变的鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)是肺腺癌形成的驱动基因,也是预测表皮生长因子受体酪氨酸激酶抑制剂药物敏感性的重要预后指标[3],因此KRAS的基因突变状态对鉴别肺腺癌患者分子靶向治疗效果具有重要意义,但临床检测KRAS基因突变状态常因检测样本量较少受阻。18F-脱氧葡萄糖(fluorodeoxyglucose,FDG)PET/CT是一种基于葡萄糖代谢的功能显像方式[4],周子东[5]等研究指出,18F-FDG PET/CT在低分化肝癌和肝内胆管细胞癌的鉴别中具有较高的诊断价值。ZHANG[6]等研究通过对非小细胞癌患者的PET和CT特征构建影像组学模型,发现其对区分表皮生长因子受体具有良好的预测价值。建立PET/CT图像影像组学模型对肺腺癌患者突变基因状态的检查具有潜在价值,可以帮助医生对不同患者制定个性化治疗策略,提高患者预后情况。但目前国内关于18F-FDG PET/CT对KRAS基因突变状态的研究尚少,故本研究通过回顾性选取本院收治的肺腺癌患者,重点分析临床特征和影像组学特征预测KRAS基因的突变状态,现报道如下。
1 资料和方法
1.1 研究资料回顾性选取2019年1月至2022年5月收治于我院行18F-FDG PET/CT检查的120例肺腺癌患者作为研究对象,按照横断面分层法将其分为建模组(80例)和验证组(40例)用于模型的建立和验证。建模组和验证组患者临床资料和KRAS突变情况比较,差异无统计学意义,可进行对比(P>0.05)。本研究经我院伦理委员会审核批准通过,所有患者及家属均对本研究知情同意。
纳入标准:病理确诊为肺腺癌[7];经二代基因测序;全部接受18F-FDG PET/CT检查;病灶边界清晰且18F-FDG出现明显浓聚;临床资料和影像学资料完整。 排除标准:既往存在其他肿瘤史;既往接受过化疗、放疗及细胞生物免疫治疗者;存在精神疾病患者;合并心肝肾等器官功能障碍者。
1.2 方法
1.2.2 图像资料采集 使用美国GE Discovery Elite PET/CT仪进行图像采集,患者在检查前禁食至少6h以上,空腹血糖控制在5-7mmol/L,按照患者体质量注射4.4 MBq/kg18F-FDG(美国GE MINI trace医用回旋加速器生产,放化纯>95%),注射后1 h进行图像采集。由一名专业医师使用螺旋扫描CT,扫描电流为50-80mA,扫描电压为120kV,PET扫描范围从股骨远端至颅骨顶部,需扫描8个床位,每个床位扫描时间均为2min。使用CT扫描数据进行图像的衰减校正,迭代法进行图像重建,迭代次数为3次,图像大小200mm,放大1倍。
1.3 基因突变检测通过穿刺活检或手术切除获得病理组织标本,进行切块、固定、脱水、石蜡包埋、切片后,采用QIAampDNAFFPE还集合选取切片进行DNA提取,经聚合酶链反应扩增和阻滞突变系统法对KRAS基因突变情况进行检测。
1.4 影像组学分析
1.4.1 病灶分割 所有入组患者图像均导入LIFEx软件,找到肿瘤原发病灶,在PET和CT图像上进行手动勾画感兴趣区,由两名副主任医师及以上职称的核医学专家进行确认并达成意见一致。
1.4.2 影像组学特征 使用Python 3.7.1中的Pyradiomics模块对PET/CT影像组学特征进行提取,包含灰度相关矩阵(gray level dependence matrix,GLDM)、灰度区域大小矩阵(gray level size zone matrix,GLSZM)、灰度共生矩阵(gray level cooccurrence matrix,GLRLM)、一阶(first order,FO)、灰度游程长度矩阵(gray level run length matrix,GLSZM)
1.4.3 特征筛选 (1)特征可重复性检验:针对2位高年资影像诊断医师(A、B)勾画的感兴趣区,分别提取影像组学特征,使用ICC对两位医师提取的特征进行评价,以ICC=0.85作为标准,ICC>0.85为一致性好。(2)使用R软件中glmnet包进行最小绝对收缩和选择算子法(least absolute shrinkage and selection operator,LASSO)回归降维进行参数筛选,最优调节参数λ值使用十倍交叉验证法获得。
1.5 评判标准美国东部肿瘤协作组(eastern cooperative oncology group, ECOG)评分[8]:总分0-5分,0分表示活动能力完全正常与正常人活动无任何差异;1分表示能自由行走并承担较轻松的日常活动和办公室工作;2分表示能自由行走,生活可以自理但基本丧失工作能力;3分表示生活可以自理,日常超出一半以上的时间需要坐轮椅;4分表示生活不能自理,长期卧床不起;5分表示死亡。
1.6 统计学分析使用SPSS 22.0进行统计学分析。计量资料首先进行正态性和方差齐性检验,服从正态分布则用(±s)表示,组间比较使用独立样本t检验;计数资料以频数表示,组间比较使用卡方检验。在建模组中经单因素Logistic回归分析筛选出的临床因素和影像组学特征分别构建临床(clinic)模型、影像组学(rad)模型。进一步筛选变量建立联合(combine)预测模型。使用受试者工作特征曲线(receiver operating characteristic curve,ROC)、Hosmer-Lemeshow检验和决策曲线分析评估建模组模型和验证组模型的区分度、校准度和模型净效益。不同曲线下面积之间差异性比较使用Delong检验,检验水准α=0.05。
ACS是以冠状动脉粥样硬化斑块破溃、继发完全或不完全闭塞性血栓形成为病理基础的临床综合征,包括UAP、NSTEMI、STEMI等类型,其不稳定斑块破裂和随之发生的血小板聚集及血栓形成是导致患者发病的主要机制[18]。近年来有研究指出,冠状动脉炎症在动脉粥样硬化斑块不稳定方面起着重要作用[19]。ACS不仅可给患者造成严重的身体痛苦,而且还可造成重大的精神刺激,以焦虑和抑郁最为常见[20]。而这些情绪障碍均可促发或加重心绞痛、心肌梗死、心律失常、心力衰竭等症状,甚至可导致患者死亡[21]。
2 结 果
2.1 建模组和验证组的一般临床资料比较建模组和验证组患者临床资料比较,差异无统计学意义(P>0.05),见表1。
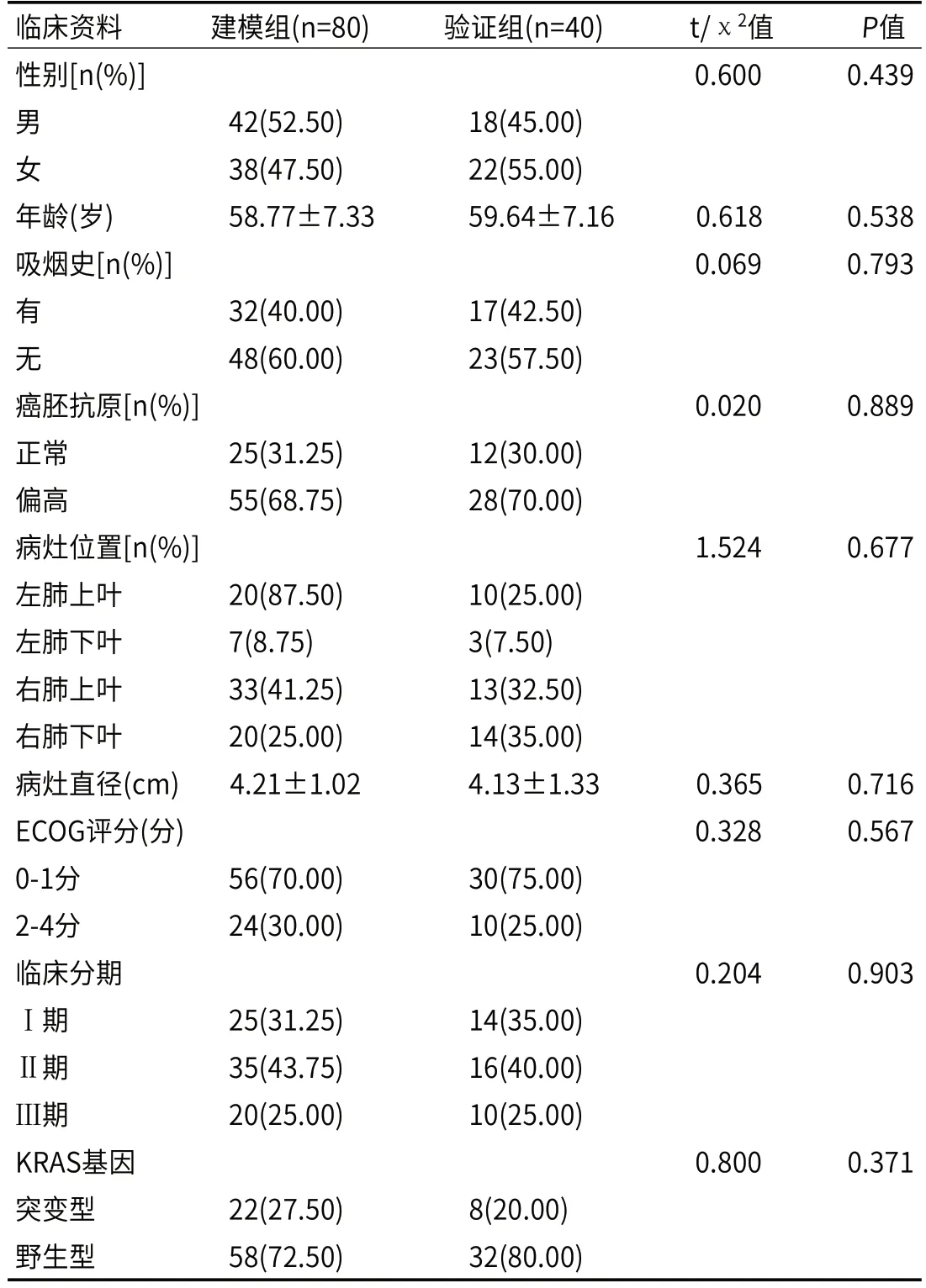
表1 建模组和验证组患者临床资料比较
2.2 构建临床预测模型
2.2.1 建模组患者临床资料比较 建模组内突变组患者与野生组患者性别、年龄、吸烟史和ECOG评分比较,差异有统计学意义(P<0.05),而癌胚抗原、病灶位置、病灶直径、临床分期比较,差异无统计学意义(P>0.05),见表2。
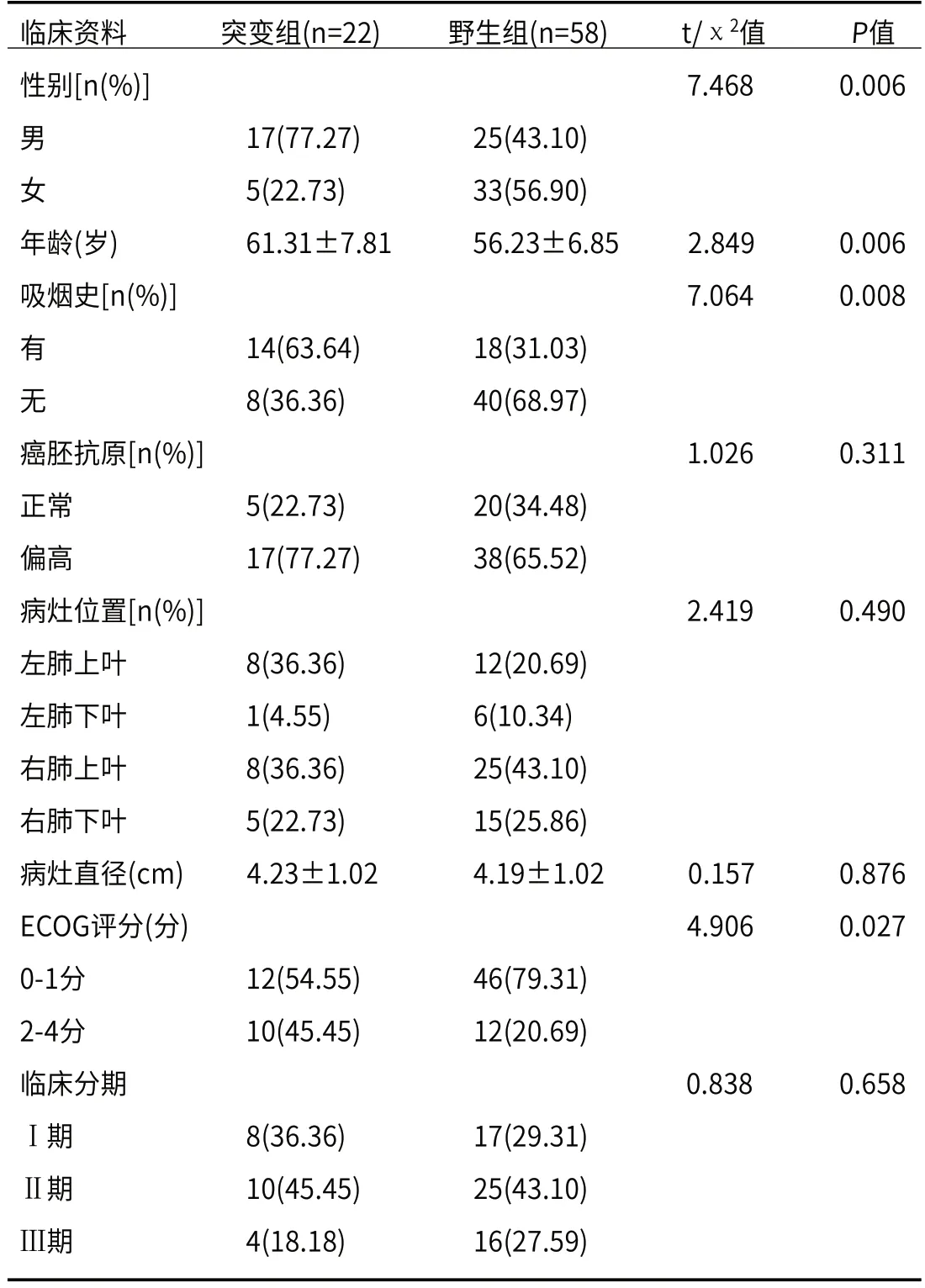
表2 突变组和野生组患者临床资料比较
2.2.2 临床预测模型构建 将2.2.1中差异有统计学意义的因素作为自变量,KRAS基因是否突变作为因变量纳入多因素logistic回归分析模型中,结果如表3所示,性别、年龄、吸烟史为肺腺癌患者KRAS基因突变的独立危险因素(P<0.05),模型表达式=1.168+0.976×性别+0.041×年龄+1.298×吸烟史。
2.3 构建影像组学模型
2.3.1 影像组学特征选取 利用Pyradiomics软件包从建模组每个患者的感兴趣区分别提取1466个影像组学特征,先通过可重复性分析后,剔除其中866个特征;再对剩余的600个影像特征LASSO回归将其进行简化,最后筛选出5个潜在预测因子,进行特征间相关性分析(相关性均小于0.9),如图1所示。

图1A-图1C 肺腺癌患者影像组学特征LASSO回归筛选及相关性热图
2.3.2 影像组学预测模型构建 将2.3.1中筛选出的5个影像组学特征纳入多因素logistic回归分析,构建影像组学模型,见表4,Rad = 1.451+1.412× orig_shape_MAL+1.274× wave_LHH_GLSZM_GLNU+0.925× wave_HHH_GLDM_DE+0.753×wave_HLL_FO_Minimum+1.168×wave_HHH_FO_TE,并根据公式计算出影像组学评分Rad-score。

表4 多因素Logistic回归分析筛选出的5个影像组学特征
2.4 联合预测模型构建基于Rad-score与临床因素构建联合预测模型,见表5,并计算出Combine预测模型=0.943+0.305×性别+0.351×年龄+0.941×吸烟史+0.795×Rad-score。
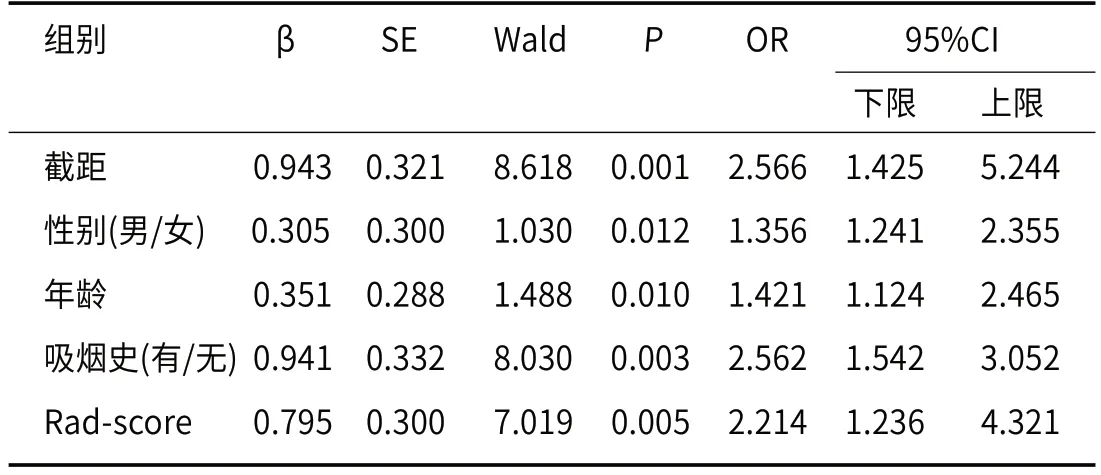
表5 Rad-score和Clinic联合预测模型
2.5 评估模型
2.5.1 ROC曲线评估模型 ROC曲线分析结果显示,如图2、表6,Clinic模型在建模组中曲线下面积为0.765(95%CI:0.721-0.815),在验证组中为0.764(95%CI:0.711-0.821)。Rad模型的曲线下面积分别为0.851(95%CI:0.802-0.921)和0.849(95%CI:0.788-0.917)。建模组和验证组中Rad模型与Clinic模型经Delong检验显示,两种模型之间差异均有统计学意义(均P<0.05)。Combine模型在建模组和验证组中的曲线下面积分别为0.922(95%CI:0.852-0.947)和0.920(95%CI:0.849-0.950),经Delong检验显著均显著高于同组Rad模型和Clinic模型(均P<0.05)。
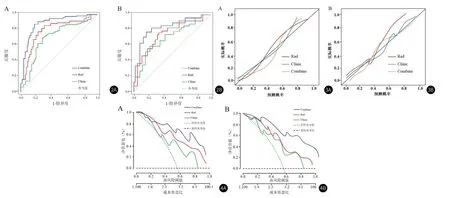
图2A-图2B Rad、Clinic及Combine模型预测肺腺癌患者KRAS突变ROC曲线;(图2A:建模组;图2B:验证组)图3A-图3B Rad、Clinic及Combine模型预测肺腺癌患者KRAS突变校准曲线;(图3A:建模组;图3B:验证组)图4A-图4B Rad、Clinic及Combine模型预测肺腺癌患者KRAS突变临床决策曲线;(图4A:建模组;图4B:验证组)
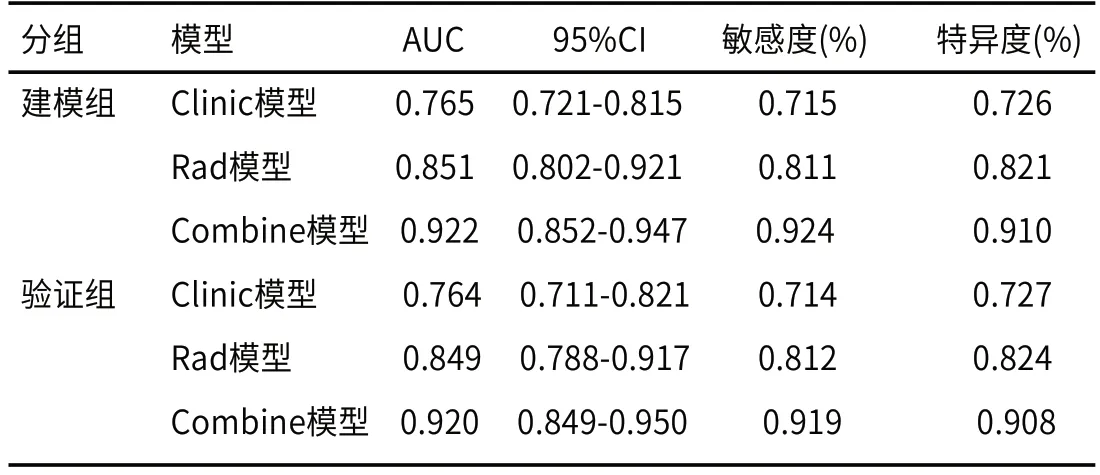
表6 三种模型在建模组和验证组中的预测效能
2.5.2 校准曲线评估模型 Hosmer-Lemeshow检验显示两组中各模型实际概率与预测概率一致性良好,模型具有较高的预测精准度,见图3。
2.5.3 临床决策曲线分析 决策曲线分析表明,在很大的阈值范围内(阈值概率>20%),Combine模型曲线均显著高于Clinic模型、Rad模型和极端曲线,说明Combine模型安全性更高,具有更高的净获益与临床价值。
3 讨 论
KRAS是表皮生长因子受体信号通路的下游调控基因,一旦发生KRAS基因12.13或61位点的突变,会造成氨基酸替换,激活表皮生长因子受体下游信号通路,正常调控细胞周期功能下降,促进肺腺癌的发生和发展,并造成表皮生长因子受体通路耐药[9-10]。陈会会等[11]研究纳入409例非小细胞肺癌患者,KRAS突变率约为13.4%(55/409),其中肺腺癌患者中KRAS突变率约为15.17%(49/323),研究结果指出有吸烟史、男性患者、ECOG评分高患者KRAS突变率更高。本研究纳入人群中KRAS突变率约为25.00%(30/120),临床特征中男性、存在吸烟史、年龄大是造成KRAS突变的独立危险因素,与上述研究基本相符。既往研究[12]指出,年龄越小患者突变率越高,这与本研究不符可能与肺腺癌KRAS突变率较低,导致存在抽样误差有关。KRAS突变位点以第2外显子的12号密码子最为常见,而吸烟患者多为G12C、G12V、G12A突变[13],可能的解释为:12号密码子是烟草致癌物的主要特异作用位点。而女性人群普遍吸烟率显著低于男性患者,故KRAS突变率显著低于男性。
影像组学可通过量化特征无创的评估肿瘤异质性,分析其与临床病理因素的相关性,预测疾病结局,可作为传统影像学分析的重要补充[14]。PET/CT属于全身成像检查,灵敏度较高,且检查一次可以获得PET图像和CT图像两种,分别表示肿瘤代谢和形态[15]。本研究经过最小绝对收缩和LASSO回归进行影像组学特征的筛选,避免了以往研究中单纯使用LASSO回归造成的重要信息丢失[16],最终共筛选5个潜在预测因子,包含3个PET特征和2个CT特征,其中4个属于小波特征,1个属于原始形状特征。本研究基于临床因素和影像组学特征因素构建预测模型,并进一步将建立临床因素与影像组学特征联合预测模型,经ROC曲线评估,三种模型在建模组和验证组中曲线下面积均>0.75,说明三种模型对肺腺癌KRAS基因突变的预测价值均较高,经Delong检验发现,建模组和验证组内三种模型的预测价值比较,差异均有统计学意义,预测效果依次为Combine模型、Rad模型和Clinic模型。本研究使用校准曲线评价各模型在建模组和验证组中的校准度,发现各模型的拟合优度检验均较好。此外,建模组中联合预测模型的整体净获益高于另外两种模型,提示联合预测模型的临床应用价值更高。本研究还存在一些不足之处:由于KRAS突变率较低,导致本研究样本量纳入较少,且本研究为回顾性研究,可能导致实验结果出现偏倚。后续将进行前瞻性、多中心、大样本的研究,并分析PET/CT影像组学对肺腺癌患者KRAS突变分析亚型的预测价值。综上所述,18F-FDG PET/CT影像组学和临床特征联合对肺腺癌患者KRAS突变具有良好的预测价值。
