产活性氧假交替单胞菌GCY全基因组序列分析
2024-01-22岳昊,吴硕,王竞*,李泽龙,顾晨
岳 昊, 吴 硕, 王 竞*, 李 泽 龙, 顾 晨
(1.大连理工大学 环境学院, 辽宁 大连 116024;2.中国电建集团华东勘测设计研究院有限公司, 浙江 杭州 311122 )
0 引 言
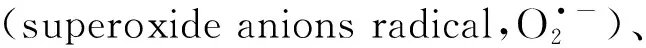
由Gauthier等[11]在1995年从交替单胞菌中分离得到的假交替单胞菌(Pseudoalteromonas),是在全球海洋生态系统中普遍存在的革兰氏阴性菌.在本课题组之前的研究中,Gu等[12]证明了Pseudoalteromonassp.GCY可通过产生的胞外ROS完成四溴双酚A的好氧共代谢降解;Li等[7]揭示了Pseudoalteromonassp.GCY降解布洛芬首先由胞外ROS启动,然后中间产物被细胞内的酶进一步降解.然而Pseudoalteromonassp.GCY的参考基因组还不清晰,且影响假交替单胞菌胞外ROS产生的因素也未知.
从大连近海表层沉积物中分离得到一株能产胞外ROS的Pseudoalteromonassp.GCY.采用Illumina测序技术对Pseudoalteromonassp.GCY基因组进行测序,并对其产ROS特性进行研究,以提供Pseudoalteromonassp.GCY(以下简称菌株GCY)的基因组信息,明晰影响产ROS的因素.研究结果将在分子水平上加深对生物源ROS产生以及影响机制的理解.
1 材料与方法
1.1 菌株的分离与鉴定
近海表层沉积物采集自中国辽宁省大连市黑石礁(38°52′34″N,121°33′58″E).连续培养120 d后,沉积物中的菌群被富集.将富集得到的菌群在人工海水制备的固体BP培养基中25 ℃下培养2 d,然后在培养基上进行重复划线,以纯化菌株GCY[12].固体BP培养基成分如下:牛肉膏1 mg/L,蛋白胨2 mg/L,四溴双酚A 50 mg/L,琼脂20 mg/L.利用场发射扫描电子显微镜(FEI Nova NanoSEM 450)观察菌株GCY的形态.
挑取固体BP培养基中的单个菌落,溶于10 μL无菌水中,80 ℃水浴变性15 min.以离心上清液为模板进行聚合酶链反应(PCR)扩增.TaKaRa 16S rDNA细菌鉴别PCR试剂盒用于扩增菌株GCY的16S rRNA基因,测序的正向引物和反向引物分别为RV-M和M13-47.扩增反应条件:94 ℃变性5 min,随后以94 ℃、60 s,55 ℃、60 s,72 ℃、1.5 min为一轮,反应30轮,最终在72 ℃下延伸5 min.切割凝胶测序,回收PCR产物,即获得菌株GCY的16S rRNA基因序列.DNA测序部分由宝日医生物技术(北京)有限公司大连分公司完成.Blastn程序用于分析菌株GCY序列与已知的16S rRNA基因序列的同源性.除特别说明外,本文提及的所有软件均使用默认参数.OrthoANI用于计算两个16S rRNA基因序列之间的平均核苷酸同源性.Clustal X用于比较相关序列.使用MEGA11,基于16S rRNA基因,利用邻近算法推断菌株GCY的系统发育树.
1.2 全基因组测序和注释
利用Illumina NovaSeq PE150短读平台和PacBio RSII长读平台对菌株GCY的全基因组进行测序.PacBio RSII长读取用于基因组组装,Illumina NovaSeq PE150短读取用于scaffold组装.对低质量的reads进行过滤(<500 bp),获得干净数据.对照Gene Ontology(GO)数据库、Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库、Clusters of Orthologous Groups(COG)数据库和Swiss-Prot数据库对基因功能进行注释.对照综合抗生素耐药性数据库(Comprehensive Antibiotic Resistance Database,CARD)注释抗性基因.采用SignalP工具预测该蛋白序列是否为分泌蛋白.
1.3 ROS产生特性
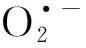
1.4 比较基因组
为进一步了解环境中生物源ROS的分布,首先在假交替单胞菌属内进行比较基因组分析,最终以与菌株GCY基因组高度相似的Pseudoalteromonasflavipulchrastrain JG1和Pseudoalteromonaspiscicidastrain JCM 20779为代表.利用Orthovenn对3个菌株的蛋白质序列比较聚类,构建基因家族.使用Mauve计算和绘制3个菌株基因组之间保守和高度同源基因组区域的共线性.对照整合微生物基因组(Integrated Microbial Genomes,IMG)数据库检索上述3个菌株的ROS产生和消除相关基因.此外,利用AnnoTree(http://annotree.uwaterloo.ca/)检测胞外ROS产生相关酶在环境微生物中的分布.
2 结果与讨论
2.1 菌株GCY鉴定与系统发育
菌株GCY在琼脂平板上的菌落与典型的假交替单胞菌相似,呈橘黄色不透明光滑的圆形.该菌是革兰氏阴性、兼性好氧、异养的动杆菌.场发射扫描电子显微镜观察表明,菌株GCY的平均尺寸为0.4~2.0 μm.16S rRNA测序结果显示,菌株GCY的16S rRNA序列全长1 447 bp(GenBank accession number KY 583737.1).16S rRNA同源性分析结果显示,菌株GCY与Pseudoalteromonaspiscicidastrain NBRC 103038和Pseudoalteromonaspiscicidastrain IAM 12932的关系最为密切.基于16S rRNA基因序列的系统发育分析结果如图1所示,菌株GCY与Pseudoalteromonaspiscicidastrain NBRC 103038形成进化枝.平均核苷酸同源性为100%,这表明它们可能属于同一种.

图1 菌株GCY的系统发育树
2.2 菌株GCY基因组特性
经过Illumina和PacBio测序得到了菌株GCY基因组的结构(图2).完整的基因组由Chr1和Chr2两个染色体环组成,图中由外到内分别为重复密度,COG、KEGG、GO基因注释结果,ncRNAs,基因组GC含量,基因组GC偏倚值.结果表明,完整基因组由两条环状染色体组成,大小为5.47 Mb,平均GC含量为43.39%.全部基因总长为4.84 Mb,占基因组总长的88.5%.预测到4 626个蛋白质编码基因、106个tRNA基因、28个rRNA基因和4个sRNA基因(表1).氨基酸运输和代谢(E)、翻译、核糖体结构和生物发生(J)、信号转导机制(T)和转录(K)是最丰富的COG类别.此外,在菌株GCY基因组序列中预测到了500个分泌蛋白.
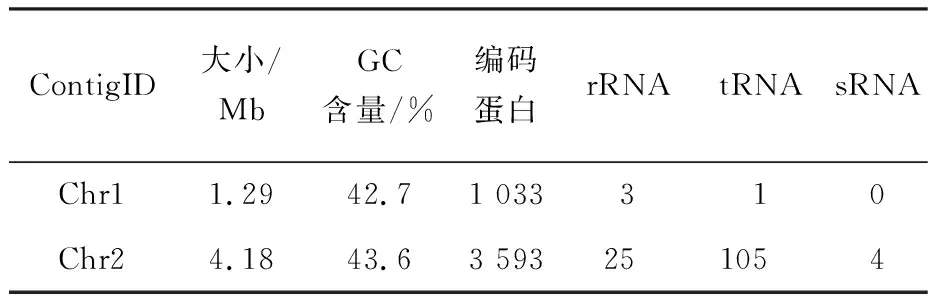
表1 菌株GCY基因组特性
2.3 基于全基因组的分析
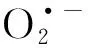
在菌株GCY基因组中还注释到32个编码糖基转移酶的基因,如ftsI、ftsW、murG和rfaQ等,这些基因可能参与了菌株GCY胞外聚合物质(extracellular polymeric substances,EPS)的形成[18].产生EPS的菌株在假交替单胞菌属中很常见[19].研究表明,EPS可以增强细菌对氧化应激的耐受性,从而减轻膜损伤[20].
此外还在菌株GCY基因组中发现了adeG、mexI、mexT、mfd、msbA、PmrE、TaeA和TriC等抗生素抗性基因.在过去的几年里,抗生素在海洋环境中被广泛发现,以往的研究表明,抗生素可引起细胞氧化应激[21-22].通过CARD分析,推测菌株GCY的耐药性主要来源于外排泵机制.这种机制在革兰氏阴性菌中普遍存在,涉及的基因包括adeG、TriC、mexT和mexI等.这些基因编码的酶可以泵送多种抗生素,赋予菌株GCY抗生素耐药性[23-24],同时减轻细胞的氧化应激.
综上所述,在菌株GCY基因组中鉴别到使其兼具产胞外ROS能力与应对氧化胁迫能力的相关基因.
2.4 ROS产生特性分析
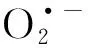
2.5 比较基因组分析
为进一步了解环境中生物源ROS的分布,首先在假交替单胞菌属内,通过比较基因组分析了菌株GCY与其他菌株的基因组特征.以与菌株GCY基因组高度相似的Pseudoalteromonasflavipulchrastrain JG1和Pseudoalteromonaspiscicidastrain JCM 20779为代表进行基因组特征分析(图4,表2).如图4所示,3个菌株核心基因组为3 737个基因,占每个基因组的90.0%~ 92.2%;菌株GCY(4 151个基因)中分别有94.3%(3 915个基因)和95.5%(3 963个基因)在菌株JG1和菌株JCM 20779中具有同源性(图4(a)),共线性分析结果与菌株GCY、JG1和JCM 20779的密切亲缘关系一致(图4(b)),被色块覆盖的序列区域在基因组中完全共线和同源.中心线以下的块表示按反向补码(逆)方向对齐的区域.重新排列用彩色线条表示.据此推测,菌株JG1和菌株JCM 20779的基因组中也存在与胞外ROS产生和消除相关的基因.这表明与菌株GCY相似的菌株也具有产胞外ROS的潜力.同时,对3个菌株基因组中ROS相关功能基因进行检索验证了这一推测:3个菌株基因组中都存在编码LAAO、Na+-转运NADH-醌氧化还原酶、超氧化物歧化酶和过氧化氢酶的基因.有研究发现假交替单胞菌属的其他种也能产生L-氨基酸氧化酶[25-26]和过氧化氢酶.以上分析表明具有产胞外ROS能力的微生物在假交替单胞菌属内广泛存在.
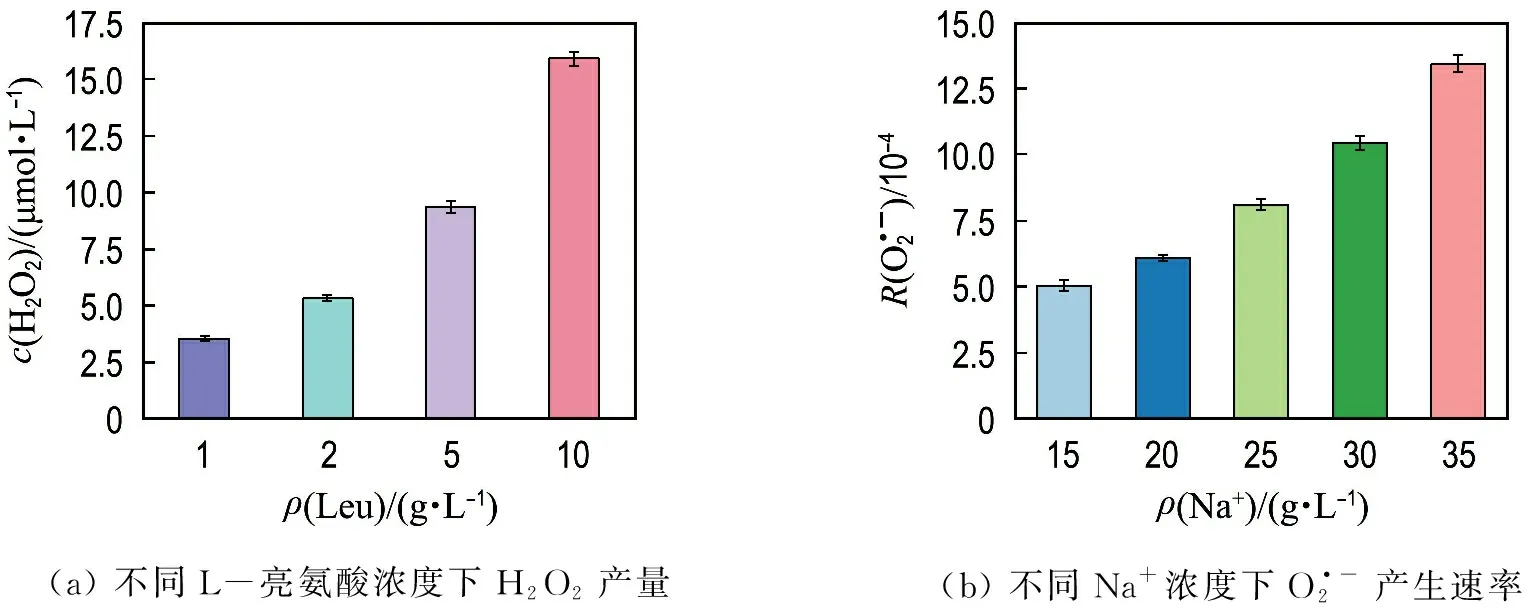
图3 ROS的产生特性
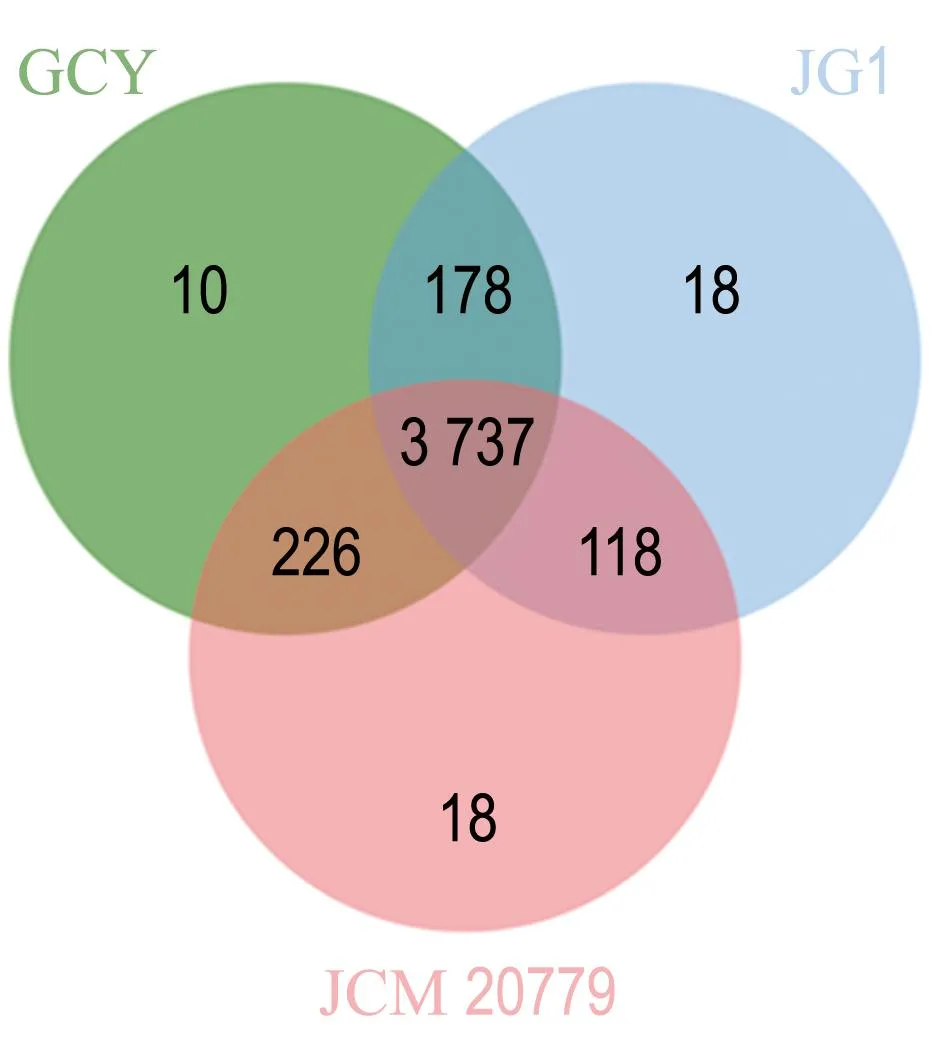
(a) 3个菌株的COGs维恩图

(b) 全基因组比对
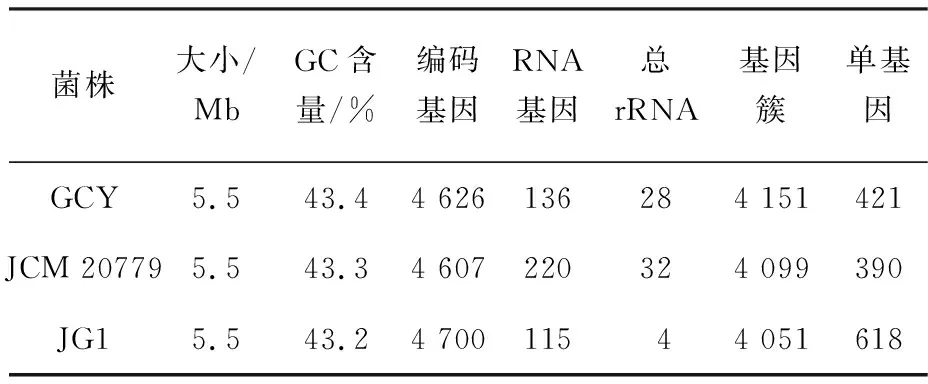
表2 菌株GCY、JG1和JCM 20779的基因组比较
进一步利用AnnoTree(http://annotree.uwaterloo.ca/)检测LAAO和Na+-转运NADH-醌氧化还原酶在环境微生物中的分布.图5展示了具有编码LAAO(图5(a))和Na+-转运NADH-醌氧化还原酶(图5(b))基因的微生物,除了海洋生物种群外,一些存在于淡水和土壤中的微生物也具有这种能力,例如广泛分布于土壤、淡水的假单胞菌已被证明产胞外ROS并因此被用于降解四溴双酚A[27].此外,研究表明与ROS产生相关的基因通过可移动遗传元件在物种间的频繁水平转移有助于它们在环境中广泛传播[28],且胞外ROS对微生物益害并存[29],因此,有理由推测具备产胞外ROS能力的微生物可能在环境中广泛存在.

(a) LAAO
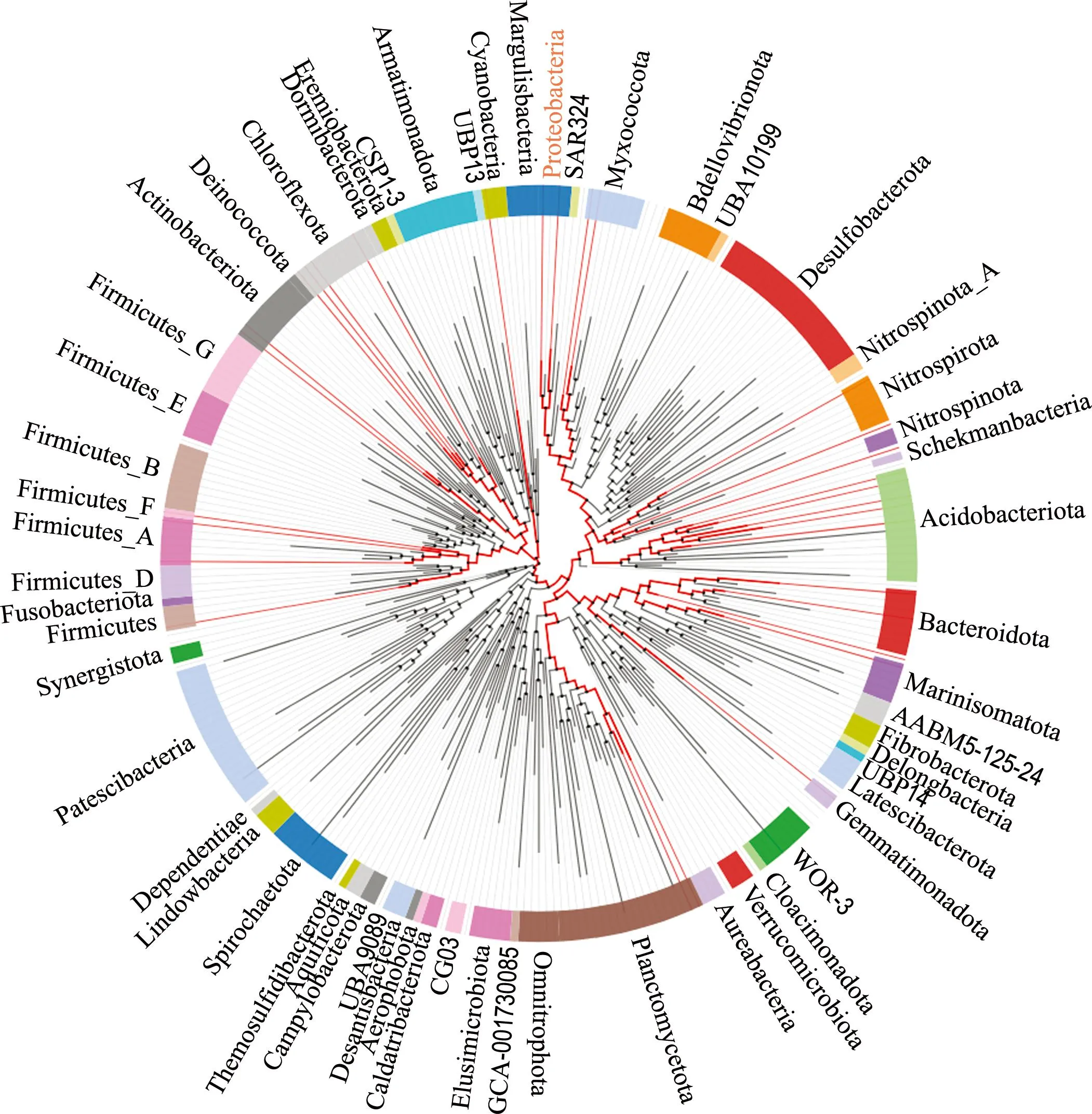
(b) Na+-转运NADH-醌氧化还原酶
3 结 语
本研究提供了具有产胞外ROS能力的Pseudoalteromonassp.GCY的生物学信息,鉴别了该菌株胞外ROS产生相关功能基因包括lodA、lodB和nqrA-F,抗氧化应激相关功能基因包括sod和kat等.在此基础上通过实验探明了氨基酸和Na+浓度是影响菌株胞外ROS产量的关键因素:在一定范围内,氨基酸和Na+浓度的增大有利于胞外ROS产量的增加.研究还探明了胞外ROS产生相关基因广泛存在于环境中的假交替单胞菌乃至各种微生物中,拓宽了对生物源ROS存在范围的认识.综上,本研究结果在分子水平上加深了对生物源ROS产生的理解,这为开发利用生物源ROS提供了更多启示.此外,鉴于ROS参与环境中多种物质转化,推测生物源ROS可能在无光区的生物元素地球化学循环中发挥了重要作用.
