基于网络药理学及实验验证探讨补肾定眩汤治疗高血压的作用机制
2024-01-20肖沐紫王思齐贾壮壮王志刚
肖沐紫,王思齐,贾壮壮,王志刚
高血压是以体循环动脉压升高为主要临床表现的心血管综合征,是我国危害严重的慢性疾病之一,是多种心脑血管疾病的重要病因及危险因素[1]。虽然对高血压病诊治取得了很多进展,药物不断更新换代,但高血压药物也有诸多不足之处,依然存在用药持续性和血压控制率不良等问题[2]。高血压病发病机制复杂,涉及遗传因素、环境因素,并与神经机制、肾脏机制、激素机制、血管机制及胰岛素抵抗等密切相关,中药具有的多组分、多靶点、多机制作用特点,在其治疗中具有独特优势。网络药理学作为系统生物学的重要组成部分,从多角度阐释药物-靶点-疾病间的复杂网络关系,与中医学整体观念的基本特点相吻合,为研究多组分、多靶点的中药机制提供可靠的方法[3-5]。本研究采用网络药理学结合动物实验验证,初步揭示补肾定眩汤对高血压病的治疗作用及调控途径,为后续基础研究及临床推广提供理论及实验依据。
1 资料与方法
1.1 补肾定眩汤活性化合物筛选 通过计算系统生物学实验室数据库(TCMSP:http://tcmsp-e.com/tcmsp.php),设置ADME 参数为OB≥30%、DL≥0.18、Caco-2≥-0.4、BBB≥-0.3、HL≥4 h,对补肾定眩汤方药组成中包含的天麻、附子、茯苓、党参、白芍、白术所含化合物进行筛选分析,构建补肾定眩汤活性化合物调控靶点数据库。
1.2 化合物-靶点网络构建 将筛选出的补肾定眩汤药物靶点通过UniProt平台(https://www.uniprot.org/)将蛋白靶点转化为基因,并采用Cytospase 3.6.1软件将补肾定眩汤化合物-靶点网络化。
1.3 潜在核心靶点筛选 基于OMIM 数据库(http://www.omim.org/)、TTD 数据库(https://db.idrblab.net/ttd/) 与DisGeNET 数据库(http://www.disgenet.org/)并结合文献报道筛选高血压疾病靶点,并与药物-靶点网络进行融合,筛选出补肾定眩汤治疗高血压病的潜在核心靶点。
1.4 潜在核心靶点之间蛋白互作网络分析 基于STRING 数据库(https://string-db.org/),将补肾定眩汤治疗高血压病的潜在核心靶点构建蛋白互作网络(protein-protein interaction network,PPI),将靶点关系可视化。
1.5 GO/KEGG 信号通路富集分析 利用DAVID数据库(https://david.ncifcrf.gov/),对生物过程(biological process,BP)、细胞成分(cellular component)、分子功能(molecular function)进行GO/KEGG 调控通路富集分析,综合预测补肾定眩汤改善高血压的调控机制。
1.6 实验动物 选取SPF 级雄性10 周龄自发性高血压大鼠(spontaneously hypertensive rat,SHR)及Wistar 大鼠,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2016-0006;饲养于天津中医药大学动物实验中心,自由进食进水,室温20~25 ℃,相对湿度56%~60%;实验动物所有操作均严格按照天津中医药大学动物伦理委员会标准执行(TCM-LAEC2015028)。
1.7 分组与干预 将50 只SHR 大鼠随机分为模型组(Model 组)、卡托普利组(Captopril 组)、补肾定眩汤低剂量组(BSDX-L 组)、中剂量组(BSDX-M组)及高剂量组(BSDX-H 组);另设10 只Wistar 大鼠为正常对照组(NC 组),每组各10 只。Captopril组每日给予卡托普利片12.5 mg/kg,补肾定眩汤低、中、高剂量组每天分别按6.3 g/kg、12.6 g/kg、18.9 g/kg 生药剂量,各组灌胃给药,NC 组和Model组给予等容积的蒸馏水灌胃,连续给药6 周。
1.8 血压测定 各组大鼠分别于给药6 周后,于大鼠清醒状态下检测尾动脉收缩压(systolic blood pressure,SBP)、舒 张 压 (diastolic blood pressure,DBP) 及平均动脉压(mean arterial pressure,MAP),每只大鼠测量3 次,取平均值。
1.9 HIF-1/TGF-β 信号通路检测 各组大鼠末次测压之后,3%异氟烷吸入麻醉后,开胸并小心分离胸主动脉,剪取主动脉弓下一段,轻轻将血管周边残留的结缔组织剥离干净,再将其放入生理盐水中进行漂洗,液氮速冻后置于-80 ℃冰箱保存。采用Western-Blot 法检测HIF-1α 蛋白表达水平,采用ELISA 法检测TGF-β 表达水平。
1.10 统计学方法 采用SPSS 21.0 统计分析软件进行分析,计量资料以均数±标准差(±s)表示,组间比较若满足正态分布,采用单因素方差分析(one-way ANOVA),组间比较若方差齐采用LSD 法,不满足方差齐性采用Tamhane's T2 法;不符合正态分布采用秩和检验;最小显著差异水平设定为P<0.05。
2 结果
2.1 补肾定眩汤活性化合物信息 通过统计筛选并删除重复或无靶点的补肾定眩汤6 味中药所含组分,最终得到23 个活性成分,其中天麻4个,附子4 个,党参5 个,白芍3 个,白术3 个,茯苓4 个,见表1。

表1 补肾定眩汤活性化合物信息
2.2 化合物调控靶点 通过对补肾定眩汤所含23 个化合物的调控靶点进行统计筛选,共获得天麻调控靶点17 个,附子调控靶点28 个,党参调控靶点71 个,白芍调控靶点61 个,白术调控靶点35 个,茯苓调控靶点44 个。
2.3 补肾定眩汤治疗高血压病的潜在核心靶点基于OMIM 数据库、TTD 数据库及DisGeNET 数据库并结合文献报道筛选高血压疾病靶点444个;与补肾定眩汤对应的化合物-靶点进行比对,筛选出15 个补肾定眩汤治疗高血压病的潜在核心靶点,见表2。
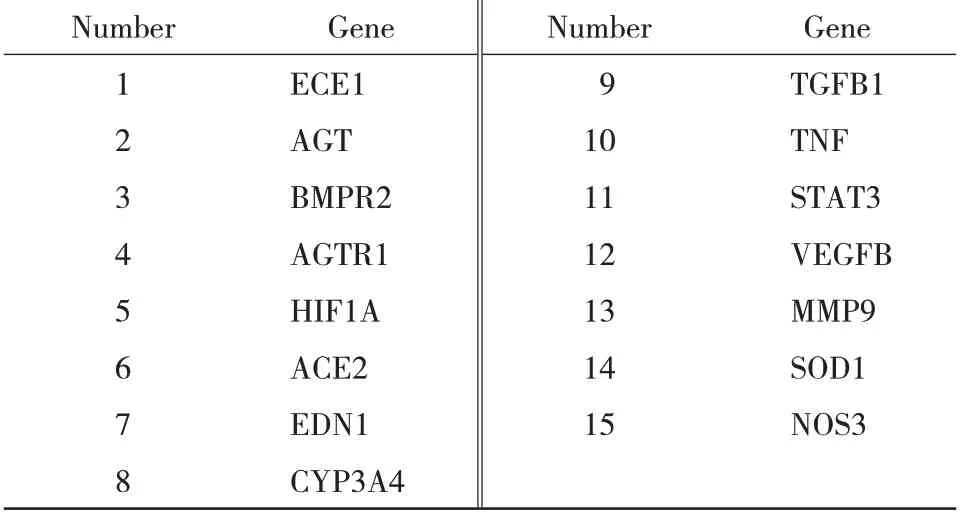
表2 补肾定眩汤治疗高血压病的潜在核心靶点
2.4 核心靶点PPI 网络 将补肾定眩汤治疗高血压病的潜在核心靶点导入STRING 平台构建PPI 网络,结果显示核心靶点PPI 网络共包含15个节点、65 条边,平均度值为8.67,其中节点代表靶点蛋白,边代表各个蛋白之间的互作关系,节点连接边数表明靶点蛋白在PPI 网络互作关系中的关键程度。
2.5 GO/KEGG 调控通路富集分析 补肾定眩汤治疗高血压病的潜在核心靶点GO/KEGG 功能富集分析表明,补肾定眩汤可通过调节血管收缩及舒张的生物过程、肾素-血管紧张素生物过程、松弛素信号通路、HIF-1 信号通路(HIF-1 signaling pathway)、转化生长因子-β 信号通路(TGF-β signaling pathway)等途径改善高血压,见图1~2。

图1 核心靶点GO 功能富集分析
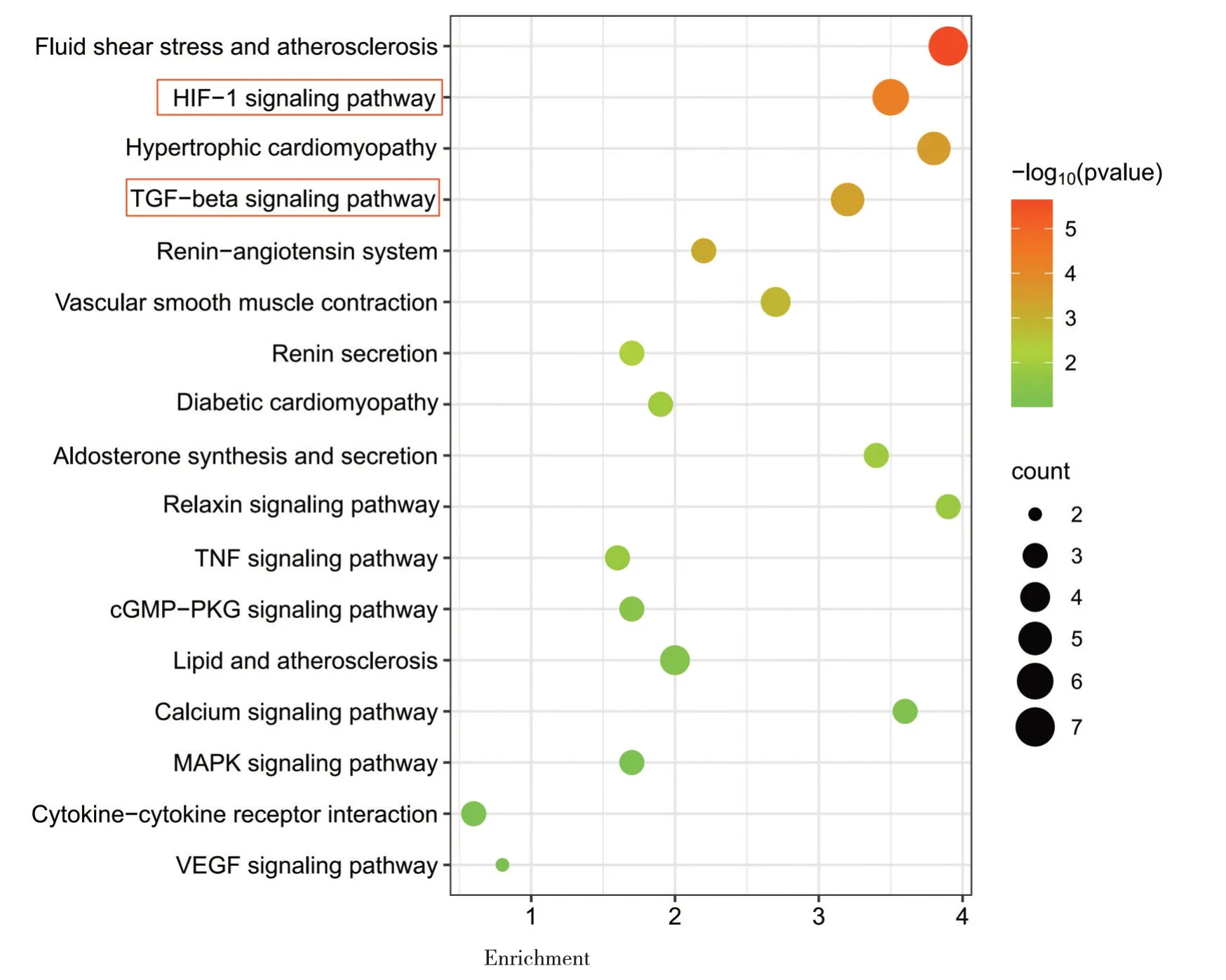
图2 潜在核心靶点KEGG 信号通路富集分析
2.6 补肾定眩汤对大鼠血压的影响 与NC 组比较,Model 组大鼠SBP、DBP、MAP 均显著升高,差异具有统计学意义(P<0.01);与Model 组比较,补肾定眩汤各剂量干预组SBP、DBP、MAP 均下降,差异具有统计学意义(P<0.05,P<0.01);其中高剂量组血压下降程度优于低、中剂量组(P<0.01),见图3。

图3 补肾定眩汤对大鼠血压的影响
2.7 补肾定眩汤对大鼠HIF-1/TGF-β 信号通路的影响
2.7.1 补肾定眩汤对HIF-1α 蛋白表达水平的影响 与NC 组比较,Model 组大鼠HIF-1α 蛋白相对表达量显著上调,差异具有统计学意义(P<0.01);与Model 组比较,补肾定眩汤低剂量干预后,HIF-1α 蛋白相对表达量无差异,中、高剂量干预后,HIF-1α 蛋白相对表达量均下降,差异具有统计学意义(P<0.05,P<0.01);其中高剂量组下降程度优于中剂量组(P<0.01),见图4。
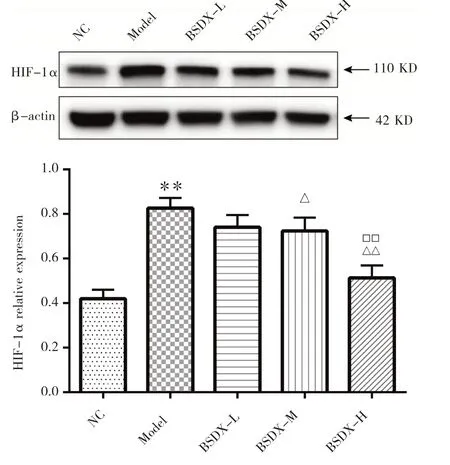
图4 补肾定眩汤对大鼠HIF-1α 蛋白表达的影响
2.7.2 补肾定眩汤对TGF-β 表达水平的影响与NC 组比较,Model 组大鼠TGF-β 表达水平显著上调,差异具有统计学意义(P<0.01);与Model 组比较,补肾定眩汤低剂量干预对TGF-β表达量无影响;中、高剂量干预后,TGF-β 表达水平显著下降,差异具有统计学意义(P<0.05,P<0.01);其中高剂量组改善程度优于中剂量组(P<0.05),见图5。

图5 补肾定眩汤对大鼠TGF-β 表达水平的影响
3 讨论
高血压发病涉及神经递质异常、肾素-血管紧张素-醛固酮系统(RAAS)激活及大小动脉结构功能失衡等机制,中医学常将其归属于“眩晕”“头痛”等范畴,认为本病的病机为本虚标实,肝阳上亢为标,肾阳亏虚为本[6-8]。中药多组分、多靶点、多机制的作用特点与网络药理学复杂网络关系特点吻合,可系统揭示中药调控疾病的物质基础及作用途径[9-11]。补肾定眩汤由天麻、附子、白芍、党参、白术、茯苓组成。网络药理学分析结果表明,补肾定眩汤含有23 个活性成分,改善高血压病的潜在核心靶点15 个,包括ECE1、AGT、BMPR2、HIF1A、ACE2、TGFB1 等;可通过调节血管收缩及舒张的生物过程、肾素-血管紧张素生物过程、松弛素信号通路、HIF-1信号通路、转化生长因子-β 信号通路等途径改善高血压。进一步通过补肾定眩汤干预SHR 大鼠模型的实验结果表明,补肾定眩汤可显著降低大鼠收缩压、舒张压及平均动脉压,显著抑制HIF-1/TGF-β 信号通路激活。
基于网络药理学对补肾定眩汤治疗高血压病作用机制研究提示,松弛素作为来源于妊娠黄体的多肽类激素,其心脑血管保护作用主要包括保护内皮、抗纤维化、抗炎症、抗氧化、舒张血管、抑制内皮细胞向间质转化等[12-13],可显著降低自发性高血压大鼠的血压,减低盐诱导高血压大鼠的收缩压[14]。RAAS 调控机制是关键的神经内分泌调节机制之一,高血压及其心血管靶细胞损伤均与该系统失调有关[15-18]。HIF-1 的稳定表达是维持心血管细胞对缺氧反应的关键条件,其调控作用涉及红细胞生成、葡萄糖转运、血管生成、糖酵解代谢、活性氧处理和细胞增殖等[19]。HIF-1α 表达量显著增加,导致其与调节血液浓度和血管内皮相关的基因异常表达,促进高血压病的发生,并且肾脏髓质HIF-1表达异常,可通过调节水盐电解质平衡参与血压调节[20]。HIF-1 直接激活血管紧张素Ⅱ受体,调节血管紧张素Ⅱ的活性,参与血压调节[21]。TGF-β 介导的信号通路参与多种生理病理调节过程,研究发现通过调节TGF-β/Smads 信号通路从而抵抗高血压大鼠心肌纤维化过程[22],对高血压及相关的心肌损伤具有显著的改善作用。内皮功能障碍是高血压发生发展过程中的重要因素,其中内皮炎症反应为重要特征之一[23],TNF-α 作为主要的促炎因子参与多种疾病引起的血管内皮细胞功能障碍和损伤,TNF-α 可抑制eNOS 转录增加氧自由基表达,与高血压引起的血管内皮细胞功能障碍密切相关[24]。在高血压早期,机体启动炎症状态,于血管壁释放大量炎性因子,进而导致血管平滑肌增生,最终发展为动脉粥样硬化[25]。VEGF 在血管生成、血管紧张度及内皮增殖迁移等方面均有重要作用,对于高血压治疗及相关靶器官损害的预防都具有重要意义[26]。NO 减少可导致血管收缩和外周阻力增加,同时可引起水钠潴留,进而导致血压升高;另外,ET-1 增加,NO 减少会进一步引发氧化应激反应,导致血管氧化细胞损伤而升高血压,VEGF 促进NO 生成,减缓血容量扩张,从而保护血管损害,降低血管紧张度,改善高血压及靶器官损害[27-28]。
本研究基于网络药理学方法,系统分析了补肾定眩汤“多组分-多靶点-多机制”治疗高血压的靶点及作用机制,并基于自发性高血压大鼠模型验证了治疗效果,为其进一步临床应用提供了科学依据。网络药理学作为基于数据库的虚拟研究模式,并不能确切地揭示药物在生物体内的调控作用及途经,因此尚需进一步明确有效成分及靶点的分子作用机制。
