表面活性剂诱导红松种鳞油脂和原花青素超声提取工艺
2024-01-19李占君,马珂,徐宜彬,王岩,杨逢建
李占君,马珂,徐宜彬,王岩,杨逢建










摘要:为研究红松种鳞油脂和原花青素超声辅助提取(UAE)工艺,以油脂和原花青素得率为响应值进行单因素分析实验,应用Box-Behnken响应面优化得出最佳工艺为67%乙醇水溶液、液料比10∶1 mL/g、茶皂素质量浓度0.3%、功率100 W、时间 20 min、水浴温度50 ℃,预期得率分别为21.24%和3.03 mg/g,实际得率为20.86%和2.98 mg/g,相对误差为1.79%、2.97%。对比得出,UAE动力学以较短的时间进入平衡状态;UAE处理可以提高种鳞粉末在溶液中的比表面积;油脂和原花青素对应DPPH和ABTS+自由基清除活性由大到小依次均为原花青素、维生素E(Ve)、油脂。研究表明红松种鳞油脂和原花青素具有较好的抗氧化能力,茶皂素诱导UAE红松种鳞油脂和原花青提取具有优势。研究成果可为红松种鳞的深度开发奠定理论基础。
关键词:红松种鳞油脂;红松种鳞原花青素;提取动力学;超声辅助提取;清除自由基能力
中图分类号:TQ645.1文献标识码:A文章编号:1006-8023(2024)01-0160-11
Ultrasonic Extraction of Oil and Proanthocyanidins from Pinus koraiensis Seed Scales Induced by Surfactant
LI Zhanjun1,2, MA Ke2, XU Yibin2, WANG Yan3, YANG Fengjian1*
(1.Key Laboratory of Forest Plant Ecology, Ministry of Education, Northeast Forestry University, Harbin 150040,China; 2.Yichun Branch of Heilongjiang Academy of Forestry, Yichun 153000, China; 3.Heilongjiang Provincial Institute of Ecology, Harbin 150081, China)
Abstract:To study the ultrasonic-assisted extraction (UAE) process of oil and proanthocyanidins from Pinus koraiensis seed scales, a single-factor analysis experiment was conducted with oil and proanthocyanidins yield as response values. The Box-Behnken response surface optimization method was applied to determine the optimal process conditions, which were as follows: 67% ethanol aqueous solution, liquid material ratio of 10∶1 mL/g, tea saponin mass concentration of 0.3%, power of 100 W, time of 20 min, water bath temperature of 50 ℃, expected yield of 21.24% and 3.03 mg/g respectively, actual yield of 20.86% and 2.98 mg/g, relative error of 1.79% and 2.97%. Comparison analysis revealed that UAE reached equilibrium in a relatively short time. UAE treatment increased the specific surface area of the seed powder in the solution. The order of DPPH and ABTS+ free radical scavenging activities for oil and proanthocyanidins was proanthocyanidins, Ve and oil, indicating that Pinus koraiensis seed scales oil and proanthocyanidins possess good antioxidant capabilities. The use of tea saponin as an inducer for UAE extraction of oil and proanthocyanidins from Pinus koraiensis seed scales demonstrated advantages. These research findings provide a theoretical basis for the in-depth development of Pinus koraiensis seed scales.
Keywords:Pinus koraiensis seed scales oil; Pinus koraiensis seed scales proanthocyanidins; extraction kinetic; ultrasonic assisted extraction; radical scavenging activity
0引言
紅松(Pinus Koraiensis)为松科、松属常绿乔木裸子植物,在我国主要分布于东北小兴安岭一带[1-3]。多为木材和观赏树种,其树干中单宁类物质和松香含量较高,种子在食品、药品和工业领域具有广泛应用[4-5]。红松果实脱粒过程中会产生大量的红松种鳞,现阶段其药用、经济价值未能得到良好的开发与应用。相关研究指出,红松提取物中挥发油与非挥发油脂含量较高,油脂主要成分有月桂烯[6]、柠檬烯[7]和石竹烯[8],为烯萜类化合物,具有较好的防腐、抗氧化效果。原花青素(Proanthocyanidins, PC)也是红松提取物的主要成分,为儿茶素或表儿茶素组合而成的多酚化合物。原花青素与体内自由基的清除、维生素C(Vc)的稳定与吸收有着密切的联系[9-14]。
近年来,红松有效成分的提取与抗氧化活性相关研究得到众多学者的关注。植物组织活性成分提取方式有超临界(Supercritical extraction)、超声辅助(Ultrasonic assisted extraction, UAE)、微波辅助(Microwave assisted extraction, MAE)、超声微波协同辅助(Ultrasonic microwave cooperative assisted extraction, UMCAE)以及传统索氏(Soxhlet extraction, SE)[9]。超聲条件下表面活性剂诱导红松种鳞活性物质提取相关研究未见报道。一方面,超声辅助提取在目标物质固有性质不被破坏情况下,实现高质、高效提取;另一方面,本研究中所应用的表面活性剂(茶皂素)是一种水溶性三萜皂苷非离子表面活性剂,具有乳化、分散、起泡、润湿和降低液体表面张力的特性,适量的茶皂素将利于有效物质的提取[10-11]。
本研究以超声辅助为提取方式,应用茶皂素诱导红松种鳞油脂、原花青素的提取。以单因素数据为基础,遵循Box-Behnken原则对关键因素进行了优化,通过与SE对比(动力学、比表面积和抗氧化活性),得出该方法的优势。最终成果可为红松种鳞中天然产物的提取与分离提供坚实的理论和数据支撑。
1材料与仪器
红松种鳞,2021年10月收集于黑龙江省五营红松原始森林(48°74′~49°9′ N, 129°15′~129°30′ E);无水乙醇、异丙醇、甲醇、丙酮、乙酸乙酯、NaOH (AR),HCl (37%),NH4Fe (SO4)2·12H2O,正丁醇、乙醇(75%),以上材料生产厂家为国药集团化学试剂有限公司;原花青素(≥98%)、茶皂素(BR, 65%)、维生素E(分析纯, 纯度50%),上海源叶;超纯水(实验室自制);S-8大孔树脂,石英砂及其他化学试剂购于天津富宇精细化工有限公司。
数控超声波清洗器(KQ-100DE/ KQ-300DE,昆山);分析天平(AUW220D,SHIMADZU Japan);旋转蒸发仪(Re-52aa,上海亚荣);双光束紫外分光光度计(TU-1901,北京普析);电冰箱(BCD-475WLDPC,青岛海尔);高速中药粉碎机(HC-250 T,浙江河城工贸);恒温干燥箱(LG 100 B,上海仪器总厂);电磁炉(C21-SDHCB9E88,浙江苏泊尔);冷冻离心机(5810R,德国艾本德);冷冻干燥机(YTLG-12A-80,上海叶拓);物理吸附仪(ASAP 2460,美国麦克);索氏提取器(250 mL,盐城新明特玻璃仪器);树脂柱(Φ15 mm × 300 mm,天津化玻),等。
2试验方法
2.1红松种鳞油脂得率与原花青素质量浓度测定
1)油脂得率的测定。布氏漏斗实现固液分离,旋转蒸发(避光,45 ℃,0.09 MPa)实现油液分离,差量法计算得率。
2)原花青素质量浓度的检测。参见DB12/T 885—2019,植物提取物中原花青素的测定,紫外/可见分光光度法,适当修改测定,修改内容:盐酸-正丁醇溶液(体积比5%∶95%),原花青素纯度≥98%,波长550 nm。标准曲线的制备:分别取0.25、0.65、1.25、2.5、3.75、5.0 mL的400 μg/mL原花青素工作液于10 mL棕色容量瓶,甲醇定容;以获得10、25、50、100、150、200 μg/mL不同质量浓度的原花青素标准品溶液,原花青素紫外扫描如图1所示。
油脂得率(%)=m2-m1m2×100%。(1)
原花青素含量(mg/g)=C×Vm2×100%。(2)
式中:m1为提取完毕粉末质量, g;m2为未经提取的粉末质量, g;C为原花青素溶液质量浓度,μg/mL;V为定容体积, mL。
2.2动力学模型
通过拟合模型,得到了红松种鳞油脂和原花青素的提取动力学模型。
2.2.1一阶动力学方程
模型方程如下
dYtdt=K1(Ye-Yt)。(3)
式中:Yt、Ye分别表示时间t和提取平衡时红松种鳞油脂得率和红松种鳞原花青素含量;t为特定时间,min;K1为一阶平衡速率常数。
相应的非线性方程通过进一步积分方程而获得,如下所示
Yt=Ye(1-e-K1t)。(4)
2.2.2二阶动力学方程
模型方程如下。
dYtdt=K2(Ye-Yt)2。(5)
式中,K2为二阶平衡速率常数。
进一步积分该方程以获得相应的非线性方程,如下所示。
Yt=K2Y2et1+K2Yet。(6)
一阶、二阶方程中,当t=0,t=t时,Yt=0为初始状态,Yt=Yt。
2.3提取因素的影响
取自然风干红松种鳞粉末(脱脂粉末用于原花青素提取)4.00 g添加到80 mL棕色蓝盖瓶中,置于超声波清洗机中。分别研究体积分数为70%不同溶剂类型(甲醇、异丙醇、乙醇、丙酮),乙醇体积分数(50%、60%、70%、80%、90%),液料比(6∶1、8∶1、10∶1、12∶1、14∶1 mL/g),表面活性剂用量(0.1%、0.2%、0.3%、0.4%、0.5%),超声功率(40、60、80、100、120 W),超声水浴温度(30、35、40、45、50、60 ℃)对油脂得率和原花青素含量提取程度的影响。
2.4工艺优化
以提取单因素实验数据为基础,分析得出影响程度较高的乙醇体积分数、液料比(mL/g)和超声水浴温度(℃)三因素进一步进行响应面的分析与优化。
2.5原花青素的纯化
以体积分数95%乙醇溶液浸泡S-8大孔树脂24 h,超纯水反复搅拌洗涤至溶液澄清。树脂依次经过质量浓度4% NaOH浸泡(12 h)、超纯水反复搅拌洗涤至中性、质量浓度4% HCl浸泡(12 h)、超纯水反复搅拌洗涤至中性,于体积分数75%乙醇溶液中浸泡备用。
原花青素粗提取溶液通過旋转蒸发(避光,40 ℃,0.09 MPa)进行浓缩,超纯水定容至10 mL。以湿法装柱,石英砂封层;上样前,超纯水冲洗树脂柱中乙醇溶剂(2~4 BV,2 BV/h),将样品溶液上柱,超纯水走柱程 (4 BV,2 BV/h)。再以75%乙醇解吸原花青素(2 BV,2 BV/h),最终合并解吸液定容检测(20 min/次,2 h)。旋转蒸发合并解吸液,(避光,40 ℃,0.09 MPa)浓缩溶液体积,冷冻干燥制样。
2.6对比实验
2.6.1提取方式
根据2.3得出参数,取适量种鳞粉末,对比研究UAE和SE条件下油脂与原花青素的提取动力学模型。
2.6.2空间结构比表面积(BET)
将UAE和SE提取处理过的粉末分别干燥处理,检测条件: 被吸附物为氮气;测量温度为195.850 ℃;热校正为无;样品质量为0.405 5 g;热自由空间为9.162 0 cm3;冷自由空间为26.641 8 cm3;平衡间隔为5 s;低压力为无;样品密度为1.000 g/cm3。
2.6.3抗氧化活性
1)1,1-二苯基-2-三硝基苯肼自由基(DPPH)
配置DPPH-95%乙醇溶液(0.064 g/L)与质量浓度为2.5、5、7.5、10、12.5、15、20、25 mg/mL油脂和1、2.5、5、7.5、10、20、30、40 μg/mL原花青素的95%乙醇溶液1∶1混合,95%乙醇溶液为空白,维生素E (Ve)为对比。混合溶液暗反应30 min,测定517 nm吸光值,以得出抗氧化活性,IC 50值以IC 50计算器得出。方程如下
R(%)=(1-AA0) × % 。 (7)
式中:R (%)为自由基清除率;A0为空白;A为样品的吸光值。
2)2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸自由基(ABTS+)
配置7 mmol/L ABTS+和140 mmol/L K2S2O8溶液,暗反应12~18 h (5 mL∶88 μL),PBS缓冲液使其OD值为0.70±0.02与样品溶液(0.5、1、1.5、2、2.5、3、4 mg/mL油脂和1、2.5、5、7.5、10、20、30、40 μg/mL原花青素的95%乙醇溶液,3 mL∶150 μL),暗反应 6 min,95%乙醇溶液为空白,Ve为对比,测定734 nm吸光值,计算同式(7),IC 50以IC 50计算器得出。
2.7统计与分析
所有实验均操作3次。数据由算术平均值和标准差组成,数据的方差分析和制图由origin Pro 2021和Minitab 19完成,所有实验均遵循邓肯多区间检验原理。
3结果与分析
3.1单因素实验
不同因素对油脂和原花青素得率的影响动力学曲线如2图所示。
3.1.1溶剂类型的影响
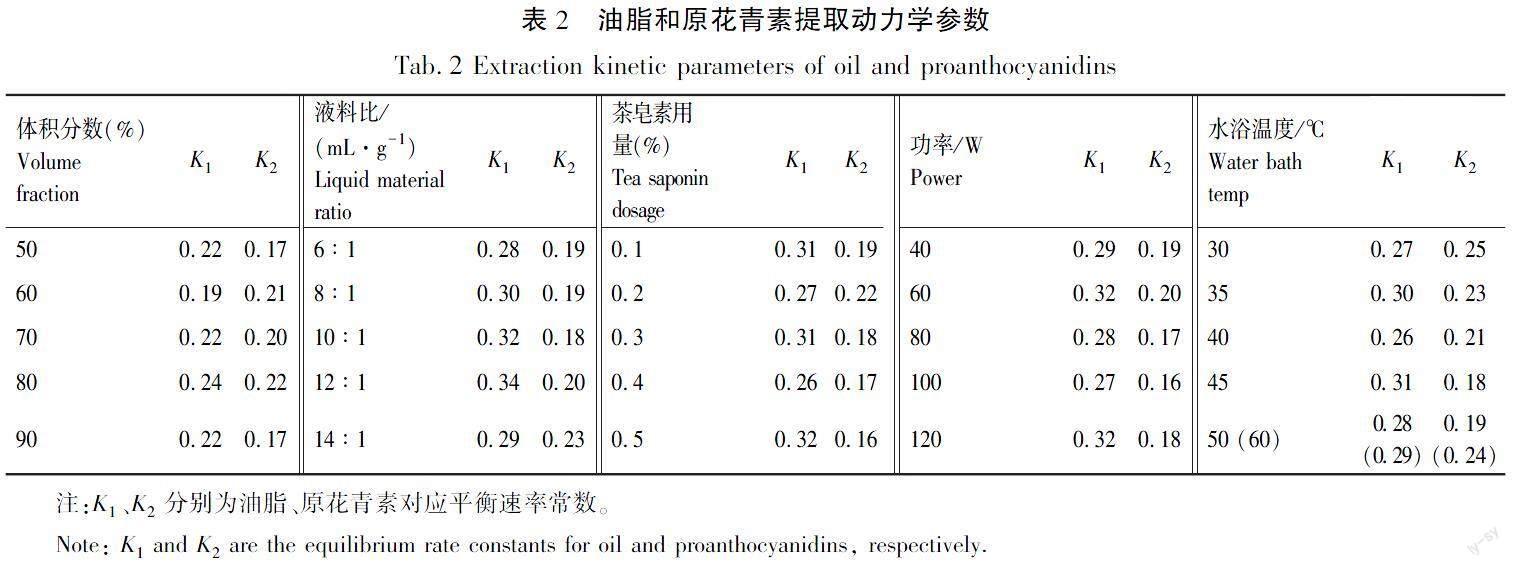
油脂与原花青素的得率会因溶剂的不同而有明显差异,如图2(a)所示,可以被解释为二者得率与溶剂类型有着密切相关的联系[12]。一阶动力学模型更适合拟合实验数据和机理的解释[13-14]。对图2(a)和表1分析,油脂提取过程中,根据其一阶平衡速率常数K,可知甲醇溶液最先进入平衡状态,乙醇溶液次之;原花青素提取过程中,乙醇溶液最先进入平衡状态,丙酮次之。综合考虑绿色环保、平衡速率、溶剂与水的互溶性和油脂、原花青素得率,因此选择乙醇进行下一步研究。
3.1.2乙醇体积分数的影响
茶皂素难溶于无水乙醇,更易溶于乙醇水溶液。因此,乙醇体积分数会影响油脂、原花青素得率如图2(b)所示。一阶动力学模型更适合拟合实验数据和机理的解释[13]。结合图2(b)和表2可知,油脂与原花青素提取过程中,虽然90% 乙醇水溶液均最先进入平衡状态,但二者得率增长率最低,相反70%时二者得率增长率最高。发生这一现象的原因在于,乙醇溶液的表面张力和相对极性与含水量呈正相关,而适宜的含水量有利于表面活性剂的溶解,可以促进物质的提取。综合考虑平衡速率与得率,故选择70%这一突变点进行下一步优化。
3.1.3液料比的影响
液料比对油脂、原花青素的得率的影响显著,如图2(c)所示。结合图2(c)和表2可知,油脂与原花青素提取过程中,分别于12∶1和14∶1时最先进入平衡状态(一阶K),而10∶1时油脂与原花青素所对应双响应指标状态最佳。这一现象原因在于:较低的液料比时,溶液内部对目标物质的溶解能力不强,易饱和;而过高的液料比时,提取溶液体系体积过大,将会吸收过多的能量,不利于物质的提取。因此,考虑到上述结果,以10∶1mL/g进行下一步优化。
3.1.4表面活性剂用量的影响
表面活性剂用量对油脂、原花青素的得率有一定的影响。结合图2(d)和表2可知,油脂和原花青素提取过程中,虽然分别于0.5%和0.2%最先进入平衡状态(一阶K),而0.3%时油脂与原花青素所对应双响应指标状态最佳。主要原因在于:当表面活性剂含量较低时,随着剂量的增加,表面张力会增加,然后趋于平稳,而过量的茶皂素会增加提取液混合物的黏度,这将抑制目标物质的溶解。综合考虑平衡速率与得率,选择0.3%进行实验。
3.1.5超声功率的影响
油脂与原花青素的得率会因超声功率的不同而有所差异,如图2(e)所示。结合表1中一阶K可知,油脂和原花青素提取过程中,均于60 W最先进入平衡状态,但此时二者得率并不理想,超声功率为100 W时油脂与原花青素的得率处于最佳状态。主要原因在于:当超声功率过高时,混合溶液体系的萃取伴随着溶剂的气化和挥发,这不利于萃取[15]。总之,油脂与原花青素的提取需要适当的超声强度,因此,综合考虑平衡速率与得率差异程度(因素之间),故选择100 W进行实验。
3.1.6超声水浴温度的影响
超声水浴温度对油脂与原花青素二者得率的影响程度显著,如图2(f)所示。结合表1中一阶K可知,油脂和原花青素提取过程中,分别于45、30 ℃最先进入平衡状态,但是二者的实际得率并不处于最佳值,而45 ℃时,油脂与原花青素的得率最佳。原因在于,相对较高的温度有利于提取溶液内部物质的循环与扩散[16-17]。另一方面,温度与提取混合溶液系统的蒸气压呈正相关,与溶液中气泡爆炸产生的表面张力呈负相关,这最终将影响传质强度,这被称为Young Laplace关系[18]。因此,选择45 ℃这一点进行下一步的工艺优化研究。
由图2动力学曲线综合观察可知,20 min 时油脂与原花青素提取均进入平衡状态,为了便于实验优化,提取时间选择20 min。
3.2响应面优化
应用Design Expert 8.0.6对单因素分析得出的
乙醇体积分数A (60%~80%)、液料比B (8∶1~12∶1 mL/g)和超声水浴温度C (40~50 ℃)三因素进行模型优化实验。优化过程包括分析组、中心组实验,油脂和原花青素得率为双响应值,拟合分析得出模型二次回归方程如下
YOil = 21.21-0.27A+0.23B+0.27C+2.50×10-3AB+0.21AC-5.00×10-3BC-2.16A2-1.22B2-0.12C2
Note: K1 and K2 are the equilibrium rate constants for oil and proanthocyanidins, respectively.
YProanthocyanidins=2.36-0.60A-2.50×10-3B+0.36C-0.078AB-0.12AC+0.11BC-0.47A2-0.20B2+0.15C2
影响因素自变量、数据方差分析和最终推断分别见表3和4。根据Fischer的“F统计”值(F)和概率值(P)对拟合模型对应回归方程中的各項系数和响应值与各变量之间的关系进行分析。造成影响的主要因素包括A、B、C,AB、AC、BC、A2、B2、C2。影响油脂得率的因素影响程度为:C>A>B,AC>BC>AB,A2>B2>C2,A、B、C表现为差异性显著,A2、B2为差异性极显著,PLack of fit为差异性不显著,R2 = 0.980 6、Adj. R2 = 0.955 7,其模型预测度和矫正系数分别为98.06%、95.57%。影响原花青素得率的因素影响程度为:A>C>B,AC>BC>AB,A2>B2>C2,B2为差异性显著,A、C、A2为差异性极显著。PLack of fit为差异性不显著,Adj. R2 = 0.978 6、调整 R2 = 0.951 2,2组方差数据分析表明该双响应优化模型拟合线性收敛、吻合程度较高。
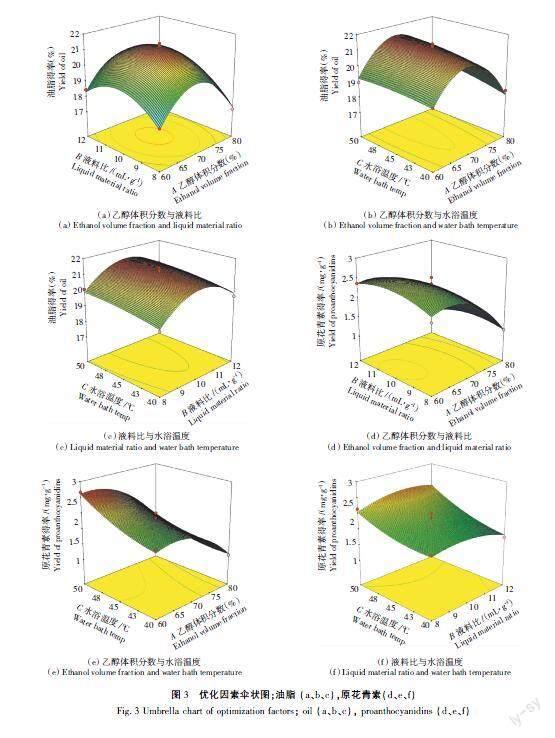
响应面优化3D伞状图如图3所示,对图3分析可知,被优化因素的最大、最小和0水平值。优化过程中,Y轴为响应值Y,X轴为另外2个因素,以此进行优化模型的拟合。当对3D伞状图分析时默认其中一因素为定值0。
图3 (a)(d)为A乙醇体积分数与B液料比对油脂和原花青素得率(双响应值)的交互影响。当A与B分别低于67%、10 mL/g时,双响应值会因其提升而得到不同程度的提高;当A与B分别高于67%、10 mL/g时,双响应值开始降低,由于AB (P>0.05),因此交互性作用为差异性不显著。由此得知,双响应值对应增量(Δ)在A=67%,B=10 mL/g时最佳。同理对图3 (b)、图3(e)和3(c)、图3(f)中影响因素AC、BC分析,AC (67%,50 ℃)、BC (10 mL/g,50 ℃)时双响应值对应增量(Δ)最佳。AC、BC (P>0.05),其交互作用均匀差异性不显著。
3.3验证实验
响应面优化得出油脂和原花青素最佳提取工艺参数:67%乙醇水溶液,液料比10∶1 mL/g,茶皂素质量浓度0.3%,超声功率100 W,超声时间 20 min,超声水浴温度50℃,油脂和原花青素预期得率分别为21.24%和3.03 mg/g,其实际得率为20.86%和2.98 mg/g,相对误差分别为1.79%、2.97%,表明因素优化有效。
3.4对比实验
为了研究不同提取方式对油脂与原花青素提取的影响,将索氏提取引入实验,对其提取动力学、空间结构表征差异进行分析与研究。
3.4.1超声辅助提取与索氏提取动力学对比
超声辅助提取油脂与原花青素得率在一定范围内与时间呈正相关,如图4所示,当提取时间在0~0.5 h时,二者得率均得到显著提升,为提取过程的高效快速期。0.5~1 h时,油脂得率逐渐趋于平衡;原花青素有降解现象发生,主要原因为:1)随着提取的不断进行,提取混合溶液体系逐渐趋于饱和,因此油脂的溶解能力会逐渐趋于平衡;2)过度超声作用产生“空化效应”会造成原花青素发生降解[19]。油脂和原花青素提取动力学趋势线于25 min时进入平衡状态,且最大实际Y油脂和Y原花青素分别为23.05%和2.30 mg/g。
按照优化最佳工艺参数进行油脂和原花青素超声提取动力研究,同时将索氏提取参数设定为:67%乙醇水溶液,液料比10∶1 mL/g,茶皂素质量浓度0.3%,加热套功率450 W,超声水浴温度50 ℃。
索氏提取过程中,当提取时间为0~1 h时,油脂与原花青素得率均得到显著提升。1~4 h时,油脂和原花青素提取动力学趋势线分别于2 h和4 h进入平衡状态,且最大实际Y油脂和Y原花青素分别为24.88%和3.28 mg/g。该提取过程满足菲克第二定律,其一阶动力学模型更适合拟合实验数据和机理的解释[13-14],UAE平衡速率常数K1均大于SE,R12均高于0.99,表明在精确度较高的情况下,油脂和原花青素的UAE (25 min)最先进入平衡状态。最终Y油脂和Y原花青素 (SE)均要高于UAE,归咎于SE过长时间的溶剂循环冲刷,因此,与SE相比UAE更具优势。
3.4.2空间结构表征
经过UAE和SE提取处理过的红松种鳞粉末的空间结构数据,见表5。
BET(UAE)和BET(SE)数值分别为(0.28±0.02) m2/g(0.21±0.03) m2/g。说明,UAE过程中所产生的“空化效应”、适当较高的剪切力与范德华力有利于植物组织的破碎,可以增加底物在提取混合溶液中的比表面积,使其与混合提取溶液实现更好的接触,最终实现有效物质的高效提取的目的[20-21]。从空间结构BET角度再一次对比证实,UAE更具优势。
3.4.3抗氧化活性
为了考察抗氧化活性,对油脂和原花青素进行了DPPH和ABTS+自由基清除实验。结果如图5所示,表明油脂和原花青素具有较好的自由基清除活性,且与二者质量浓度呈线性正相关。根据50%清除率(IC50值),评估了二者的自由基清除能力。DPPH和ABTS+自由基清除活性由大到小依次均為:原花青素、Ve、油脂。油脂具备自由基清除活性主要原因在于,一方面,该类油脂为烯萜类物质,不饱和成分含量较高;另一方面,超声波使其有效成分不被破坏而保持原貌[22]。原花青素因其不饱和类物质的相对含量较高,因此自由基清除活性非常可观,结果与Li等[23]结论有共鸣。总之油脂和原花青素具有较好的自由基清除活性,可被作为天然抗氧化剂进行深度开发。
4结论与讨论
本研究对红松种鳞油脂和原花青素超声提取工艺进行了系统性研究。以提取动力学单因素实验数据为基础,选用响应面法对影响因素进行深度优化,最佳优化工艺参数为:67%乙醇水溶液,液料比10∶1 mL/g,茶皂素质量浓度0.3%,超声功率100 W,超声时间 20 min,超声水浴温度50 ℃,油脂和原花青素预期得率分别为21.24%和3.03 mg/g,其实际得率为20.86%和2.98 mg/g,相对误差分别为1.79%、2.97%。对比实验得出:UAE提取动力学趋势线能够以较短的时间最先进入平衡状态;经提取处理后的鳞粉末空间结构表征,BET(UAE)和BET(SE)数值分别为(0.28±0.02) m2/g和(0.21±0.03) m2/g;提取得到的油脂和原花青素对应DPPH和ABTS+自由基清除活性顺序依次均为:原花青素、Ve、油脂,表明油脂和原花青素具有较好的抗氧化能力,与Li等[24]超声提取紫苏籽油具有较好清除自由基能力的研究趋势相同。进一步说明茶皂素诱导超声辅助处理有利于油脂和原花青素的提取。最终成果可为红松种鳞中天然产物的提取与分离提供坚实的理论和数据支撑。
【参考文献】
[1]WEI J, LI X, XU H, et al. Evaluation of the genetic diversity of Pinus koraiensis by EST-SSR and its management, utilization and protection[J]. Forest Ecology Management, 2022, 505: 119882.
[2]NING Q R, GONG X W, LI M Y, et al. Differences in growth pattern and response to climate warming between Larix olgensis and Pinus koraiensis in Northeast China are related to their distinctions in xylem hydraulics [J]. Agricultural and Forest Meteorology, 2022, 312: 108724.
[3]THOMAS P, FARJON P A. The IUCN Red List of Threatened Species, e.T42373A2975987[J]. IUCN, 2013.
[4]HOU K, BAO M, WANG L, et al. Aqueous enzymatic pretreatment ionic liquid-lithium salt based microwave-assisted extraction of essential oil and procyanidins from pinecones of Pinus koraiensis[J]. Journal of Cleaner Production, 2019, 236: 117581.
[5]YEN G C, DUH P D, HUANG D W, et al. Protective effect of pine (Pinus morrisonicola Hay.) needle on LDL oxidation and its anti-inflammatory action by modulation of iNOS and COX-2 expression in LPS-stimulated RAW 264.7 macrophages[J]. Food & Chemical Toxicology, 2008, 46: 175-185.
[6]KEKEVI B, MERT E H. Synthesis of β-myrcene-based macroporous nanocomposite foams: altering the morphological and mechanical properties by using organo-modified nanoclay[J]. Journal of Applied Polymer Science, 2020, 38: 50074.
[7]KUMAR M, CHONG C T, KARMAKAR S. Comparative assessment of combustion characteristics of limonene, Jet A-1 and blends in a swirl-stabilized combustor under the influence of pre-heated swirling air[J]. Fuel, 2022, 316: 123350.
[8]ABDOLLAHI M, SEFIDKON F, CALAGARI M, et al. Impact of four hemp (Cannabis sativa L.) varieties and stage of plant growth on yield and composition of essential oils[J]. Industrial Crops and Products, 2020, 155: 112793.
[9]ZOU J S, SHAN J J, XIE T, et al. Research progress of platycodin D [J]. Chinese Traditional Patent Medicine, 2014, 36(4): 823-827.
[10]LIAO Y, LI Z, ZHOU Q, et al. Saponin surfactants used in drug delivery systems: A new application for natural medicine components[J]. International Journal of Pharmaceutics, 2021, 603, 120709.
[11]ZHU Z, WEN Y, YI J, et al. Comparison of natural and synthetic surfactants at forming and stabilizing nanoemulsions: Tea saponin, Quillaja saponin, and Tween 80[J]. Journal of Colloid and Interface Science, 2019, 536, 80-87.
[12]CHIVATE M M, PANDIT A B. Quantification of cavitation intensity in fluid bulk [J]. Ultrason. Sonochemistry, 1995, 2: S19-S25.
[13]CHEN F L, LIU S S, ZHAO Z Y, et al. Ultrasound pre-treatment combined with microwave-assisted hydrodistillation of essential oils from Perilla frutescens (L.) Britt. leaves and its chemical composition and biological activity[J]. Industrial Crops and Products, 2020, 143: 11908.
[14]CHEN F L, ZHANG Q, FEI S M, et al.Optimization of ultrasonic circulating extraction of samara oil from Acer saccharum using combination of Plackett-Burman design and Box-Behnken design[J]. Ultrasonics Sonochemistry, 2017, 35: 161-175.
[15]LI Z J, GAO J H, GUO X, et al. Research on the ultrasonic extraction process and physicochemical properties of perilla seed oil[J]. Forest Engineering, 2019, 35(4):76-81,88.
[16]JIA K H, LI Z J, YAO Y, et al. Optimization of ultrasonic assisted extraction of rosmarinic acid from Perilla frutescens meal and it's antioxidant capacity[J]. Forest Engineering, 2022, 38(4): 89-97.
[17]SONG J B, LIU Y G, ZHOU X H, et al. Effects of transient thermal stress on chlorophyll fluorescence parameters and pigments content in leaves of three plants in autumn[J]. Journal of West China Forestry Science, 2021, 50(6)140-148.
[18]MOHAMMADPOUR H, SADRAMELI S M, ESLAMI F, et al. Optimization of ultrasound-assisted extraction of Moringa peregrina oil with response surface methodology and comparison with Soxhlet method[J]. Industrial Crops and Products, 2019, 131: 106-116.
[19]JIAO T H, LU Y, YE L L, et al. Extraction of proanthocyanidins from red raspberry seed by ultrasonic-assisted technology and evaluation of proanthocyanidin's anti-ultraviolet ability[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(6):98-105.
[20]CHEN F L, GUO Y, KANG J, et al. Insight into the essential oil isolation from Foeniculum vulgare Mill. fruits using double-condensed microwave-assisted hydrodistillation and evaluation of its antioxidant, antifungal and cytotoxic activity [J]. Industrial Crops & Products, 2020, 144: 112052.
[21]LI W, ZHANG J, ZHANG L. Assessment of the formation of A-type proanthocyanidin by model reaction to blueberry extract and epicatechin[J]. LWT-Food Science and Technology, 2020, 134: 110169.
[22]ZHANG Q, GAO W B, GUO Y, et al. Aqueous enzyme-ultrasonic pretreatment for efficient isolation of essential oil from Artemisia argyi and investigation on its chemical composition and biological activity[J]. Industrial Crops & Products, 2020, 158:113031.
[23]LI Q, WANG X, CHEN J, et al. Antioxidant activity of proanthocyanidins-rich fractions from Choerospondias axillaris peels using a combination of chemical-based methods and cellular-based assay[J]. Food Chemistry, 2016, 208, 309-317.
[24]LI Z J, LIU Y W, LIANG Y T, et al. Study of the optimization and kinetics of the surfactant-induced ultrasonic-assisted extraction of perilla seed oil: Free radical scavenging capacity and physicochemical and functional characteristics[J]. Sustainable Chemistry and Pharmacy, 2023, 32, 100977.
