青藏高原冬克玛底冰川可培养细菌群落特征研究
2024-01-18贾谱超张昺林章高森刘光琇
贾谱超, 张 威, 刘 阳, 田 茂, 张昺林,章高森, 刘光琇, 陈 拓
(1. 中国科学院 西北生态环境资源研究院 沙漠与沙漠化重点实验室,甘肃 兰州 730000; 2. 中国科学院 西北生态环境资源研究院冰冻圈科学国家重点实验室,甘肃 兰州 730000; 3. 甘肃省极端环境微生物资源与工程重点实验室,甘肃 兰州 730000; 4. 中国科学院大学,北京 100049)
0 引言
冰川是由积雪经过多年反复融冻、累积和压实等作用而形成的复杂生态系统,主要由雪、冰和融水3 种相互关联的生境组成。冰川因其低温、寡营养、强辐射等恶劣的自然条件,构成了冰川特有生态环境特征,这种极端寒冷的生境中生存的大量微生物使其成为一个天然的微生物资源保藏库。随着全球气候变暖引发冰川消融,大量封存在冰川中的微生物逐渐被释放出来[1],导致冰川中大量的微生物资源随着冰川的消融而流失。
冰川微生物主要来源于周围环境,包括细菌、病毒、原生生物和真菌及其孢子等等,随着冰川发育,这些微生物被封存在冰川冰中。在冰川微生物的研究中,高通量测序、宏基因组等各种分子水平上的研究方法现已十分普遍,但传统的培养方法因其可得到完整的生命体,并能在个体水平研究微生物的各项生理生化指标,是获得微生物资源和微生物全基因组的必要手段,仍被广泛应用[2]。研究表明,冰川中微生物细胞数量范围为2×102~7×107CFU·mL-1(colony forming units per milliliter)[3-8],细菌群落丰富度低于土壤、水体和其他富营养生境。大量研究中冰川可培养细菌大多来源于放线菌门、变形菌门、拟杆菌门和厚壁菌门,但在不同生境中细菌群落结构不同,可培养细菌的数量也因生境的改变而不同[9-13]。然而,目前对于冰川微生物的可培养研究仍不够,且冰川微生物资源的流失从未停止。
冬克玛底冰川位于唐古拉山脉,其融水作为长江源头之一,部分冰川微生物会随融水进入下游,这些幸存者中包含一些远古时期的细菌,可能对下游生态系统造成重大影响。该区域的气候主要受西风带和印度洋季风的影响,呈现出冬季干冷、夏季暖湿的特性[14],年平均气温为-5 ℃[15],降水集中于5—9 月,降水量436.6 mm,占全年比例为92.5%~94.1%[16]。相关可培养细菌的研究工作表明,冬克玛底冰川雪样中细菌来源于放线菌门、变形菌门和厚壁菌门,且放线菌门是优势门[13];而冰川前沿土壤可培养细菌研究同样发现放线菌门是优势门,且25 ℃培养条件下分离的属的丰度和多样性大于4 ℃[17]。通过非培养手段研究发现冬克玛底冰川末端表层冰和基底冰也具有不同的细菌群落[18]。这些研究表明:冰川中不同生境条件下,微生物的群落分布差异较大,可培养微生物在异质的生境中系统进化会发生改变[10]。目前,对于冬克玛底冰川微生物的研究不多,且都只研究了一种冰川生境,同时研究雪、冰和融水3种生境能够更系统全面地了解冰川生态系统可培养细菌多样性和群落构成。
本文通过可培养方法,研究冬克玛底冰川5 430 m、5 550 m 和5 670 m 海拔表层雪、表层冰及冰下融水3种生境中可培养细菌多样性及其群落结构特征,发现疑似新种48 株,丰富了冬克玛底冰川微生物资源的理论基础,对唐古拉山区域生态环境评估及微生物物种资源发掘有一定参考价值,以期为之后的冰川微生物研究提供科学依据,为微生物资源库提供数据支撑及菌种资源。
1 材料和方法
1.1 样品采集
唐古拉山脉,位于中国西藏自治区东北部与青海省边境处,东段为西藏与青海的界山,东南部延伸接横断山脉的云岭和怒山。本研究样品于2021年9月下旬在唐古拉山冬克玛底冰川(图1),海拔每隔120 m 采集冰、雪和融水样品,采集的所有样品用无菌采样袋(Bombardier, 加拿大)和无菌瓶(比克曼,中国)分装,每个海拔不同类型的样品均采集三个平行样(图1)。将采集的样品放入冰箱-20 ℃低温保存运回实验以进行后续细菌培养实验。

图1 冬克玛底冰川采样点Fig. 1 Sampling sites of Dongkemadi Glacier
1.2 样品理化性质的测定
将解冻后的样品使用定性滤纸过滤,然后取其中一部分用pH 测量仪(PT-10, Sartorius, 德国)对水体样品pH 值进行测定;取另一部分样品用电导率测量仪(DDSJ-308A,上海雷磁)对水体电导率(electrical conductance, EC)进行测量;Cl-、NO3-、SO42-、Na+、K+、Mg2+及Ca2+的含量均在中国科学院西北生态环境资源研究院冰冻圈科学国家重点实验室测定,具体方法参照文献[19]。
1.3 细菌分离培养
选用5 种不同的培养基:R2A 琼脂培养基(R2A)、R2A 改良琼脂培养基(R2A-Y,培养基中每升额外添加1 g酵母膏)、营养琼脂、胰蛋白胨大豆肉汤培养基(TSB)和脑心浸出液肉汤(BHI),培养基参考德国菌种保藏中心(https://www.dsmz.de)配方。
在超净台中将冰样置于灭菌的5 L 烧杯中,切除表面1 cm,取出冰样置于无菌瓶在4 ℃冰箱缓慢融化,雪样同样置于4 ℃冰箱缓慢融化。在超净台中从冰样和融水样分别取200 μL 涂布于R2A、R2A-Y、营养琼脂、TSB 和BHI 琼脂培养基上。在超净台中将200 mL雪样融水过滤到0.22 μm无菌Millipor微孔滤膜上,将滤膜悬浮在2 mL 0.9%的生理盐水中,充分震荡以悬浮细菌细胞,然后取200 μL 涂布在培养基表面进行培养。所有样品在无光条件下培养,每种培养基做6个平行样,其中3个置于25 ℃条件下培养,另外3 个置于10 ℃条件下培养。培养1周后开始对25 ℃培养箱的平板进行计数和不同表型特征菌落的分离和纯化,3 周后开始对10 ℃培养箱的平板进行同样操作。分离、纯化出的细菌加入25%的甘油混合后放置于冻存管中并保存至-80 ℃冰箱中。
1.4 可培养细菌的16S rRNA 基因的扩增以及序列测定
对可培养细菌进行16S rRNA基因的扩增,引物采用通用引物27F(5′-AGAGTTTGATCCTGGCT CAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)[20]。扩增体系(25 μL):12.5 μLTaqDNA 聚合酶,10.5 μL ddH2O,1 μL 引物。扩增反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s 和72 ℃延伸45 s进行30个循环;最后72 ℃延伸20 min。PCR 扩增的产物送至西安擎科生物公司进行序列测定,将测定得到的16S rRNA 基因序列提交至GeneBank(NCBI)获取序列登录号:ON693689-ON693837。
1.5 序列比对及系统发育树的构建
将提交至NCBI 的16S rRNA 基因序列在EZBioCloud 数据库进行比对(www. ezbiocloud. net);clustal muscle 方法进行比对,p-distance 方法计算的距离,选择邻近相接法对序列进行分析;用MEGA11构建系统发育树。
2 结果与分析
2.1 冬克玛底冰川样品理化性质分析
冰川样品中,雪的pH 值呈弱酸性,5.71~5.86;EC 较低,3.45~5.51 μS·cm-1。Cl-、NO3-、Na+、Mg2+和Ca2+含量随着海拔变化差异显著;其中Na+、Mg2+和Ca2+含量随海拔增加含量降低(表1)。雪样的SO42-和K+含量随着海拔变化无显著性差异(表1)。
冰的pH 值的范围为6.55~6.57,电导率较低,10.93~48.30 μS·cm-1。Cl-、Na+、K+、Mg2+、Ca2+、NO3-和SO42-含量随着海拔变化差异显著,其中NO3-和SO42-含量随海拔增加而增加(表1)。
冰川融水的pH 值的范围为6.93~7.30;电导率范围在73.30~134.77 μS·cm-1之间。Na+、K+、Mg2+、Ca2+、Cl-、NO3-和SO42-含量随着海拔变化差异显著,其中Cl-、NO3-和SO42-含量随着海拔增加而增加(表1)。
2.2 冬克玛底冰川可培养细菌数量
不同温度下可培养细菌数量显著不同;在10 ℃培养条件下,10 ℃培养温度下培养得到的细菌数量平均值为539 CFUs·mL-1,显著高于25 ℃的189 CFUs·mL-1[图2(a)]。雪样在10 ℃培养条件下,可培养细菌数量平均值是8 CFUs·mL-1,在25 ℃时是12 CFUs·mL-1,10 ℃培养得到的数量平均值低于25 ℃[图2(b)];冰样和融水样在10 ℃培养条件下,培养得到的细菌数量平均值(冰样1567 CFUs·mL-1,融水样44 CFU·mL-1)均显著高于25 ℃(冰样528 CFU·mL-1,融水样27 CFU·mL-1)[图2(c)~2(d)]。
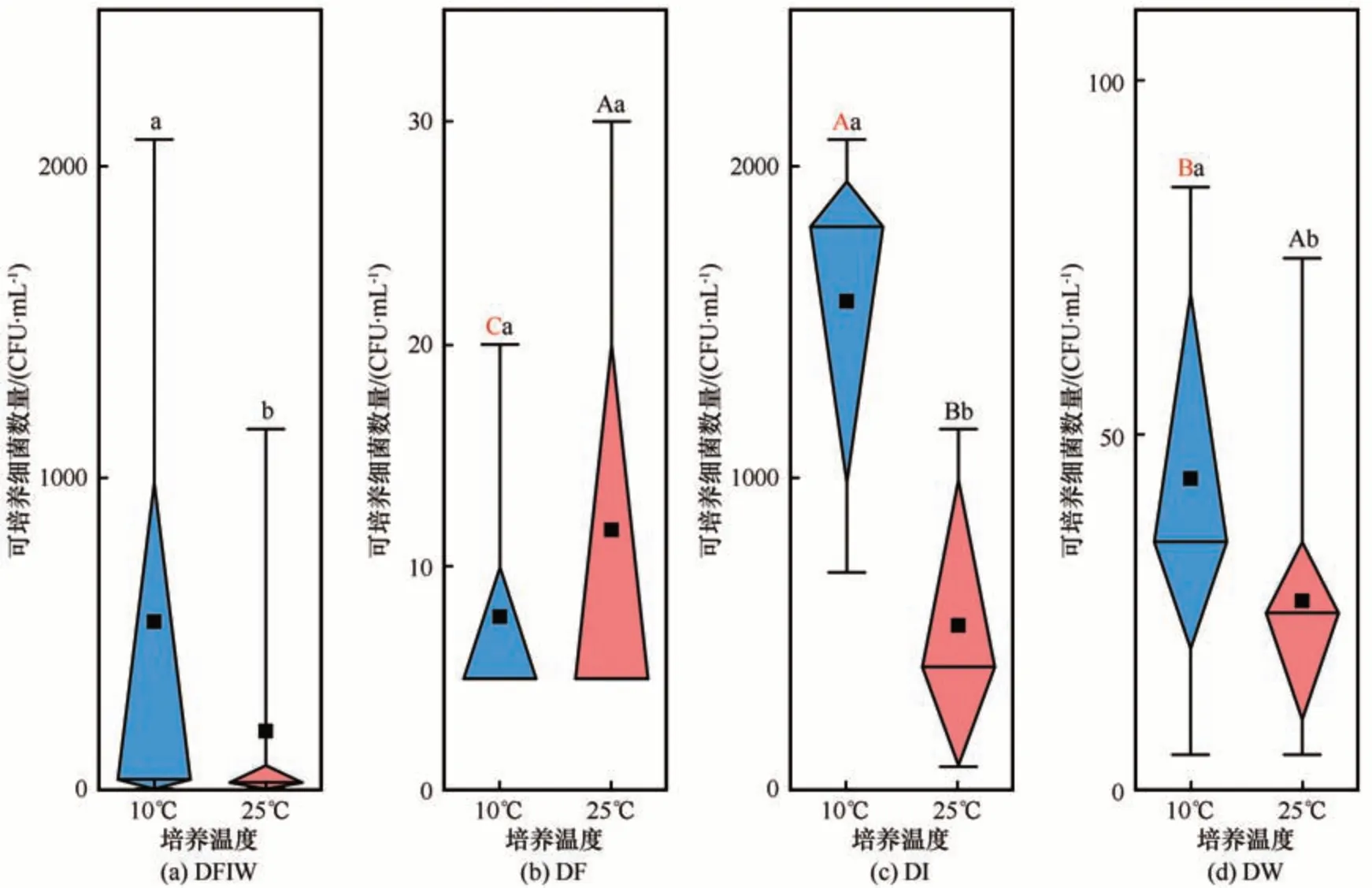
图2 冬克玛底冰川可培养细菌数量Fig. 2 Abundance of the culturable bacteria from the Dongkemadi Glacier
研究还发现不同样品类型,培养得到的细菌数量也不同。在10 ℃培养条件下从雪、冰和融水样培养得到的细菌数量显著不同,表现为冰样>融水样>雪样。在25 ℃从雪、冰和融水样培养得到的细菌数量同样表现为冰样>融水样>雪样,但雪样和融水样间的差异性不显著。
2.3 冬克玛底冰川可培养细菌群落结构特征
根据培养基上细菌菌落的表型特征,分离、纯化得到149 株细菌。将这些细菌的16S rRNA 基因序列在EZBioCloud数据库进行比对,分析发现冬克玛底冰川分离出的菌株分别归属于4 个门,放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)。
本次研究共分离得到了放线菌门中的16个属,分别是库克菌属(Kocuria)、微杆菌属(Microbacterium)、节杆菌属(Arthrobacter)、假节杆菌属(Pseudarthrobacter)、红球菌属(Rhodococcus)、土壤球菌属(Agrococcus)、密执安棍状杆菌属(Clavibacter michiganensis)、类诺卡氏菌属(Nocardioides)、纤维素单胞菌属(Cellulomonas)、血杆菌属(Sanguibacter)、链霉菌属(Streptomyces)、冷杆菌属(Cryobacterium)、气微菌属(Aeromicrobium)、居真菌细菌属(Mycetocola)、根戈德里谷氨酸杆属(Paeniglutamicibacter)和盐地杆菌属(Salinibacterium),库克菌属为优势属(图3)。

图3 放线菌门可培养细菌基于16S rRNA基因序列构建的系统发育树Fig. 3 Phylogenetic tree of Actinobacteria culturable bacteria based on 16S rRNA gene sequence
变形菌门中分离得到13个属,分别是马赛菌属(Massilia)、鞘氨醇单胞菌属(Sphingomonas)、短波单胞菌属(Brevundimonas)、鞘氨醇盒菌属(Sphingopyxis)、紫色杆菌属(Janthinobacterium)、不动杆菌属(Acinetobacter)、副球菌属(Paracoccu)、嗜冷杆菌属(Psychrobacter)、极单胞菌属(Polaromonas)、皱纹单胞菌属(Rugamonas)、假单胞菌属(Pseudomonas)、Aquirhabdus和红育菌属(Rhodoferax),马赛菌属为优势属(图4)。
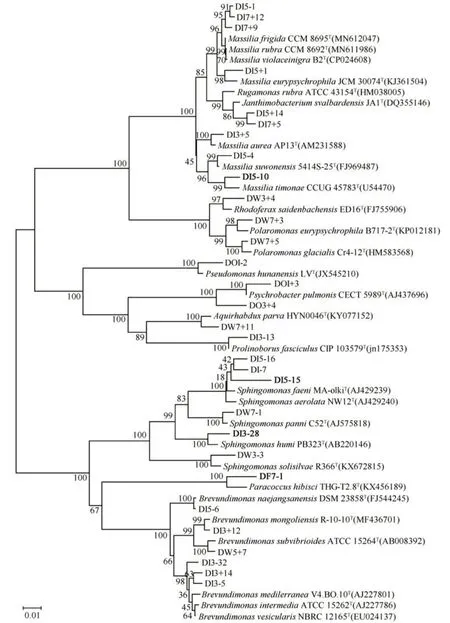
图4 变形菌门可培养细菌基于16S rRNA基因序列构建的系统发育树Fig. 4 Phylogenetic tree of Proteobacteria culturable bacteria based on 16S rRNA gene sequence
拟杆菌门中分离出4 个属,分别是黄杆菌属(Flavobacterium)、薄层菌属(Hymenobacter)、土地杆菌属(Pedobacter)和Kaistella,其中黄杆菌属是优势属(图5)厚壁菌门分离出3个属,分别是芽孢杆菌属(Bacillus)、微小杆菌属(Exiguobacterium)和类芽孢杆菌(Paenibacillus),芽孢杆菌属是优势属(图6)。
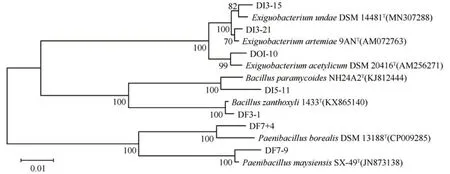
图6 厚壁菌门可培养细菌基于16S rRNA基因序列构建的系统发育树Fig. 6 Phylogenetic tree of Firmicutes culturable bacteria based on 16S rRNA gene sequence
研究表明,16S rRNA 基因同一性为98.7%作为物种级临界值[21],本研究中发现与已分离发表的菌种相似度低于98.7%的细菌有46 株,均为潜在新种。
2.4 冬克玛底冰川可培养细菌分布特征
统计不同温度下可培养细菌物种发现,不同培养温度,培养得到的细菌群落结构不同,具体表现在物种数目和组成。在10 ℃培养条件下,共分离出55个种(28个属),而在25 ℃只分离出43个种(23个属)。有些细菌只在一个培养温度发现,气微菌属、冷杆菌属、居真菌细菌属、根戈德里谷氨酸杆属、盐地杆菌属、Aquirhabdus、副球菌属、嗜冷杆菌属、极单胞菌属、皱纹单胞菌属、假单胞菌属、黄杆菌属和土地杆菌属只从10 ℃培养温度分离得到,纤维素单胞菌属、密执安棍状杆菌属、血杆菌属、不动杆菌属、副球菌属、鞘氨醇盒菌属、芽孢杆菌属和微小杆菌属只从25 ℃培养温度分离得到,而其他属在两个培养温度下均能分离得到[图7(a)]。

图7 冬克玛底冰川可培养细菌物种数(a)和CFU(b)Fig. 7 Number of species (a) and colony forming units (b) of the culturable bacteria from the Dongkemadi Glacier
研究还发现,不同生境,培养得到的细菌群落结构也不同。本次培养共分离出36个属,雪中分离出8 个属,冰中28 个,融水中14 个。在10 ℃培养条件下,雪中分离出5 个种,冰中35 个,融水中21 个;在25 ℃下,雪中分离出5 个种,冰中32 个,融水中8个。微杆菌属在3 种生境中均能分离得到,土壤球菌属仅在雪样中分离得到;纤维素单胞菌属、密执安棍状杆菌属、库克菌属、居真菌细菌属、根戈德里谷氨酸杆属、假节杆菌属、盐地杆菌属、血杆菌属、不动杆菌属、紫色杆菌属、嗜冷杆菌属、假单胞菌属、皱纹单胞菌属和微小杆菌属仅在冰样中分离得到;气微菌属、类诺卡氏菌属、Aquirhabdus、红育菌属、鞘氨醇盒菌属和类芽孢杆菌仅在融水样中分离得到[图7(a)]。
在10 ℃和25 ℃培养条件下,放线菌门均为优势门,分别占60.64%和77.76%,在属水平上,以库克菌属(24.49%和44.31%)、微杆菌属(19.83%和25.52%)和马赛菌属(10.35%和4.48%)为优势属。冰样中的最优势属为库克菌属,而融水样和雪样中的最优势属均为微杆菌属[图7(b)]。
2.5 冬克玛底冰川可培养细菌多样性
辛普森多样性指数(Simpson’s diversity index)、物种均匀度指数(species evenness index)、香农-威纳指数(Shannon-Weiner index)和物种数目(number of species)4个多样性指数的统计结果均表明不同培养温度,冬克玛底冰川3 种样品总的可培养细菌多样性不同,且10 ℃培养条件下,可培养细菌的多样性高于25 ℃[图8(a)]。
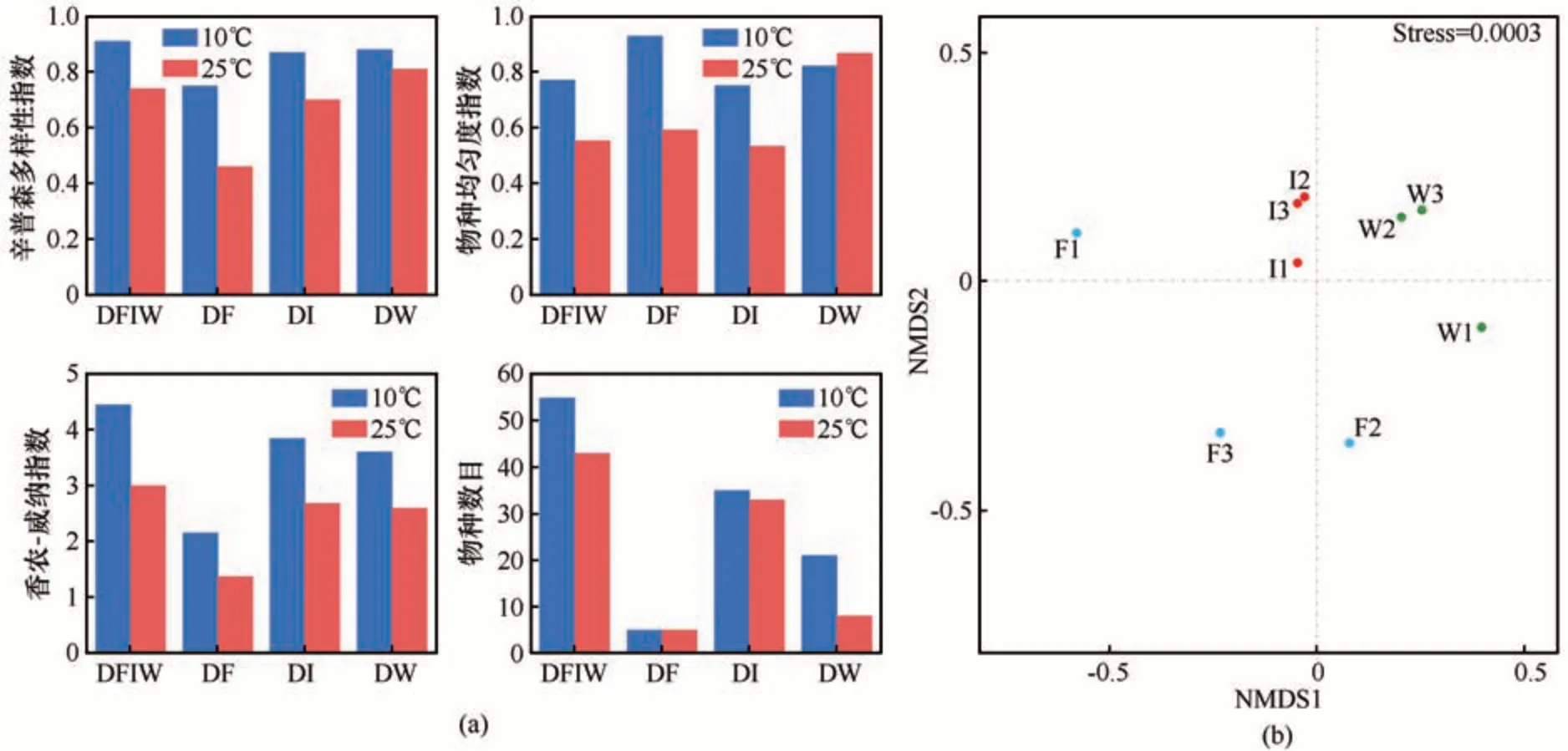
图8 冬克玛底冰川可培养细菌α-多样性(a)和β-多样性(b)Fig. 8 α-diversity (a) and β-diversity (b) of the culturable bacteria from the Dongkemadi Glacier
4 个多样性指数的统计结果均发现不同生境,可培养细菌多样性也不同。其中,香农-威纳指数和物种数目的统计结果一致,在10 ℃和25 ℃两个培养条件下多样性均表现为冰样>融水样>雪样。两个温度培养条件下辛普森多样性一致表现为融水样>冰样>雪样[图8(a)]。10 ℃培养条件下物种均匀度:雪样>融水样>冰样;25 ℃培养条件下物种均匀度:融水样>雪样>冰样[图8(a)]。NMDS 图结果显示冬克玛底冰川3种不同生境的细菌群落结构明显不同,且相比雪样,冰样与融水样的可培养细菌群落结构更相近[图8(b)]。
3 讨论
3.1 可培养细菌群落结构特征
本研究从冬克玛底冰川分离得到的可培养细菌可分为4个门,分别是放线菌门、变形菌门、拟杆菌门和厚壁菌门,与其他冰川研究结果一致[10,13,22-24]。无论在可培养细菌数量还是物种数目方面,放线菌门都是冰川生态系统的优势菌门[25-27],本研究中冬克玛底冰川也有类似的结果。
不同温度下冬克玛底冰川可培养细菌的数量显著不同,在10 ℃培养条件下可培养细菌的数量高于25 ℃。相关研究结果表明,不同培养温度下可培养细菌数量差异显著[17],可培养细菌数量与温度呈负相关关系[28-29]。冰川细菌经过了一定时间的反复融冻和低温封存,冰样和融水样的细菌群落已发生了变化,部分不耐冷的细菌因不适应低温环境而被淘汰,存活下来的细菌可能更适应低温环境。冷杆菌属、嗜冷杆菌属和极单胞菌属等只在10 ℃培养条件下被分离的耐冷细菌,极大可能在冰川消融的大趋势下消失;而纤维素单胞菌属、血杆菌属和副球菌属这些只在25 ℃培养温度分离得到的非耐冷细菌,随着冰川消融,它们可能在经过低水温的冰前河流时就被淘汰。
本研究结果与其他冰川对比,包括安第斯山脉玻利瓦尔冰川[26]、北极斯瓦尔巴群岛冰川[30]、卓奥友峰冰川[31]、天山乌鲁木齐河源1 号冰川[32-33]、老虎沟12 号冰川[33-34]和慕士塔格冰川[22,33,35]等[11,36-38]。结果发现包括优势属(库克菌属、微杆菌属和马赛菌属)在内的28 个属在其他冰川均被发现,而纤维素单胞菌属、假节杆菌属、根戈德里谷氨酸杆属、血杆菌属、Aquirhabdus、皱纹单胞菌属、鞘氨醇盒菌属和Kaistella在其他冰川未见报道。冬克玛底冰川发现的细菌门和优势属在其他冰川相关研究中也被发现,可能是由于这些冰川相似的极端环境对于细菌的选择性造就了细菌群落结构的相似性。冬克玛底冰川存在大量独有的属,这可能是由于其微生物来源不同,并且受到温度、湿度、太阳辐射程度和营养水平等一系列环境条件的影响而造成的[39]。研究还发现疑似新种49 株,分离的可培养细菌中32.21%为潜在新种,说明冰川是一个极好的微生物资源库[40],可以为冰冻圈微生物资源开发及利用提供数据支撑及菌种资源。目前,冰川消融的情况十分严峻,在冰川消失前相关领域的科研工作者应尽力保存微生物资源以便进一步研究和利用[41]。
3.2 不同生境中细菌群落结构差异
比较三种生境可培养细菌的多样性指数,发现不同生境中可培养细菌多样性不同。不同生境中可培养细菌数量差异显著。在其他冰川也发现了类似现象,有研究表明崇测冰帽雪样、土样和冰碛物中的可培养细菌数量差异很大[10];祁连山七一冰川雪和融水中的可培养细菌数量差异同样很大[38]。冰样中可培养细菌数量远高于融水样和雪样,这可能与样品中的非水溶性固形物有关,冰样中非水溶性固形物含量最多,为细菌提供了稳定栖息的微环境。
在属水平雪样、冰样和融水样中发现的细菌有重合,但部分属是单一样品独有的。相似结果在其他冰川也有报道,如崇测冰帽雪样、土样和冰碛物[10,42];青藏高原竹溪冰川融化池和冰周河流[42];玉龙雪山白水1 号冰川前沿土壤和融水[44]。这3 种生境重合的细菌是微杆菌属,在其他冰川的生境中也比较常见[24,27,45],微杆菌属还是冬克玛底冰川的优势属,其很有可能在冰川生态系统中稳定发挥重要作用。冰样中发现的属最多,雪样有75%的属与冰样重合,融水样有64.3%的属与冰样重合,雪样只有12.55%的属与融水样重合;说明相比融水样,雪样和冰样的群落相似度更高;且相比雪样,融水样和冰样的群落相似度更高。冬克玛底冰川9月末的平均温度在0 ℃以下[15],冰川雪消融较少,冰川融水大部分来自受冰体压力和地热融化的底层冰,导致了雪与融水细菌群落差异巨大。
3.3 可培养细菌群落结构与环境因子相关性分析
研究发现冬克玛底冰川可培养细菌数量与Cl-、K+和Ca2+的含量,以及pH 和EC 呈正相关关系,与海拔(EL)呈反相关关系(表2)。相关研究表明,K+和Ca2+等离子浓度可代表冰雪中粉尘的含量[46-47],粉尘不仅可作为细菌的“载体”,将微生物从冰川周围环境中携带至冰川,其中还含有微生物赖以生存的营养物质,为微生物提供了生存的微生态环境。已有的研究表明pH 值同样对细菌数量影响显著[48-49],主要原因可能是本次雪样的pH 呈弱酸性,而冰和融水的pH 值均在7左右,中性的环境更适合绝大多数细菌的生存。

表2 可培养细菌多样性与环境因子的相关性Table 2 Correlation between culturable bacterial diversity and environmental factor
研究结果表明,环境因子还会影响微生物群落的多样性[50-51]。在之前冰川微生物相关研究中未发现多样性与Cl-浓度的明显相关性,但在盐碱化土壤微生物的研究中发现了与本研究相似的结果[50]。对于pH 值与细菌多样性的相关性,部分研究与本研究有类似的结论[52],但还有研究结果表明pH 值与细菌多样性在不同生境的相关关系不同[53]。pH值与细菌多样性的相关关系受生境酸碱性影响,大多微生物更适合中性环境,环境是酸性时,pH 值与细菌多样性是正相关关系[54-55],环境是碱性时,pH值与细菌多样性是负相关关系[56]。
4 结论
本研究以冬克玛底冰川雪、冰和融水为研究对象,分离得到三类样品中放线菌门、变形菌门、拟杆菌门和厚壁菌门,其中放线菌门是优势菌门。雪样在不同培养温度下得到的可培养细菌数量差异不显著;而冰样和融水样在不同培养温度下得到的可培养细菌数量差异显著。
冰样中可培养细菌数量远高于融水样和雪样,这可能与样品中的非水溶性固形物有关,冰样中非水溶性固形物含量最多,为细菌提供了稳定栖息的微环境。在属水平,雪样、冰样和融水样中发现的细菌有重合,雪样和冰样的群落相似度更高。
Cl-、K+、Ca2+、Na+和Mg2+的含量和pH 与冬克玛底冰川可培养细菌数量和多样性均呈正相关关系,且与Cl-、Ca2+的含量和pH 的相关性较大,这可能与冰川中粉尘的含量有关。
研究发现疑似新种49株,分离的可培养细菌中32.21%为潜在新种,说明冰川是一个极好的微生物资源库,可以为冰冻圈微生物资源开发及利用提供数据支撑及菌种资源。
致谢:对唐古拉冰冻圈与环境观测研究站全体成员在本研究采样阶段提供的帮助与指导表示衷心的感谢。
