膜滤工艺中添加Fe2+及在不同干燥工艺条件下对牛乳胶束酪蛋白的结构及功能性质的影响
2024-01-18冯子真杨继涛郑杰秦娟娟杨敏
冯子真,杨继涛*,郑杰,秦娟娟,杨敏
1(甘肃农业大学 农业资源化学与应用研究所,甘肃 兰州,730070)2(甘肃农业大学 理学院,甘肃 兰州,730070)
牛乳酪蛋白是牛奶中最主要的蛋白质组分,约占蛋白质总量的80%,因其产量巨大,受到了人们广泛关注。牛乳酪蛋白结构具有脯氨酸和谷氨酰胺组成的序列,并且钙与磷蛋白相结合,导致了天然的分子亲和力,其通过疏水、氢键以及静电相互作用,使得数千个酪蛋白分子聚集在一起形成了胶束态酪蛋白[1-2]。食品工业中,可以采用加酸沉降法提取牛乳酪蛋白,但是会破坏胶束酪蛋白的原有形态,所以人们一直致力于提取酪蛋白的新工艺的开发与研究。
膜滤工艺是一种分离技术,其原理是利用不同分子质量截留膜及加压循环装置,来达到分离目的。牛乳中各成分分子质量差距较大,使用膜滤工艺可以高效地提取酪蛋白,分离过程中只需加水循环洗涤,故能最大程度保持酪蛋白的原有结构,所得酪蛋白是一种稳定且无定形的聚集物的形式,称为胶束酪蛋白浓缩物(micellar casein concentrates,MCC)[3-4]。
铁元素是人体必需元素之一,在运输O2以及增强免疫方面均起到重要作用。食用蛋白与铁相互作用,一直受到研究者们关注,通过蛋白质溶液体系下对铁离子络合,辅助以冷冻干燥及喷雾干燥等手段,来考察铁离子对蛋白质结构与食品功能性影响。例如,BANJARE等[5]使用喷雾干燥技术络合乳清蛋白与铁从而改善了其生物可及性;ESTRADA等[6]使用豌豆蛋白与铁进行包埋后探究其氧化等理化特性,然而目前对于胶束酪蛋白浓缩物作为铁离子的基础载物的研究鲜有报道。
在此次研究中利用膜滤工艺提取牛乳酪蛋白,工艺中采用不同浓度Fe2+水溶液进行多次洗涤,利用冷冻干燥及喷雾干燥2种工艺制备出不同的样品。利用紫外、红外、荧光光谱以及圆二色谱等手段分析Fe2+对胶束酪蛋白浓缩物的二级结构影响,并探究其热稳定性、溶解性、浊度、吸油及乳化性等理化性质变化规律,以期对胶束酪蛋白浓缩物产品的生产与开发提供理论参考。
1 材料与方法
1.1 材料与仪器
巴氏杀菌奶(当日),兰州庄园牧场股份有限公司(中国兰州);大豆油,益海嘉里金龙鱼粮油食品股份有限公司;FeCl2、十二烷基硫酸钠、姜黄素(均为分析纯),上海麦克林生化科技有限公司。
H1850台式离心机,湖南湘仪实验室仪器开发有限公司;RNF0460-01膜滤机,厦门福美科技有限公司;FD-1-50冷冻干燥机,北京博医康实验仪器有限公司;NAI-GZJ喷雾干燥机,上海那艾精密仪器有限公司;AD500S-H高速均质机,上海昂尼仪器仪表有限公司;TU-1901双光束分光光度计,北京普析通用仪器有限责任公司;RF-5301PC荧光分光光度计,日本津岛公司;JASCOJ-1700圆二色谱仪,日本分光株式会社;STA449 F5热分析仪,德国耐驰仪器制造有限公司,实验用水均为二次蒸馏水。
1.2 胶束酪蛋白浓缩物的制备
根据GB 5749—2022《生活饮用水卫生标准》,铁离子质量浓度含量不超过0.3 mg/L,因此选择配制Fe2+为0.1、0.2、0.3 mg/L水溶液进行膜滤洗涤。二次蒸馏水作为空白对照组。先将巴氏杀菌牛乳在4 000×g离心20 min进行脱脂,后经过100 kDa有机膜的微滤系统,采取0.5 MPa跨膜压力,按照Fe2+水溶液∶脱脂奶=4∶1(体积比)水洗脱盐脱糖后,微滤浓缩至1 L的酪蛋白胶束溶液,分别经过冷冻干燥(freeze drying,FD)及喷雾干燥(spraying drying,SD)得到2组工艺组合下MCC样品,根据添加Fe2+浓度分别标记为MCC-Fe0,MCC-Fe0.1,MCC-Fe0.2,MCC-Fe0.3。
1.3 紫外可见光谱(ultraviolet-visible spectrum,UV)
分别配制不同MCC样品,质量浓度均为1.0 mg/mL,用二次蒸馏水作为空白,使用双光束分光光度计在波长190~320 nm进行紫外吸收光谱扫描。
1.4 荧光光谱测定(fluorescence spectrometry,FS)
分别配制不同MCC样品,质量浓度均为1.0 mg/mL,使用荧光分光光度计对290~700 nm内记录发射光谱,选择激发波长为280 nm,发射狭缝及激发狭缝为10 nm进行荧光光谱分析。
1.5 傅里叶红外光谱分析(Fourier transform infrared spectrometer,FTIR)
使用傅里叶红外光谱仪(Nicolet iS50 FTIR,美国赛默飞世尔科学公司)进行红外光谱扫描,扫描范围400~4 000 cm-1,扫描32次,分辨率为4 cm-1。
1.6 圆二色谱分析(circular dichroic chromatography,CD)
分别配制不同MCC样品,质量浓度均为0.5 mg/mL,使用圆二色谱仪进行解析,设定温度4 ℃,光谱范围190~260 nm,选择杨氏算法计算相关二级结构含量,所有样品均已重复3次实验。
1.7 热重分析(thermogravimetry-derivative thermogravimetry,TG-DTG)
参考DOH等[7]的方法,略有修改。选择温度范围25~600 ℃,升温速率6 ℃/min,保护气流速50 mL/min,反应气流速50 mL/min,均为N2气氛,使用热分析仪(STA 449 F5,德国耐驰仪器制造有限公司)对样品进行热稳定性分析。
1.8 溶解度分析
参考CANO-CHAUCA等[8]的方法,分别配制10.0 mg/mL MCC溶液,取10 mL放置于离心管中,使用高速离心机以4 000 r/min离心10 min,小心去除上清液,放置于鼓风干燥箱内,恒温60 ℃干燥至恒重,记为A1,原样品质量记为A2,平行3次,取其平均值,以此测定相应溶解度。溶解性的计算如公式(1)所示:
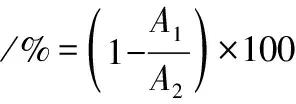
(1)
1.9 浊度分析
配制1.0 mg/mL的MCC溶液,使用紫外可见分光光度计在860 nm处测定MCC溶液吸光度值,以吸光度大小表述溶液的浊度,去离子水做对比,平行测定3次,取其平均值,以此测定所有样品浊度。
1.10 吸油性分析
参考杨敏等[9]的方法对吸油性进行测定,将0.5 g不同MCC样品分别与5 mL大豆油涡旋5 min,静置后使用离心机以4 000×g离心30 min,离心后将油层吸除,称取沉淀质量。吸油性的计算如公式(2)所示:

(2)
1.11 乳化性及乳化稳定性分析
参考JIANG等[10]的方法测定乳化活力指数(emulsifying activity index,EAI)及乳化稳定性(emulsion stability index,ESI),将8 mL大豆油与24 mL质量浓度为2.0 mg/mL MCC溶液在高速均质机下以10 000 r/min均质1 min,混合均匀后静置,分别取静置0、30 min的50 μL胶束酪蛋白溶液与5 mL质量浓度为1.0 g/L的十二烷基硫酸钠溶液混合后,利用分光光度法在500 nm测定其吸光度。乳化性的计算如公式(3)、公式(4)所示:
(3)
(4)
式中:ρ,初始溶液的质量浓度,g/mL;φ,光径1 cm;θ,乳状液中油相体积分数(θ=0.25);A0,起始吸光度;A30,30 min的吸光度。
1.12 数据及显著性分析
采用SPSS Statistics 22、Origin 9对实验数据进行统计分析,数据用平均值±标准偏差表示,差异性利用小写字母标识(P<0.05)。
2 结果与分析
2.1 UV分析
紫外吸收光谱如图1所示,样品在277 nm左右出现吸收峰,其中冻干组吸光度明显高于喷干组,这种结果是由于特征氨基酸基团暴露增加所造成的。在冻干组中,随着Fe2+浓度增加,吸光度发生减少。这是由于Fe2+与酪氨酸、色氨酸中基团发生了相互缔合作用,并且浓度越大作用力越强。喷干组具有类似规律,MCC-Fe0.1-SD吸光度达到最高,这可能是由于加入少量Fe2+后,加之随着喷干过程的进行反而让MCC中酪氨酸、色氨酸发生了暴露。
2组样品的吸光度都会随着离子浓度的增大发生蓝移,最大吸收波长都出现由277 nm蓝移至275 nm,这说明MCC中色氨酸和酪氨酸所处微环境发生改变,MCC的二级结构可能发生变化[11]。
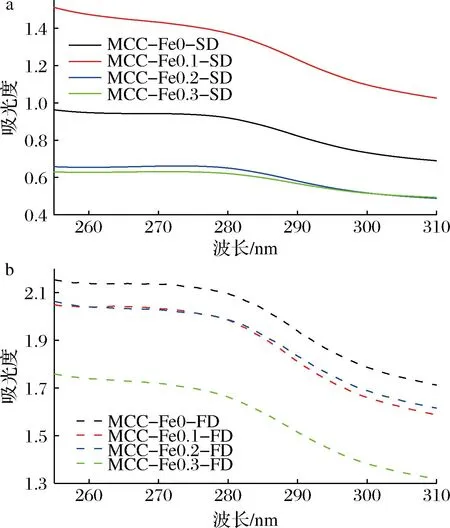
a-喷雾干燥;b-冷冻干燥图1 不同Fe2+浓度下的MCC的紫外吸收光谱图Fig.1 UV absorption spectra of MCC at different Fe2+ concentrations
2.2 FS分析
样品荧光光谱如图2所示,2组样品的最大荧光强度都出现在对照组中,加入Fe2+后荧光强度都有明显下降,Fe2+具有淬灭效果,可能由于在解离折叠作用下,色氨酸会暴露于亲水环境中[12]。喷干样品组随着Fe2+浓度的增加,荧光强度逐渐减小,而冻干组加入离子后呈现与喷干组相反趋势。
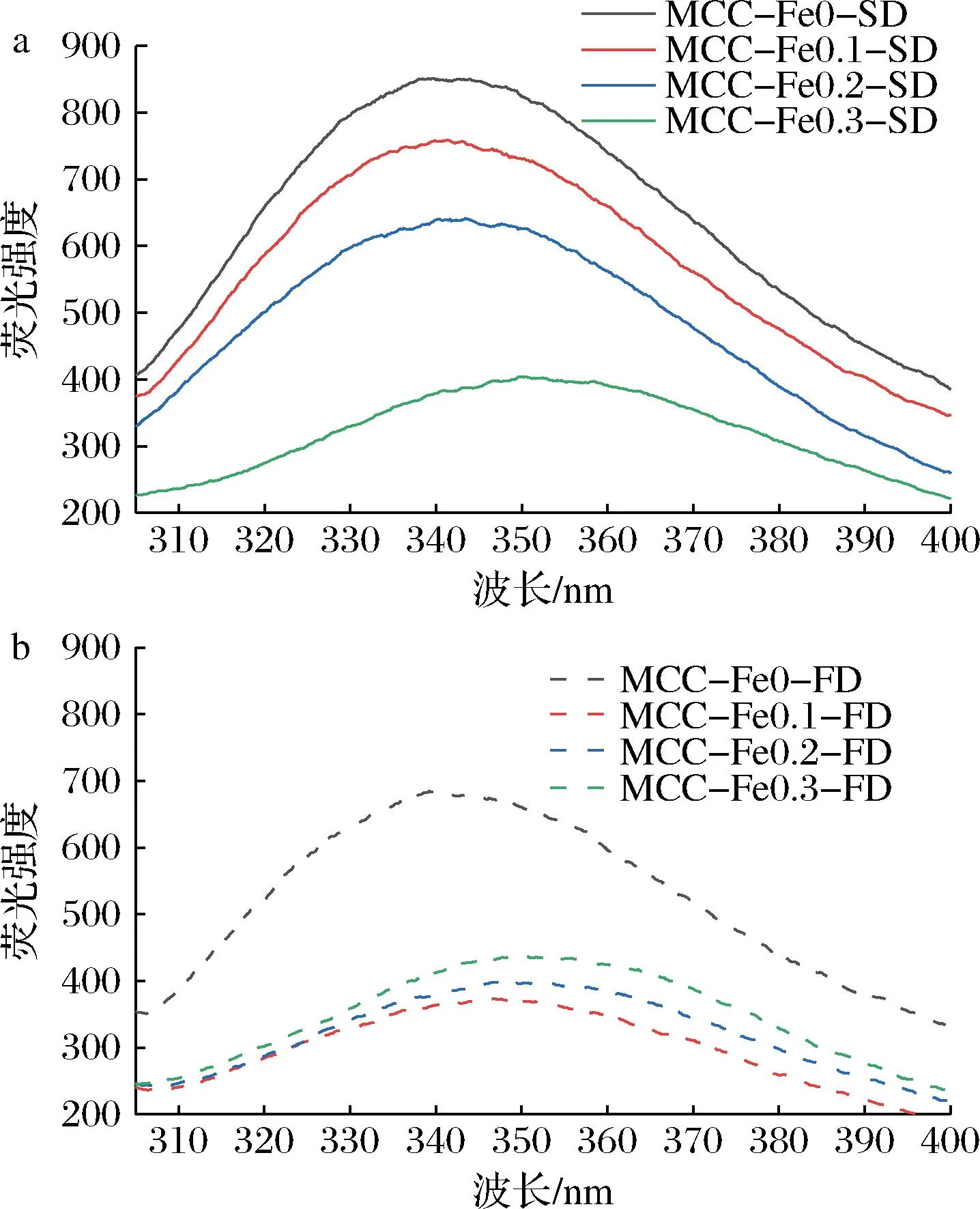
a-喷雾干燥;b-冷冻干燥图2 不同Fe2+浓度下的酪蛋白胶束的荧光光谱图Fig.2 Fluorescence spectra of casein micelles at different Fe2+concentrations
2组对比可以得到:冻干组样品荧光强度普遍小于喷干组,这可能是由于干燥工艺的不同导致疏水性差异。已有研究表明,冻干样品的表面疏水性低于喷干样品,这与本研究结果一致[13]。
根据KEERATI-U-RAI等[14]的理论,蛋白质结构松散从而使得色氨酸残基暴露,表明蛋白质内色氨酸与酪氨酸残基微环境的改变。随着Fe2+浓度增大,最大发射波长也随之发生红移,这也反映了MCC二级结构发生变化。
2.3 FTIR分析
样品红外可见光谱如图3所示,在2 919 cm-1处出现的吸收峰是C—H键的伸缩振动峰,但是各个样品之间的C—H伸缩振动并没有太大变化,这表示Fe2+浓度及干燥工艺的不同并没有对样品氢键发生显著改变,3 400 cm-1左右的峰主要归属于蛋白质负载水的信号峰,可以看出冻干样品水峰强度大于喷干样品,说明冻干样品含水量大于喷干样品[15]。
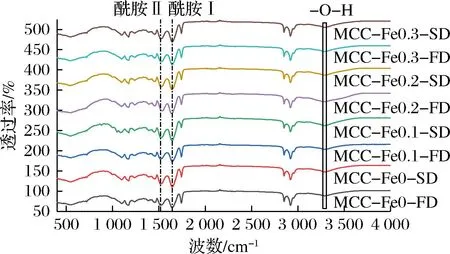
图3 不同Fe2+浓度下的酪蛋白胶束的红外光谱图Fig.3 Infrared spectra of casein micelles at different Fe2+ concentrations

2.4 CD分析
可以在图4中看到,干燥工艺与Fe2+添加均对MCC二级结构产生了影响,喷干组中未检测出α-螺旋结构,随着Fe2+的加入β-折叠含量发生减少,转角含量逐渐增大,无规卷曲含量也有所增加。冻干组样品中在Fe2+浓度最大一组中并未检测到α-螺旋,β-折叠与无规卷曲在Fe2+质量浓度0.3 mg/L时含量最大,转角含量在0.2 mg/L最大。
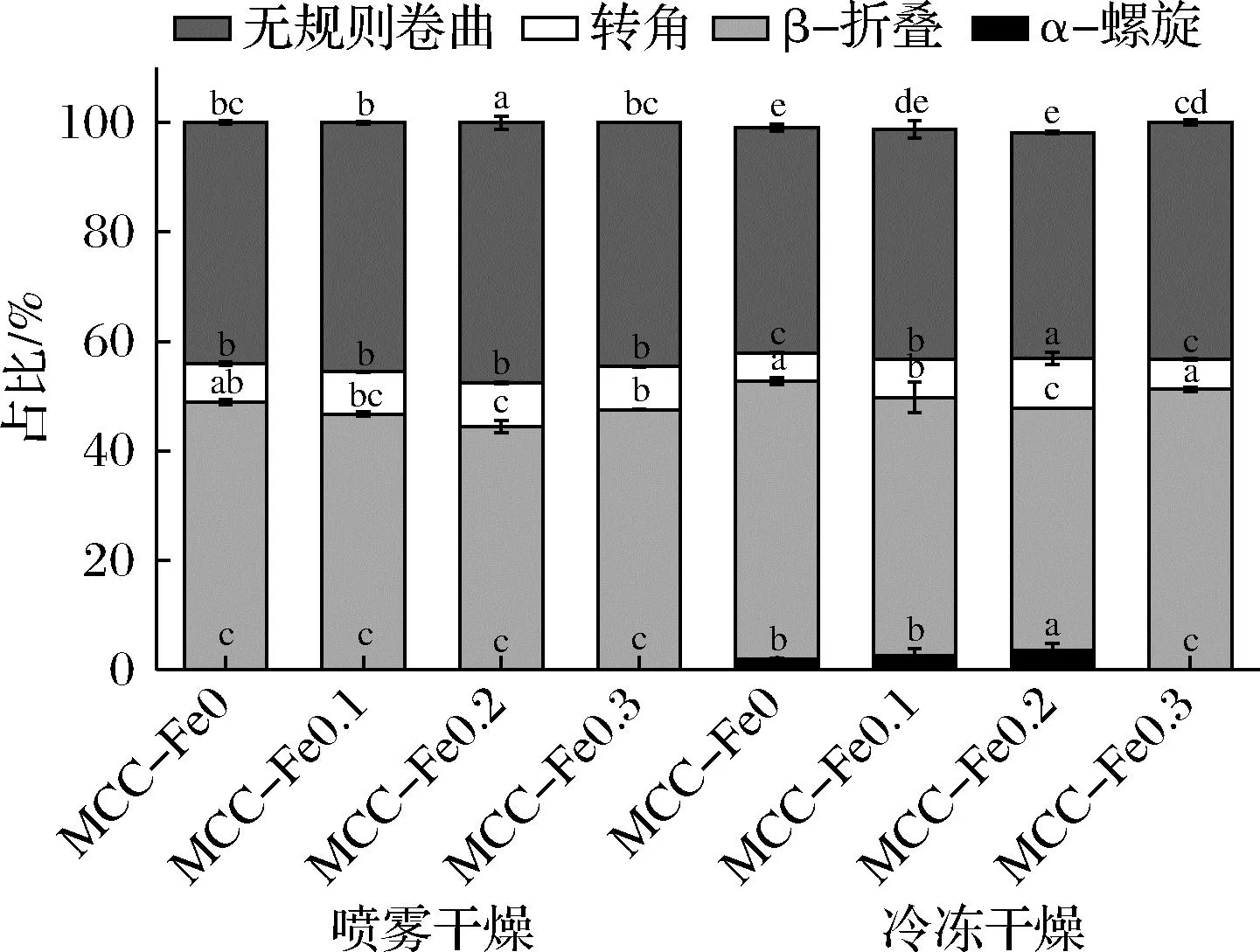
图4 不同Fe2+浓度下的酪蛋白胶束的圆二色谱分析图Fig.4 Circular dichroism of casein micelles at different Fe2+ concentrations注:不同小写字母代表差异显著,P<0.05(下同)。
根据显著性分析可以看到,α-螺旋在冻干组具有明显差异(P<0.05),差异性出现在0.2 mg/L组,同样的在喷干组时,β-折叠、无规卷曲与转角的差异性也出现在0.2 mg/L处。而在冻干组β-折叠与转角的差异性出现在0.1与0.2 mg/L处,无规卷曲的差异性出现在0.3 mg/L处。
差异性对比可以看到在加入Fe2+后,样品的二级结构发生了改变,与之前红外、紫外及荧光光谱所得到的研究结果保持一致。
2.5 TG-DTG分析
通过图5可以看到,冻干组MCC在347.5 ℃处出现一个失重峰,随着不同浓度Fe2+的加入,失重峰升温至362.5、354、362 ℃处,这说明样品的热稳定性与对照组相比有了明显的提升,其中在质量浓度为0.1 mg/L处的热稳定性最好。喷干样品失重峰温度均高于对应冻干组,这是由于喷干工艺下蛋白质颗粒更加紧密造成的。随着Fe2+浓度的增大,失重峰温度提升,这说明了在此时加入Fe2+会使得热稳定性升高,这与冻干组结果一致。在吸热时,蛋白质处于热变性的过程,蛋白质状态呈现有序到无序的转变,随着温度升高及浓度的变化,多肽链展开,使得酪蛋白变性的发生,说明适当添加Fe2+在加热时有稳定蛋白质结构作用[17]。
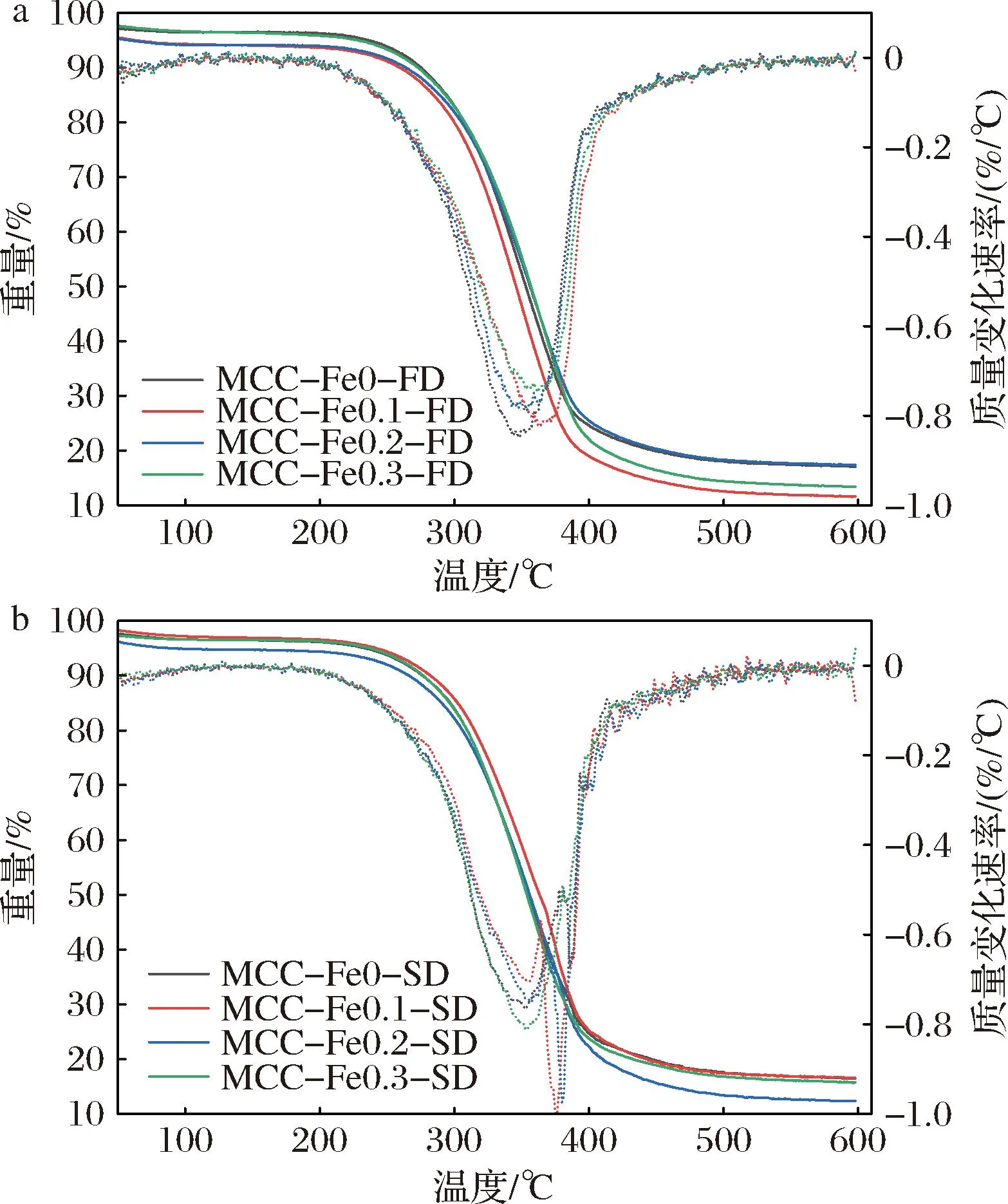
a-喷雾干燥;b-冷冻干燥图5 不同Fe2+浓度下的冷冻干燥与 喷雾干燥的酪蛋白胶束TG图Fig.5 TG plots of freeze-dried and spray-dried casein micelles at different Fe2+ concentrations
2.6 溶解性分析
样品的溶解性如图6所示,冻干组溶解度均值略大于喷干组,不具有显著性差异。
与相应对照组相比,加入Fe2+后的MCC溶解度均略有降低,但是并不显著。添加Fe2+后,质量浓度达到0.2 mg/L时喷干与冻干样品溶解度均最高,这可能是因为Fe2+加入后表面基团的变化,使得更多亲水区域的暴露会让MCC与水的相互作用更加明显,从而导致溶解度的提升[18]。之前REN等[18]的研究提出,通过喷雾冷冻干燥工艺后,溶解性与MCC孔隙率、胶体磷酸钙解离程度以及低温等因素相关,通过冷冻干燥后,MCC的疏水作用力得到削弱。这些因素或许可以解释冷冻干燥后的样品溶解性相对于喷雾干燥后的样品溶解性更高。

图6 不同Fe2+浓度下的酪蛋白胶束的溶解度Fig.6 Solubility of casein micelles at different Fe2+ concentrations
2.7 浊度分析
样品的浊度如图7所示,加入Fe2+后浊度普遍大于对照组,这表明Fe2+加入,会提高MCC浊度。喷干组的浊度始终大于冻干组样品,两组之间具有显著性差异,其中MCC-Fe0.3喷干样品浊度最高。
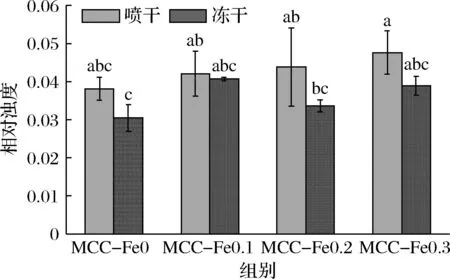
图7 不同Fe2+浓度下的酪蛋白胶束的浊度Fig.7 Turbidity of casein micelles at different Fe2+concentrations
喷干组样品浊度随添加Fe2+浓度增加而增加,这可能是由于Fe2+浓度的增大而导致MCC相互之间静电斥力下降,发生团聚造成的现象[19]。冻干组样品在Fe2+加入后,呈现先减小后增大的趋势,实验结果表明,随着Fe2+的加入,MCC尺寸发生变化,内部结构可能发生坍塌解离或酪蛋白出现聚集导致浊度变化[20]。
2.8 吸油性
样品的吸油性可以从图8中看到,由于冻干样品较能保持酪蛋白胶束原始状态,其结构孔隙率较高,冻干样品吸油性要明显高于喷干样品,其各组均值为喷干样品3~5倍,具有显著性差异。
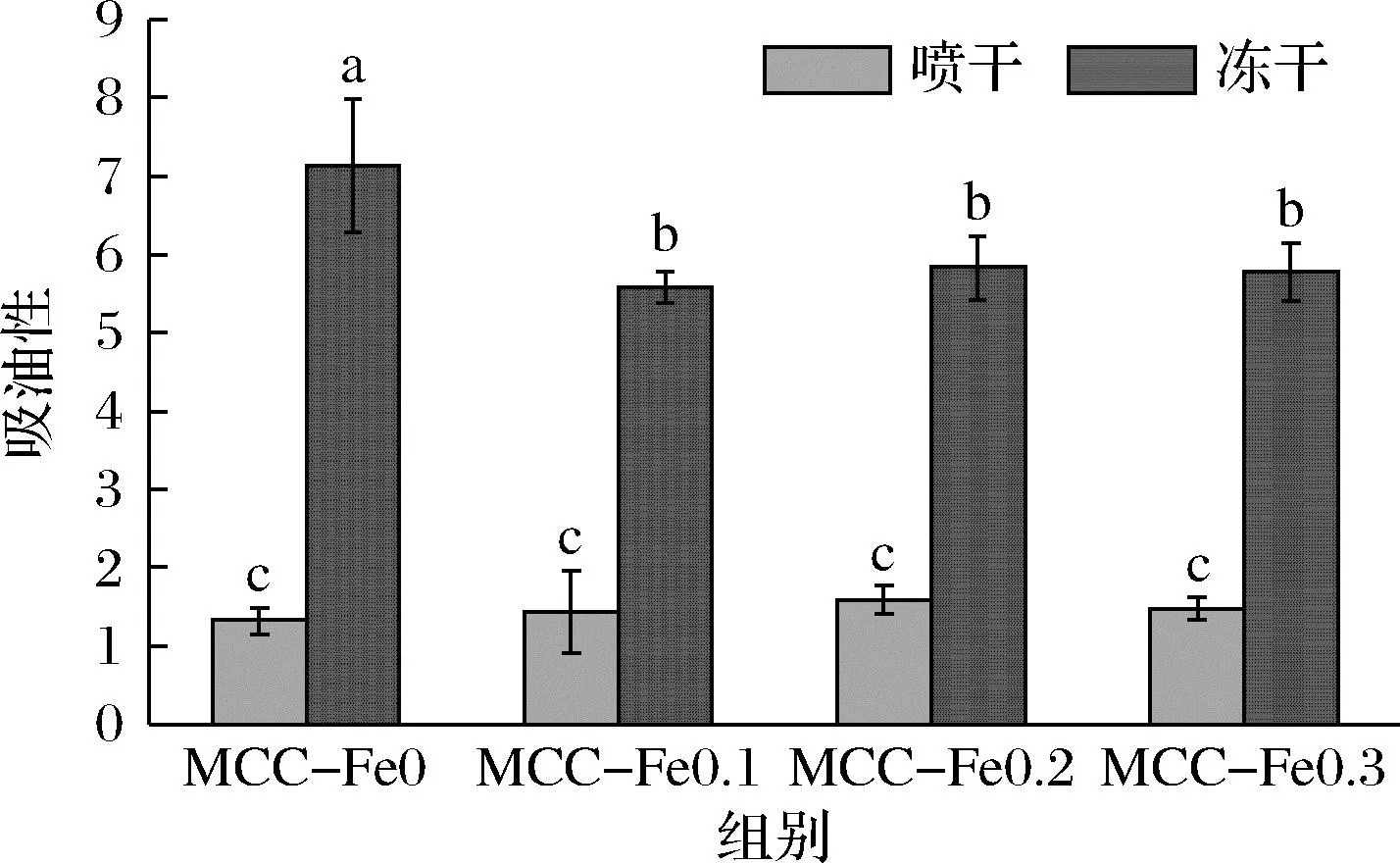
图8 不同Fe2+浓度下的酪蛋白胶束的吸油性Fig.8 Oil absorption of casein micelles at different Fe2+concentrations
其中喷干组随着Fe2+浓度的增加,吸油量升高,在0.2 mg/L时吸油量达到最大,吸油量为(1.59±0.17) g/g,比对照组提升了16%。冻干组样品吸油量均低于相应对照组,说明冻干条件下Fe2+添加会降低MCC的持油能力,Fe2+加入0.2 mg/L时持油能力降低幅度最小。
2.9 乳化活力指数与乳化稳定性分析
对于MCC的乳化活力指数,如图9所示,Fe2+加入后出现明显差异性,乳化活力指数与对照组相比都

a-乳化活力指数;b-乳化稳定性图9 不同Fe2+浓度下的酪蛋白胶束的 乳化活力指数及乳化稳定性Fig.9 Emulsification vitality index and emulsion stability of casein micelles at different Fe2+ concentrations
出现明显的升高,在质量浓度达到0.2 mg/L之后,喷干组的乳化活力指数相比于冻干组来说,出现了明显升高,并且在0.3 mg/L时二者差距达到10%。
冻干组乳化活力指数在0.1 mg/L处乳化活力到达最大,之后随着浓度的增大乳化活力逐渐降低。喷干组乳化活力指数呈现出随Fe2+浓度的增加而增加的趋势,在0.3 mg/L时乳化活力值达到最大。
冻干样品的乳化稳定性随着浓度的增大逐渐减小,这说明了Fe2+的加入对于冻干组的乳化稳定性产生了负作用。喷干组在加入Fe2+后先是下降后上升,特别是在Fe2+质量浓度增加到0.3 mg/L,其乳化稳定性相比于对照组较好地提升。综合乳化活力与乳化稳定性,冻干工艺中膜滤水洗液Fe2+最佳质量浓度为0.1 mg/L,喷干工艺为0.3 mg/L。
总的来说,对于所得到的喷雾干燥的EAI高于冷冻干燥,而冷冻干燥的ESI高于喷雾干燥。这或许因为喷雾干燥工艺所导致的液滴收缩,使得水分扩散系数的降低以及表面张力的增大从而得到的蛋白质塌陷以及结构松散,更容易达到乳状液的状态,所得的乳化活力指数更高,而冷冻干燥工艺所产生的溶质聚集以及其板状颗粒的结构,使得蛋白质结构紧密,所以冷冻干燥的乳化稳定性要高于喷干组[21]。
3 结论与讨论
本研究采用鲜牛乳脱脂后,在膜滤工艺下加入梯度浓度Fe2+水洗液,利用冻干工艺以及喷干工艺制备出系列MCC粉末;利用UV、FS、FTIR以及CD测试手段表征其结构的变化,结果表明喷雾干燥及冷冻干燥工艺对MCC二级结构影响较显著,Fe2+水洗液浓度越大二级结构变化越明显,其中α-螺旋,β-折叠,无规卷曲与转角都发生了不同程度的改变。Fe2+的加入同时也提高了酪蛋白胶束的吸油性、浊度以及热稳定性;Fe2+的加入对MCC溶解性没有显著影响;Fe2+加入使得MCC的乳化性得到改善。喷干工艺中,随着Fe2+浓度变大,其乳化活力指数也增大,冻干组中加入0.1 mg/L Fe2+时,其乳化活力指数升至最高。由于干燥工艺不同,冻干组的乳化稳定性要高于喷干组,但是加入0.3 mg/L Fe2+喷干组的MCC则高于冻干组。本研究中Fe2+水洗液浓度设计满足食品工业用水要求,相关实验结果可以为膜滤工艺下不同性能MCC制备提供参考依据。