丙二酸的生物合成及其发酵优化
2024-01-18凌春榕杨小雁耿嘉宝毛银赵运英邓禹
凌春榕,杨小雁,耿嘉宝,毛银,赵运英*,邓禹*
1(江南大学,粮食发酵与食品生物制造国家工程研究中心,江苏 无锡,214122)2(江南大学,江苏省生物活性产品 加工工程研究中心,江苏 无锡,214122)3(山东渤海实业集团有限公司,山东省油脂油料精深加工技术 重点实验室,山东 滨州,256599)
丙二酸,又称胡萝卜酸,是一种非常重要的二元羧酸,广泛应用于多种领域,其酯类可用于染料和药物的基本有机合成材料[1]。当前,丙二酸主要是通过化学法利用非可再生石油原料生产[2-5],化学法生产丙二酸面临巨大的环境和价格问题,且存在效率低、污染环境重和提纯步骤复杂问题[1, 6]。因此通过工业生物技术使用可再生原料制备丙二酸具有更大的竞争优势。
随着现代生物技术的发展,研究者已经开发了以β-丙氨酸、丙二酰辅酶A和草酰乙酸为前体的3种非天然代谢途径合成丙二酸[7]。SONG等[8]在大肠杆菌W3110中过量表达6个基因(ppc、aspA、panD、pa0132、yneI和sdh),构建了一种经过β-丙氨酸途径的丙二酸生物合成途径,通过补料分批发酵,该工程菌株能够生产3.60 g/L的丙二酸。付雯宣等[9]通过过量表达ppc、aspC、panD、pa0132、yneI和pyc基因,在大肠杆菌BL21中成功构建了丙二酸生物合成重组菌株;并将ppc和aspC以及pa0132和yneI分别进行融合表达,在5 L发酵罐中,丙二酸产量最高达5.61 g/L。丙二酰辅酶A途径基于来自酿酒酵母的EHD3突变基因编码的酰基辅酶A水解酶,在酵母和大肠杆菌中过表达该基因可合成丙二酸[10]。LI等[11]对线粒体3-羟基异丁酰辅酶A水解酶基因EHD3进行了突变,并进一步探索了突变株和ACC1**与Delta序列位点的整合,通过调节丙二酰辅酶A途径中关键酶的表达来改善前体供应和抑制其竞争途径,该重组菌株在5 L发酵罐中可以生产1.62 g/L的丙二酸。GU等[12]设计了一种新的丙二酸合成途径,通过体外筛选获得一种草酰乙酸脱羧酶,使草酰乙酸经α-酮基脱羧酶和琥珀酸半醛脱氢酶依次催化转化为丙二酸;并将该途径在嗜热菌丝体中构建,丙二酸的产量为42.5 mg/L。该途径大大缩短了丙二酸的合成途径,意义重大。
本文通过过量表达磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase, Ppc)基因(ppc)、天冬氨酸转氨酶(aspartase, AspA)基因(aspA)、天冬氨酸-α-脱羧酶(aspartate-α-decarboxylase, PanD)基因(panD)、琥珀酸脱氢酶(succinate dehydrogenase, SdhC)基因(sdhC)、β-丙氨酸丙酮酸转氨酶(β-alanine pyruvate transaminase, Pa0132)基因(pa0132)和琥珀酸半醛脱氢酶(succinic semialdeyde dehydrogenase, YneI)基因(yneI)构建丙二酸生物合成菌株BL21(PPP),并对该菌株发酵工艺进行了优化,进一步提高了丙二酸的产量,为生物法合成丙二酸提供了新思路。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
本实验所用菌株和质粒详见表1及表2。

表1 本研究所用菌株Table 1 Strains used in this study

表2 本研究所用质粒Table 2 Plasmids used in this study
1.1.2 培养基
LB(Luria-Bertani)培养基(g/L):蛋白胨10,酵母粉5,NaCl 10;
SOB(super optimal broth)培养基(g/L):蛋白胨20,酵母粉5,MgCl2·6H2O 2.03,NaCl 0.5,KCl 0.186;
TB(terrific-broth)培养基(g/L):蛋白胨12,酵母粉24,K2HPO4·3H2O 16.34,KH2PO42.31;
YT(yeast extract tryptone)培养基(g/L):蛋白胨16,酵母粉10,NaCl 10;
固体培养基需添加20 g/L的琼脂粉,添加的抗菌素终浓度为1 mmol/L。
1.1.3 试剂
DNA聚合酶、Marker,TaKaRa公司;C115重组酶,诺唯赞公司;DNA纯化及质粒提取试剂盒,生工生物工程(上海)股份有限公司;丙二酸、丁二酸标准品、生物素,Sigma公司;富马酸,北京伊诺凯科技有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG),碧云天生物公司;胰蛋白胨、酵母提取物,英国Oxoid公司;琼脂粉、葡萄糖、NaCl、MgCl2·6H2O、KCl、K2HPO4·3H2O、KH2PO4、乙酸、乳酸等试剂购自上海国药试剂集团。
1.1.4 引物
本研究所有引物合成及测序由苏州安升达生物有限公司完成,引物序列如表3所示。

表3 本研究所用引物序列Table 3 Primer sequence used in this study
1.2 实验方法
1.2.1 质粒构建
基因来源:磷酸烯醇式丙酮酸羧化酶基因(ppc)、天冬氨酸转氨酶(aspartase,AspA)基因(aspA)、天冬氨酸-α-脱羧酶基因(panD)、琥珀酸脱氢酶基因(sdhC)来源于BL21(DE3)。β-丙氨酸丙酮酸转氨酶基因(pa0132)来源于铜绿假单胞菌(Pseudomonasaeruginosa)、琥珀酸半醛脱氢酶基因(yneI)来源于大肠杆菌K12。
构建:分别用pTrc-aspA-F/pTrc-aspA-R、pTrc-panD-F/pTrc-panD-R、pCDF-PPC-F/pCDF-PPC-R、pCDF-SDHC-F/pCDF-SDHC-R和pRSF-yneI-F/pRSF-yneI-R五对引物以大肠杆菌基因组为模板,扩增获得aspA、panD、ppc、sdhC和yneI基因;β-丙氨酸丙酮酸转氨酶基因(pa0132)由苏州安升达生物科技有限公司合成,用引物pRSF-pa0132-F和pRSF-pa0132-R扩增获得pa0132基因;用pTrc-bone-F和pTrc-bone-R、pCDF-bone-F和pCDF-bone-R、pRSF-bone-F1和pRSF-bone-R1分别将质粒pTrc99A、pCDFDuet-1和pRSFDuet-1线性化,与相应片段在同源重组酶C115的作用进行同源重组,获得质粒pTrc-T7-aspA-panD、pCDF-T7-ppc-sdhC和pRSF-T7-pa0132。用引物pRSF-bone-F2和pRSF-bone-R2将pRSF-T7-pa0132线性化,将yneI基因和pRSF-T7-pa0132全质粒片段在同源重组酶C115的作用下进行同源重组,获得质粒pRSF-T7-pa0132-T7-yneI。
1.2.2 重组菌株的构建
通过电转化法将质粒pTrc-T7-AspA-panD、pCDF-T7-ppc-sdhC和pRSF-T7-pa0132-T7-yneI转化至BL21(DE3)感受态细胞中,通过菌落PCR进行验证,获得重组菌BL21(PPP)。
1.2.3 基因表达的鉴定
挑取单克隆于25 mL的LB培养基中,37 ℃培养10~12 h。再将上述菌液转接至LB培养基中过夜培养,按2%接种量转接至LB培养基中,37 ℃培养3~4 h后,添加终浓度为1 mmol/L的IPTG进行诱导,并转至30 ℃进行培养。隔12 h取样,样品处理后进行SDS-PAGE分析。
1.2.4 发酵实验
摇瓶发酵:重组菌株接种至LB培养基中37 ℃传代两次,发酵时取传代结束菌液接种至添加了4 g/L葡萄糖的发酵培养基中,37 ℃、250 r/min 培养3~4 h,添加IPTG进行诱导,转移至30 ℃培养,发酵72 h,每隔12 h取样,测定OD600值和丙二酸合成量。
培养基种类优化:选取LB、YT、SOB及TB培养基进行发酵实验,探究最适培养基种类。
诱导剂浓度优化:在SOB培养基中培养3~4 h后添加不同浓度(0.05、0.1、0.5、1.0、1.5 mmol/L)的IPTG,探究最适诱导剂浓度。
初始糖浓度优化:在SOB培养基中添加不同质量浓度(4、8、12、16 g/L)的葡萄糖作为初始糖,探究最适初始糖浓度。
外源添加物质:以添加4 g/L葡萄糖的SOB培养基为基础,在发酵4 h后添加不同质量浓度(0、25、50、75、100 μg/L)的生物素或不同质量浓度(0、4、8、16、24 g/L)的富马酸。
5L发酵罐发酵:重组菌株接种至LB培养基中培养12 h,再按2%接种量接种于LB培养基中,37 ℃、250 r/min 培养12 h后,以10%的接种量接种于5 L发酵罐。发酵期间用氨水进行pH调节,葡萄糖母液质量浓度为800 g/L。5 L发酵罐起始装液量为2 L,起始转速为200 r/min,每隔2 h提高50 r/min,将溶氧维持在25%左右,直到转速为400 r/min,一直维持到发酵结束。
1.2.5 代谢物含量测定及定性分析
细胞的生长情况:通过600 nm处的光密度(OD600)来衡量,上罐前期糖及乙酸等含量使用Y15全自动分析仪(BioSystems,巴塞罗那,西班牙)进行快速检测,每次取样时记录数据以绘制菌株生长曲线。
定量:发酵液以12 000 r/min离心10 min,取上清液用10 mmol/L H2SO4进行稀释,用0.22 μm水系滤膜过滤,经由HPLC检测代谢物的含量。检测所用流动相为5 mmol/L H2SO4,流速0.6 mL/min,色谱柱为Bio-Rad HPX-87H色谱柱,柱温35 ℃,进样量10 μL。通过示差检测器对发酵液中的代谢物进行定量。
定性:本研究采用LC-MS对发酵液进行分析。
2 结果与分析
2.1 重组菌株的构建
富马酸可以在AspA、PanD、Pa0132和YneI的共同作用下转化为丙二酸,如图1所示,该过程涉及多个酶参与催化反应,为了避免4个基因在一个质粒上共同表达造成质粒负担过大,我们将其两两组合分别构建在2个质粒上进行表达,如图2-a所示。为了增加前体的供应,同时过量表达ppc基因和sdhC基因。
将上述的3个质粒电转化到大肠杆菌BL21(DE3)感受态细胞中,重组转化子经菌落PCR(正确的克隆条带分别是:1 964、3 124、2 934 bp)和SDS-PAGE检测结果。如图2-b和图2-c所示,获得丙二酸合成菌株BL21(PPP)。
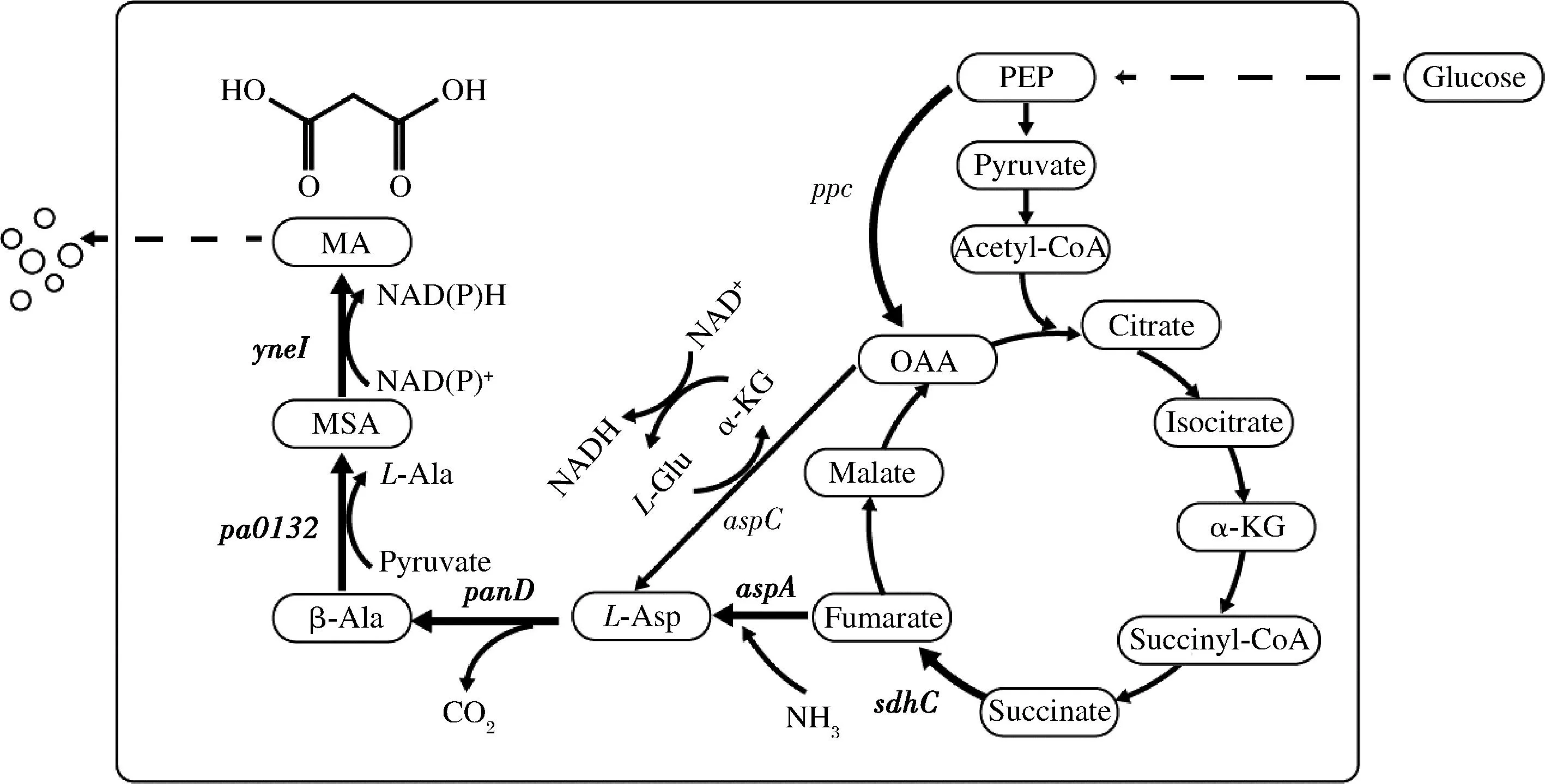
Glucose-葡萄糖;PEP-磷酸烯醇式丙酮酸;Pyruvate-丙酮酸;Acetyl-CoA-乙酰辅酶A;Citrate-柠檬酸;Isocitrate-异柠檬酸;α-KG-α-酮戊二酸;Succinyl-CoA-琥珀酰辅酶;Succinate-琥珀酸;Fumarate-富马酸;Malate-苹果酸;OAA-草酰乙酸;L-Asp-L-天冬氨酸;β-Ala-β-丙氨酸;MSA-丙二 酸半醛;MA-丙二酸图1 大肠杆菌的丙二酸合成代谢途径Fig.1 Metabolic pathway for the production of malonate acid in Escherichia coli注:粗箭头表示相应基因通过质粒进行过表达。

a-质粒图谱;b-菌落PCR验证;c-SDS-PAGE验证图2 质粒图谱、菌落PCR验证及SDS-PAGE验证结果Fig.2 Plasmid mapping, the colony PCR validation and SDS-PAGE validation results
2.2 BL21(PPP)丙二酸生物合成菌株的摇瓶发酵
将构建好的菌株BL21(PPP)以2%的接种量接种至SOB培养基中进行摇瓶发酵,以验证其生产丙二酸的能力,结果如图3-a所示,该菌株在发酵72 h可通过高效液相法检测到0.24 g/L的丙二酸。随后通过LC-MS检测对该样品进行丙二酸定性分析,结果如图3-b所示,样品中的特征离子碎片与标品相同,由此可确定该菌株可生产丙二酸。
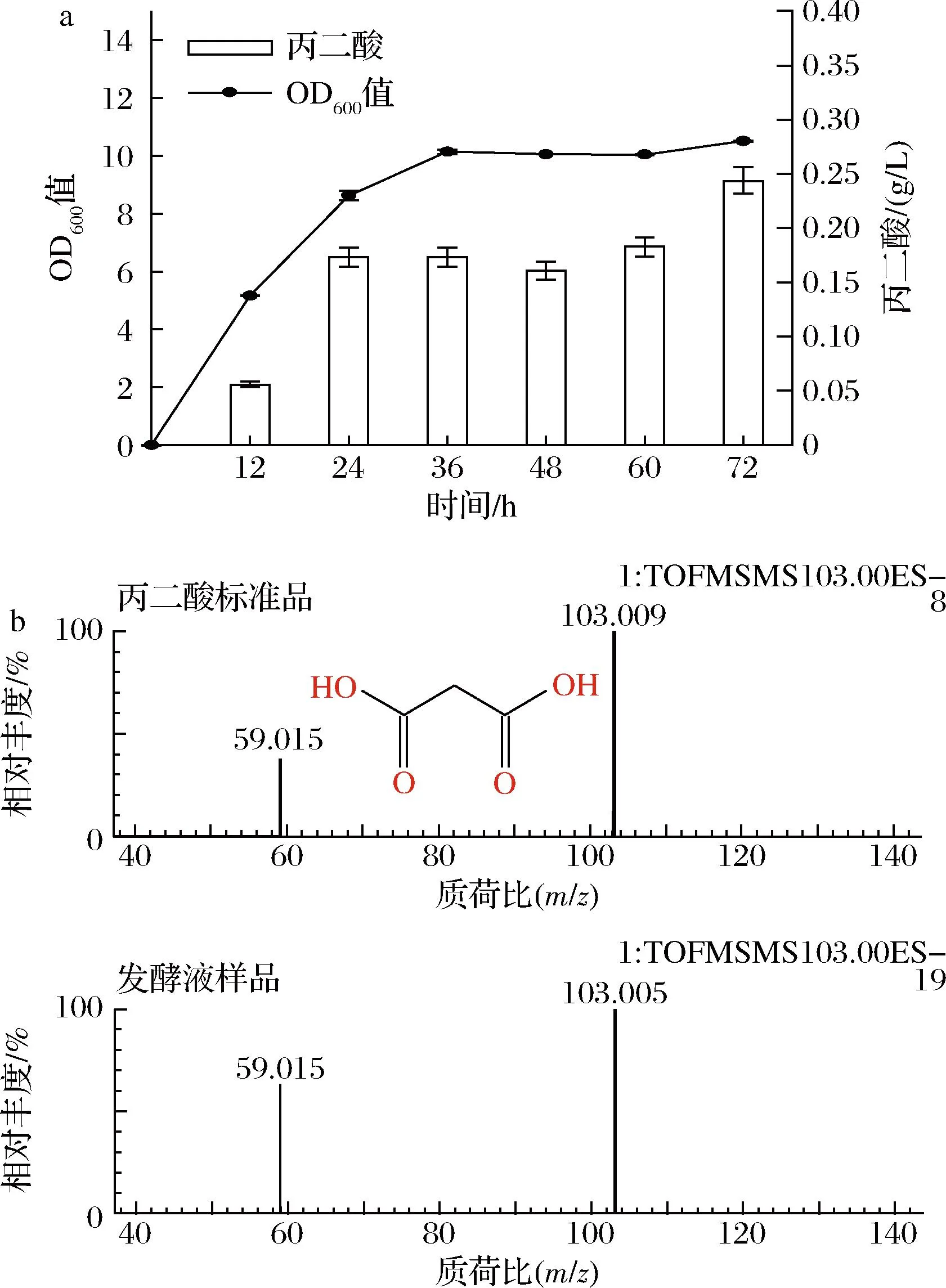
a-菌株BL21(PPP)的生长曲线及丙二酸产量图; b-丙二酸标准品及发酵72 h样品质谱检测图谱图3 菌株 BL21(PPP) 丙二酸的产量及发酵液 液质联用检测分析结果Fig.3 Production of malonic acid in strain BL21(PPP) and its LC-MS analysis results
2.3 BL21(PPP)丙二酸生物合成菌株发酵条件优化
由于获得的丙二酸的积累量很低,为了获得更高的产物浓度,对菌株BL21(PPP) 的发酵条件进行了优化(单因素试验),包括培养基种类、诱导剂浓度、初始糖浓度和外源添加物等。
2.3.1 培养基种类对丙二酸积累的影响
选取LB、YT、SOB及TB培养基进行发酵实验,结果如图4所示。
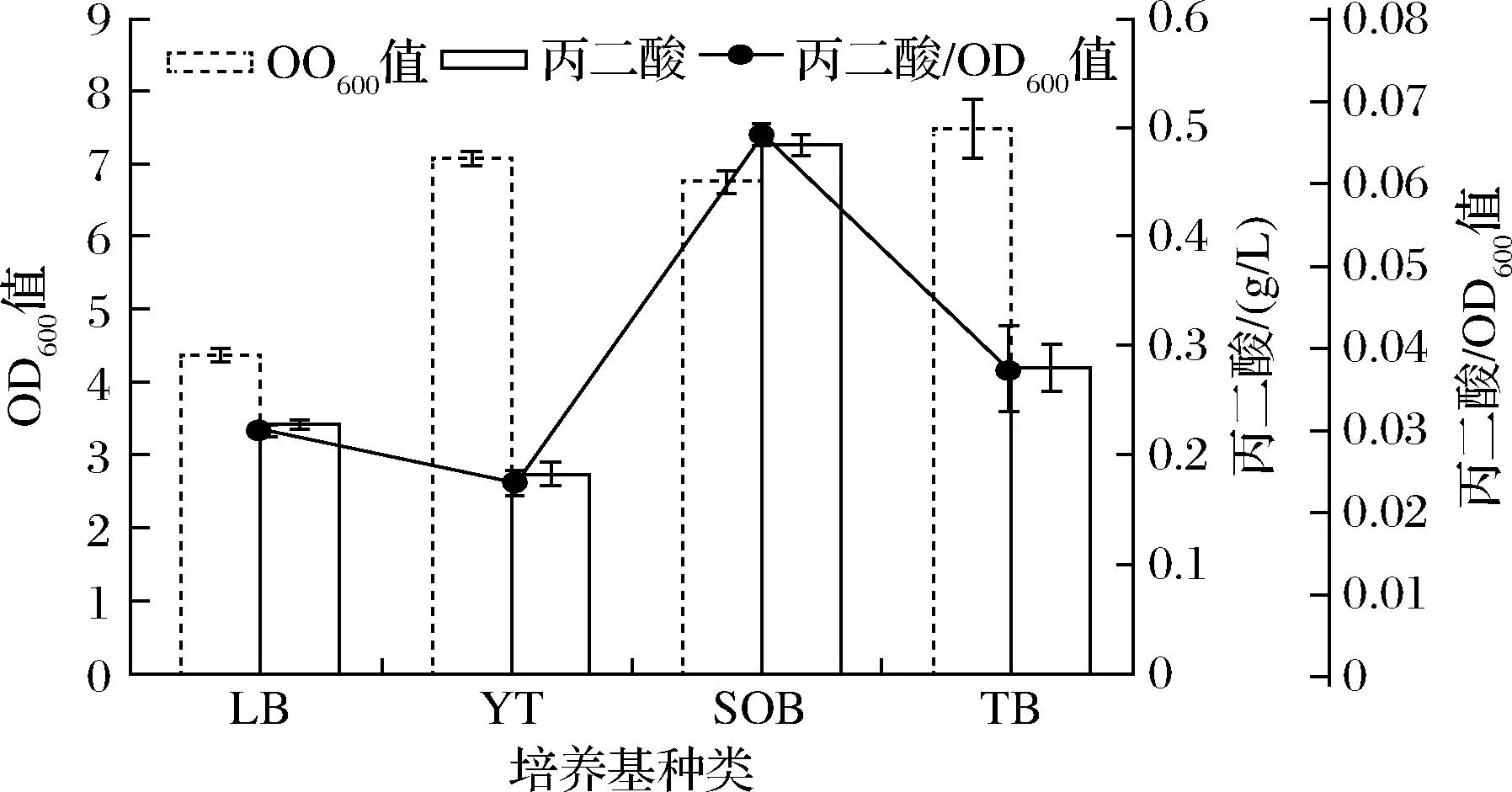
图4 不同发酵培养基对丙二酸产量的影响Fig.4 Effect of different fermentation medium on malonic acid production
在不同培养基当中,菌株BL21(PPP)的生长状况及生产丙二酸的能力均不同,菌株BL21(PPP)在TB培养基中获得较高的生物量,这可能与TB培养基中含有较多氮源有关,但菌体合成过量的含氮类代谢副产物[13],不利目标产物的合成。菌株BL21(PPP)在SOB培养基中能够积累较多的丙二酸(0.48 g/L)。因此,在本实验中以SOB培养基进行发酵。
2.3.2 诱导剂浓度优化
上述3个质粒的启动子均为诱导型,需要借助IPTG诱导目的基因表达[14],而IPTG浓度对菌体的生长及基因的表达均有一定的影响[15],故选择合适的IPTG浓度对于合成丙二酸有重要意义。由图5可知,当IPTG浓度为0.05 mmol/L时,菌株BL21(PPP)生长未受到明显抑制,并且能够合成较多的丙二酸(0.39 g/L)。
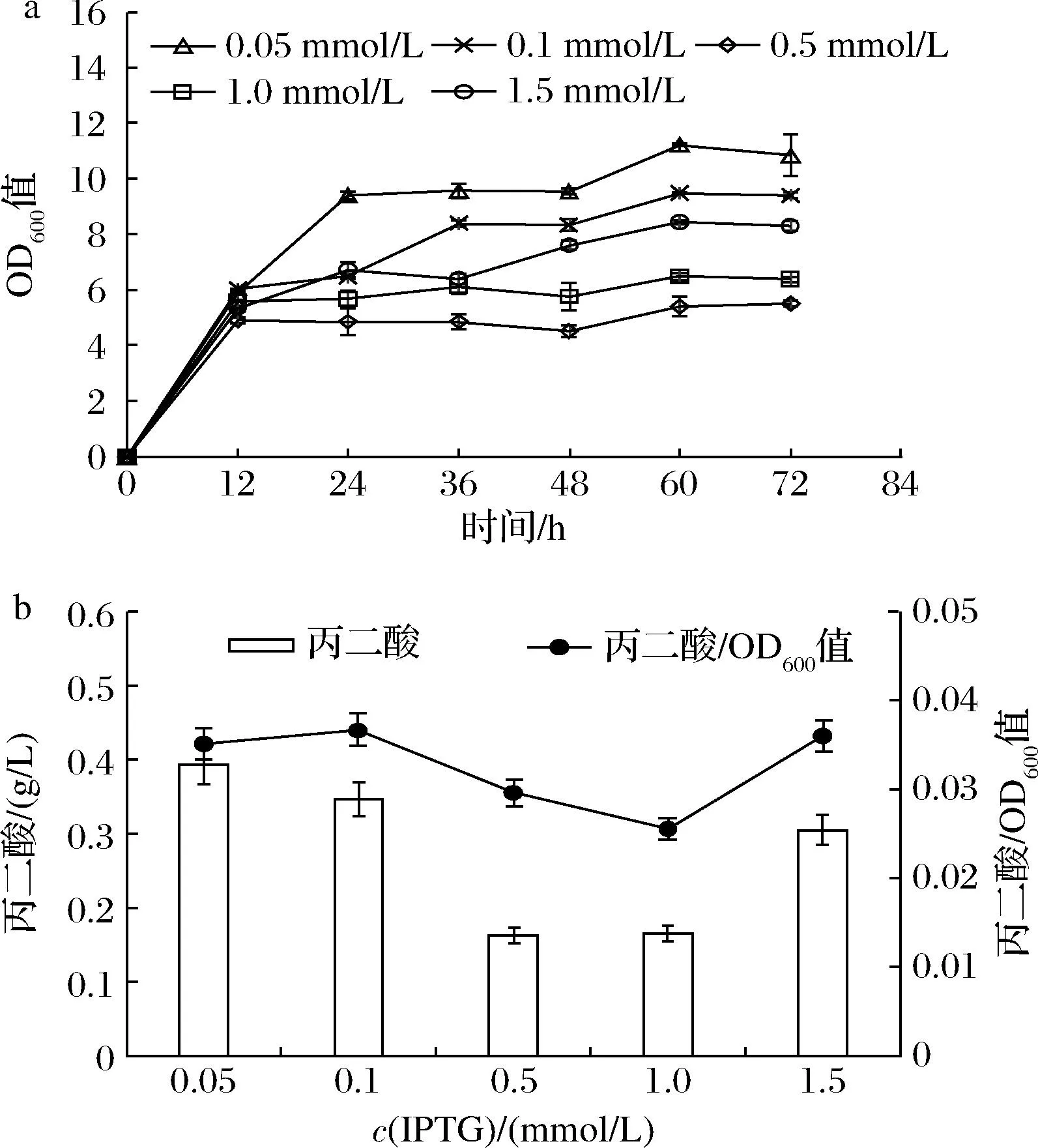
a-不同IPTG浓度下菌株 BL21(PPP) 的生长曲线; b-不同IPTG浓度下菌株 BL21(PPP) 丙二酸的产量图5 IPTG浓度优化Fig.5 Optimization of the IPTG concentration
2.3.3 初始糖浓度优化
葡萄糖作为快速碳源,容易被菌体吸收利用,经常被添加在发酵培养基中供菌体生长及合成目的产物。但是葡萄糖若供给过量,可能会引起“葡萄糖效应”,影响菌体生长,并且可能会产生大量杂酸,抑制目的产物的合成[16],所以需要探究最适合丙二酸合成的初始葡萄糖浓度。由图6可知,在菌株BL21(PPP)在初始葡萄糖添加量为4 g/L时能合成较多的丙二酸(0.32 g/L),随着添加葡萄糖浓度的增加,发酵结束时葡萄糖剩余量越多,并且会积累较多的乙酸,而乙酸过多会影响菌体生长,不利于蛋白的表达,并抑制产物的合成[17]。
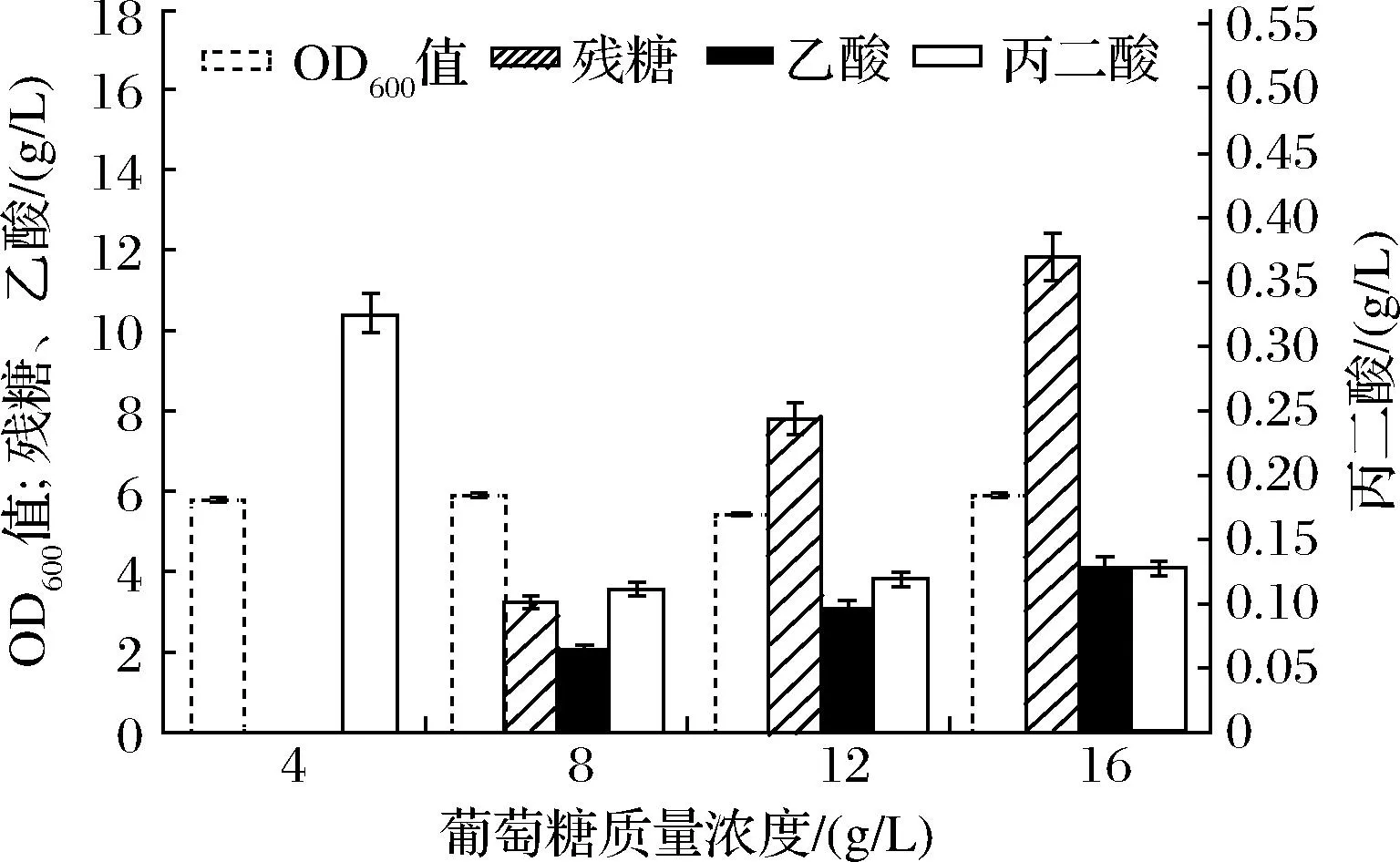
图6 初始糖浓度的优化Fig.6 Optimization of the initial glucose concentration
2.3.4 生物素对丙二酸合成的作用探究
磷酸烯醇式丙酮酸在磷酸烯醇式丙酮酸羧化酶(Ppc)的作用下转化为草酰乙酸,缩短了代谢路径,减少碳流失和能量的损耗。但是二元酸代谢产物对Ppc活力有一定的抑制作用,其中天冬氨酸是强抑制剂[18],L-天冬氨酸可与Ppc结合,改变其构像,使其失去催化能力[19]。因此,本文引入T7启动子上调ppc基因的表达。另外,生物素是多种羧化酶的辅酶[20],陈园园等[21]通过添加生物素使目标产物提高了84.26%。结果如图7所示,在添加75 μg/L生物素的发酵条件下,丙二酸的积累量较高(0.34 g/L),比对照组提高了32.59%,说明一定量的生物素添加有利于丙二酸合成。
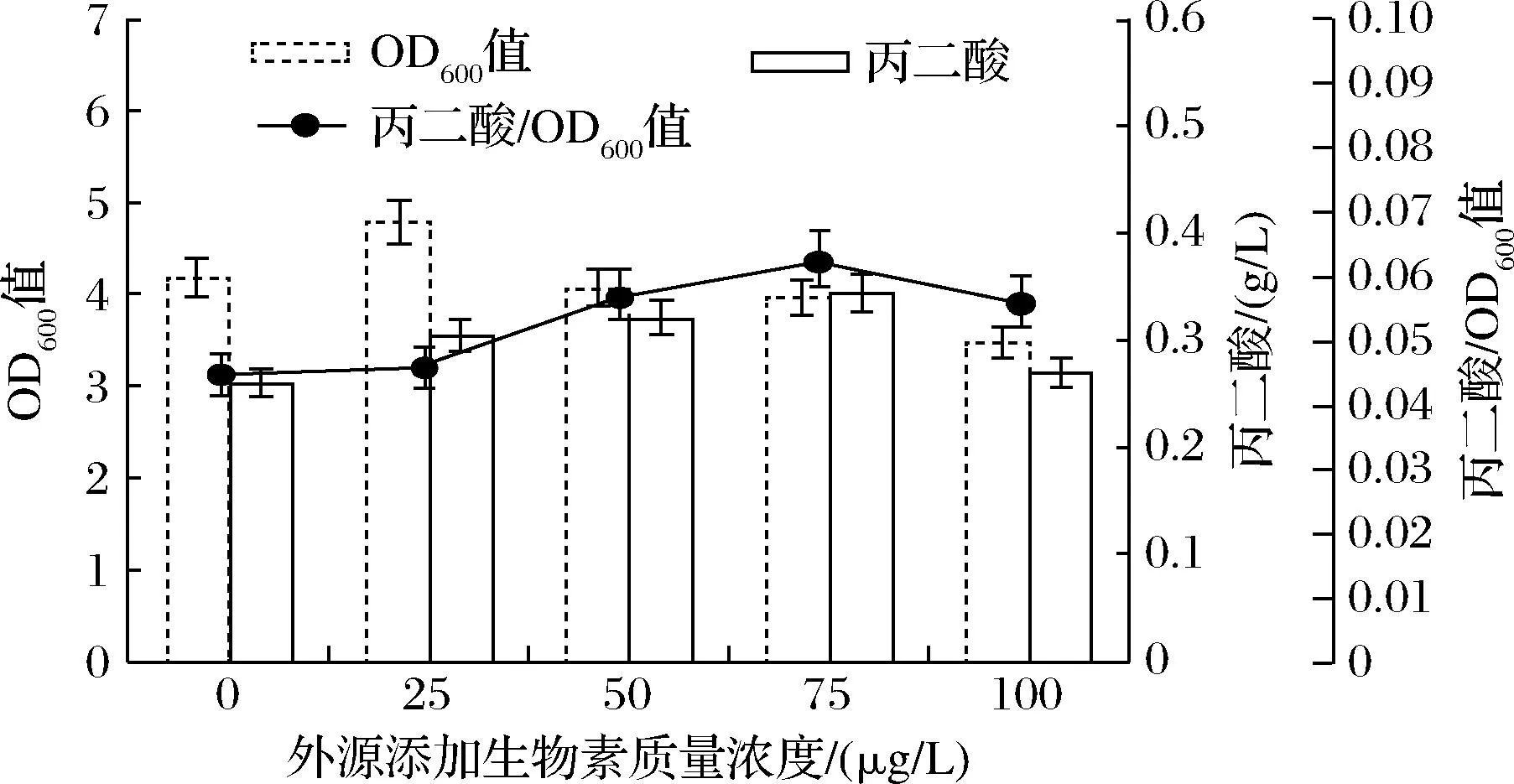
图7 生物素对丙二酸产量的影响Fig.7 Effect of biotin on malonic acid production
2.3.5 添加富马酸对丙二酸合成的影响
富马酸作为β-丙氨酸途径的前体物质,提高富马酸的浓度,可以提高碳通量,进而提高丙二酸的合成。为了探究最适的外源添加富马酸浓度,以添加了4 g/L葡萄糖的SOB培养基为对照组,分别添加不同浓度的富马酸,用菌株BL21(PPP)进行摇瓶发酵实验。不同浓度富马酸的添加都有利于丙二酸产量的提高(图8),随着富马酸浓度的提高,丙二酸的产量逐渐提高。综合考虑生产成本及富马酸的转化率,选择富马酸添加质量浓度为8 g/L,此时,丙二酸的产量和富马酸的摩尔转化率较高,为1.2 g/L和0.17 mol/mol(丙二酸/富马酸)。
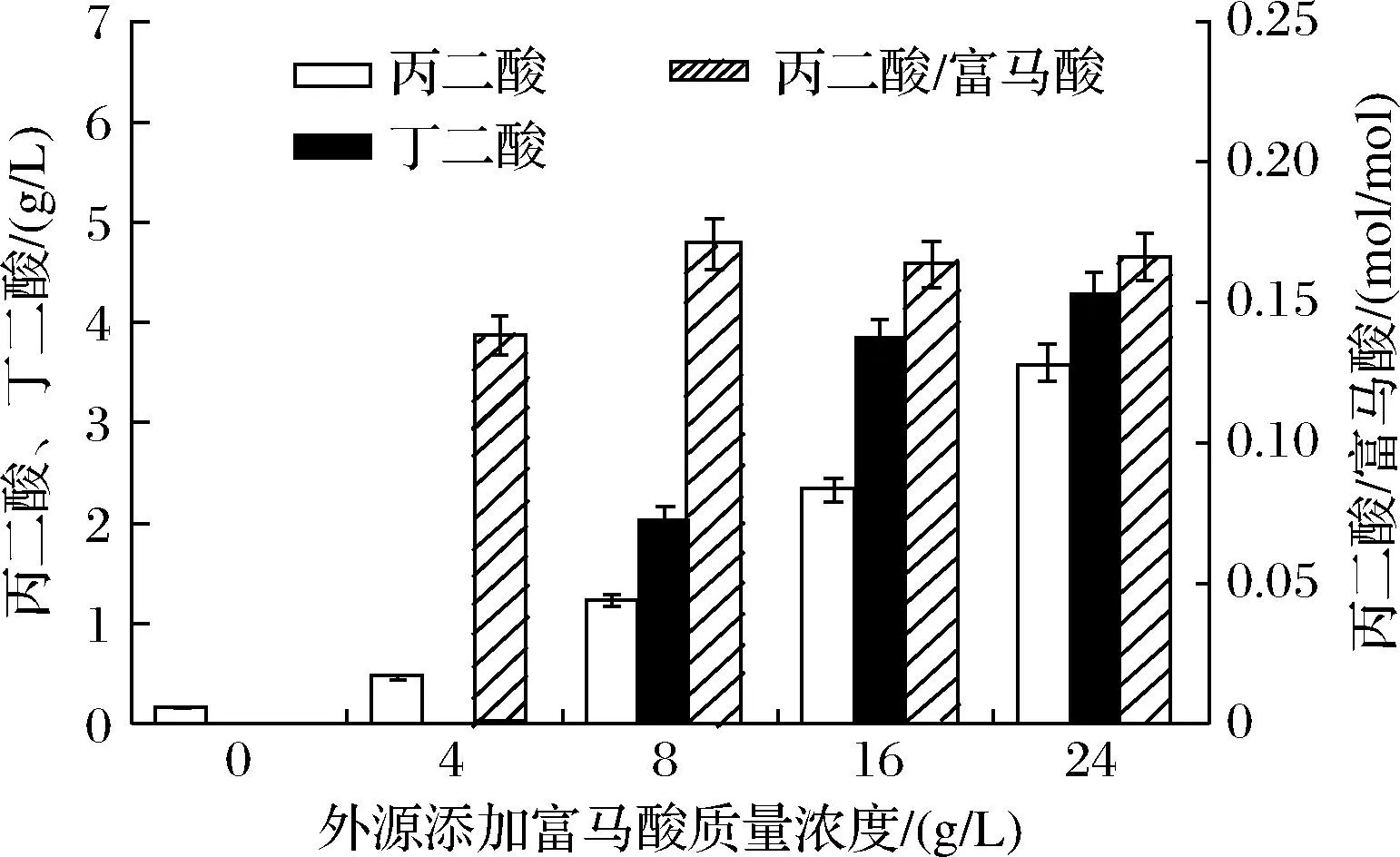
图8 添加富马酸对丙二酸产量的影响Fig.8 Effect of fumarate on malonic acid production
2.4 5 L发酵罐中重组菌株BL21(PPP)发酵条件优化
2.4.1 补料方式对重组菌株BL21(PPP)合成丙二酸的影响
为了进一步提高丙二酸的产量,参考摇瓶发酵优化的结果,本文采用5 L发酵罐进行放大培养对重组菌合成丙二酸的能力进行检测。首先在初始糖消耗完毕之后,进行葡萄糖的单独连续补加,流加速度为7 mL/h,并在37 ℃培养12 h后添加IPTG (0.05 mmol/L)进行诱导,培养温度降低至30 ℃。结果如图9-a所示,菌株BL21(PPP)最高OD600值约为11.84,在发酵72 h可积累1.5 g/L丙二酸。但是我们发现这种连续补料方式,在发酵后期因糖消耗速度下降造成大量的葡萄糖积累,易引起“葡萄糖效应”。
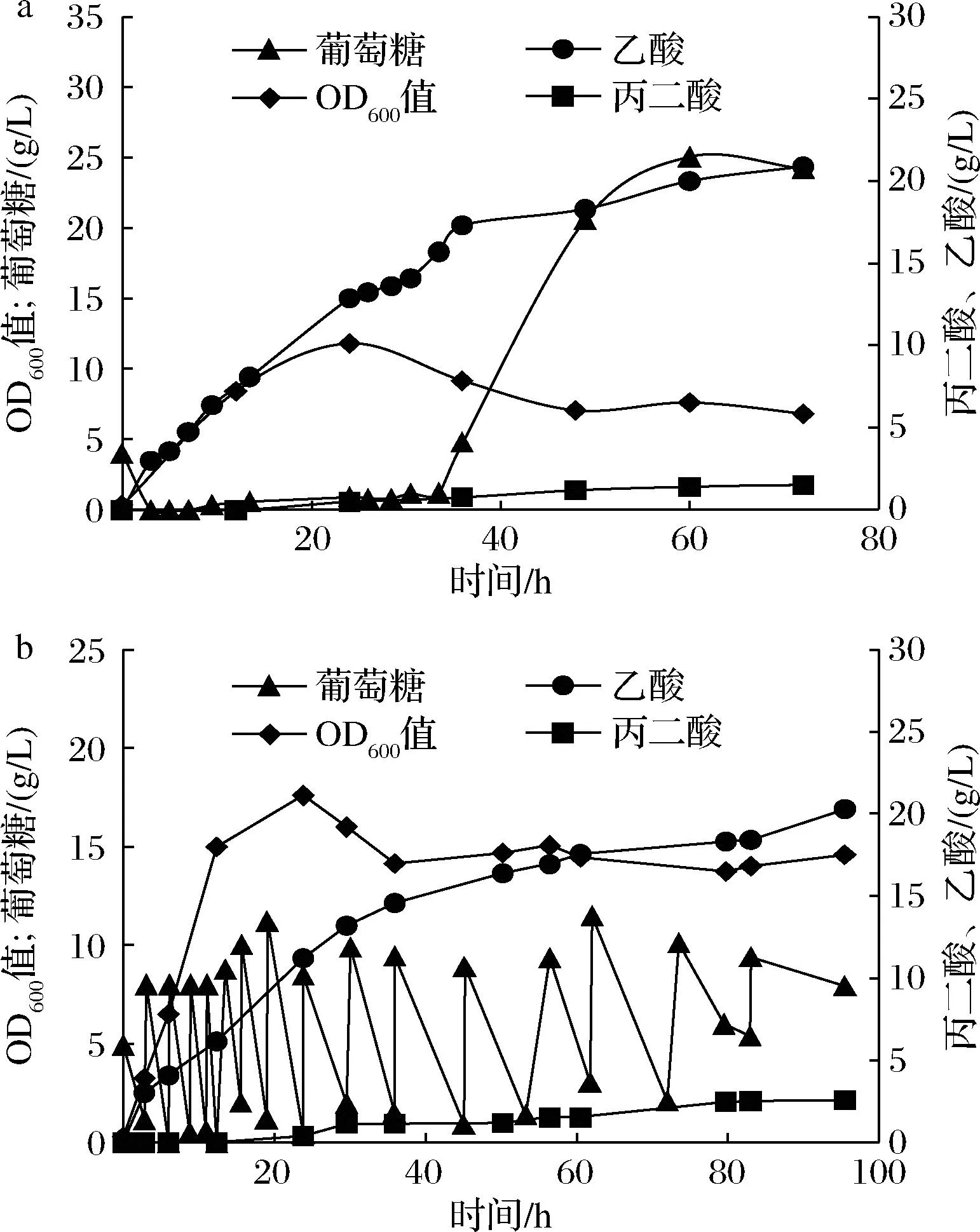
a-连续补料发酵结果;b-间歇补料发酵结果图9 菌株BL21(PPP) 5 L发酵罐发酵结果Fig.9 Results of 5 L fermenter fermentation of strain BL21(PPP)
改用间歇补料的方式进行葡萄糖的补加,在培养物中葡萄糖质量浓度低于约0.5 g/L时进行补加,每次手动补加至终质量浓度为8 g/L;由于在5 L发酵罐发酵过程中菌体量比摇瓶发酵的多,相同的IPTG浓度可能会造成拉动力不够,所以本文尝试分别在12 h和36 h都进行诱导剂的添加,每次添加IPTG的终浓度为0.05 mmol/L。结果如图9-b所示,菌株BL21(PPP)在79 h能合成约2.5 g/L的丙二酸,提高了66.67%;最高OD600值约为17.8,提高了约50.34%。
2.4.2 外源添加富马酸对重组菌株BL21(PPP)合成丙二酸的影响
在前期的实验中确定了富马酸的添加质量浓度(8 g/L),本研究尝试在12 h诱导时将富马酸与诱导剂IPTG一起加入,但是发现丙二酸产量仅为2.9 g/L(图10-a)。猜测添加的富马酸可能被用于菌体生长,导致富马酸进入丙二酸合成途径的量较少。所以本文尝试对发酵温度进行梯度降温,以期降低菌株的生长速度,并且增加了富马酸的添加,进行5次投放。同样采用间歇补料的方式进行葡萄糖的补加,结果如图10-b所示,丙二酸的产量提高至12.42 g/L,富马酸的摩尔转换率为0.346 mol/mol(丙二酸/富马酸)。
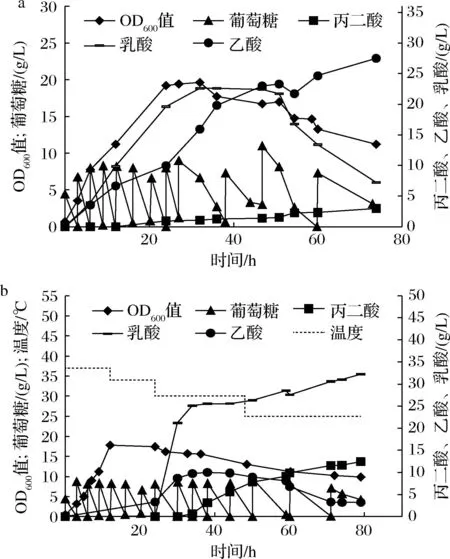
a-外源添加1次富马酸发酵结果; b-外源添加5次富马酸并进行梯度降温的发酵结果图10 菌株BL21(PPP)外源添加富马酸的5 L发酵罐结果Fig.10 Results in 5 L fermenter of strain BL21(PPP) with addition of fumaric acid
3 结论与讨论
天冬氨酸可以由草酰乙酸通过天冬氨酸转氨酶催化的转氨化反应生成,也可以由富马酸通过AspA催化的胺化反应生成。但是由草酰乙酸和谷氨酸生成天冬氨酸和α-酮戊二酸的转氨化反应,会进一步与α-酮戊二酸的还原反应相耦合,以再生谷氨酸[22];同时AspC可以催化丙酮酸生成L-丙氨酸,并且与生成L-天冬氨酸的效率相当[23]。由于此转氨化特性,AspC路线不易控制,可以通过提供额外的底物实现对AspA路线的有效控制。所以,本文为了实现丙二酸的生物合成,参照β-丙氨酸途径合成丙二酸[8],以大肠杆菌BL21(DE3)作为底盘细胞,选择AspA路线,通过过表达6个基因(aspA、panD、ppc、sdhC、yneI和pa0132),构建了丙二酸合成途径,获得菌株BL21(PPP),并通过摇瓶发酵验证其合成丙二酸的能力。为了进一步获得更高的丙二酸产量,本文对菌株的发酵条件进行了优化,我们获得了有利于丙二酸合成的摇瓶发酵条件。为了验证该菌株的丙二酸合成能力,利用5 L发酵罐对其进行放大培养,在5 L发酵罐中丙二酸的最高积累量为12.42 g/L,富马酸的摩尔转换率为0.346 mol/mol(丙二酸/富马酸),但是我们发现副产物积累量是非常高的,导致碳源大量流失。产量低的另一个原因是丙二酸合成途径中的关键酶缺失,并且YneI催化丙二酸半醛转化为丙二酸的效率不高,这可从SONG等[8]的研究结果看出,如何提高丙二酸半醛的转化效率是提高丙二酸产量的关键,后续可以考虑对该酶进行定点随机突变,以期获得对丙二酸半醛有高催化效率的突变体。